Токсический синдром переднего сегмента глаза
Токсический синдром переднего сегмента глаза (ТСПСГ). Диагностика, лечениеНеобходимо проводить дифференциальную диагностику между токсическим синдромом переднего сегмента глаза (ТСПСГ) и инфекционным эндофтальмитом, так как патогенез и лечение данных состояний значительно различаются. Заболеваемость токсическим синдромом переднего сегмента глаза (ТСПСГ) после хирургического лечения катаракты, глаукомы и выполнения оперативных вмешательств на роговице составляет от 0,1% до 2,0% и растет во всем мире из-за вспышек нозокомиальных инфекций в лечебных учреждениях. Токсический синдром переднего сегмента глаза (ТСПСГ) обычно диагностируется в течение нескольких часов после операции; у всех пациентов возникает нарушение зрения, развивается тяжелый отек роговицы от одного края лимба до другого (хирургические травмы становятся причиной локального отека), наблюдается опалесценция влаги передней камеры, возможно образование гипопиона, выпадение фибрина, а также минимальная гиперемия конъюнктивы или эписклеры на фоне минимальных болевых ощущений или при их отсутствии (в 75-80% случаев у пациентов с эндофтальмитом присутствует болевой синдром). Токсический синдром переднего сегмента глаза (ТСПСГ) обычно возникает в первый день после операции, но вирулентный бактериальный эндофтальмит может также развиваться в эти сроки. Осложнениями данного заболевания могут быть глаукома вследствие образования периферических передних синехий и повреждение трабекулярной сети, а также хронический воспалительный процесс, кистозный макулярный отек (КМО), повреждение эндотелия роговицы и повреждение радужки (ригидный зрачок и дефекты, выявляемые при трансиллюминации). Причинами возникновения токсического синдрома переднего сегмента глаза (ТСПСГ) в основном являются лекарственные препараты, хирургические инструменты, оборудование и расходные материалы в операционной. Проблемы могут быть следствием использования некачественных инфузионных растворов (Cytosol и др.) и вискоэластиков, интраокулярного введения лидокаина или адреналина (рН, доза, консерванты, стабилизаторы: бисульфиты или метабисульфиты), антибиотиков (рН, концентрация, доза), Кеналога (активное вещество и консерванты). Проблемы, связанные с хирургическими инструментами, оборудованием и расходными материалами, могут являться следствием бактериальной контаминации парового стерилизатора (фильтров, емкостей для растворов и внутренних стенок камеры), денатурации вискоэластика при повторной стерилизации канюли, присутствия бактериальных эндотоксинов погибших при автоклавировании грамотрицательных бактерий, а также загрязнения ультразвукового стерилизатора и ванночек с ферментами или моющими средствами, использующихся для предстерилизационной очистки инструментов.
Одноразовые инструменты не должны использоваться повторно. Дополнительными причинами развития токсического синдрома переднего сегмента глаза (ТСПСГ) являются эндотоксины из водопроводной воды, моющих средств и остатки химических веществ на хирургических инструментах, а также неполная очистка многоразовой канюли. Хирургическими факторами являются неполное удаление ядра хрусталика, травма радужки, использование ирис-ретракторов, вискоэластиков, введение препаратов в переднюю камеру, имплантация ИОЛ и эндоскопическая циклофотокоагуляция. Существует много преимуществ использования одноразовых пинцетов, ножниц, пик и канюль: инструменты малого калибра (25 или 23G) могут быть легко повреждены во время очистки и стерилизации, после выполнения каждого вмешательства их нужно выбрасывать, это устраняет риск их контаминации (прионами трансмиссивной губчатой энцефалопатии, или коровьего бешенства, бактериями, вирусами гепатита, ВИЧ, денатурированными белками, бактериальными эндотоксинами). У всех ножниц и пинцетов есть зазор, а так как величина ВГД больше атмосферного давления, белки втягиваются в этот зазор. Использование одноразовых инструментов снижает стоимость хирургического вмешательства вследствие отсутствия затрат на очистку, стерилизацию, упаковку, хранение, дублирующий комплект, складские услуги (труд и материалы). Если есть подозрение на бактериальный эндофтальмит, то сначала нужно выполнить забор материала из передней камеры; отрицательные результаты бактериологического анализа биоптата свидетельствуют, что у пациента присутствует токсический синдром переднего сегмента глаза (ТСПСГ). Забор материала СТ должен быть выполнен, если в нем присутствуют плавающие помутнения или воспалительные конгломераты. При подозрении на инфекционную этиологию патологического процесса необходимо выполнить забор материала из СТ и в зависимости от результатов бактериологического анализа проводить лечение путем введения в витреальную полость антибиотиков; витрэктомия в таких случаях не является необходимой. Если хирург уверен в диагнозе токсического синдрома переднего сегмента глаза (ТСПСГ), частое закапывание глазных капель, содержащих антибиотики, и тщательное наблюдение, как правило, являются достаточными мерами для купирования воспаления и восстановления остроты зрения. С другой стороны, никто не обвинит хирурга, если он осуществит забор материала СТ для бактериологического анализа и выполнит интравитреальное введение антибиотиков, если подозревает диагноз инфекционного эндофтальмита. — Также рекомендуем «Методика биопсии стекловидного тела и введения антибиотиков. Рекомендации» Оглавление темы «Лечение травм глаз»:
|
Источник
Ключевые слова: послеоперационный эндофтальмит, TASS-синдром, витрэктомия, антибиотики, стекловидное тело.
Эндофтальмит — (от греч. endo — внутри и ophthalmos — глаз) — это гнойное воспалительное заболевание внутренних оболочек глаза. Возникает вследствие инфицирования бактериями или грибами во время травмы, интраоперационно или в раннем послеоперационном периоде, в редких случаях — из-за распространения инфекции из эндогенных источников. Учитывая патогенез заболевания, время, необходимое для миграции патогенов в заднюю камеру глаза и накопления там медиаторов воспаления, составляет не менее 2 суток.
По механизму возникновения эндофтальмит подразделяют на:
– Острый послеоперационный (возникает в срок до 2 недель после выполненной операции)
– Хронический послеоперационный
– Посттравматический
– Эндогенный
Частота развития эндофтальмита после экстрации катаракты, по данным Европейского общества катаральных и рефракционных хирургов (ESCRS) [1], составляет 0,35 % без применения интракамерального введения цефуроксима, с применением — 0,05 %. В США, по данным Нила Шорстейна (Neal H. Shorstein) — 0,31 % и 0,014 % соответственно [8].
Этиология ипатогенез
По данным исследования Endophthalmitis Vitrectomy Study (EVS), основным источником инфицирования является микрофлора поверхности конъюнктивы пациента [7]. Самыми распространенными причинами развития острого послеоперационного эндофтальмита являются коагулазонегативные стафилококки, в частности Staphylococcus epidermidis (33–77 %); Staphylococcus aureus (10–21 %). При хроническом эндофтальмите наиболее вероятным возбудителем является Proprionibacterium acnes.
Таблица 1
Микроорганизмы, часто встречающиеся при остром послеоперационном эндофтальмите [1]
Распространённость (%) | Виды микроорганизмов |
33–77 % | КНС (коагулазонегативные стафилококки) |
10–21 % | Staphylococcus aureus |
9–19 % | BHS (β-гемолитические стрептококки), S. pneumoniae, ∂-гемолитические стрептококки, включая S. mitis и S. salivarius |
6–22 % | Грамотрицательные бактерии, включая Ps. aeruginosa |
До 8 % | Грибы (виды Candida, виды Aspergillus, виды Fusarium) |
Таблица 2
Микроорганизмы, часто встречающиеся при хроническом или позднем послеоперационном эндофтальмите [1]
Виды микроорганизмов |
Proprionibacterium acnes |
Виды Corynebacterium |
S. epidermidis |
Грибы |
К факторам риска развития эндофтальмита относятся:
– Увеличенное время операции у неопытного хирурга
– Повреждение задней капсулы хрусталика и стекловидного тела во время операции
– Наличие у пациента блефарита до операции
– Поверхность интраокулярных линз как среда для развития микроорганизмов
– Недостаточная стерилизация инструментов и операционного поля
Следует также отметить роль бесшовных оперативных методик в развитии послеоперационного эндофтальмита: использование туннельного бесшовного разреза роговицы способствует повышению частоты развития эндофтальмита после факоэмульсификации катаракты вследствие возможности всасывания в переднюю камеру слезной жидкости в раннем послеоперационном периоде.
По данным руководства ESCRS, у пациентов с роговичным туннелем вероятность развития эндофтальмита в 5,88 раз больше, чем при корнеосклеральном доступе [1].
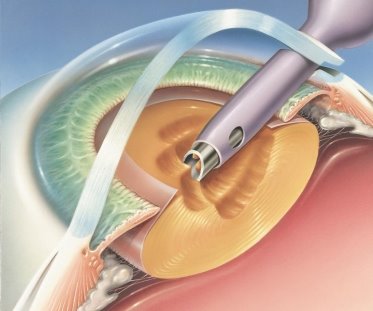
Рис. 1. Применение роговичного тоннельного доступа
В том же руководстве сообщается, что при имплантации силиконовых интраокулярных линз (ИОЛ) вероятность развития эндофтальмита в 3,13 раз выше в сравнении с линзами из акрила или другого материала, а хирургические осложнения сопровождались 4,95-кратным увеличением данного риска. Большинство имплантируемых ИОЛ на данный момент изготовлены из гидрофобного акрила, а силиконовые встречаются редко по причине инфекционных осложнений и риска повредить линзу при имплантации через разрезы менее 2,8 мм [15].
Клиника идиагностика
К основным клиническим проявлениям эндофтальмита, согласно исследованию EVS, относятся: нечёткость зрения (94 % пациентов), болевой синдром (74 %), отёк век (34 %), гипопион (80 %), покраснение глаза (82 %), помутнение сред глаза (74 %). Лизис стекловидного тела и замещение его гнойными массами вызывают жёлто-зелёный рефлекс с глазного дна.
По степени тяжести эндофтальмит может быть условно разделен на лёгкий, средней тяжести и тяжёлый:
– Лёгкий: слабо выраженный болевой синдром, умеренная инъекция глазного яблока, возможно проведение офтальмоскопии.
– Средней тяжести: выраженный болевой синдром и инъекция глазного яблока, невозможна офтальмоскопия, значительно снижена острота зрения, допускается наличие витреита, хемоза, отёка век.
– Тяжёлый: выраженный болевой синдром с иррадиацией в соответствующую половину черепа; выраженные: инъекция глазного яблока, хемоз, гипопион, витрит, отёк век; невозможна офтальмоскопия; снижение остроты зрения вплоть до светооощущения.
А. М. Южаков предложил классификацию в зависимости от формы развития:
– Очаговый эндофтальмит (абсцесс стекловидного тела), стадии I–II
– Диффузный эндофтальмит, стадии I–IV
– Смешанная форма, стадии I–IV
– Панофтальмит — конечный результат инфекционного процесса
При подозрении на послеоперационный эндофтальмит каждый час определяется острота центрального зрения, при ее резком снижении незамедлительно приступают к хирургическому лечению. Снижение зрительных функций до светоощущения является прогностически неблагоприятным фактором. Помимо визометрии, проводится биомикроскопия и офтальмоскопия для динамической оценки послеоперационного воспаления. Из инструментальных методов исследования обязательным является УЗИ (B-scan).
Дополнительно также проводятся периметрия и электрофизиологические исследования зрительного нерва и сетчатки (электроретинография). Снижение их показателей будет указывать на токсическое повреждение внутренних оболочек глаза и являться показанием для хирургического лечения.
Перспективным методом диагностики и контроля эффективности лечения является лазерная тиндалеметрия. Принцип работы основан на измерении интенсивности лазерного луча, отраженного от взвешенных во влаге передней камеры клеток и крупномолекулярных белков (альбуминов и макроглобулинов). Когда частица белка или клетка проходит через фокус лазера, происходит отражение излучения.
До начала лечения обязательным является предварительная пункция передней камеры глаза и биопсия стекловидного тела для проведения бактериологического анализа. Взятые пробы окрашивают по Граму (экспресс-метод) с дальнейшей идентификацией микроорганизмов и определением чувствительности к антибиотикам.
ПЦР с использованием праймеров широкого диапазона, нацеленных на высококонсервативные регионы эубактериальной 16S рДНК (18S рДНК для грибов), может выявлять и амплифицировать минимальные количества бактериальной ДНК, с их последующим секвенированием и идентификацией. Она обеспечивает намного лучшее выявление патогенов, особенно в случаях хронического эндофтальмита с малым количеством патогенов [9].
Дифференциальная диагностика сTASS-синдромом
Синдром токсического повреждения переднего сегмента глаза (TASS-синдром, экссудативно-воспалительная реакция) — состояние, сходное с эндофтальмитом по клиническим проявлениям, но имеющее другой патогенез. Синдром токсического повреждения переднего сегмента глаза (TASS-синдром) представляет собой стерильную послеоперационную воспалительную реакцию, вызываемую веществом неинфекционного происхождения, попавшим в передний сегмент глаза, что приводит к токсическому повреждению внутриглазных тканей.
Основные группы веществ, которые при попадании в передний сегмент могут вызвать TASS-синдром:
- Вещества извне, которые случайно проникают в переднюю камеру глаза во время или после операции (например, повидон-йод для местного применения).
- Продукты, вводимые в переднюю камеру глаза как часть хирургической процедуры, такие как сбалансированный солевой раствор из партии, произведенной с ошибочным рН или осмолярностью (или с лекарственными препаратами, добавленными в операционной) или анестетики (безопасным является только не содержащий консервантов 1 % лидокаин). Любой лекарственный препарат, вводимый в глаз, не должен содержать консервантов и должен использоваться в надлежащей концентрации, чтобы избежать развития токсических реакций.
- Раздражающие вещества на инструментарии, скопившиеся вследствие его неправильной очистки и/или стерилизации (например, денатурированные офтальмологические вискоэластики, оставшиеся на многоразовом инструментарии, стабильные к воздействию тепла эндотоксины, сульфатные примеси после автоклавирования паром).
К отличительным признакам TASS-синдрома относятся:
– Раннее начало (уже через 12–24 часа после операции)
– Отек роговицы от лимба до лимба, вторичный по отношению к распространенному повреждению слоя эндотелиальных клеток
– Повреждение радужной оболочки (фиксированный, расширенный или неправильной формы зрачок, дефекты просвечивания радужной оболочки)
– Высокое ВГД вследствие повреждения трабекулярной сети
– Отсутствие витрита (наиболее важная характеристика TASS-синдрома, поскольку он характеризуется главным образом воспалением переднего сегмента глаза, в то время как при эндофтальмите вовлекается задний сегмент).

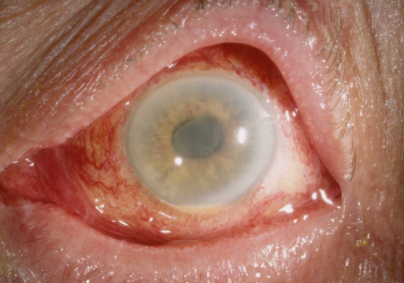
Рис. 2. Отёк роговицы, деформация зрачка и гипопион у пациента с TASS-синдромом [6]
Лечение TASS-синдрома включает в себя интенсивное применение местных кортикостероидов (и иногда пероральных).
Лечение острого послеоперационного эндофтальмита
Основными методами лечения являются витрэктомия и интравитреальное введение антибиотиков. ESCRS рекомендует при наличии витреоретинального хирурга и оснащенной операционной проводить стандартную трехпортовую центральную или полную витрэктомия по принципу «Ubi pus ibi evacuat» («Где гной, там очищай»). При центральной витрэктомии остается часть основы стекловидного тела, в то время как более полная витрэктомия сопровождается риском ятрогенного отслоения сетчатки, что является потенциальной катастрофой. Данный выбор остается за витреоретинальным хирургом.
После того, как витрэктомия выполнена, через один из разрезов склеры с использованием иглы диаметром 25–30G интравитреально вводятся антибиотики. В случае выполнения полной витрэктомии дозу следует уменьшить на 50 %. Данную инъекцию следует проводить медленно, в течение 1–2 минут, в середину стекловидного тела, направляя конец иглы вверх, подальше от макулы. Отдельные шприцы и отдельные иглы, для меньшей вероятности контаминации, вводятся через уже имеющееся отверстие. Затем интравитреально вводится дексаметазон (не содержащий консервантов).
Когда операцию «золотого стандарта» невозможно выполнить вследствие отсутствия витреоретинального хирурга и витреоретинальной операционной, приемлемым вариантом является проведение биопсии стекловидного тела с интравитреальным введением антибиотиков без последующей терапевтической витрэктомии («серебряный стандарт»). Поскольку простая аспирация с помощью иглы зачастую безуспешна, ее можно провести с помощью портативного витректора.
Дозы интравитреальных антибиотиков следует выбирать особо тщательно, потому что зазор для ошибки между терапевтической дозой и токсичностью является узким, особенно для аминогликозидов (гентамицин в дозе 200 мкг является эффективным, но в дозе 400 мкг может быть токсичным, вызывая макулярный инфаркт).
Комбинацией лекарственных средств первого выбора являются ванкомицин (1 мг) сцефтазидимом (2 мг).
Комбинация второго выбора: ванкомицин (1 мг) вкомбинации самикацином (0,4 мг), особенно у пациентов с чувствительностью к ß-лактамам. Несмотря на синергизм между ванкомицином и амикацином в отношении грамположительных микроорганизмов, многие хирурги избегают применения аминогликозидов для эрадикации грамотрицательных бактерий из-за риска ретинальной токсичности.
И. А. Фролычев предлагает введение раствора антибиотика в витреальную полость сочетать с тампонадой ПФОС [2], ввиду того, что раствор антибиотика активно перемещается с пузырем ПФОС в зависимости от положения тела пациента («на спине» — максимальное воздействие у зубчатой линии сетчатки, в положении стоя или сидя — воздействие на верхние отделы сетчатки, «на боках» — воздействие на назальную или височную половину сетчатки). При этом риск токсического локального воздействия растворов антибиотиков значительно снижается. При использовании ПФОС уменьшается риск токсического поражения макулярной зоны струей вводимого интравитреально АБ препарата. ПФОС, создавая противодействие вводимой струе препарата, препятствует токсическому повреждению макулы, освобождает хирурга от необходимости вводить раствор антибиотика медленно в течение 2–3 минут.
Тяжелый острый гнойный эндофтальмит следует лечить с использованием дополнительной системной антибиотикотерапии теми же лекарственными препаратами, которые используются для интравитреальной терапии. Такая схема лечения поможет поддерживать значимые интравитреальные концентрации лекарственного препарата на протяжении более длительного времени путем уравновешивания диффузии введенного препарата из глаза.
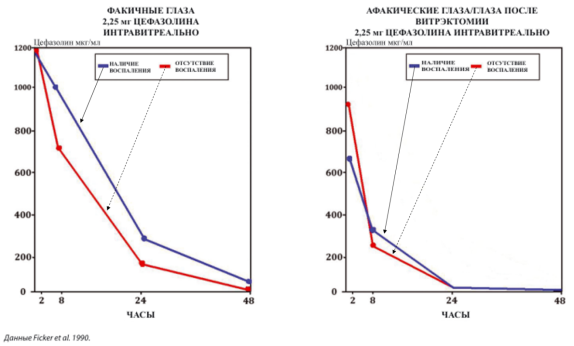
Рис. 3. Скорость выведения цефазолина из стекловидного тела [1]
Лечение хронического послеоперационного эндофтальмита
В отличие от острого послеоперационного эндофтальмита, представляющего собой неотложное состояние, в случае возможного хронического послеоперационного эндофтальмита имеется больше времени для правильной постановки диагноза и выбора вида лечения.
При хроническом эндофтальмите микроорганизмы изолированы в капсулярном мешке и защищены биопленкой; также они могут иметь внутриклеточную локализацию внутри макрофагов, где их не достигают антибиотики, часто используемые для лечения острого эндофтальмита. Однако некоторые антибиотики, такие как кларитромицин, хорошо абсорбируются при приеме внутрь, хорошо проникают в глаз, обладают антибиопленочными свойствами и концентрируются внутри нейтрофилов и макрофагов, где они в лучшей степени способны уничтожать внутриклеточные грамположительные бактерии.
Некоторые исследования [10,11] нашли применение кларитромицина эффективным и рекомендовали использовать дозу в 500 мг 2 раза в день на протяжении 2–4 недель. Добавление промывания ванкомицином капсулярного мешка повышало частоту ответа на лечение в случаях инфекции, вызванной видами Propionibacterium [13].
Для лечения хронического эндофтальмита существует несколько вариантов хирургических вмешательств:
– Промывание антибиотиком капсулярного мешка при первичной пункции передней камеры или при последующем вмешательстве в случаях положительного результата бакпосева
– Интравитреальная инъекция антибиотиков (ИИАБ)
– Витректомия рars plana (ВПП) с ИИАБ
– ВПП с частичной капсулэктомией (ЧК) и ИИАБ
– ВПП с тотальной капсулэктомией (ТК), ИИАБ, извлечением или заменой ИОЛ (зИОЛ)
Чем более агрессивным является лечение, тем ниже частота рецидивирования [14].
Профилактика
Таблица 3
Основные этапы антисептики впредоперационном периоде
1. Обязательная обработка повидон-йодом роговицы и конъюнктивального мешка |
2. Обязательная обработка повидон-йодом окологлазничной области |
3. Использование медицинской спецодежды (халат, перчатки и пр.) и специального режима вентиляции в операционной |
4. Обкладывание глаза салфетками, заклеивание век и ресниц (не обрезать) |
Основой профилактики послеоперационного эндофтальмита является соблюдение правил асептики и антисептики. Применение местных антибиотиков в каплях перед операцией не показано ввиду низкой эффективности и отсутствия доказательной базы [12].
В некоторых европейских странах (Швеция, Франция) для профилактики эндофтальмита применяют антибиотик Апрокам (Цефуроксим) цефалоспоринового ряда, активный в отношении многих возбудителей бактериальных эндофтальмитов. В Российской Федерации зарегистрированных антибиотиков для интракамерального или интравитреального введения нет, и даже интравитреальное введение ванкомицина с целью лечения происходит off-label ввиду отсутствия соответствующих рекомендаций в инструкции препарата.
Литература:
- Руководство ESCRS по профилактике и лечению эндофтальмита после операции по удалению катаракты: данные, дилеммы и выводы — 2013. — Текст: электронный // ESCRS: [сайт]. — URL: https://www.escrs.org/endophthalmitis/guidelines/RUSSIAN.pdf (дата обращения: 08.05.2020).
- Фролычев, И. А. Экспериментальное обоснование этапного лечения послеоперационных эндофтальмитов с применением перфторорганического соединения с растворами антибактериальных препаратов: специальность 14.01.07 «Глазные болезни»: диссертация на соискание ученой степени кандидата медицинских наук / Фролычев Иван Александрович; ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» имени акад. С. Н. Федорова» Минздрава России. — Москва, 2019. — 170 c. — Текст: непосредственный.
- Недзвецкая, О. В. Инфекционный эндофтальмит (внутриглазная раневая инфекция) / О. В. Недзвецкая. — Текст: непосредственный // Медицина неотложных состояний. — 2010. — № 6(31).
- Бодрова, С. Г. Лазерная тиндалеметрия при ношении мягких контактных линз / С. Г. Бодрова, Л. Н. Аксакова, Н. П. Паштаев. — Текст: непосредственный // Современная оптометрия. — 2008. — № 6. — С. 14–15.
- Pandya, H. Postoperative Endophthalmitis / H. Pandya. — Текст: электронный // Medscape: [сайт]. — URL: https://emedicine.medscape.com/article/1201260-overview (дата обращения: 08.05.2020).
- Deschênes, J. Toxic Anterior Segment Syndrome (TASS) / J. Deschênes. — Текст: электронный // Medscape: [сайт]. — URL: https://emedicine.medscape.com/article/1190343-overview (дата обращения: 08.05.2020).
- Endophthalmitis Vitrectomy Study (EVS). — Текст: электронный // ClinicalTrials: [сайт]. — URL: https://clinicaltrials.gov/ct2/show/NCT00000130 (дата обращения: 08.05.2020).
- Shorstein, N. H. Decreased postoperative endophthalmitis rate after institution of intracameral antibiotics in a Northern California eye department / N. H. Shorstein, K. Winthrop, L. Herrinton. — Текст: непосредственный // Journal of cataract and refractive surgery. — 2013. — № 39. — С. 8–14.
- The diagnosis of delayed post-operative endophthalmitis by polymerase chain reaction of bacterial DNA in vitreous samples. / P. Hykin [и др.]. — Текст: непосредственный // Journal of Medical Microbiology. — 1994. — № 40(6). — С. 408–415.
- Warheker, P. T. Successful treatment of saccular endophthalmitis with clarithromycin / P. T. Warheker, S. R. Gupta, D. C. Mansfield. — Текст: непосредственный // Eye. — 1998. — № 12. — С. 1017–1019.
- Karia, N. Postoperative proprionibacterium acnes endophthalmitis. / N. Karia, G. W. Aylward. — Текст: непосредственный // Ophthalmology. — 2001. — № 108. — С. 634–635.
- Prospective randomized comparison of 1-day and 3-day application of topical 0.5 % moxifloxacin in eliminating preoperative conjunctival bacteria. / L. He [и др.]. — Текст: непосредственный // Journal of Ocular Pharmacology and Therapeutics. — 2009. — № 25(4). — С. 373–378.
- Oral clarithromycin as a treatment option in chronic post-operative endophthalmitis. / F. A. Pellegrino [и др.]. — Текст: непосредственный // Archivos de la Sociedad Española de Oftalmología. — 2005. — № 80. — С. 339–344.
- Deramo, V. A. Treatment of Propionibacterium acnes endophthalmitis. / V. A. Deramo, T. D. Ting. — Текст: непосредственный // Current Opinion in Ophthalmology. — 2001. — № 12. — С. 225–229.
- Findl, Oliver Intraocular Lens Materials and Design / Oliver Findl. — Текст: электронный // Semantic Scholar: [сайт]. — URL: https://pdfs.semanticscholar.org/0ee8/1d6e497e912a8e3c6061c16b167d373e744f.pdf (дата обращения: 08.05.2020).
Основные термины (генерируются автоматически): стекловидное тело, ESCRS, токсическое повреждение, передний сегмент глаза, EVS, антибиотик, передняя камера глаза, глазное яблоко, выраженный болевой синдром, лекарственный препарат.
Источник

