Синдромом делеции митохондриальной днк что это
Делеции и дупликации митохондриальной ДНК. Синдром ПирсонаДанные типы мутаций мтДНК обычно возникают de novo в соматических клетках на ранней стадии эмбриогенеза и приводят к манифестации спорадических случаев митохондриальных болезней. Наследование этих мутаций невозможно, поскольку, как предполагается, ооциты с крупными перестройками мтДНК не способны дать начало развитию эмбриона [DiMauro S., 1993]. Типичным неврологическим проявлением делеций/дупликаций мтДНК является прогрессирующая наружная офтальмоплегия, которая может входить в структуру сложных мультисистемных синдромов. Наиболее изученным из них является синдром Кернса-Сейра. Это заболевание характеризуется развитием на 1 —2-м десятилетии жизни прогрессирующей наружной офтальмоплегии (птоз, ограничение движений глазных яблок, иногда двоение) в сочетании с пигментной дегенерацией сетчатки, атриовентрикуляртюй блокадой сердца, миопатией, атаксией, нейросенсорной глухотой, эндокринными расстройствами. При развернутой клинической картине большинство больных погибают от патологии сердца через 10-20 лет от начала заболевания. Нередко в клинике могут наблюдаться те или иные редуцированные варианты синдрома Кернса-Сейра. При лабораторных исследованиях обычно выявляется повышение уровня белка в спинномозговой жидкости, лактат-ацидоз, феномен «рваных красных волокон» в мышечных биоптатах. Около 80% больных с синдромом Кернса-Сейра имеют те или иные делеции митохондриалыюго генома протяженностью от 2 до 10,4 кб, причем 30-40% из них имеют идентичную делецию 4977 нуклеотидов, захватывающую сегмент мтДНК от гена АТФазы 8 до гена ND 5 (рис. 68а) [Moraes С. et al., 1989; DiMauro S., 1993; Wallace D., 1993].
Описаны более редкие случаи, когда при тех или иных вариантах синдрома Кернса-Сейра у больных выявлялись дупликации или точковые мутации мтДНК [DiMauro S., 1993; Servidei S., 1997]. Все описанные мутации являются гетероплазмическими, и различные уровни гетероплазмии в разных тканях-мишенях обусловливают значительный полиморфизм клинических проявлений болезни. Ярким примером указанного полиморфизма является синдром Пирсона — злокачественная младенческая форма поражения костного мозга с панцитопенией, обусловленная теми же крупными делениями мтДНК, что и синдром Кернса-Сейра. Основное молекулярное различие между данными заболеваниями заключается в том, что при синдроме Кернса-Сейра содержание мутатной мтДНК в мышцах достигает 80% против 5% в кроветворных клетках, тогда как у больных с синдромом Пирсона наблюдаются обратные соотношения [Schon E., DiMauro S., 1994]. Более того, с возрастом пропорция мутантной мтДНК в мышечной ткани повышается, а в клетках костного мозга, напротив, снижается вследствие интенсивной митотической сегрегации в сторону нормальных стволовых клеток. С клинической точки зрения драматизм ситуации заключается в том, что больные с синдромом Пирсона, у которых в детстве ценой множественных трансфузий удалось компенсировать фатальный дефект кроветворения, фактически обречены спустя 10-15 лет заболеть другим тяжелейшим и некурабельным митоходриальным недугом — синдромом Кернса-Сейра. — Также рекомендуем «Прогрессирующая наружная офтальмоплегия. Биохимическая классификация болезней» Оглавление темы «Митохондриальная патология нервной системы»: |
Источник
Эта статья о группе аутосомно — рецессивных заболеваний. Для аналогично сокращенного (MDDS) редкого неврологического состояния, см Малы де debarquement .
| синдром истощения митохондриальной ДНК | |
|---|---|
| Синонимы | синдром истощения мтДНК |
| синдром истощения митохондриальной ДНК наследуется по аутосомно-рецессивному типу | |
Синдром истощения митохондриальной ДНК ( МДС или MDDS ) представляет собой любой из группы аутосомно — рецессивных расстройств , которые вызывают значительное снижение митохондриальной ДНК в пораженных тканях. Симптомы могут быть любой комбинацией миопатии , hepatopathic или encephalomyopathic . Эти синдромы влияют на ткани в мышцах, печени, или как мышцы и мозг, соответственно. Состояние , как правило , со смертельным исходом в младенчестве и раннем детстве, хотя некоторые из них сохранились до подросткового возраста с миопатическим вариантом и некоторые из них выжили во взрослую жизнь с SUCLA2 encephalomyopathic вариантом. Там в настоящее время нет медицинского лечения любой формы MDDS, хотя некоторые предварительные процедуры показали снижение симптомов.
классификация
MDDS представляют собой группу генетических расстройств , которые разделяют общую патологию — отсутствие функционирования ДНК в митохондриях . Есть вообще четыре класса MDDS:
- форма , которая в первую очередь влияет мышцы , связанные с мутациями в TK2 гене;
- форма , которая в первую очередь влияет на мозг и мышцы , связанные с мутациями в генах SUCLA2 , SUCLG1 или RRM2B ;
- форма , которая в первую очередь влияет на мозг и печень , связанный с мутациями в DGUOK , MPV17 , POLG или TWNK (также называемый PEO1 ); а также
- форма , которая в первую очередь влияет на мозг и желудочно — кишечный тракт , связанный с мутациями в ECGF1 (также называемый TYMP ).
Признаки и симптомы
Все формы MDDS очень редки. MDDS вызывает широкий спектр симптомов, которые могут возникнуть у новорожденных, младенцев, детей и взрослых, в зависимости от класса MDDS; в каждом классе симптомы также разнообразны.
В MDDS , связанных с мутациями в TK2 , дети , как правило , развиваются нормально, но примерно на два года возраста, симптомы общей мышечной слабости ( так называемый « гипотония »), усталость, отсутствие выносливости и трудности кормления начинают появляться. Некоторые малыши начинают терять контроль над мышцами в их лице, рот и горло, а также могут иметь трудности с глотанием. Двигательные навыки , которые были уроки могут быть потеряны, но в целом функционирование мозга и способность думать не влияет.
В MDDS , связанный с мутациями в SUCLA2 или SUCLG1 , которые в основном влияют на мозг и мышцы, гипотония обычно возникает у детей раннего возраста , прежде чем они 6 месяцев, их мышцы начинают чахнуть, и есть задержка психомоторного обучения (обучение базовых навыков , такие как ходьба, разговор и преднамеренное, координируются движение). Позвоночника часто начинается с кривым ( сколиозом или кифозом ), и ребенок часто имеет аномальные движения ( дистония , атетоз или хорея ), подавая трудность, кислотный рефлюкс , потеря слуха, задержку роста, а также трудности с дыханием , которые могут привести к частым легочным инфекциям. Иногда эпилепсия развивается.
В MDDS , связанных с мутациями в RRM2B , что в первую очередь влияет на мозг и мышцы, есть снова гипотония в первые месяцы, симптомы молочнокислого ацидоза , как тошнота, рвота, и быстрое глубокое дыхание, обездоленности , включая оставшиеся небольшие, задержки или регресс головы в движении, и потеря слуха. Многие системы организма страдают.
В MDDS , связанных с мутациями в DGUOK , которые в первую очередь влияют на мозг и печень, существуют две формы. Существует форма раннего начала , в которых симптомы возникают из проблем во многих органах в течение первой недели жизни, особенно симптомов молочнокислого ацидоза , а также низкий уровень сахара в крови. В течение нескольких недель после рождения у них может развиться печеночная недостаточность и связанный с ним желтухи и вздутие живота, и многие неврологические проблемы , включая задержки развития и регресса, а также неконтролируемого движения глаз . Редко в этом классе уже редких заболеваний, симптомы только связанные с заболеванием печени появляются позже в младенчестве или в детстве.
В MDDS , связанный с мутациями в MPV17 , которые в первую очередь влияют на мозг и печень, симптомы похожи на те , которые вызваны DGUOK , а также появляются вскоре после рождения, как правило , с меньшими и менее серьезными неврологическими проблемами. Существует подмножество людей Навахо происхождения , которые развиваются навахо neurohepatopathy, который в дополнение к этим симптомам также легко ломаются кости , которые не вызывают боли, деформированные руки или ноги, а также проблемы , связанные с их роговиц .
В MDDS , связанный с мутациями в POLG , которые в первую очередь влияет на мозг и печень, симптомы очень разнообразны и могут появляться в любое время от вскоре после рождения до старости. Первые признаки заболевания, которые включают в себя трудноразрешимые припадки и неспособность выполнить значимые этапы развития, как правило , происходят в младенчестве, после первого года жизни, но иногда , как в конце пятого года. Первичные симптомы заболевания являются задержкой развития, прогрессирующим умственным развитием , гипотония (низкий тонус мышц), спастичность (жесткость конечностей) , возможно , что приводит к квадриплегии , и прогрессивное слабоумие . Приступы могут включать в себя Epilepsia partialis континуумов , тип захвата , который состоит из повторяющихся миоклонических (мышцы) рывков. Optic атрофия может также произойти, что часто приводит к слепоте . Потеря слуха может также произойти. Кроме того, хотя физические признаки хронической печеночной дисфункции не могут присутствовать, многие люди страдают от нарушения печени , ведущее к печеночной недостаточности.
В MDDS , связанных с мутациями в PEO1 / C10orf2 , что в первую очередь влияют на мозг и печень, симптомы появляются вскоре после рождения или в раннем детстве, с гипотонией, симптомы молочнокислого ацидоза, увеличение печени, питающихся проблемы, отсутствие роста и задержки психомоторного навыки. Неврологический, развитие замедляется или останавливается, и эпилепсия возникает, как и сенсорные проблемы , как потеря контроля глаз и глухоты, а также нервно — мышечных проблемы , как отсутствие рефлексов, мышечную атрофию и подергивание и эпилепсия.
В MDDS , связанных с мутациями в генах , связанных с мутациями ECGF1 / TYMP , что в первую очередь влияет на мозг и желудочно — кишечного тракта, симптомы могут возникнуть в любое время в течение первых пятидесяти лет жизни; Чаще всего они возникают , прежде чем человек оказывается 20. Потеря веса часто , как это отсутствие способности желудка и кишечника автоматически расширяться и сжиматься , и , таким образом , двигаться через него ( так называемый желудочно — кишечная моторику ) — это приводит к ощущению полного после еды только небольшое количество пищи, тошнота, кислотный рефлюкс, все пострадавшие развиваются потеря веса и прогрессивная желудочно — кишечная моторика , проявляющаяся как раннее насыщение, тошнота, понос, рвоты и боль в животе и отеках. Люди также развивать невропатия , слабость и покалывание. Есть часто проблемы со зрением, и умственное развитие.
причины
MDDS вызваны генетическими мутациями , которые могут быть унаследованы от родителей или могут образовываться спонтанно во время развития плода.
Миопатический МДС сильно коррелирует с различными мутациями в гене TK2 , видя снижение активности TK2 до менее чем 32% людей с МДС , найденных с мутацией. Поскольку ТК2 играет ключевую роль в митохондриальных спасательных путях нескольких дезоксирибонуклеозидтрифосфат (дНТФ), пониженная активность может привести к меньшему количеству циклирования нуклеотидов. Это отсутствие нуклеотидной рециркуляции является вредным , так как митохондрии не могут синтезировать совершенно новые дезоксинуклеотиды, а внутренняя мембрана митохондрий предотвращают отрицательно заряженные нуклеотиды в цитозоле от входа.
В SUCLA2 ген кодирует бета-субъединицы SCS-A. Этот фермент катализирует синтез сукцината и коэнзима А в сукцинил-КоА, но также связан с комплексом , образованный нуклеозиддифосфат киназы (NDPK) в последнем шаге дНТФ спасательного пути.
RRM2B ген, который выражается в клеточном ядре , кодирует один из двух версий R2 субъединицу рибонуклеотидредуктазы , который генерирует нуклеотидные предшественник , необходимые для репликации ДНК путем уменьшения рибонуклеозида Дифосфаты к деоксирибонуклеозид Дифосфатов. Версия R2 , кодируемый RRM2B индуцируется TP53 , и необходим для нормального репарации ДНК и мтДНК синтеза в не пролиферирующих клеток. Другая форма R2 выражается только в делении клеток.
DGUOK ген кодирует для митохондриального деоксигуанозина киназы (DGK), который катализирует фосфорилирование деоксирибонуклеозидов в нуклеотиды. POLG кодирует для каталитических субъединицы пол- ГА, который является частью митохондриальной ДНК — полимеразы.
Другие причины являются мутацией тимидинфосфорилазы (TyMP), сукцинат-СоА — лигазы, альфа — субблок ( SUCLG1 ) и PEO1 / мерцания (C10orf2).
диагностика
MDDS диагностируется на основе системных симптомов , представляющих у детей раннего возраста, а затем клиническое обследование и лабораторные тесты (например, высокие лактата уровни являются общей) медицинской визуализацией, и , как правило, наконец , подтвердили и официально определены с помощью генетического тестирования.
лечение
Там нет лечения MDDS, но некоторые симптомы могут управляться. Для оставшихся в живых , живущих с MDDS, есть препараты для контроля эпилепсии , и физическая терапия может помочь с контролем мышц. Трансплантаций печени может принести пользу людям с вовлечением печени.
Прогноз
миопатическая форма
ТК2 связанные миопатические результаты формы в мышечной слабости, быстро прогрессирует, что приводит к дыхательной недостаточности и смерти в течение нескольких лет от начала заболевания. Наиболее частой причиной смерти является легочная инфекция. Лишь немногие люди дожили до позднего детства и юности.
Encephalomyopathic форма
SUCLA2 и RRM2B родственные формы приводят к деформации в мозг. Исследование 2007 на основе 12 случаев из Фарерских островов (где есть относительно высокий уровень заболеваемость в связи с эффектом основателя ) предположило , что результат часто бывает плохой с ранней летальностью. Более поздние исследования (2015 г.) с 50 человек с SUCLA2 мутациями, с диапазоном 16 различных мутаций, показывают высокую изменчивость результатов с числом людей , уцелевших во взрослую жизнь (медиана выживаемости составила 20 лет. Существует существенные доказательства (р = 0,020) что люди с миссенс мутациями имеют более длинные показатели выживаемости, что может означать , что некоторые из полученного белка имеют некоторую остаточную активность фермента.
RRM2B мутации были зарегистрированы в 16 детей с тяжелой encephalomyopathic МДС, что связано с ранним началом (неонатальном или младенческом), презентации полиорганной и смертности в младенческом возрасте.
Hepatopathic форма
DGUOK , POLG и MPV17 родственные формы приводит к дефектам в печень. Дисфункция печени прогрессирует у большинства лиц с обеими формами DGUOK связанного МДСА и является наиболее частой причиной смерти. Для детей с формой в полиорганной, пересадка печени не обеспечивает увеличение выживаемости.
Заболевания печени, как правило, прогрессируют в печеночную недостаточность у пораженных детей с MPV17 связанным МДСОМ и трансплантация печени остается единственным вариантом лечения печеночной недостаточности. Примерно половина пострадавших детей сообщили, не трансплантацию печени и умер из-за прогрессирующей печеночной недостаточности — большинство во младенчестве или раннем детстве. Несколько детей были зарегистрированы, чтобы выжить без пересадки печени.
Исследование
Нуклеозидная перепускная терапия является экспериментальным лечением , направленным на восстановление нормального уровня дезоксирибонуклеотидов (дНТФ) в митохондриях .
Смотрите также
- дело Чарли Гард
Рекомендации
внешняя ссылка
Источник
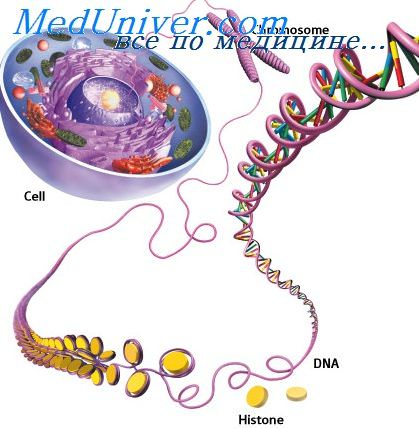
МОСКВА, 10 июл — РИА Новости, Татьяна Пичугина. В митохондриях, интересующих генетиков, врачей, криминалистов и археологов, содержится информация об эволюции биосферы, истории человечества и неизлечимых пока генетических болезнях. Какие загадки удалось решить с их помощью — в материале РИА Новости.
Генетический код преподносит сюрпризы
Долгое время считалось, что у человека только один геном — в ядре клетки. Именно его структуру расшифровали в 1953 году Френсис Крик и Джеймс Уотсон. А спустя несколько лет нечто вроде ДНК обнаружили в митохондриях — крошечных органеллах внутри клеток. Оказалось, что они содержат еще один, совершенно самостоятельный геном, только гораздо меньших размеров.
Информация в митохондриальной ДНК (ее называют мтДНК) некоторых живых организмов закодирована не так, как в ядерной молекуле, не универсальным кодом. Отличия небольшие, но принципиальные.
Митохондрии снабжают энергией клетку. В ее внутренней мембране вырабатываются молекулы АТФ — универсальное топливо организма. Так вот, геном митохондрии кодирует информацию о синтезе белков-ферментов, без которых производство топлива невозможно.
У человека один из самых маленьких митохондриальных геномов, всего 16,5 тысячи пар нуклеотидов, 37 генов. Для сравнения: у наземных растений — сотни тысяч пар.
В митохондрии умещается несколько молекул ДНК. Они свернуты в клубок вместе с белками. В свою очередь, в клетках тела в зависимости от специализации содержится множество митохондрий.
Одно из самых удивительных открытий состоит в том, что в половых клетках — неравное число митохондрий. В человеческих сперматозоидах их нет. Это приводит к тому, что мтДНК наследуется только от матери к дочери. К тому же она не может рекомбинироваться, как ядерная ДНК, то есть составлять разные вариации из двух родительских хромосом. По наследству передаются клоны мтДНК.
Как же вышло, что у нас в клетке два разных генома? Еще в конце XIX века появилась гипотеза, что митохондрии — это бактерии-симбионты, живущие внутри клетки. Они первыми на заре эволюции живого мира стали использовать кислород для дыхания. Возможно, им было безопаснее жить внутри большой клетки, не способной к фотосинтезу. Так возник симбиоз двух типов клеток, который привел к появлению многоклеточных организмов. В наши дни эта гипотеза стала основной.
Ученые расшифровывают мтДНК
Тот факт, у человека есть второй геном, долго оставался в тени, пока в конце XX века не разработали новые методы секвенирования ДНК и обработки больших объемов данных.
В 1987 году американские ученые сравнили митохондриальные ДНК у представителей 147 разных народов из пяти регионов Земли. Выяснилось, что все они произошли от общего предка по материнской линии — митохондриальной Евы, жившей в Африке двести тысяч лет назад.
Дело в том, что если некая популяция людей разделяется и каждая группа начинает вести относительно изолированный образ жизни, то у них со временем накапливаются разные наборы мутаций, по числу которых можно определить время расхождения групп.
Митохондриальная ДНК оказалась очень удобной для изучения ископаемых останков человека. В ядре клетки — только одна молекула ДНК, тогда как митохондрий в одной клетке — десятки тысяч. К тому же молекула мтДНК свернута в кольцо. Поэтому она более устойчива к внешним воздействиям и выдерживает даже небольшое нагревание, что важно, к примеру, при идентификации обгоревших останков.
Недаром у неандертальцев сначала расшифровали митохондриальный геном. Эту работу завершил в 2009-м шведский ученый Сванте Паабо.
Сейчас за относительно небольшие деньги в коммерческих компаниях можно заказать тест своей мтДНК и узнать регион, из которого произошли предки по материнской линии.
Поломка во втором геноме
Митохондриальная ДНК мутирует в 17 раз быстрее, чем ядерная. В результате в одной клетке могут быть митохондрии с разным геномом. Если число мтДНК-мутантов преобладает, митохондрии начинают работать неправильно, а клетки гибнут. Пострадать может любой орган: мозг, мускулы, почки, кровь, глаза, уши.
Диагностика митохондриальных болезней очень сложная, лечения от них нет. Зато генетики научились предотвращать их наследование. В одном случае берут донорскую яйцеклетку от здоровой женщины, не родственной супруге по материнской линии. Ее оплодотворяют семенем супруга и подсаживают в матку.
В другом — из донорской яйцеклетки удаляют собственное ядро и вставляют туда ядро из яйцеклетки супруги. Затем оплодотворяют составную яйцеклетку спермой супруга и подсаживают в матку. Рожденных таким способом называют «детьми от трех родителей».
Источник
