Синдром печеночной недостаточности этиология патогенез
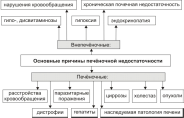
Печеночная недостаточность представляет собой состояние, при котором происходит снижение одной или нескольких функций печени ниже уровня, необходимого для обеспечения нормальной жизнедеятельности организма.
Классификация
В зависимости от варианта клинического течения выделяют острую и хроническую печеночную недостаточность, а по количеству нарушенных функций — парциальную и тотальную.
Этиология
Причины, приводящие к возникновению печеночной недостаточности, можно подразделить на две группы: печеночные и внепеченочные. Первую группу составляют патологические процессы, развивающиеся в самой печени или в желчевыводящих путях: вирусные гепатиты, токсическое повреждение, воздействие лекарственных средств, дистрофия, цирроз печени, генетические дефекты гепатоцитов, холестаз, обусловленный конкрементами (камнями) в желчны: протоках, воспаление стенки желчевыводящих путей, опухоли голо® ки поджелудочной железы и т. д.
Вторая группа причин включаем себя патологические процессы, локализованные вне печени, но в конечном итоге распространяющиеся на нее: шок, коллапс, сердечная недостаточность, почечная недостаточность, белковое голодание и др
Патогенез
Различные этиологические факторы вызывают повреждение гепатоцитов, сопровождающееся деструкцией их мембран и органелл, включая лизосомы.
Это приводит к выходу лизосомальных ферментов в цитоплазму и активации внутриклеточных аутолитичаских процессов. Помимо гибели печеночных клеток в результате прямого цитопатического воздействия патологических факторов при печеночной недостаточности часто имеет место аутоиммунный процесс.
Клинические проявления
Печеночная недостаточность характеризуется нарушением всех видов обмена веществ.
Расстройства обмена углеводов
При печеночной недостаточности снижается способность гепатоцитов к синтезу гликогена из глюкозы и, напротив, к его расщеплению. Угнетается также глюконеогенез. Совокупность указанных нарушений клинически проявляется нестабильностью уровня глюкозы в крови: гипергликемия после приема пищи и гипогликемия натощак.
Нарушения липидного обмена
Нарушения липидного обмена заключаются в снижении способу ности гепатоцитов метаболизировать холестерин в холестеринэстеи являющийся менее атерогенным веществом. Также угнетается синтез антиатерогенных липопротеинов.
Нарушения белкового обмена
Нарушения белкового обмена включают в себя следующие изменения:
• угнетение синтеза альбуминов, приводящее к гипоальбуминемии, диспротеинемии (изменение нормального соотношения между отдельными белками плазмы) и гипоонкии крови (снижение ее онкотического давления);
• нарушение синтеза прокоагулянтов, ферментов и белков, принимающих участие в свертывании крови, что влечет за собой развитие коагулопатии, характеризующейся повышенной кровоточивостью;
• снижение активности ферментов, катализирующих дезаминирование аминокислот и синтез мочевины из аммиака, в результате чего происходит повышение концентрации аммиака и свободных аминокислот в крови.
Нарушения обмена ферментов
Повреждение гепатоцитов сопровождается угнетением синтеза и секреции холинэстеразы, а также усилением выхода из печеночных клеток различных ферментов, в частности орнитин- и карбамилтрансферазы, аргиназы и трансаминаз (аланинаминотрансферазы и аспартатаминотрансферазы).
Нарушения обмена витаминов
При печеночной недостаточности развиваются эндогенные печеночные гиповитаминозы. Этому способствуют несколько механизмов:
• уменьшение интенсивности всасывания жирорастворимых витаминов в кишечнике;
• снижение способности печеночных клеток превращать витамины из неактивной формы (провитамины) в активную;
• снижение активности образования коферментов из витаминов. Нарушение барьерной (детоксикационной) функции печени.
Данное расстройство приводит к повышению концентрации в крови различных токсических веществ (фенол, индол, скатол, аммиак, кадаверин, тирамин, путресцин).
Печеночная кома
Этиология и патогенез
Печеночная кома возникает на терминальной стадии прогрессирующей печеночной недостаточности, когда нарастающая интоксикация организма приводит к выраженному повреждению прежде всего ЦНС (гепатоцеребралъный синдром) и других органов и систем. В качестве непосредственной причины печеночной комы выступают токсические продукты метаболизма, обезвреживание которых в норме осуществляется печенью.
Динамика печеночной комы складывается из трех стадий, из которых первые две можно охарактеризовать как прекоматозное состояние:
1. Стадия психоэмоциональных расстройств. На этой стадии отмечаются смена настроения, инверсия сна (сонливость в дневное время и бессонница ночью), расстройства памяти.
2. Стадия неврологических расстройств и нарушения сознания, сопровождающаяся спутанностью сознания, бредом, «хлопающим тремором».
3. Стадия собственно комы, характеризующаяся полной утратой сознания, угнетением всех рефлексов, исчезновением а- и (З-активно-сти на электроэнцефалограмме.
В зависимости от особенностей патогенеза выделяют три варианта печеночной комы: шунтовый, печеночноклечточный и смешанный.
Шунтовая печеночная кома
Чаще всего данный вид комы возникает в результате цирроза печени, сопровождающегося на поздних стадиях своего развития синдромом портальной гипертензии, т. е. повышением давления в воротной вене. Как указывалось выше, длительная портальная гипертензия ведет к открытию порто-кавальных анастомозов через пищеводные, геморроидальные и пупочную вены.
В этом случае кровь, оттекающая от органов брюшной полости, поступает в общий кровоток, минуя печень, В такой крови содержатся не-обезвреженные токсические вещества (индол, скатол, аммиак), что и приводит к интоксикации организма.
Печеночноклеточная кома
Печеночноклеточная кома возникает по причине массивного некроза печеночной паренхимы, сопровождающегося глубоким угнетением всех функций печени. В основе патогенеза данного вида комы лежат несколько механизмов.
Во-первых, это повышение содержания в крови токсических веществ, в особенности тех из них, которые оказывают церебротоксическое действие. Наиболее важную роль среди подобных веществ играет свободный аммиак. Также токсическим эффектом обладают всасывающиеся в кровь в кишечнике продукты распада некоторых аминокислот (индол, скатол). Во-вторых, развитию комы способствуют гипогликемия и ацидоз.
Смешанный тип печеночной комы представляет собой комбинацию механизмов шунтового и печеночноклеточного видов комы.
Принципы патогенетической терапии
Главный принцип лечения печеночной комы заключается в детоксикации организма и применении гепатопротекторов, в частности глюкозы, метионина, витаминов и др. Необходимо исключить из пищевого рациона пациента белковую пищу. С целью профилактики нарушений свертывания крови следует вводить прокоагулянты.
Для предупреждения присоединения инфекций применяются антибиотики широкого спектра действия и противовирусные препараты. Поскольку печеночная кома чаще всего развивается в исходе массивного повреждения паренхимы печени, проводимые лечебные мероприятия не всегда оказываются эффективными.
Источник
Печеночная недостаточность (ПН) – синдром, характеризующийся снижением одной, нескольких или всех функций печени ниже уровня, необходимого для обеспечения нормальной жизнедеятельности организма.
ПН делится на виды по следующим признакам:
1. По числу нарушенных функций:
§ парциальная;
§ тотальная.
2. По течению:
§ острая;
§ хроническая.
3. По исходу:
§ летальная;
§ нелетальная.
Причины печеночной недостаточности
1. Патологические процессы, локализующиеся в печени и желчевыводящих путях:
§ гепатиты: вирусные, бактериальные, токсогенные;
§ дистрофии (гепатозы);
§ циррозы;
§ опухоли печени;
§ паразитарные поражения ее;
§ генетические дефекты гепатоцитов;
§ камни, опухоли, воспаления желчевыводящих путей с выраженным холестазом.
I. Внепеченочные патологические процессы:
§ шок, в том числе послеоперационный;
§ сердечная недостаточность;
§ общая гипоксия;
§ почечная недостаточность;
§ белковое голодание;
§ гипоавитаминоз Е;
§ дефицит селена;
§ эндокринопатии, в частности острая недостаточность надпочечников.
Патогенез печеночной недостаточности
Действие этиологического фактора ® изменение молекулярной архитектоники мембран гепатоцитов ® усиление свободнорадикального и перекисного окисления липидов ® частичная или полная деструкция мембран + повышение их проницаемости ® выход из лизосом их гидролаз, что потенцирует повреждение мембран клеток ® освобождение поврежденными макрофагами фактора некроза опухоли и интерлейкина-1, способствующих развитию воспалительной и иммунной реакции в печени ® образование аутоантител и аутосенсибилизированных Т-киллеров, вызывающих дополнительное аутоаллергическое повреждение гепатоцитов.
Нарушение участия печени в углеводном обмене заключается в:
- гипогликемия натощак из-за снижения способности гепатоцитов расщеплять гликоген до глюкозы и снижения активности инсулиназы;
- гипергликемия после приема пищи из-за снижения способности гепатоцитов превращать глюкозу в гликоген.
Это обусловливает характерный признак печеночной недостаточности (ПН) — неустойчивый уровень глюкозы крови.
Нарушение участия печени в липидном обмене характеризуется снижением способности гепатоцитов:
- превращать более атерогенную форму холестерина (свободный холестерин) в менее атерогенный эстерифицированный холестерин;
- образовывать липопротеиды, обладающие антиатерогенным действием (ЛПВП (a-липопротеипды)).
- образование холестериновых и пигментных камней: черные – билирубинат кальция, коричневые – билирубинат кальция + жирные кислоты (холевая, дезоксихолевая, таурохолевая).
Первые два изменения ведут к увеличению в крови уровня свободного холестерина и к снижению антиатерогенных фосфолипидов, что способствует отложению холестерина в стенках сосудов и развитию атеросклероза.
Нарушение участия печени в белковом обмене включает:
- снижение синтеза гепатоцитами альбуминов ® гипоальбуминемия и гипоонкия крови, что на стадии развития портальной гипертензии способствует развитию асцита;
- диспротеинемия — снижение количества альбуминов и увеличение содержания в плазме глобулинов.
- уменьшение биосинтеза ферментов и белков — прокоагулянтов (протромбина, проакцелерина, проконвертина) ® развитие коагулопатий (этому способствует также уменьшение всасывания в кишечнике жирорастворимого витамина К, поскольку ПН сочетается с нарушением желчеобразовательной и желчевыделительной функции печени);
- снижение активности процесса дезаминирования аминокислот и синтеза мочевины из аминогрупп и аммиака в орнитиновом цикле, что ведет к снижению в крови содержания мочевины. Дефицит a-кетоглутаровой к-ты ® снижение окисления и образования АТФ.
Нарушение биосинтеза гепатоцитами ферментов заключается в уменьшении секреции гепатоцитами в кровь образуемых ими ферментов (холинэстеразы, инсулиназы и др.). Кроме того, повреждение гепатоцитов сопровождается увеличением выхода из них в кровь внутриклеточных ферментов: аланин-трансаминазы и глютамат-трансаминазы.
Расстройство обмена витаминов состоит в:
- снижении всасывания в кишечнике жирорастворимых витаминов A, D, Е, К;
- уменьшении способности гепатоцитов превращать провитамины в активные витамины (например, каротин в витамин А);
- торможении процесса образования из витаминов коферментов (например, из пантотеновой кислоты — ацетил коэнзим А, из витамина B1 — кокарбоксилазы пирувата).
77. – Виды, механизмы возникновения и дифференциальная диагностика желтух.
Источник
Печёночная
недостаточность характеризуется стойким
снижением или полным выпадением одной,
нескольких или всех функций печени, что
приводит к нарушению жизнедеятельности
организма.
Виды
По
различным критериям (масштаб повреждения,
происхождение, скорость возникновения,
обратимость повреждений) выделяют
несколько видов печёночной недостаточности
• Происхождение.
†
Печёночноклеточная
(печёночная). Является результатом
первичного повреждения гепатоцитов и
недостаточности их функции.
† Шунтовая
(обходная). Обусловлена нарушением тока
крови в печени и в связи с этим — её
сбросом (минуя печень) по анастомозам
(портокавальным и кавокавальным) в общий
кровоток.
• Скорость
возникновения и развития.
† Молниеносная,
или фульминантная. Развивается в течение
нескольких часов.
† Острая.
Развивается в течение нескольких суток.
† Хроническая.
Формируется в течение нескольких недель,
месяцев или лет.
• Обратимость
повреждения гепатоцитов.
† Обратимая.
Наблюдается при прекращении воздействия
патогенного агента и устранении
последствий этого воздействия.
† Необратимая
(прогрессирующая). Развивается в
результате продолжающегося влияния
причинного фактора и/или неустранимости
патогенных изменений, вызванных им.
Нередко приводит к гибели пациента.
2. Причины (этиология)
Причины
развития недостаточности печени могут
быть собственно печёночными (гепатогенные
— патологические процессы и/или
воздействия, прямо повреждающие клетки
печени) и внепечёночными (негепатогенные
— патологические процессы, протекающие
за пределами печени, но вторично
повреждающие её).

Дистрофии- наиболее
часто развиваются под действием
химических веществ (например, антибиотиков,
сульфаниламидов, наркотиков; промышленных
ядов — бензола, четырёххлористого
углерода, метанола, нитрокрасок, бытовых
ядов, этанола и др. спиртов, отравлений
грибами).
Гепатиты
Гепатиты
— воспаление печени — обычно возникают
в результате вирусной инфекции или
интоксикации.
Вирусные
гепатиты — группа полиэтиологичных
вирусных поражений печени с различными
механизмами и путями передачи возбудителей.
Впервые отделить инфекционный гепатит
от прочих поражений печени предложил
выдающийся отечественный терапевт С.П.
Боткин
(1888). Клинико-морфологическая картина
заболеваний характеризуется
преимущественным развитием диффузного
воспалительного процесса в печёночной
ткани с соответствующими астеновегетативными
и общетоксическими проявлениями,
желтухой, гепатоспленомегалией и рядом
возможных внепечёночных поражений
(артриты, узелковые периартерииты,
гломерулонефриты и т.д.).
Циррозы печени
Циррозы
печени — хронически протекающие
патологические процессы в печени,
характеризующиеся прогрессирующим
повреждением и гибелью гепатоцитов,
развитием избытка соединительной ткани
(фиброзом), замещающей паренхиму.
Проявляется недостаточностью функций
печени и нарушением кровотока в ней.
Нарушения кровообращения
Из
нарушений кровообращения наибольшее
клиническое значение имеет развитие
портальной гипертензии различного
происхождения — стойкого повышения
давления в сосудах системы воротной
вены выше нормы (выше 6 мм рт.ст.).
• Наиболее
частые причины внутрипечёночной
портальной гипертензии: цирроз печени,
шистосомоз, опухоли печени, гемохроматоз.
• Портальная
гипертензия предпечёночного генеза
обусловлена блокадой притока крови по
портальным сосудам (например, в результате
сдавления, окклюзии, аневризм, тромбозов
ствола воротной или селезёночной вены).
• Подпечёночного
генеза портальная гипертензия вызвана
препятствием оттока крови от печени
(например, при констриктивном перикардите
в результате кальцификации ткани
перикарда, при тромбозе, эмболии,
сдавлении нижней полой вены).
Длительно
текущая портальная гипертензия нередко
приводит к дистрофии печени и её
недостаточности.
Нарушения
кровообращения центрального,
органно‑тканевого,
в сосудах микроциркуляторного русла
наиболее часто наблюдаются при коллапсе,
шоке, коме, сепсисе, обширных ожогах.
Другие причины
Существует
множество и других причин развития
печёночной недостаточности.
• Паразитарные
(например, шистосомоз, клонорхоз,
описторхоз, фасциолёз), опухолевые и
наследуемые поражения печени (например,
гликогенез типа IV или гемохроматоз), а
также холестаз.
• Гипоксия
различного генеза (например, циркуляторная
— при сердечной недостаточности,
тканевая — при интоксикациях, субстратная
— при СД).
• Хроническая
почечная недостаточность.
• Гипо-,
дисвитаминозы (например, гиповитаминозы
E, D, A).
• Эндокринопатии
(например, гипокортицизм, патология
паращитовидных желёз).
Общий патогенез
печёночной недостаточности
Воздействие
фактора, повреждающего гепатоциты,
формирует разветвлённую сеть
взаимозависимых и взаимопотенцирующих
изменений.
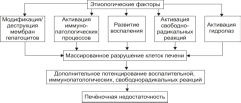
Рис.
25–4. Основные общие звенья патогенеза
печёночной недостаточности.
Модификация
и/или деструкция плазмолеммы, других
мембран и цитоскелета гепатоцитов,
развитие иммунопатологических,
воспалительных, свободнорадикальных
процессов, активация гидролаз приводит
к массированному разрушению клеток
печени, выходу в интерстиций их
содержимого, включая многочисленные
гидролитические ферменты. Названные
факторы дополнительно потенцируют
воспалительные, иммунопатологические
и свободнорадикальные реакции. Это, в
свою очередь, делает процесс поражения
печени тотальным и нарастающим по
степени.
Проявления
Печёночная
недостаточность характеризуется
признаками расстройств обмена веществ
и функций печени.
• Расстройства
обмена веществ.
† Белки.
‡ Нарушение
синтеза гепатоцитами альбуминов
проявляется гипоальбуминемией и
диспротеинемией. Гипоальбуминемия
способствует развитию отёков и
формированию асцита (в условиях повышения
давления крови в сосудах воротной вены).
‡ Торможение
синтеза белков системы гемостаза
(проконвертина, проакцелерина, фибриногена,
протромбина, факторов Кристмаса и
Стюарта‑Прауэр,
антикоагулянтных белков C и S) приводит
к гипокоагуляции белков крови, развитие
геморрагического синдрома (кровоизлияний
в ткани, кровотечений).
‡ Снижение
эффективности реакций дезаминирования
аминокислот приводит к увеличению
содержания в крови и моче аминокислот.
‡ Подавление
в гепатоцитах орнитинового цикла синтеза
мочевины из токсичного для организма
аммиака проявляется снижением повышением
концентрации аммиака в крови.
† Липиды.
‡ Нарушение
синтеза в печёночных клетках ЛПНП и
ЛПОНП нередко сопровождается развитием
липидной дистрофии печени (жирового
гепатоза).
‡ Повышение
в плазме крови уровня холестерина
(обладающего проатерогенным свойством).
† Углеводы.
Для патологии печени характерны
подавление гликогенеза, снижение
эффективности гликогенолиза, нарушения
образования глюкозы. Указанные
расстройства проявляются низкой
резистентностью организма к нагрузке
глюкозой: гипогликемией натощак и
гипергликемией вскоре после приёма
пищи, особенно углеводной.
† Витамины.
При печёночной недостаточности
развиваются гипо‑
и дисвитаминозы за счёт:
‡ нарушения
высвобождения из продуктов питания и
всасывания в кишечнике жирорастворимых
витаминов A, D, E, K,
‡ снижения
эффективности трансформации провитаминов
в витамины (например, ‑каротина
в витамин A),
‡ торможения
образования коферментов из витаминов
(например, тиаминпирофосфата из витамина
B1,
флавинмононуклеотида и динуклеотида
из витамина B2,
пиридоксаль–5–фосфата из витамина B6,
коэнзима А из пантотеновой кислоты).
† Минеральные
вещества (железо, медь, хром). Например,
при наследственной патологии —
гемохроматозе в ткани печени накапливается
железо, развиваются гепатомегалия и
цирроз.
• Нарушения
функций печени.
†
Дезинтоксикационная
функция. Характеризуется снижением
эффективности процессов детоксикации
в печени:
‡ эндогенных
токсинов (образующихся и/или накапливающихся
в кишечнике — фенолов, скатолов, аммиака,
путресцина, кадаверинов и патогенных
продуктов метаболизма — низкомолекулярных
жирных кислот, сульфатированных
аминокислот и др.).
‡ экзогенных
ядовитых веществ (например, токсинов
грибов и микробов; ядохимикатов; ЛС).
† Антимикробная
функция. При печёночной недостаточности
страдают фагоцитоз клетками фон
Купффера
различных микроорганизмов, транспорт
IgА в жёлчь, где они оказывают
бактериостатическое и бактерицидное
действие.
†
Желчеобразование
и желчевыделение (с развитием желтух и
нарушений пищеварения).
Печеночная
энцефалопатия (гепатоцеребральный
синдром) — нервно-психическое расстройство
с нарушением интеллекта, сознания,
рефлекторной деятельности и функций
жизненно важных
органов.
Выделяют острую и хроническую печеночную
энцефалопатию (последняя может длиться
годами с периодическими эпизодами
прекомы).
Различают
4 стадии
печеночной энцефалопатии.
Стадия
I — продромальная. Появляются
начальные изменения психики — замедление
мышления, нарушение поведения,
дезориентация больного в окружающей
действительности, расстройства сна
(сонливость днем, бессонница ночью),
слезливость, слабодушие. Пациенты могут
впадать в периоды оцепенения с фиксацией
взгляда. Характерным и достаточно ранним
симптомом является изменение почерка
(дизграфия). ЭЭГ, как правило, не изменена.
Стадия
II — начинающаяся кома. Усугубляются
симптомы I стадии. У части больных
появляются судороги и психомоторное
возбуждение, во время которого они
пытаются убежать из палаты. Формируются
стереотипные движения, например хлопающий
тремор рук (астериксис), оглушенность.
Больные могут стать неопрятными,
фамильярными. Часто повышается температура
тела, появляется печеночный запах изо
рта. На ЭЭГ обнаруживаются незначительные
начальные изменения.
Стадия
III — ступор. Пациенты
пребывают в длительном сне, прерываемом
редкими пробуждениями. В неврологическом
статусе отмечаются ригидность мускулатуры,
маскообразное лицо, замедление
произвольных движений, грубые нарушения
речи (дизартрия), гиперрефлексия, клонус
коленной чашечки и др. На ЭЭГ выявляются
глубокие нарушения, форма кривой
приближается к изолинии.
Стадия
IV — кома. Теряется
сознание, отсутствует реакция на болевой
раздражитель, в начальной фазе отмечаются
патологические рефлексы. В дальнейшем
зрачки расширяются, рефлексы угасают,
падает артериальное давление, может
появиться дыхание Куссмауля или
Чейна-Стокса и наступает смерть.
Следовательно, печеночная
кома —
это терминальная стадия печеночной
энцефалопатии, характеризующаяся
утратой сознания, отсутствием рефлексов
и нарушением основных функций органов.
Факторы,
провоцирующие быстрое развитие комы:
белковая пища, прием диуретиков (не
сберегающих калий), седативных средств.
Летальность больных, находящихся в IV
стадии, достигает 80-90%.
По этиологии выделяют
4 вида комы: 1)
эндогенная; 2) экзогенная; 3) смешанная;
4) электролитная.
Эндогенная (истинная)
кома развивается при массивном некрозе
гепатоцитов в случаях острой печеночной
недостаточности, при этом характерно
нарушение многих функций печени, у
пациентов отмечаются выраженная
кровоточивость, повышение уровня
свободного билирубина в крови,
гиперазотемия печеночного типа,
печеночный запах изо рта. Лечению
поддается с трудом.
Экзогенная (шунтовая,
обходная) кома чаще возникает при
циррозах в случае развития мощных
коллатералей между системами воротной
и нижней полой вен. Также может возникать
при искусственном наложении портокавальных
анастомозов, по которым кровь из
кишечника, богатая биологически активными
веществами (БАВ — аммиак, кадаверин,
путресцин и др.), минуя печень, вливается
в общий кровоток и оказывает токсический
эффект на мозг. Эта форма легче поддается
терапии (диализ крови, очищение кишечника,
антибиотики широкого спектра действия),
имеет более благоприятный прогноз.
Чаще
наблюдается смешанная кома,
которая развивается при далеко зашедшем
циррозе печени с гибелью большого числа
гепатоцитов и наличием портокавальных
анастомозов.
Электролитная кома
связана с развитием гипокалиемии. В
патогенезе играют роль вторичный
альдостеронизм, применение мочегонных
препаратов, не сберегающих калий, частые
рвоты, поносы, что приводит к нарушению
электролитного баланса (гипокалиемия,
алкалоз). Проявляется резкой слабостью,
снижением тонуса мышц, адинамией,
судорожными подергиваниями икроножных
мышц, нарушением сердечной деятельности
(тахикардия, ритм «дятла»), нарушением
дыхания. Лечение электролитной комы —
применение препаратов калия.
Патогенез
печеночной энцефалопатии и комы. Механизм
развития печеночной энцефалопатии
изучен не до конца. Существуют три
наиболее распространенных теории:
1.
Теория токсического действия
аммиака. Аммиак
образуется во всех тканях, где происходит
обмен белков и аминокислот. Однако
наибольшее его количество поступает в
кровяное русло из желудочно-кишечного
тракта. Источником аммиака в кишечнике
служат любые вещества, содержащие азот:
распадающиеся белки пищи, некоторые
полипептиды, аминокислоты и мочевина,
поступившие из крови. Высвобождение
аммиака происходит с помо-
щью
ферментов — уреаз и аминоацидооксидаз
кишечной микрофлоры и слизистой
кишечника. 80% аммиака, поступающего из
кишечника через портальную вену в
печень, превращается в мочевину
(орнитиновый цикл). Из аммиака, не
включенного в орнитиновый цикл, а также
различных амино- и кетокислот (глутамат,
α-кетоглутарат и др.) под влиянием
глутамат-синтетазы образуется глутамин.
Оба механизма предотвращают попадание
токсичного аммиака в общий кровоток.
Но при печеночной недостаточности
наблюдается повышение концентрации
аммиака не только в крови, но и в мозговой
жидкости. Поступление катионов аммония
через гематоэнцефалический барьер в
нейроны головного мозга вызывает их
энергетическое голодание (аммиак
соединяется с α-кетоглутаровой кислотой
с образованием глутамина, вследствие
этого наблюдается отток α-кетоглутарата
из ЦТК, что приводит к снижению синтеза
АТФ) и как следствие к нарушению функции
клеток ЦНС.
2. Теория
ложных нейротрансмиттеров (transmitto —
передаю). Нарушение функции печени
способствует снижению концентрации
аминокислот с разветвленной цепью —
валина, лейцина, изолейцина, которые
используются как источник энергии, и
повышению уровня ароматических
аминокислот — фенилаланина, тирозина,
триптофана (метаболизм их в норме
осуществляется в печени, при заболеваниях
печени концентрация этих аминокислот
возрастает не только в крови, но и в моче
— аминоацидурия). В норме соотношение
между аминокислотами с развлетвленной
цепью и ароматическими аминокислотами
составляет 3-3,5. При патологии этот
показатель снижается. Для перечисленных
аминокислот существует единая транспортная
система, и ароматические кислоты
используют освободившуюся транспортную
систему для проникновения через ГЭБ в
мозг, где тормозят ферментную систему,
участвующую в синтезе нормальных
медиаторов. Снижается синтез дофамина
и норадреналина и образуются ложные
нейтротрансмиттеры (октопамин,
β-фенилэтиламин и др.).
3. Теория
усиленной ГАМКергической передачи. Суть
данной теории заключается в том, что
при патологии нарушается клиренс ГАМК
в печени (ГАМК образуется в реакции
декарбоксилирования глутаминовой
кислоты). ГАМК накапливается в ткани
мозга, оказывая ингибирующий эффект на
нейроны, нарушая их функцию, что приводит
к развитию печеночной энцефалопатии.
Кроме
того, существенную роль в механизме
развития печеночной энцефалопатии и
комы играют роль и другие нарушения:
интоксикация, кислотно-основные,
водно-электролитные (гипокалиемия,
гипернатриемия) и гемодинамические
расстройства.
Соседние файлы в предмете Патологическая физиология
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
