Мкб код прогрессирующего мышечного дистрофии
Содержание
- Описание
- Симптомы
- Течение и стадии
- Причины
- Лечение
- Профилактика
Названия
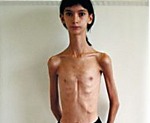
Прогрессирующая мышечная дистрофия Дюшена.
Описание
Мышечная дистрофия Дюшенна — наследуемая прогрессирующая мышечная дистрофия, характеризующаяся началом в раннем возрасте, симметричной атрофией мышц в сочетании с сердечно-сосудистыми, костно-суставными и психическими нарушениями, злокачественным течением.
Симптомы
Первые признаки заболевания проявляются в 1-3 года жизни слабостью мышц тазового пояса. Уже на 1-м году обращает на себя внимание отставание детей в моторном развитии. Они, как правило, с задержкой начинают садиться, вставать, ходить. Движения неловкие, при ходьбе дети неустойчивы, часто спотыкаются, падают. В 2-3 года появляются мышечная слабость, патологическая мышечная утомляемость, проявляющаяся при физической нагрузке — длительной ходьбе, подъеме на лестницу, изменение походки по типу «утиной». В этот период обращает на себя внимание своеобразная «стереотипная» динамика движений детей во время вставания из горизонтального положения, с положения на корточках или со стула. Вставание происходит поэтапно с активным использованием рук — «взбирание лесенкой» или «взбирание по самому себе». Атрофии мышц всегда симметричны. Вначале они локализуются в проксимальных группах мышц нижних конечностей — мышцах тазового пояса, бедер, а через 1-3 года быстро распространяются в восходящем направлении на проксимальные группы мышц верхних конечностей — плечевой пояс, мышцы спины. Вследствие атрофии появляются лордоз, «крыловидные» лопатки, «осиная» талия. Типичным, «классическим» симптомом заболевания является псевдогипертрофия икроножных мышц. При пальпации мышцы плотные, безболезненны. У многих больных в результате селективного и неравномерного поражения различных групп мышц рано возникают мышечные контрактуры и сухожильные ретракции. Мышечный тонус снижен преимущественно в проксимальных группах мышц. Глубокие рефлексы изменяются с различной последовательностью. В ранних стадиях болезни исчезают коленные рефлексы, позже — рефлексы с двуглавой и трехглавой мышц. Ахилловы рефлексы длительное время остаются сохранными.
Одной из отличительных особенностей миодистрофии Дюшенна является сочетание данной формы с патологией костно-суставной системы и внутренних органов (сердечно-сосудистой и нейроэндокринной систем). Костно-суставные нарушения характеризуются деформациями позвоночника, стоп, грудины. На рентгенограммах обнаруживают сужение костномозгового канала, истончение коркового слоя длинных диафизов трубчатых костей.
Сердечно-сосудистые расстройства клинически проявляются лабильностью пульса, артериального давления, иногда глухостью тонов и расширением границ сердца. На ЭКГ регистрируются изменения миокарда (блокада ножек пучка Гиса и ). Нейроэндокринные нарушения встречаются почти у половины пациентов. Чаще других даются синдром Иценко-Кушинга, адипозогенитальная дистрофия Бабинского-Фрелиха. Интеллект у многих больных в различной степени (от легкой дебильности до имбецильности).
Течение и стадии
Течение быстро прогрессирующее. Значительные двигательные расстройства равиваются ко второму десятилетию жизни и ограничивают самостоятельное передвижение больных. Смерть наступает на втором или третьем десятилетии жизни обычно от пневмонии.
Причины
Наследуется по рецессивному, сцепленному с Х-хромосомой типу. Доброкачественное течение такой миодистрофии имеет вариант мышечной дистрофии Беккера. Заболевание описано Дюшенном в 1853 г.
Частота 3,3 на 100 000 населения, 14 на 100 000 родившихся. В подавляющем большинстве случаев болеют мальчики. Случаи заболевания у девочек крайне редки, хотя и возможны при кариотипе ХО и при структурных аномалиях хромосом (Хр21,2, ген DMD дистрофина).
Лечение
Лечение направлено на поддержание физической активности пациента и улучшения качества его жизни. Использование прозов позволяет больным двигаться и замелдляет формирование сколиоза. Разрабатывается генная терапия (гены дистрофина и утрофина). Симптоматическое лечение.
При наличии контрактур и фиксации суставов показано ортопедическое вмешательство.
Лекарственная терапия: преднизолон по 0,75 мг/кг/сут. Увеличивает мышечную массу у мальчиков, страдающих мышечной дистрофией Дюшенна, замедляя прогрессирование болезни.
Профилактика
Профилактика состоит в генетическом консультировании родителей.
Источник
Содержание
- Описание
- Дополнительные факты
- Причины
- Симптомы
- Диагностика
- Дифференциальная диагностика
- Лечение
Названия
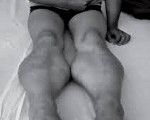
Название: Прогрессирующая мышечная дистрофия Беккера.
Прогрессирующая мышечная дистрофия Беккера
Описание
Прогрессирующая мышечная дистрофия Беккера. Вариант наследственной сцепленной с Х — хромосомой миодистрофии, отличающейся более замедленным и доброкачественным течением. Заболевание характеризуется постепенно усугубляющейся и распространяющейся мышечной слабостью, гипотонией и атрофией, первоначально возникающей в мышцах бедер и тазового пояса. Диагностический поиск включает неврологическое обследование, консультацию генетика и кардиолога, нейрофизиологическое тестирование нервно-мышечного аппарата, ДНК диагностику, биопсию мышц с морфологическим, иммунологическим и гистохимическим изучением полученных образцов. Лечение симптоматическое и, к сожалению, малоэффективное. Прогрессирование болезни приводит к потери больными способности самостоятельно передвигаться к возрасту 40 лет.
Дополнительные факты
Прогрессирующая мышечная дистрофия Беккера впервые была описана в 1955 г. Как доброкачественный вариант течения мышечной дистрофии Дюшенна. В последующем многочисленные исследования в области неврологии, генетики и биохимии обнаружили существенные отличия в характере течения, биохимической и морфологической основе этих заболеваний. В результате клиническая форма Беккера была выделена как самостоятельная нозология.
Мышечная дистрофия Беккера входит в группу миопатий (миодистрофий) — заболеваний, возникающих вследствие нарушений строения и метаболизма мышечной ткани и проявляющихся мышечной слабостью. Патология наследуется рецессивно сцеплено с Х-хромосомой, поэтому болеют только лица мужского пола. Частота встречаемости составляет 1 новорожденный на 20 тыс. Детей.
Прогрессирующая мышечная дистрофия Беккера
Причины
В основе заболевания лежит мутация в гене, ответственном за кодирование белка дистрофина. Примерно 30% от общего числа случаев мышечной дистрофии Беккера приходится на т. Н. «свежие» мутации. Ген располагается в 21 локусе (в регионе Хр21. 2–р21. 1) короткого плеча Х-хромосомы. Примерно у 65-70% больных обнаруживаются крупные делеции указанного участка, у 5% — дупликации, у остальных — точковые мутации. Указанные структурные перестройки гена не влекут за собой полного прекращения синтеза дистрофина, как при дистрофии Дюшенна, а потенцируют синтез аномального усеченного белка, в некоторой степени способного выполнять свои функции. Это и обуславливает более доброкачественный характер дистрофии Беккера в сравнении с вариантом Дюшенна.
В норме белок дистрофин поддерживает целостность сарколеммы — мембраны миоцитов (мышечных волокон), обеспечивает эластичность и устойчивость миофибрилл при мышечном сокращении. Неспособность аномального дистрофина адекватно выполнять эти функции приводит к нарушению целостности мембран мышечных волокон. В следствие этого происходят дегенеративные изменения цитоплазматических компонентов последних и повышенная транспортировка ионов калия внутрь миоцитов. Результатом таких биохимических и морфологических сдвигов является гибель миофибрилл и разрушение мышечных волокон. На месте погибших миоцитов происходит образование соединительной ткани, что обуславливает феномен псевдогипертрофии — увеличение объема и плотности мышцы при резком снижении ее сократительной способности.
Симптомы
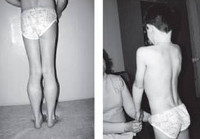
Прогрессирующая мышечная дистрофия Беккера манифестирует обычно в период от 10 до 15 лет, в некоторых случаях раньше. Начальными признаками заболевания выступают чрезмерная утомляемость и мышечная слабость в тазовом поясе и нижних конечностях. У ряда пациентов первыми проявлениями являются периодические болезненные мышечные судороги (крампи), локализующиеся в ногах. Мышечная слабость обуславливает затруднение при подъеме по лестнице, при необходимости встать из положения сидя. Со временем формируется переваливающаяся «утиная» походка. Для того, чтобы встать, пациент вынужден использовать вспомогательные миопатические приемы — опираться руками о расположенные рядом предметы мебели или, при отсутствии таковых, использовать в качестве опоры собственное тело (симптом Говерса).
Как и другие наследственные миопатии, заболевание Беккера характеризуется симметрично развивающимися атрофиями мышц. В первую очередь поражаются мышцы бедра и тазового пояса, затем процесс распространяется на мускулатуру плечевого пояса и проксимальных мышц рук. В начале болезни формируются псевдогипертрофии, наиболее выраженные в икроножных, дельтовидных, трех- и четырехглавых мышцах. По мере прогрессирования миодистрофии они трансформируются в мышечные гипотрофии.
Слабость в руках. Слабость мышц (парез). Судороги.
Диагностика
Прогрессирующая мышечная дистрофия Беккера диагностируется неврологом на основании анамнеза, клинических данных, дополнительных обследований и генетического тестирования. В неврологическом статусе наблюдается снижение мышечной силы и умеренное снижение мышечного тонуса в проксимальных отделах конечностей, выпадение коленных рефлексов при симметричном снижении сухожильных рефлексов дистальных отделов ног и верхних конечностей, полная сохранность чувствительности.
Среди клинических анализов наибольшее значение имеет биохимический анализ крови, который выявляет многократное повышение уровня КФК. Данные электронейрографии позволяют исключить поражение нервных волокон, электромиография свидетельствует о первично-мышечном типе поражения. Биопсия мышц проводится только после отрицательных результатов генетического анализа. Морфологическое исследование полученного материала определяет диффузную разнокалиберность, дистрофические и некротические изменения мышечных волокон, разрастание соединительной ткани. Проводится специальное иммунное окрашивание образцов с последующим определением наличия в них дистрофина.
Подтвердить диагноз мышечной дистрофии Беккера позволяет консультация генетика с проведением анализа ДНК. Выявление дупликаций или делеций в гене Хр21 дает возможность установить точный диагноз. Отрицательный результат анализа ДНК не говорит об отсутствии патологии, поскольку могут иметь место точковые мутации, поиск которых представляет собой сложную и более дорогостоящую процедуру.
С целью выявления сердечной патологии назначается электрокардиография, Эхо-КГ, консультация кардиолога. Кардиологическое обследование может обнаружить нарушение внутрижелудочковой проводимости, АВ-блокаду, дилатацию желудочков, гипертрофические изменения миокарда, кардиомиопатию, сердечную недостаточность.
Дифференциальная диагностика
Дифференциальная диагностика проводится с прогрессирующей мышечной дистрофией Дрейфуса, миодистрофией Дюшена, мышечной дистрофией Эрба-Рота, метаболической миопатией, полимиозитом и дерматомиозитом, воспалительной миопатией, спинальной амиотрофией, наследственной полиневропатией.
Пренатальная диагностика рекомендована, когда мать является носителем патогенного гена. Если ребенок мужского пола, то вероятность развития заболевания у него составляет 50%. Биопсия хориона может проводиться в сроке 11-14 нед. Беременности, амниоцентез — после 15-й недели, забор пуповинной крови (кордоцентез) — на сроке больше 18 нед.
Лечение
На современном этапе несколькими группами ученых ведутся настойчивые исследования в области поиска эффективных методов лечения прогрессирующих миодистрофий. В настоящее время пациенты получают в основном метаболическую и симптоматическую терапию. Разработаны различные схемы лечения, позволяющие улучшить двигательные возможности больного и несколько замедлить прогрессирование болезни. Пациентам назначают актопротекторы (этилтиобензимидазол), неостигмин, АТФ, анаболические стероиды (метиландростендиол), сердечные средства. По вопросу длительной терапии глюкокортикоидами (преднизолоном) клиницисты имеют различные мнения. Одни считают, что подобное лечение тормозит прогрессирование миодистрофии, другие отвергают это предположение.
Наблюдения показали, что постельный режим усугубляет мышечную слабость. Поэтому пациентам рекомендуется умеренная физическая активность, занятия плаваньем. Поддержание мышечной эластичности и силы, а также профилактика контрактур проводится средствами массажа, физиотерапии и лечебной гимнастики. По показаниям проводится хирургическое лечение контрактур. Применение различных ортопедических средств (ходунков, инвалидных колясок, фиксаторов для ног, экзоскелетов) позволяет расширить двигательные возможности пациентов и их способность к самообслуживанию. По показаниям проводится хирургическое лечение контрактур.
Источник
Содержание
- Описание
- Дополнительные факты
- Причины
- Симптомы
- Диагностика
- Дифференциальная диагностика
- Лечение
Названия
Название: Прогрессирующая мышечная дистрофия Дрейфуса.

Прогрессирующая мышечная дистрофия Дрейфуса
Описание
Прогрессирующая мышечная дистрофия Дрейфуса. Наследственная мышечная миодистрофия, отличающаяся медленным прогрессированием, ранним развитием локтевых контрактур, ретракций шейных мышц и ахилловых сухожилий, сопутствующими нарушениями сердечной проводимости. Заболевание может наследоваться, как сцеплено с Х-хромосомой, так и аутосомно. Мышечная слабость и гипотрофии проявляются преимущественно в мышцах голени и проксимальных отделов рук. Диагностический алгоритм включает исследование неврологического статуса, биохимию крови, ЭМГ и ЭНГ, рентгенографию органов грудной клетки, ЭКГ, эхокардиографию, генеалогический анализ, ДНК-диагностику. Лечение симптоматическое. Могут потребоваться ортопедические операции и имплантация электрокардиостимулятора.
Дополнительные факты
Мышечная дистрофия Дрейфуса отличается более медленным развитием мышечной слабости, ранним образованием контрактур и сухожильных ретракций, тяжелыми поражениями проводящей системы сердца, требующими имплантации кардиостимулятора. С 1961 года британский невролог Дрейфус и его американский коллега доктор Хоган совместно изучали большую семью, члены которой страдали от миодистрофии, наследуемой сцеплено с Х-хромосомой. Первоначально исследователи считали заболевание доброкачественным клиническим вариантом прогрессирующей миодистрофии Дюшенна, однако в ходе многолетних наблюдений они пришли к выводу о необходимости его выделения в самостоятельную нозологическую единицу. Последующие успехи генетики и биохимии, позволившие установить этиопатогенетический субстрат болезни, подтвердили доводы Дрейфуса и Хогана.

Прогрессирующая мышечная дистрофия Дрейфуса
Причины
Прогрессирующая мышечная дистрофия Дрейфуса является генетически детерминированной патологией и представлена тремя вариантами: рецессивным Х-сцепленным и аутосомными — доминантным и рецессивным. Первый вариант обусловлен мутациями в гене EMD, расположенном на участке Xq26. 3 Х-хромосомы и отвечающем за кодирование синтеза белка эмерина. Аутосомные варианты возникают при генетических аберрациях в регионе 1q21. 2-q21. 3 1-й хромосомы в гене LMNA/C, кодирующем белки ламины A и C. При наличии одной мутации в указанном гене отмечается аутосомно-доминантный тип наследования, а при двух мутациях — аутосомно-рецессивный.
Ламины А/С и эмерин входят в состав мембраны ядерной оболочки миоцитов, поддерживают ее структуру и функции. Недостаток этих белков приводит к нарушению строения мышечных волокон, что наиболее выражено в скелетной и сердечной мышечной ткани. Наблюдения показывают, что при однотипных мутациях мышечная дистрофия Дрейфуса может иметь различные фенотипические проявления, варьирующие от самого мягкого до наиболее тяжелого клинического течения.
Симптомы
Как правило, мышечная дистрофия Дрейфуса манифестирует в возрасте от 5 до 16 лет. Первыми симптомами заболевания выступают контрактуры локтевых суставов, ретракция (укорочение) мышц заднешейной группы и ахилловых сухожилий. Изменения в шейных мышцах обуславливают вынужденное запрокидывание головы назад и ограничение подвижности позвоночника в шейном отделе. Укорочение ахилловых сухожилий приводит к ходьбе с опорой на наружные края стоп или с постановкой ног на носочки.
Мышечная слабость и гипотрофии обычно появляются позже, вначале малозаметны и характеризуются медленным прогрессированием. В первую очередь поражаются мышцы перонеальной группы (расположенные на внешней стороне голени), мускулатура плечевого пояса и проксимальных отделов верхних конечностей. В отличие от прогрессирующей мышечной дистрофии Беккера, для миодистрофии Дрейфуса не характерны псевдогипертрофии мышц голеней. Мышцы лица остаются интактными. В некоторых случаях наблюдается сколиоз, вызванный ретракцией паравертебральных мышц и контрактурами межпозвоночных суставов. При этом искривление позвоночника носит стабильный характер и не усугубляется со временем.
Развитие детей до возникновения болезни адекватно возрастным нормам. После манифестации миодистрофия медленно прогрессирует вплоть до 20-летнего возраста, когда наблюдается стабилизация процесса. В большинстве случаев пациенты сохраняют способность ходить, подниматься по лестнице, вставать из положения сидя на корточках, не прибегая к приемам Говерса. Главным, отягощающим течение болезни фактором, является патология сердечной мышцы с нарушением сердечной проводимости.
Слабость в руках. Слабость мышц (парез).
Диагностика
Дистрофия Дрейфуса диагностируется совместными усилиями специалистов в области неврологии и генетики. Для выявления сердечной патологии обязательна консультация кардиолога, при наличии деформаций позвоночного столба и контрактур — консультация ортопеда.
Неврологический осмотр определяет умеренное снижение мышечной силы в проксимальных отделах верхних конечностей (бицепс и трицепс плеча, дельтовидная мышца и тд ) и дистальных отделах ног (перонеальные мышцы), гипотонию и гипотрофию указанных мышечных групп, сухожильную арефлексию, полную сохранность сенсорной функции. Дополнительно назначаются электронейрография и электромиография, результаты которых указывают на первично-мышечный тип поражения и позволяют исключить другие нервно-мышечные заболевания (миастению, синдром Гийена-Барре, БАС).
В биохимическом анализе крови отмечается умеренное или незначительное повышение уровня КФК (креатинфосфокиназы). Микроскопия образцов, взятых путем биопсии мышц, выявляет наличие гипер- и атрофированных мышечных волокон, отсутствие ядерного окрашивания миоцитов. Характерными ранними изменениями на электрокардиограмме являются снижение амплитуды волны P и удлинение PR-интервала. При отсутствии изменении ЭКГ рекомендовано проведение холтеровского мониторирования. Увеличение границ сердца по данным рентгенографии грудной клетки говорит о наличии кардиомиопатии. Установить более точный кардиологический диагноз позволяет ЭхоКГ.
Окончательный диагноз миодистрофии Дрейфуса может быть подтвержден генетиком по результатам генеалогического анализа и ДНК-диагностики.
Дифференциальная диагностика
Дифференциальный диагноз осуществляется с мышечной дистрофией Эрба-Рота, миодистрофиями Дюшенна и Беккета, метаболической миопатией, дерматомиозитом и тд заболеваниями.
Лечение
Прогрессирующая мышечная дистрофия Дрейфуса, как и другие генные заболевания, не имеет пока эффективного специфического лечения. Проводимая неврологами терапия направлена на поддержание оптимального метаболизма мышц и периферической нервной системы, облегчение нервно-мышечной передачи, предупреждение тромбообразования и церебральной эмболизации, приводящей к инсульту. В рамках этого пациенты получают медикаментозные курсы, включающие назначение АТФ, пентоксифиллина, витаминов В, неостигмина.
Для длительного сохранения больными двигательной функции рекомендовано регулярное проведение массажа и постоянные занятия лечебной физкультурой. В комплексном симптоматическом лечении эффективна физиотерапия — электрофорез неостигмина, тепловые процедуры, водолечение. При образовании контрактур для восстановления способности пациентов самостоятельно двигаться проводят ортопедические операции — тенотомию, тенолиз ахиллова сухожилия, хирургическое устранение локтевых контрактур.
Ведущую роль в терапии дистрофии Дрейфуса играет кардиологическое лечение. Выявление брадикардии является показанием к имплантации электрокардиостимулятора. При развитии желудочковой аритмии (обычно в позднем периоде заболевания) предпочтительнее установка кардиовертер-дефибриллятора.
Источник
