Врожденный и инфантильный нефротический синдром у детей

Согласно МКБ, нефротический синдром – это не диагноз, а несколько объединенных симптомов. К ним относятся белок в моче, уменьшение содержания вещества в плазме, повышенное количество жиров в крови. Внешне состояние сопровождается отеками. Встречается оно нечасто: на 100 тысяч детей 14-16 случаев. Наблюдается зависимость от пола. В раннем возрасте девочки болеют в 2 раза реже. Ближе к подростковому периоду частота заболевания одинаковая.
Чаще всего синдром легко поддается лечению. При таком диагнозе больных помещают в стационар. Там исследуют состояние почек и ищут первопричину.
Характеристика нефротического синдрома у детей
Появление нефротического синдрома (не стоит путать с нефритическим!) может быть связано с почечными болезнями и патологиями, воспалительными процессами. Выделяют первичную (у новорожденного) и вторичную форму.

Провоцирующие факторы и механизм развития
Врожденный нефротический синдром у детей возникает из-за нарушения в строении генов, у младенцев меняется структура фильтрующего органа, нарушаются его функции. Иногда патология может появляться из-за инфекции: токсоплазмоз, краснуха, сифилис, гепатит, герпес. При этом поражается сразу несколько внутренних органов. К нефрозу приводят также изменения в обмене веществ. Возникают они из-за генетической предрасположенности, неправильной работы надпочечников и щитовидной железы. При неустановленном патогенезе патологию называют идиопатическим нефротическим синдромом у детей.
Важно знать! При вторичной форме не всегда удается найти причину возникновения. Сложность диагностики заключается в том, что инфантильный нефроз появляется из-за множества болезней.
Считается, что нефротический синдром связан с аутоиммунными процессами. В почках накапливаются циркулирующие иммунные комплексы. Они появляются в результате взаимодействия антител с внешними и внутренними антигенами. Это приводит к воспалению фильтрующего органа, к закупорке каналов, гломерулонефриту, нарушению циркуляции, утончению стенок. Из-за этого обратное всасывание белка происходит неправильно, и он проникает в урину.
Основные симптомы
Первоначальным и самым явным признаком является выраженная отечность. Возникает она из-за недостатка соединений из белка в организме. Если синдром будет развиваться, могут появиться другие симптомы.
В начале болезни можно заметить интоксикацию. Отеки распространяются быстро, за несколько часов они с голени могут дойти бедра. На данном этапе может быть поставлен ошибочный диагноз отек Квинке из-за схожей симптоматики. Кроме анамнеза и осмотра, необходимо пройти лабораторные исследования.
При нефротическом синдроме проводят изучение анализов на микропрепарате. Исследования отразят увеличение следующих показателей:
- СОЭ;
- тромбоциты;
- альбумины;
- жировые соединения;
- глобулины;
- уровень белка.
В запущенных вариантах наблюдается кровь в урине, гипертония. Поэтому необходимо диагностировать синдром как можно раньше.
Помимо отеков, возможны следующие клинические симптомы:
- повышенное сердцебиение;
- чувство сухости в рту;
- учащенное дыхание;
- тошнота, рвота;
- упадок сил;
- учащенное мочеиспускание;
- боль в животе.
Из-за отечности и обезвоживания в скором времени кожа становится сухой и трескается. Симптомы обычно ярко выражены. На основании всех полученных данных составляется история болезни, назначается лечение.
Варианты осложнений
Проблемы возникают чаще всего из-за утраты белка. Увеличивается токсичность применяемых лекарств, которые связаны с альбумином. Ослабляется иммунитет организма, что в свою очередь приводит к частым болезням и инфекциям. Может развиться анемия в связи с недостатком железа.
Увеличивается шанс появления атеросклероза. Из-за недостатка витамина Д может появиться рахитоподобный синдром. У детей бывает увеличенная кровоточивость.
Важно знать! При синдроме в районе грудной клетки может застаиваться жидкость. Такое явление приводит к отеку легкого. Дыхание будет затруднено, губы посинеют, появится одышка.
Иногда в детском возрасте из-за осложнения появляются новые аллергические реакции на отдельные компоненты лекарств. Выражается это в бессоннице, изменчивом настроении, нарушении работы желудочно-кишечного тракта.

Диагностирование патологии
Главным этапом в постановке диагноза являются результаты лабораторного исследования урины и крови. Помимо этого, проводится осмотр, анамнез.
Могут быть назначены следующие исследования:
- бакпосев, общий анализ мочи;
- урина по Нечипоренко, Зимницкому;
- общий анализ крови, иммунологическое исследование;
Дополнительно изучают осадок, делают рентген и УЗИ фильтрующего органа и мочевыделительной системы в целом.
Лечение нефротического детского синдрома
Лечат синдром в стационаре. Почти в каждой больнице существует свое нефрологическое отделение. Оно оборудовано всеми необходимыми инструментами для исследования и контроля над лечением.
Медикаменты
На начальном этапе терапию проводят с помощью «Преднизолона». Чаще всего он помогает. Вводится по 2 миллиграмма на килограмм веса каждый день. Прием препарата длится 2,5-2 месяца. Если есть положительная реакция, дозировку немного уменьшают. Начинают лечение в стационаре, а затем, если есть эффект, пациента выписывают домой. В дальнейшем «Преднизолон» могут назначать с меньшей частотой приема (не каждый день) в качестве поддерживающей терапии.
Принимают стероиды в течении полугода. У лекарств есть много побочных эффектов. Узнавая о них, дети и родители хотят отказаться или вовсе перестают пить препараты. Особенно часто это происходит, когда у больного есть положительная реакция. Однако отказ от терапии опасен. Отмена приема приводит к обострению заболевания. Оно вернется в тяжелой форме, могут возникнуть осложнения.
Важно знать! Поэтому важно до детей и родителей донести необходимость длительного приема. Только полное лечение приведет к избавлению от синдрома. Побочные эффекты от стероидов не постоянные, они пройдут по истечении какого-то времени. Вес становится нормальным, кости крепче, голова перестает болеть, перемены настроения исчезают.
Когда возникает острый нефротический синдром у детей, его также лечат «Преднизолоном», но курс составляет 3-4 месяца.
Иногда прием стероидов не помогает. В таком случае ждут 1,5-2 месяца и, если положительной реакции нет, меняют курс лечения. Выписываются гормоны. Пьются они в большой дозировке через определенные интервалы.
Если и это не помогает, проводят биопсию почки. Исследование нужно для того чтобы определить, является ли нефрит идиопатическим или возможно установить его форму. Могут быть назначены иммуносупрессоры и цитостатики.
Диета
Иногда нефротический синдром возникает повторно. В таких случаях помимо лечения препаратами может быть назначена специальная диета. Она помогает справиться с отечностью и обезвоживанием. Включает в себя следующие рекомендации:
- Нельзя есть блюда с сильными приправами и пряностями.
- Питье должно быть ограниченным и зависит от диуреза. Ребенку можно пить только такой объем воды, который был выделен в прошлые сутки. Допускается погрешность в плюс/минус 15 миллилитров на килограмм.
- Не рекомендуется принимать в пищу бульоны и копчености.
- Следует убрать соль из рациона.
Когда спадут отеки, можно будет принимать блюда с небольшим содержанием соли. Жидкость начинают пить независимо от объема диуреза.
При остром типе синдрома рекомендуется постельный режим. При этом назначаются облегченные занятия ЛФК. Они нужны чтобы предотвратить запоры, переломы и поддержать мышцы в активном состоянии.
Прогноз лечения
Когда заболевание поддается лечению стероидами, прогноз бывает хорошим. Симптомы исчезают относительно рано. Чаще всего, в 90% случаях, болезнь больше не возвращается, происходит полное выздоровление.
Однако будущее может стать не таким радужным из-за возможных осложнений. К ним относятся инфекции, азотемия, тромбоз вен, гематурия и артериальная гипертензия. Пересадка почки также увеличивает риск развития последствий и рецидивов.
Те синдромы, которые не удается устранить глюкокортикоидами, проходят тяжелее. Подбор терапии осуществляется дольше, лечение будет сложнее.
Профилактика
Как таковых мер предотвращения синдрома не существует. В данном случае стараются следовать общим рекомендациям при заболеваниях мочевыводящих путей и почек. К ним относятся своевременное лечение ОРВИ, избегание переохлаждения, правильное питание и физические нагрузки, позволяющие укрепить иммунитет.
При синдроме также важно полностью лечить имеющиеся хронические или острые заболевания фильтрующего органа и его патологий. Некоторые препараты имеют нефротоксический эффект, например, «Нормопрес». Поэтому перед их применением обязательно нужно проконсультироваться с врачом.
 В целом, здоровье ребенка необходимо контролировать. Избегайте перегрева и простуд. Положительный эффект для иммунитета дает закаливание. При возникновении болезней или наличии симптомов нужно своевременное лечение. Запускать заболевание нельзя. Иногда стоит посещать врача нефролога для осмотра и консультации.
В целом, здоровье ребенка необходимо контролировать. Избегайте перегрева и простуд. Положительный эффект для иммунитета дает закаливание. При возникновении болезней или наличии симптомов нужно своевременное лечение. Запускать заболевание нельзя. Иногда стоит посещать врача нефролога для осмотра и консультации.
Нефротический синдром – это несколько симптомов, которые объединены в одну группу. Возникает он на фоне других заболеваний. Главным проявлением является отечность. Диагностика проводится на основании анамнеза и анализов крови и мочи.
Лечение проводят сначала в стационаре, затем амбулаторно. При своевременном обнаружении и успешной терапии риск возникновения рецидива мал. Профилактики для нефроза не существует, нужно придерживаться общих рекомендация для укрепления здоровья.
Источник
Вторичный и врожденный нефротические синдромы у детей. Диагностика
Нефротический синдром может быть также вторичным проявлением многих поражений почечных клубочков: мембранозная нефропатия, мезангиокапиллярный, постинфекционный и волчаночный гломерулонефрит, геморрагический васкулит. Вторичный нефротический синдром следует подозревать у больных старше 8 лет при наличии артериальной гипертонии, гематурии, нарушения функции почек, внепочечных симптомов (сыпь, артралгия и др.) или низкого уровня комплемента в крови.
В некоторых регионах мира ведущими причинами нефротического синдрома являются малярия и шистосомоз. Вызывают нефротический синдром вирусы гепатита В и С, филярии, возбудитель проказы и ВИЧ.
Нефротический синдром сопутствует злокачественным опухолям, особенно у взрослых. У больных с солидными опухолями (например раком легкого, желудка или кишечника) почечная патология часто напоминает мембранозную нефропатию. По видимому, в этих случаях в почках откладываются комплексы опухолевых антигенов со специфическими антителами. При лимфомах, особенно лимфоме Ходжкина, поражение почек чаще всего напоминает болезнь минимальных изменений. Предполагается, что продуцируемый лимфомой лимфокин увеличивает проницаемость стенки клубочковых капилляров. Нефротический синдром возможен и до обнаружения опухоли, но исчезает при ее регрecce и возобновляется при рецидиве.
К развитию нефротического синдрома приводит также многочисленные лекарственные средства и химические вещества. Гистологическая картина почек в этих случаях может напоминать мембранозную нефропатию (пенициллин, каптоприл, препараты золота, НПВС, соединения ртути), болезнь минимальных изменений (пробенецид, этосуксимид, метимазол, литий) или мезангиокапиллярный гломерулонефрит (прокаинамид, хлорпропамид, фенитоин, триметадион, параметадион).
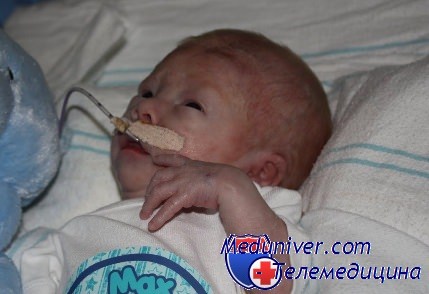
Врожденный нефротический синдром у детей
При развитии нефротического синдрома у детей первых 3 мес. жизни он считается врожденным. Чаще всего наблюдается врожденный нефротический синдром финского типа — аутосомно-рецессивное заболевание, наиболее распространенное среди потомков выходцев из Скандинавии (частота 1:8000). В его основе лежит мутация расположенного на хромосоме 19 гена NPHS1, который кодирует белок нефрин (важнейший компонент фильтрационных щелей между ножками подоцитов). Считается, что нефрин определяет нормальную функцию фильтрационного барьера в почечных клубочках. Гистологически синдром характеризуется в основном расширением проксимальных канальцев, пролиферацией клеток мезангия и склерозом клубочков.
У грудных детей обнаруживаются массивная протеинурия (которую можно определить и внутриутробно по повышению уровня а-фетопротеина) и отеки. Плацента увеличена. Больные часто рождаются недоношенными с респираторным дистрессом и расхождением швов черепа. Отеки сохраняются, часто возникают инфекционные заболевания, и к 5-летнему возрасту больные обычно погибают от почечной недостаточности. Кортикостероиды и иммуносупрессивные средства неэффективны.
Уменьшить протеинурию и улучшить состояние больных можно с помощью ингибиторов АПФ, индометацина и односторонней нефрэктомии. Однако в этих случаях чаще выполняют двустороннюю нефрэктомию с последующим постоянным диализом и активными диетическими мерами. В конце концов требуется трансплантация почки. В семьях, где имелись или имеются больные с врожденным нефротическим синдромом финского типа, для пренатальной диагностики определяют уровень а-фетопротеина в амниотической жидкости. Диагноз можно подтвердить данными анализа ДНК.
Другие причины врожденного нефротического синдрома включают врожденные инфекции, такие как сифилис, токсоплазмоз, краснуха и ЦМВ-инфекция, а также ВИЧ и вирус гепатита В. Поражение почек в этих случаях выражено слабее, чем при врожденном нефротическом синдроме финского типа, и излечение основного заболевания смягчает или устраняет почечную патологию.
У небольшого числа больных с врожденным нефротическим синдромом наблюдается диффузный мезангиальный склероз с прогрессирующим склерозом мезангия клубочков и быстрым ухудшением функции почек. Терминальная стадия почечной недостаточности развивается за несколько месяцев или лет. Диффузный мезангиальный склероз может быть как отдельным заболеванием, так и проявлением синдрома Дени-Дрэша (сочетание нефробластомы с мужским псевдогермафродитизмом). В основе этого синдрома лежит мутация гена опухоли Вильмса (WT1) на хромосоме 11.
— Также рекомендуем «Функция канальцев почек. Канальцевая фильтрация»
Оглавление темы «Заболевания почек у детей»:
- Нефротический синдром у детей. Причины и диагностика
- Идиопатический нефротический синдром у детей. Диагностика
- Лечение нефротического синдрома у детей. Гормоны
- Осложнения нефротического синдрома у детей. Прогноз
- Вторичный и врожденный нефротические синдромы у детей. Диагностика
- Функция канальцев почек. Канальцевая фильтрация
- Почечный канальцевый ацидоз. Проксимальноканальцевый
- Цистиноз у детей. Синдромы Лоу и Фанкони
- Дистальноканальцевый ацидоз у детей. Клиника
- Гиперкалиемический некроз почечных канальцев у детей. Диагностика и лечение
Источник
Семейный (генетический) нефротический синдром связан с наличием генных мутаций преимущественно рецессивного характера. Как правило, данные мутации ведут к нарушению биосинтеза и экспрессии белков, формирующих щелевую диафрагму между малыми отростками подоцитов, что ведет к их расплавлению и нарушению. Наиболее изучены мутации NPHSI (врожденный нефротический синдром финского типа – нарушение синтеза нефрина) и NPHS2 (семейный аутосомно-рецессивный стероидрезистентный нефротический синдром – нарушение синтеза подоцина) .
Другим видом мутаций, приводящих к нефротическому синдрому (НС), являются мутации гена WT-1.
Врожденный НС финского типа — заболевание аутосомно-рецессивной природы, детально описан на примере финской популяции, где превалируют две основные разновидности мутаций нефрина — fin-major и fin minor в генe нефрина, расположенном на 19-й хромосоме. Имеются многочисленные описания случаев этого заболевания у лиц других национальностей, однако в нефинской популяции за его развитие ответственны другие мутации спонтанного типа, которых описано более 60.
Клиника
При рождении ребенка с НС финского типа обращает на себя внимание значительное увеличение массы плаценты. В период беременности можно зафиксировать, повышение уровня а-фетопротеина в крови матери. Все признаки нефротического синдрома, появляются с рождения или первых дней жизни. Заболевание характеризуется неуклонным прогрессирующим снижением почечных функций с развитием тХПН в среднем к 3-4-м годам. Морфологически характерно резко выраженное и распространенное расширение канальцев. Клубочки могут выглядеть интактно или иметь умеренные признаки уплотнения мезангиальных структур с последующим формированием склероза. Иммунофлюоресцентное исследование малоинформативно, на электронной микроскопии обнаруживается диффузное расплавление малых ножек подоцитов.
Диагностика врожденного НС финского типа базируется на клинических данных, семейном анамнезе и обнаружении известных генных мутаций. Биопсия почки рекомендуется на 2-3-м месяце жизни. В более ранние сроки патогномоничные изменения могут быть не выражены. Необходимо исключить врожденный сифилис и ЦМВ-инфекцию как причины врожденного или инфантильного НС.
Лечение
Проводится постоянное восполнение потери белка с мочой путем инфузий 20% раствора альбумина и высокобелковой диеты. Для лечения отеков применяется фуросемид. В тяжелых случаях выполняется односторонняя нефрэктомия или проводится так называемая фармакологическая нефрэктомия путем назначения высоких доз индометацина и ингибиторов АПФ (иАПФ). По мере прогрессирования болезни может понадобиться комбинированное антигипертензивное лечение (иАПФ, антагонисты кальция) и диализ.
В связи с постоянной потерей белка, развивается белково- энергетическая недостаточность, возрастает опасность инфекций. Возможно проведение двухсторонней нефрэктомии в возрасте около 6 месяцев с началом диализной терапии, проводимой до выполнения трансплантации почки.
Возврата болезни после трансплантации не происходит, однако описаны случаи развития аутоиммунного нефрита вследствие формирования организмом реципиента антител к нефрину.
При семейном стероид-резистентном НС с нарушениями NPHS2 ген подоцина расположен на 1-й хромосоме. Известно более 30 мутаций этого гена, приводящих к развитию семейного стероидрезистентного НС. Некоторые мутации сопровождаются дебютом НС на первом году жизни и другие НС в подростковом или взрослом периоде жизни. Хотя ФСГС типичен для НС, связанного с мутацией подоцина, на ранних стадиях болезни могут выявляться минимальные изменения в гломерулах, как правило, без свечения иммуноглобулинов или комплемента.
У пациентов с мутациями NPHS2 иммуносупрессивная терапия, не применяется. Предпочтение отдается ингибиторам АПФ и блокаторам рецепторов AT II. Возврат в трансплантированную почку происходит редко. При этом эффективны бывают циклофосфамид, стероиды и плазмаферез, хотя антител к подоцину не выявляют. Семьи со случаями аутосомно-рецесивного НС подлежат медико-генетическому консультированию.
Мутации гена WT-1 могут являться причиной синдрома Denys-Drash, проявляющегося ранним началом и быстрым прогрессированием НС. Болезнь часто сочетается с мужским псевдогермафродитизмом и опухолью Вильмса, однако возможно развитие неполных вариантов синдрома. Морфологической основой синдрома Denys-Drash служит диффузный мезангиальный склероз. Дифференциальный диагноз, исходя из морфологических особенностей, может проводиться с диффузным мезангиальным склерозом на фоне врожденной ЦМВ-инфекции. Иммуносупрессивная терапия не показана, возврата НС в трансплантировнаной почке не происходит.
Другим заболеванием, связанным с мутацией WT1, является синдром Fraiser, также проявляющийся НС, но с более поздним дебютом и не столь быстрым прогрессированием. Также характерно сочетание с мужским псевдогермафродитизмом. Изменения в почках представлены ФСГС, резистентным к стероидам и иммунодепрессантам. Больным выполняются гонадэктомия и пластика с формированием женских фенотипических признаков.
НС может быть составной частью симптомокомплекса различных генетических заболеваний. К ним относятся различные синдромы (Charcot-Marie-Tooth, Schimke, Galloway-Mowat, Pierson и др) (А.Н. Цыгин, 2010), при которых развивается НС и терминальная ХПН в сочетании с аномалиями ЦНС, скелета или с глазными нарушениями.
Семейные случаи НС могут быть связаны также с амилоидозом почек на фоне периодической болезни или других вариантов амилоидоза генетической природы. Описано около 30 семей с аутосомно-доминантным НС, связанным с мутацией подоцитарного белка а-актинина, ген которого располагается на 19-й хромосоме. Заболевание при этом дебютирует в возрасте 30-40 лет с дальнейшим прогрессированием. На сегодняшний день известно около 90 различных подоцитарных белков, поэтому не исключено открытие новых видов мутаций, ответственных за развитие семейных случаев НС.
Таким образом, если НС развивается у детей до 1 года, вероятность наличия мутаций генов подоцитов равна 80%. Генетические и синдромальные причины НС определяют резистентность к иммуносупрессивной терапии. Таким пациентам назначаются инфузии альбумина, иАПФ, НПВП для снижения протеинурии. В долгосрочном аспекте при тяжелой протеинурии радикальным лечением является трансплантация почки.
Источник
