Врожденные пороки развития плода при синдроме дауна
Врожденные пороки развития плода (ВПР) – это пожалуй, самое опасное осложнение беременности, приводящее к детской инвалидности и смертности.
Рождение ребенка с врожденными дефектами развития – всегда большая травма для любых родителей. Статистика в этом плане не утешающая: в России частота ВПР достигает 5-6 случаев на 1000 детей.
К сожалению, предвидеть данные патологии до беременности не представляется возможным. Ребенок с врожденными пороками развития может появиться абсолютно в любой семье независимо от наличия или отсутствия вредных привычек, образа жизни или материального достатка.
Какие бывают нарушения в развитии плода при беременности
Все аномалии развития плода при беременности можно разделить на несколько видов:
1. Наследственные
Наследственные заболевания являются следствием генных мутаций. Мутация — это изменение наследственных свойств организма из-за перестроек в структурах, которые ответственны за хранение и передачу генетической информации. К ним относятся синдром Дауна, синдром Патау, синдром Эдвардса и др.
2. Врожденные
Врожденные аномалии — заболевания, приобретаемые в утробе матери из-за воздействия внешних факторов (нехватка витаминов и микроэлементов, травмы при беременности и пр.). Они могут затрагивать практически любые органы. К врожденным порокам развития плода относятся пороки сердца, неразвитость головного мозга, челюстно-лицевые деформации и др.
3. Мультифакториальные (сочетанный фактор)
Деления аномалий развития плода на виды довольно условно, потому что в подавляющем большинстве случаев задержки развития являются сочетанием наследственных и врожденных факторов.
Классификация пороков развития плода
Наиболее распространенные пороки внутриутробного развития плода:
- Аплазия (отсутствие какого-либо органа);
- Дистопия (расположение органа в нехарактерном для него месте);
- Эктопия (смещение органа наружу или в соседнюю полость тела);
- Гипотрофия, гипоплазия (снижение массы тела плода, недоразвитость);
- Гипертрофия, гиперплазия (увеличение в размерах какого-либо органа);
- Атрезия (заращение естественных отверстий);
- Срастание парных органов;
- Стеноз (сужение каналов и отверстий органов плода);
- Гигантизм (увеличение тела и внутренних органов плода в размерах);
- Дисхрония (ускорение или торможение развития процессов).
Хочется отметить, что степень выраженности патологий может быть совершенно разной. Это зависит от расположения генетической поломки, а также от длительности и интенсивности токсического воздействия на плод. Четкого соотношения между ними не прослеживается.
Женщина, которая подверглась токсическому воздействию при беременности, может родить абсолютно здорового ребенка. При этом риск появления задержки в развитии у будущего потомства данного плода сохраняется, как следствие генетической поломки с отсутствием клинических проявлений.
Причины появления пороков развития плода
Вопрос изучения патологий развития плода очень многообразен. Данной темой занимаются специалисты разного уровня и направлений — генетики, эмбриологи неонатологи, специалисты пренатальной диагностики.
Разобраться в причинах появления ВПР, порой, не так то просто. Отклонения в наборе хромосом одного или обоих родителей приводят к рождению ребенка с такими заболеваниями, как синдром Дауна, Патау, Эдвардса, гемофилия, дальтонизм и др.
Причиной наследственных патологий является генная мутация. К появлению врожденных аномалий приводят различные неблагоприятные воздействия на органы плода во время беременности, особенно в критические периоды его развития. Факторы, которые вызывают ВПР, называют тератогенными.
Самые изученные тератогенные факторы:
- медикаментозные (прием средств, запрещенных при беременности или в определенный период беременности);
- инфекционные (корь, краснуха, цитомегаловирус, ветряная оспа, передающиеся от матери к плоду);
- ионизирующее излучение (рентген, радиоактивное излучение);
- алкогольный фактор (прием беременной женщиной большого количества алкоголя может привести к тяжелейшему алкогольному синдрому у плода, несовместимому с жизнью);
- никотиновый фактор (курение во время беременности может спровоцировать отставание в развитии ребенка);
- токсические и химические (женщинам, работающим на вредном производстве, за несколько месяцев до беременности и на весь ее срок следует исключить контакты с агрессивными химическими и токсическими веществами во избежание появления тератогенного эффекта у плода);
- недостаток витаминов и микроэлементов (нехватка фолиевой кислоты и полиненасыщенных кислот Омега-3, белков, йода, отсутствие сбалансированного питания могут привести к отставанию в развитии плода, нарушениям работы головного мозга).
Нередко в появлении ВПР плода большую роль играет наследственная предрасположенность. Если у родителей или ближайших родственников ребенка имели место быть врожденные пороки развития, то риск родить ребенка с такими же дефектами возрастает во много раз.
Критические периоды развития плода
Внутриутробное развитие плода длится в среднем 38-42 недели. Все это время плод хорошо защищен от внешних факторов плацентарным барьером и иммунной системой матери. Но существует 3 критических периода, в которые он очень уязвим по отношению к вредным агентам. Поэтому в это время беременной женщине стоит особенно беречь себя.
Первый критический период наступает примерно на 7-8 день после оплодотворения, когда зародыш проходит этап имплантации в матку. Следующий опасный срок – с 3 по 7 и с 9 по 12 недели беременности, когда происходит образование плаценты. Болезнь, химическое или радиационное воздействие на беременную женщину в эти периоды может привести к внутриутробным порокам развития плода.
Третьим критическим периодом беременности становится 18-22 неделя, когда происходит закладка нейронных связей головного мозга и начинает свою работу система кроветворения. С этим сроком связана задержка умственного развития плода.
Факторы риска возникновения аномалий развития плода
Факторы риска ВПР со стороны матери:
- возраст больше 35 лет – задержка внутриутробного развития, генетические нарушения;
- возраст до 16 лет – недоношенность, недостаток витаминов и микроэлементов;
- низкий социальный статус – инфекции, гипоксия плода, недоношенность, задержка внутриутробного развития;
- недостаток фолиевой кислоты – врожденные пороки развития нервной системы;
- прим алкоголя, наркотических веществ и курение – задержка внутриутробного развития, синдром внезапной смерти, фетальный алкогольный синдром;
- инфекции (ветряная оспа, краснуха, герпетические инфекции, токсоплазмоз) – ВПР, задержка внутриутробного развития, пневмония, энцефалопатия;
- артериальная гипертония — задержка внутриутробного развития, асфиксия;
- многоводие – врожденные пороки развития ЦНС, патологии ЖКТ и почек;
- заболевания щитовидной железы – гипотиреоз, тиреотоксикоз, зоб;
- заболевания почек — задержка внутриутробного развития, нефропатия, мертворождение;
- заболевания легких и сердца – врожденные пороки сердца, задержка внутриутробного развития, недоношенность;
- анемия — задержка внутриутробного развития, мертворождение;
- кровотечения – анемия, недоношенность, мертворождение
Факторы риска ВПР со стороны плода:
- аномалии предлежания плода – кровоизлияние, врожденные пороки развития, травма;
- многоплодная беременность – фетофетальная трансфузия, асфиксия, недоношенность;
- задержка внутриутробного развития – мертворождение, врожденные пороки развития, асфиксия,
Факторы риска во время родоразрешения: - преждевременные роды – чревато развитием асфиксии;
- поздние роды (задержка родов на 2 недели и более) – возможно развитие асфиксии или мертворождение;
- длительные роды – асфиксия, мертворождение;
- выпадение пуповины – асфиксия.
Аномалии развития плаценты:
- небольшая плацента – задержка внутриутробного развития;
- большая плацента – развитие водянки плода, сердечной недостаточности;
- преждевременная отслойка плаценты – возможна большая кровопотеря, развитие анемии;
- предлежание плаценты – чревато кровопотерей и развитием анемия.
Диагностика пороков развития плода
Пренатальная диагностика аномалий развития плода и генетических патологий – процесс очень сложный. Одним из этапов этой диагностики являются скрининговые обследования, назначаемые беременной женщине на сроке 10-12, 20-22 и 30-32 недели (в каждом из триместров). Этот анализ представляет собой исследование крови на биохимические сывороточные маркеры хромосомной патологии (пороки развития).
Это позволит получить предположение о наличии или отсутствии у плода хромосомных аномалий, а проведение узи как дополнительного метода диагностики покажет, есть ли отклонения в физическом развитии плода. Узи должно выполняться высококлассным специалистом и на качественной аппаратуре. Результаты каждого исследования оцениваются совместно, без разрыва друг с другом.
Скрининг не гарантирует стопроцентной патологии, он лишь позволяет определить группу высокого риска среди беременных. Это важная и необходимая мера и, не смотря на добровольный характер, большинство будущих мам понимают это. Нередки случаи, когда специалисты затрудняются ответить на вопрос о наличии генетических дефектов у плода. Тогда в зависимости от триместра беременности пациентке назначаются инвазивные методы исследования:
- биопсия хориона (исследование ворсин хориона)
Делается в 1 триместре беременности (11-12 неделя) и позволяет выявить генетические аномалоии развития плода.
- амниоцентез (исследование анатомической жидкости, в которой находится плод)
В 1 триместре данный анализ выявляет гиперплазию коры надпочечников, во 2 – заболевания ЦНС, хромосомные патологии.
- плацентоцентез (исследование частиц плаценты)
Выполняется с 12 по 22 недели беременности для выявления генетических патологий.
- кордоцентез (забор крови из пуповины плода)
Позволяет выявить подверженность плода генным или инфекционным заболеваниям.
На обязательную консультацию к генетику направляют беременных женщин:
- чей возраст превышает 35 лет;
- имеющих ребенка или детей с генетическими отклонениями;
- имевших в анамнезе выкидыши, неразвивающуюся беременность, мертворождение;
- в семье которых есть родственники с синдромом Дауна и другими хромосомными аномалиями;
- переболевших вирусными заболеваниями в 1 триместре беременности;
- принимавших запрещенные при беременности лекарственные препараты;
- получившие воздействие радиации.
Для диагностики патологий плода после рождения применяются следующие методы исследований: анализы крови, мочи и прочих биологических жидкостей, рентген, компьютерная и магнитно-резонансная томография, ультразвук, ангиография, бронхо и гастроскопия, прочие иммунные и молекулярные методы…
Показания к прерыванию беременности
Любое выявление ВПР плода предполагает предложение о прерывании беременности по так называемым медицинским показаниям. Если женщина отказывается от этого и решает оставить ребенка, ее берут под особый контроль и наблюдают за беременностью более тщательно.
Но будущей маме следует понимать, что здесь важны не только ее чувства и переживания, но и то, что рожденные с серьезными дефектами и патологиями дети часто оказываются нежизнеспособны или остаются глубокими инвалидами на всю жизнь, что, безусловно, очень тяжело для любой семьи.
Существуют и другие показания к прерыванию беременности:
- злокачественные новообразования (беременность с онкологическим заболеванием противопоказана);
- заболевания сердечно-сосудистой системы (пороки сердца, тромбоз глубоких вен, тромбоэмболия);
- неврологические заболевания (рассеянный склероз, миастения);
- инфекционные заболевания (краснуха, туберкулез в активной форме, вирусный гепатит в острой и тяжелой стадии, сифилис);
- заболевания крови и кроветворных органов (гемоглобинопатия, апластическая анемия, лейкоз);
- заболевания глаз (болезни зрительного нерва и сетчатки);
- заболевания почек (мочекаменная болезнь в острой форме и с большими конкрементами, острый гломерулонефрит);
- диффузные заболевания соединительной ткани;
- эндокринные нарушения (сахарный диабет, тиреотоксикоз, некомпенсированный гипотиреоз в тяжелых формах);
- некоторые гинекологические заболевания;
- акушерские показания (неподдающийся терапии гестоз и сильный токсикоз беременной, сопровождающийся тяжелой рвотой, гестационная трофобластическая болезнь, тяжелые наследственные заболевания, выявленные во время беременности и пр.)
Аборт по медицинским показаниям проводится только с согласия пациентки.
Профилактика врожденных пороков развития плода
Основным мероприятием, направленным на профилактику появления ВПР плода, является планирование беременности. От качественной подготовки может зависеть не только успех зачатия, но и процесс вынашивания беременности, быстрое и правильное родоразрешение и здоровье матери и ребенка в дальнейшем.
Перед планированием беременности необходимо пройти ряд обследований: сдать анализы на скрытые инфекции (ЗППП), ВИЧ, гепатит, сифилис, проверить свертываемость крови, гормональный статус, санацию полости рта, сделать узи органов малого таза для исключения воспалительных заболеваний и новообразований, посетить терапевта для выявления всех возможных хронических заболеваний, в идеале пройти генетическое тестирование обоим родителям.
Ключевым моментом в профилактике врожденных аномалий плода становится поддержание здорового образа жизни, отказ от вредных привычек, сбалансированное и полноценное питание, исключение воздействия на ваш организм любых негативных и вредных факторов. Во время беременности важно своевременно лечить все возможные заболевания и соблюдать предписания акушера-гинеколога.
Лечение ВПР плода
Способы лечения врожденных пороков развития плода значительно различаются в зависимости от природы и степени тяжести аномалии. Статистика по данной проблеме, к сожалению, не утешительна. Четверть детей с врожденными аномалиями погибает уже в течение первого года жизни.
Еще 25% могут жить достаточно долго, имея при этом не поддающиеся или трудно излечимые физические и умственные нарушения. И всего лишь 5% рожденных с ВПР детей поддаются лечению, в основном хирургическим путем. В некоторых случаях помогает консервативное лечение. Иногда пороки развития становятся заметны только по мере взросления, какие-то протекают и вовсе бессимптомно.
Источник
Хорошо известно, что врожденные аномалии сердца встречаются почти у половины детей с синдромом Дауна и оказывают большое влияние на младенческую выживаемость. С середины прошлого столетия проводилось множество исследований по выявлению частоты, специфичности и характера пороков сердца у этих детей. Так, в период 1970–1980-х гг. отмечалось повышение распространенности врожденных аномалий сердечнососудистой системы у пациентов с синдромом Дауна. Связано это было в основном с улучшением диагностики открытого артериального протока и дефекта межпредсердной перегородки (M. J. Khoury, J. D. Erickson, 1992). По данным зарубежных авторов, при синдроме Дауна наиболее часто встречаются дефект межжелудочковой перегородки, дефект межпредсердной перегородки, общий открытый атриовентрикулярный канал, тетрада Фалло и другие пороки, составляющие менее 1 %.
За годы научных наблюдений стало очевидным, что для выявления врожденного порока сердца у новорожденного с синдромом Дауна физическое обследование, включающее осмотр и аускультацию, является обязательным, но недостаточным. Так, McElhinney и др. установили, что информативность физического обследования для выявления сердечных аномалий у детей с синдромом Дауна не превышает 80 %. Оказалось, что 15 из 114 исследуемых детей при осмотре не имели признаков врожденных пороков сердца, но при ультразвуковом исследовании у них были диагностированы сердечные аномалии, а девяти из них в дальнейшем потребовалось оперативное лечение.
Материалы и методы
Нами проведено исследование частоты встречаемости и особенностей клинической картины врожденных пороков сердца и персистирующих фетальных коммуникаций у 522 детей с синдромом Дауна в возрасте от 0 до 8 лет, воспитывающихся в домашних условиях. Дети получали медико-психолого-педагогическую помощь в Центре ранней помощи Благотворительного фонда «Даунсайд Ап», где наблюдались с момента обращения (возраст при первом посещении варьировал от 0 до 7 лет) до 8 лет. При первичном обращении проводился сбор анамнеза, клиническое обследование, анализ медицинской документации. Все дети, даже в случае отсутствия клинически выраженных симптомов порока сердца, направлялись на электрокардиографическое и эхокардиографическое обследования и, при необходимости, на лечение в соответствующие профильные кардиологические стационары и диспансеры.
Результаты
У всех пациентов синдром Дауна был подтвержден хромосомным исследованием. Регулярная трисомия 21-й хромосомы была выявлена у 499 детей (499/522), что составило 90,4 %, транслокационная форма – у 24 (4,3 %), мозаицизм – у 28 (5,1 %), у одного ребенка трисомии 21-й и Х хромосом (кариотип 48,ХХХ,+21) – 0,2 %.
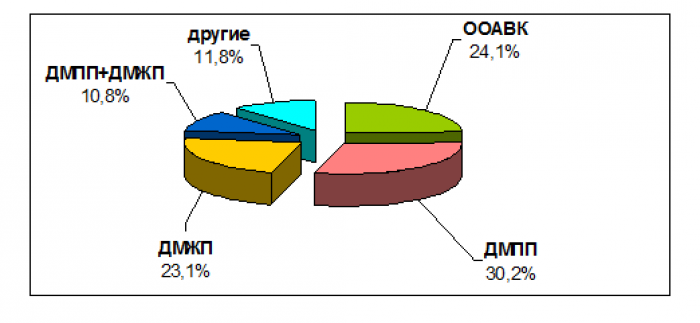
Получены результаты эхокардиографического исследования 428 детей (см. рис.). Врожденные пороки сердца диагностированы у 195 (195/428), что составило 45,6 %. В структуре этих аномалий у детей с синдромом Дауна чаще отмечался дефект межпредсердной перегородки (ДМПП), а именно в 30,2 % (59/195) случаев. Общий атриовентрикулярный канал (ОАВК) составил 24,1 % (47/195), дефект межжелудочковой перегородки (ДМЖП) – 23,1 % (45/195), сочетание дефектов межпредсердной и межжелудочковой перегородок (ДМПП+ДМЖП) – 10,8 %. Другие пороки, такие как тетрада Фалло, стеноз легочной артерии и др., в сумме составили 11,8 % (23/195). Персистенция гемодинамически значимого открытого артериального протока (ОАП), потребовавшего оперативного вмешательства, была выявлена в 2,8 % (12/428).
 Структура сердечных аномалий у детей с синдромом Дауна
Структура сердечных аномалий у детей с синдромом Дауна
Почти все исследуемые нами дети родились доношенными. Срок родов составил 38,2 ± 1,3 недель. Однако при оценке антропометрических данных новорожденных с синдромом Дауна и врожденными пороками сердца оказалось, что их физическое развитие страдает еще внутриутробно. Задержка физического развития (ЗВУР) – масса тела при рождении ниже 10 перцентилей в соответствии со сроком гестации в сравнении с показателями физического развития Г. М. Дементьевой, Е. В. Короткой – отмечалась у 18,7% детей. У всех новорожденных с сердечными аномалиями наблюдалась асимметричная форма ЗВУР (Pounderal Index, PI>25). Вероятно, задержка физического развития формировалась под влиянием, в основном, не генетического фактора.
Известно, что у новорожденных с синдромом Дауна нередко отмечается морфофункциональная незрелость (по нашим данным, она встречается в 17,9 % случаев). У детей с морфофункциональной незрелостью часто недооцениваются размеры дефекта межпредсердной перегородки, который рассматривают как открытое овальное окно даже при гемодинамической его значимости, и артериального протока, в то время как имеет место недостаточность кровообращения. Застойная легочная гипертензия приводит к развитию пневмонии. Возникновение и затяжное течение пневмонии у детей с синдромом Дауна объясняется характерными для них иммунологическими нарушениями.
Хорошо известно, что манифестация сердечной недостаточности у детей раннего возраста, в отличие от детей старшего возраста, может протекать под маской других состояний. Помимо классических симптомов, таких как тахикардия (учащение сердцебиения), тахипноэ (увеличение частоты дыхания), цианоз кожи и слизистых, типичны вялое сосание, снижение темпов физического и психомоторного развития. В подобных случаях у педиатров возникают определенные затруднения в проведении дифференциальной диагностики при наличии у ребенка синдрома Дауна. У таких детей клинические симптомы недостаточности кровообращения могут расцениваться как проявления особенностей психомоторного развития, типичных для синдрома Дауна. Так, если возникают трудности вскармливания: ребенок вялый, неохотно берет грудь или соску, вяло сосет, не может высосать необходимый объем питания, вплоть до полного отказа от кормлений, такие проблемы часто объясняются мышечной гипотонией, общей вялостью, характерной для детей с синдромом Дауна, с последующим назначением общеукрепляющего массажа, что ухудшает состояние ребенка. В дальнейшем отмечается плохая прибавка в весе. Она направляет клиницистов на выявление патологии со стороны желудочно-кишечного тракта, гипогалактии у матери, исследования качества молока, его инфицированности. В борьбе с прогрессирующей гипотрофией младенца нередко переводят на искусственные смеси. Важно отметить, что гипотрофия может стать причиной отсрочки оперативного лечения порока сердца и/или неблагоприятно повлиять на его исход.
Таким образом, слабая нацеленность педиатров на выявление симптомов недостаточности кровообращения у ребенка с синдромом Дауна затрудняет ее своевременную диагностику, а следовательно, и адекватное лечение врожденного порока сердца.
Наглядным примером будет анализ истории болезни.
Андрей Б., от первой, физиологично протекавшей беременности. Роды в срок. Вес мальчика при рождении – 3000 г., рост – 51см, оценка по шкале АПГАР 88б. Состояние ребенка после рождения удовлетворительное. Отмечались признаки морфофункциональной незрелости, фенотипические признаки синдрома Дауна. С целью подтверждения хромосомной патологии была взята кровь для определения кариотипа. Выявлена регулярная трисомия 21-й хромосомы. С первых суток жизни отмечался систолический шум при аускультации грудной клетки. Для исключения аномалий развития сердца проведено ЭХОКГ и обнаружено открытое овальное окно размером 4 мм. Ребенок был выписан домой под наблюдение участкового педиатра и кардиолога по месту жительства. В дальнейшем мальчик стал вялым, неохотно брал грудь, отмечались частые срыгивания, редкий стул. За месяц ребенок прибавил в весе 210 г. При осмотре обращали на себя внимание признаки недостаточности кровообращения: одышка в покое, умеренная тахикардия. Мальчик был направлен в НЦССХ им. Бакулева, где диагностирован порок развития сердца – дефект межпредсердной перегородки размером 6 мм со значительным нарушением сердечной гемодинамики. Рентгенограмма грудной клетки показала расширение корней легких, КТИ = 57 %. По данным ЭКГ: отклонение электрической оси сердца вправо. В возрасте 4 месяцев проведено оперативное лечение дефекта межпредсердной перегородки.
Успехи в области кардиохирургии за последние десятилетия позволили повысить выживаемость младенцев с синдромом Дауна и патологией сердечнососудистой системы с 78 % в 1985 г до 90 % к 2004 г. (Claire Irving и др., 2008).
Hijii Т. и др. (1997) сообщили, что до 24-летнего возраста доживают 87,8 % пациентов с синдромом Дауна, перенесших оперативное лечение врожденного порока сердца.
При сравнении течения и исходов оперативного лечения полной формы атривентрикулярного канала у младенцев с синдромом Дауна и без синдрома, в работе, проведенной на базе НЦССХ им. Бакулева, Т. И. Задко отмечает, что у детей с синдромом Дауна быстрее развивается легочная гипертензия, важным механизмом в развитии которой, очевидно, является окислительный стресс. Генетически обусловленные особенности антиоксидантной системы, в том числе изначально низкий уровень глутатиона и более высокая антиоксидантная активность сыворотки у детей с синдромом Дауна (Н. П. Котлукова, О. И. Артеменко и др., 2008), свидетельствуют о более высоком окислительном стрессе при развитии легочной гипертензии при пороках сердца с легочной гиперволемией.
Из ранних осложнений хирургической коррекции атриовентрикулярного канала у детей с синдромом Дауна чаще встречаются инфекционно-септические осложнения, тогда как у детей без синдрома – острая сердечная недостаточность (Т. И. Задко, 2005). Это обстоятельство объясняется анатомическими особенностями порока и имеющимися иммунологическими нарушениями у младенцев с трисомией 21-й хромосомы.
Выводы
Полученные нами данные частоты сердечных аномалий не противоречат уже известным в литературе. Около половины детей с синдромом Дауна имеют патологию сердечнососудистой системы: 45,5 % – врожденные пороки сердца, 2,8 % – гемодинамически значимый открытый артериальный проток.
Анализ данных проведенных исследований, а также собственные полученные результаты делают очевидной необходимость раннего кардиологического обследования всех новорожденных с синдромом Дауна, включающего помимо осмотра и аускультации проведение эхокардиологического и электрокардиологического исследований. Внимательный подход и оценка клинических симптомов, а также знание генетически обусловленных особенностей детей с синдромом Дауна помогут своевременно диагностировать недостаточность кровообращения и начать адекватную терапию. Все дети с выявленными пороками сердца должны быть консультированы кардиохирургом для определения необходимости и сроков оперативного лечения.
Литература
- Задко Т. И. Синдром Дауна в сочетании с полной формой атриовентрикулярной коммуникации: актуальность, диагностика, сопутствующая патология, анатомия, особенности естественного течения, результаты хирургического лечения // Детские болезни сердца и сосудов. – 2005. – № 6. – С. 10–18.
- Роль окислительного стресса и антиоксидантной системы в патогенезе врожденных пороков сердца / Н. П. Котлукова, О. И. Артеменко, М. П. Давыдова, О. Н. Ильина, Л. А. Курбатова // Педиатрия. – 2009. – Т. 87, № 1. – С. 24–28.
- Cassidy S. B., Allanson J. E. Management of Genetic Syndromes. 2-nd ed. – P. 191–210. URL: https://www.wiley.com/en-us/Management+of+Genetic+Syndromes%2C+3rd+Edition-p-9780470191415
- Correlation between abnormal cardiac physical examination and echocardiographic findings in neonates with Down syndrome / D. B. McElhinney, M. Straka, E. Goldmuntz, E. H. Zackai // American Journal of Medical Genetics. – 2002. – Part A. – P. 238–241.
- Khory M. J., Erickson J. D. Improved ascertainment of cardiovascular malformation in infants with Down syndrome, Atlanta, 1968 through 1989 // Epidemiology. – 1992. – Vol. 136. – P. 1457–1464.
- Life expectancy and social adaptation in individuals with Down syndrome and without surgery for congenital heart disease / T. Hijii, J. Fukushige, H. Igarashi et al. // Clinical Pediatrics. – 1997. –Vol. 36. – P. 327–332.
- Twenty-year trends in prevalence and survival of Down syndrome / C. Irving, A. Basu, S. Richmond et al. // European Journal of Human Genetics. – 2008. – Vol. 16. – P. 1336–1340.
Источник
