Уремический синдром основные механизмы патогенеза


Уремия — это тяжелое клиническое проявление прогрессирующей почечной недостаточности, вызванное аутоинтоксикацией азотистыми и другими токсическими метаболитами. Проявляется нарастающей астенией, бледностью и субиктеричностью кожи, мучительным зудом, петехиальной сыпью, артериальной гипертензией, запахом аммиака изо рта, диспепсическими расстройствами, нарушением дыхания. Диагностируется с помощью биохимического исследования крови, пробы Реберга, УЗИ почек, экскреторной урографии, нефросцинтиграфии. Лечение предполагает комплексную терапию основного заболевания, коррекцию метаболических расстройств и отдельных симптомов, проведение ЗПТ, трансплантацию почки.
Общие сведения
Уремия (мочекровие) является ведущим клинико-биохимическим синдромом, развивающимся во 2-3 стадиях ОПН и при терминальной ХПН. Расстройство вызвано накоплением в крови пациентов токсичных продуктов обмена, которые в норме выводятся почками. Термин «уремия» для определения интоксикационного синдрома, возникающего у больных, страдающих почечной недостаточностью, был предложен в 1840 году французскими врачами П.А. Пьорри и Д. Л’Эритье.
Традиционно уремический синдром рассматривается как самостоятельное патологическое состояние в связи с полисистемностью поражений, тяжестью симптоматики, неблагоприятным витальным прогнозом, которые выходят за рамки прямых признаков ренальной патологии. Как и почечная недостаточность, мочекровие может быть острым и хроническим.

Уремия
Причины уремии
Аутоинтоксикация при мочекровии связана с прогрессированием острой или хронической почечной недостаточности. Соответственно причинами возникновения уремического синдрома являются те же ренальные и экстраренальные факторы, которые нарушили функционирование почек. Специалисты в сфере урологии и нефрологии выделяют следующие группы причин, вызывающих состояние уремии:
- Заболевания почек. Уменьшение количества активных нефронов со снижением почечной функциональности становится следствием гнойной, аутоиммунной, ишемической деструкции почечных тканей. Развитие уремии возможно при пиелонефрите, гломерулонефрите, наследственном нефрите, волчаночной нефропатии, пионефрозе, отторжении почечного трансплантата, тромбозе вен почек.
- Онкопатология. Азотная интоксикация наблюдается при разрушении раковым процессом ренальной паренхимы, повреждении гемато-уремического барьера у больных с аденокарциномой почки и другими злокачественными неоплазиями органа. Уремия также возникает вследствие почечной дисфункции при паранеопластической нефропатии, осложнившей экстраренальные опухоли.
- Обструкция мочевыводящих путей. Нарушение оттока мочи приводит к повышению давления в канальцах и гломерулах. Попаданию токсинов в кровь способствует разрушение клубочковых мембран. Обструкционный механизм уремии отмечается при мочекаменной болезни, мочеточниково-влагалищных свищах, сморщенном мочевом пузыре, аденоме простаты и др.
- Повреждение почек при отравлениях и интоксикациях. Почечная недостаточность с уремическим синдромом является этапом развития или исходом ряда токсических нефропатий. Уремия вследствие острой и хронической деструкции почек диагностируется при балканской эндемической нефропатии, лекарственном поражении почек, контраст-индуцированных дисфункциях.
- Экстраренальные причины. Недостаточностью почек осложняются острые состояния (кардиогенный шок, ДВС-синдром, кровотечения). Поражение почек выявляется при сахарном диабете, гипертонической болезни, туберкулезе, гестозах, других соматических, эндокринных, инфекционных болезнях. Дисметаболические нефропатии с исходом в уремию возникают при нарушениях обмена веществ.
Патогенез
Механизм развития уремического синдрома при ОПН, ХПН основан на комплексном повреждающем воздействии метаболитов, выведение которых нарушается при ренальной дисфункции. Ключевую роль в патогенезе уремии играет накопление продуктов белкового обмена, в первую очередь — мочевины, которая подвергается трансформации в кишечнике, выводится через кожу, слизистые оболочки, органы дыхания, раздражая их ткани. Токсическое воздействие на клетки разных органов и систем оказывают аммиак, метаболиты ароматических кислот (фенолы, индолы, скатолы), среднемолекулярные пептиды, ацетон, протеазы, ряд других соединений.
Повреждение клеточных мембран и нарушение работы ферментных систем при уремии усугубляет интоксикационный синдром и провоцирует полиорганную недостаточность. Низкая экскреция веществ с кислой реакцией, ингибирование процессов аммонио- и ацидогенеза, нарушение канальцевой реабсорбции завершается развитием ацидоза, электролитного дисбаланса, возникновением тяжелых мозговых, сердечно-сосудистых, дыхательных, гормональных расстройств.
Симптомы уремии
Клиническая картина уремического синдрома обычно формируется постепенно. Первыми признаками уремии являются изменения общего состояния: слабость, быстрая утомляемость, нарушения когнитивных функций, ухудшение аппетита, сонливость в дневное время с последующей ночной бессонницей, выраженная жажда, снижение температуры тела до 35,0-35,5° C. Кожа становится сухой, бледной с желтоватым оттенком, при длительной почечной недостаточности — серой. Появляется сильный зуд, петехиальная сыпь, расчесы.
Язык покрыт сероватым налетом, изо рта пациента слышен запах аммиака. У многих больных отмечается повышение артериального давления. На поздней стадии уремии происходит выделение токсических метаболитов через слизистые ЖКТ и дыхательной системы, что проявляется симптомами гастроэнтерита (тошнота, рвота, диарея), болью в горле, сухим кашлем. В тяжелых случаях наблюдается шумное глубокое дыхание, свидетельствующее о поражении дыхательного центра.
Осложнения
Длительное декомпенсированное течение уремии приводит к развитию острой энцефалопатии, при которой наблюдается спутанность сознания, наличие бреда и галлюцинаций, миоклонии, судороги. На фоне ионного дисбаланса выявляется аритмия, сердечная недостаточность. Угнетение иммунитета повышает риск возникновения и тяжесть течения инфекционных процессов. Для уремии характерно формирование плеврита и перикардита вследствие выделения кристаллов мочевины через серозные оболочки.
Расстройство может осложняться желудочно-кишечными, легочными, носовыми, маточными кровотечениями, причиной которых являются изъязвления слизистых, снижение количества тромбоцитов и белков свертывающей системы крови. При значительном снижении уровня кальция уремия усугубляется остеопорозом, остеомаляцией, гиперплазией паращитовидных желез. Наиболее опасное осложнение заболевания – уремическая кома, которая развивается при высокой концентрации аммиака в крови, выраженном метаболическом ацидозе и зачастую завершается летальным исходом.
Диагностика
Постановка диагноза уремии не представляет затруднений при наличии характерных клинических признаков и изменений биохимического состава крови. Подозревать нарушение фильтрационной и выделительной функции нефронов следует у пациентов, которые имеют заболевания мочевой системы в анамнезе. Для диагностики применяют ряд лабораторных и инструментальных методов исследования:
- Биохимический анализ крови. У всех больных отмечается многократное повышение уровня мочевины. Увеличивается концентрация креатинина, его количество кор релирует с тяжестью состояния. Для уремии типично уменьшение уровня альбуминов, диспротеинемия, изменение показателей электролитного обмена — снижение содержания натрия и кальция, повышение концентрации калия.
- Проба Реберга. Фильтрационная способность почек определяется с помощью формульного метода на основании данных об уровне креатинина в моче и плазме. При скорости клубочковой фильтрации от 60 мл/мин до 15 мл/мин у пациента диагностируют компенсированную стадию уремии. Показатель ниже 15,0 мл/мин считается прогностически неблагоприятным и свидетельствует о декомпенсации состояния.
- УЗИ почек. Ультразвуковое исследование позволяет быстро оценить состояние коркового и мозгового вещества органа, выявить абсцесс почки, почечнокаменную болезнь, злокачественные новообразования, склеротические изменения, которые могут служить непосредственной причиной уремии. Сонографию обычно дополняют проведением УЗДГ почечных сосудов для оценки ренального кровотока.
- Рентгенография. Рентгенологически можно визуализировать форму и контуры чашечно-лоханочной системы, мочеточников, мочевого пузыря, динамику заполнения мочевыводящих путей контрастом. Из-за нагрузки на почки при введении контрастного вещества у пациентов с выраженной уремией урографию применяют ограниченно. Экскреторную урографию сочетают с проведением нефросцинтиграфии.
Изменения в клиническом анализе крови при уремии неспецифичны, обычно наблюдается нормохромная анемия, повышение СОЭ, возможна тромбоцитопения, относительная лимфопения. В общем анализе мочи отмечается гипоизостенурия, цилиндрурия, эритроцитурия, при декомпенсированных состояниях рН мочи снижается до 4,5-5. В качестве дополнительных методов обследования мочевыделительной системы могут применяться КТ, МРТ.
Дифференциальная диагностика уремии проводится с гипохлоремической азотемией, гепаторенальным и панкреоренальным синдромами, печеночной энцефалопатией, эклампсией, атипичным гемолитико-анемическим синдромом, в терминальных стадиях — с диабетической комой и другими коматозными состояниями. Кроме врача-нефролога и уролога пациента могут консультировать гематолог, токсиколог, ревматолог, онколог, инфекционист, эндокринолог, анестезиолог-реаниматолог.
Лечение уремии
Выбор врачебной тактики определяется формой и причинами развития почечной недостаточности, особенностями клинической картины, тяжестью состояния пациента. Основными терапевтическими задачами являются максимальное сохранение функциональной способности почек, предупреждение и уменьшение интоксикационных нарушений, коррекция возникших расстройств.
Медикаментозные и хирургические методы ведения больных с уремией дополняют изменением диеты со снижением калорийности, ограничением белковых продуктов, соли, введением в рацион свежих овощей и фруктов, оказывающих ощелачивающий эффект. Для устранения проявлений мочекровия кроме терапии основного заболевания, на фоне которого развилась почечная недостаточность, могут быть использованы:
- Инфузионная терапия. Введение коллоидных, кристаллоидных растворов направлено на коррекцию водно-электролитного и кислотно-щелочного дисбаланса, уменьшение интоксикации. Грамотная дезинтоксикационная и регидратационная терапия позволяет уменьшить проявления полиорганной недостаточности, нормализовать работу сердца и головного мозга. Инфузии специальных составов при необходимости применяют для парентерального питания больных.
- Лекарственная коррекция отдельных симптомов. Чаще всего пациентам с уремией назначают противоанемическую терапию (эритропоэтины, препараты железа, фолиевой кислоты, витамин B12, переливание цельной крови, эритроцитарной массы), гипотензивные средства. При мучительном зуде для усиления дезинтоксикационного эффекта инфузий рекомендованы энтеросорбенты, осмотические слабительные. Для лечения сердечной недостаточности используют гликозиды.
- Заместительная почечная терапия. При недостаточной эффективности фармакотерапии, выраженной ОПН и прогрессирующей ХПН со значительными полиорганными нарушениями, угрозе развития уремической комы показана аппаратная детоксикация. В зависимости от возможностей лечебного учреждения и состояния пациента для удаления токсичных метаболитов разово или периодически проводят перитонеальный диализ, гемодиализ, гемофильтрацию, гемодиафильтрацию.
Хирургическое лечение уремии эффективно при острых интоксикационных состояниях, вызванных обструкцией мочевыводящих путей. Для обеспечения естественного пассажа мочи при обтурации камнем мочеточника выполняют уретеролитотомию, уретеролитоэкстракцию, контактную и дистанционную уретеролитотрипсию. При невозможности восстановления ренальной паренхимы у пациентов, страдающих хроническими нефрологическими заболеваниями, единственным радикальным методом лечения является трансплантация почки.
Прогноз и профилактика
Исход заболевания зависит от степени нарушения функции почек и наличия сопутствующих патологий. Прогноз при острой уремии относительно благоприятный, если скорость клубочковой фильтрации превышает 30 мл/мин. Благодаря использованию ЗПТ у 65-95% таких пациентов удается достичь положительного терапевтического результата. В хронических случаях больным требуется пожизненное проведение диализа либо трансплантация почки. Специфической профилактики не существует. Для предупреждения развития уремии необходима своевременная диагностика и комплексная терапия состояний, которые могут вызвать необратимое ухудшение выделительной функции почек.
Источник
Гемолитико-уремический синдром — эпидемиология, патогенез
Патофизиологические механизмы гемолитико-уремического синдрома представлены на рисунке. В его основе лежит повреждение эндотелия мелких сосудов тромбозами. Это приводит к классической диагностической триаде — микроангиопатической гемолитической анемии, тромбоцитопении и почечной недостаточности. Гемолитико-уремический синдром — самая частая причина ОПН у прежде здоровых детей.
В 90% случаев заболеванию предшествует кишечная инфекция, вызванная продуцирующим веротоксины (токсины, сходные с цитотоксином Shigella dysenteriae) штаммом Escherichia coli. В таких случаях гемолитико-уремический синдром называют типичным.
Остальные 10% можно разделить на вторичные и идиопатическую формы. Вторичный гемолитико-уремический синдром может возникать как осложнение других инфекций, особенно вызванных Streptococcus pneumoniae и редко ВИЧ, а также на фоне системных заболеваний, таких как СКВ, системная склеродермия, гомоцистинурия с метилмалоновой ацидемией типа cb1 С и злокачественные новообразования.
Кроме того, причиной могут служить некоторые лекарственные средства, в том числе митомицин, циклоспорин, такролимус, кокаин, хинин. Идиопатический гемолитико-уремический синдром может быть спорадическим и наследственным — описаны аутосомно-доминантный и аутосомно-рецессивный типы. У лиц с наследственным гемолитико-уремическим синдромом иногда отмечается недостаточность некоторых компонентов комплемента, особенно фактора Н. Ген, с дефектом которого предположительно связан наследственный гемолитико-уремический синдром, расположен на 1-й хромосоме (сегмент 1q32) — там, где локализованы гены, кодирующие регуляторные белки комплемента. Наследственный гемолитико-уремический синдром следует заподозрить при нетипичном течении заболевания.
Гемолитико-уремический синдром и тромботическая тромбоцитопеническая пурпура могут иметь сходные клинические проявления за счет общей для обоих заболеваний тромботической микроангиопатии. Однако различия в этиологии, патогенезе, реакции на лечение и исходах указывают на существование двух разных заболеваний, а не двух вариантов течения одной патологии. Состояние, напоминающее гемолитико-уремический синдром, иногда встречается при тяжелой артериальной гипертонии.
Эпидемиология гемолитико-уремического синдрома
Более чем у 85% детей с гемолитико-уремическим синдромом заболевание развивается на фоне инфекции, вызванной штаммом Escherichia coli О157:Н7. Эта инфекция чаще возникает в возрасте от 9 мес до 4 лет. В виде спорадических случаев и эпидемий она встречается повсеместно; по непонятным причинам у американских негров она редка.
В Северной Америке заболеваемость повышается летом и осенью. Резервуаром инфекции служит крупный рогатый скот, в США носительство штамма Escherichia coli О157:Н7 выявляют примерно у 1% скота. Escherichia coli погибает под действием высокой температуры, поэтому причиной заражения часто служит недостаточная кулинарная обработка говядины.
Иногда возбудителя обнаруживают в воде естественных водоемов и плавательных бассейнов. Источником заражения могут стать некипяченое коровье молоко, а также загрязненные навозом овощи и фрукты и приготовленные из них соки. Реже встречается передача от больного человека здоровому. Риск гемолитико-уремического синдрома у детей до 15 лет с геморрагическим колитом, вызванным штаммом Escherichia coli 0157:Н7, составляет 8—10%.
Лучший способ профилактики инфекции — тщательная кулинарная обработка при приготовлении блюд из говядины, а также мытье фруктов и овощей. Регулярное мытье рук предотвращает контактный путь заражения. Еще эффективнее могли бы защитить от инфекции обработка мяса ионизирующим излучением и вакцинация, но пока эти методы недоступны.
В настоящее время испытывается препарат под названием Synsorb-Pk, представляющий собой синтетический рецептор веротоксинов на инертном носителе — диатомите. Этот рецептор способен избирательно связывать веротоксины. Применение Synsorb-Pky детей с геморрагическим колитом, вызванным штаммом 0157:Н7, возможно, снизит заболеваемость гемолитико-уремическим синдромом.
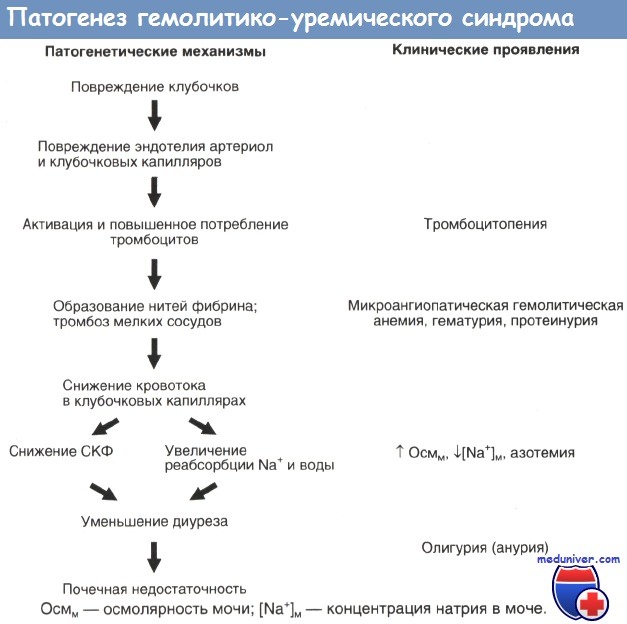
Патогенез гемолитико-уремического синдрома
Большой шаг вперед в изучении патогенеза гемолитико-уремического синдрома был сделан в 1983 г., когда Кармали и соавторы обнаружили, что в 85% случаев заболеванию предшествовала кишечная инфекция, вызванная вырабатывающим веротоксины штаммом Escherichia coli О157:Н7. Веротоксины сходны с цитотоксином, вырабатываемым Shigella dysenteriae; их название связано с тем, что они оказывают цитопатическое действие на клетки почки зеленой мартышки (линия Vera). Сегодня известно, что штамм О157:Н7 вырабатывает два вида веротоксинов — ST-1 и ST-2.
Рецептором для них служит гликолипид Gb3, который в больших количествах содержится на поверхности эндотелия клубочков почек человека. In vitro веротоксины действуют и на клетки почечных канальцев, что, по-видимому, также играет роль в поражении почек при гемолитико-уремическом синдроме. К выработке веротоксинов способны и другие штаммы Escherichia coli, в том числе О103:Н2, вызывающий инфекцию мочевых путей с последующим развитием гемолитико-уремического синдрома.
Вслед за поражением клубочкового эндотелия веротоксинами запускается каскад реакций, приводящий к повреждению и тромбозам мелких сосудов почек: в местах повреждения эндотелия откладывается фибрин, разрушаются эритроциты и тромбоциты, в сыворотке повышаются уровни факторов, способствующих свертыванию крови (тканевого фактора, фактора активации тромбоцитов, антиактиватора плазминогена 1, фактора фон Виллебранда, тромбоксана А2), и снижаются уровни противосвертывающих факторов (простациклина, тромбомодулина, урокиназы и тканевого активатора плазминогена). Подобная картина разворачивается в мелких сосудах и других органов.
Escherichia coli вырабатывают также липополисахариды, которые стимулируют продукцию цитокинов, усиливающих повреждение эндотелиальных клеток.
Полагают, что веротоксины могут связываться с эритроцитарным антигеном Р1 (этот антиген имеется у 75% людей), предотвращая тем самым гемолитико-уремический синдром, но убедительных доказательств этой гипотезы пока не получено.
Изредка гемолитико-уремический синдром может развиваться после инфекции, вызванной Streptococcus pneumoniae. Этот микроорганизм вырабатывает нейраминидазу — фермент, расщепляющий сиаловые кислоты на поверхности эритроцитов, тромбоцитов и эндотелиальных клеток клубочков. При этом обнажается малоизученный пока антиген Томсена—Фриденрейха, к которому образуются антитела (IgM).
В результате наступает гемолиз, возникает тромбоцитопения, повреждаются капилляры клубочков почек. У таких больных положительна прямая проба Кумбса, затруднено определение группы крови. Применение свежезамороженной плазмы противопоказано, так как она является дополнительным источником антител к антигену Томсена— Фриденрейха. Смертность при данной форме гемолитико-уремического синдрома достигает 50%.
— Также рекомендуем «Клиника и диагностика гемолитико-уремического синдрома»
Оглавление темы «Гломерулопатии»:
- Фокально-сегментарный гломерулосклероз — эпидемиология, патогенез
- Клиника и диагностика фокально-сегментарного гломерулосклероза
- Лечение и прогноз фокально-сегментарного гломерулосклероза
- Мембранозная нефропатия — эпидемиология, патогенез
- Клиника и диагностика мембранозной нефропатии
- Лечение и прогноз мембранозной нефропатии
- Осложнения нефротического синдрома
- Гемолитико-уремический синдром — эпидемиология, патогенез
- Клиника и диагностика гемолитико-уремического синдрома
- Лечение и прогноз гемолитико-уремического синдрома
Источник
