Тактика ведения беременности с антифосфолипидным синдромом

Статья посвящена особенностям течения антифосфолипидного синдрома у беременных и вариантам терапии
Беременность существенным образом влияет на иммунную систему матери: депрессия клеточного звена иммунитета, повышенная секреция иммуноглобулинов, снижение функции лимфоцитов вследствие экспрессии особых белков PSP (pregnancy-specific proteins). Все эти преобразования направлены на выживание плода. Процессы изменения цитокинового профиля Т-хелперов 2 типа являются доминирующими в поддержании «иммунотолерантности» при беременности и могут влиять на различные аутоиммунные заболевания. Существует ряд феноменов, с помощью которых можно увидеть влияние ревматической патологии на беременность, и наоборот. Процессы эти носят разнонаправленный характер: с одной стороны, может отмечаться как дебют системного аутоиммунного заболевания (САЗ), так и обострение существующей патологии (например, вспышка люпус-нефрита), с другой стороны, описаны многочисленные случаи ремиссии, индуцированной беременностью, у пациенток с ревматоидным артритом. Кроме того, аутоиммунная дисфункция, характерная для САЗ, наличие антифосфолипидных антител (АФА) могут привести к повышению риска выкидыша, гибели плода и преэклампсии. Трансплацентарный транспорт патологических макромолекул, особенно анти-Ro/La или SS-A, SS-B антител, напрямую влияет на плод и повышает вероятность развития неонатальной волчанки. Наконец, высокая иммуновоспалительная активность, поражение внутренних органов в рамках САЗ могут оказать существенное влияние на показатели материнской и фетальной смертности.
Беременность вызывает множество физиологических изменений в организме матери помимо дисфункции иммунной системы. Так, отмечается значительное увеличение объема циркулирующей крови (до 40–45%), что может усугубить течение заболеваний почек или сердечно-сосудистой системы. Скорость клубочковой фильтрации (СКФ) увеличивается примерно на 50% при нормальном течении беременности, поэтому у пациентки с предшествующей протеинурией почти наверняка будет отмечаться некоторое увеличение количества белка в моче. В результате изменений коагуляционного звена гемостаза, активности тромбоцитов, фибринолиза, венозного стаза, компрессии сосудов беременной маткой, вынужденного постельного режима повышается вероятность тромботических осложнений. Отмечаются отек и кровоточивость десен, желудочно-пищеводный рефлюкс, значительные потери костной массы из-за беременности, лактации, а также возможного применения глюкокортикостероидов (ГКС). Таким образом, даже нормальная беременность может усугубить течение САЗ.
Физиологические или патологические изменения, в т. ч. вызванная беременностью гипертензия, могут также имитировать активность САЗ, что представляет собой определенные трудности при проведении дифференциального диагноза. Например, покраснение или гиперпигментацию лица легко спутать с центробежной скуловой сыпью по типу «бабочки». Ладонная эритема у беременных может выглядеть, как кожный васкулит. Физиологический лейкоцитоз, анемия и низкий уровень тромбоцитов вследствие гемодилюции, распространенной у беременных, могут имитировать гематологические проявления САЗ. В результате повышения уровня фибриногена, анемии может отмечаться ускорение скорости оседания эритроцитов, и данный параметр не может быть объективным маркером активности заболевания. Многие женщины предъявляют жалобы на диффузные артралгии, боли в мышцах и костях, особенно во время первой беременности. Гипертензия, протеинурия, почечная недостаточность и отеки, связанные с гестозом, могут имитировать различные заболевания или их обострение, включая волчаночный нефрит, острую склеродермическую нефропатию, рецидив васкулита, некротизирующего гломерулонефрита. HELLP-синдром – вариант преэклампсии, характеризующийся низким количеством тромбоцитов, повышенным уровнем печеночных ферментов, гемолизом, болью в животе, может имитировать системную красную волчанку (СКВ) или обострение системного васкулита. Наконец, эклампсию, которая включает в себя судорожный синдром или нарушение мозгового кровообращения, можно спутать с поражением центральной нервной системы при СКВ или нейроваскулитом.
Антифосфолипидный синдром
В начале 1950-х гг. антифосфолипидный синдром (АФС) был описан как вариант СКВ или волчаночноподобного синдрома. Однако очень скоро было установлено, что связь между гиперпродукцией АФА и тромботическими нарушениями наблюдается в отсутствие достоверных клинических и серологических признаков СКВ или какого-либо другого ведущего заболевания. Для определения этой новой нозологической формы был предложен термин «первичный антифосфолипидный синдром».
Разработка методов радиоиммунологического (1983) и иммуноферментного анализа для определения антител к кардиолипину способствовала расширению исследований, касающихся роли АФА при заболеваниях человека. Оказалось, что эти антитела являются серологическим маркером своеобразного симптомокомплекса, включающего венозные и/или артериальные тромбозы, различные формы акушерской патологии (в первую очередь привычное невынашивание беременности), тромбоцитопению, а также другие разнообразные неврологические, кожные, сердечно-сосудистые, гематологические нарушения. В 1986 г. G. Hughes et al. предложили обозначать этот симптомокомплекс как АФС. В 1994 г. на VI международном симпозиуме, посвященном изучению АФА, было предложено называть АФС синдромом Hughes – по имени английского ревматолога, впервые описавшего его и внесшего наибольший вклад в разработку этой проблемы.
В 2006 г. в Сиднее произошел последний пересмотр критериев этого заболевания. Несколько изменена была трактовка клинических проявлений, в лабораторные критерии добавлены антитела к бета-2 гликопротеину I (АБ2ГП) (табл. 1). На основе австралийских критериев в настоящее время строится практическая диагностика АФС.
![Таблица 1. Дополненные критерии антифосфолипидного синдрома (Сидней, 2006) [1] Таблица 1. Дополненные критерии антифосфолипидного синдрома (Сидней, 2006) [1]](https://www.rmj.ru/upload/medialibrary/f85/f85acd6d40c7dfd5904308d4df8c6b29.png)
Клинический спектр проявлений, которые связывают с АФС, достаточно широк: мигрень, артриты/артралгии, легочная гипертензия, livedo reticularis, язвы ног и др. Хотя большинство из них не были включены в итоговые критерии диагностики АФС от 2006 г., место этих феноменов активно обсуждается в литературе.
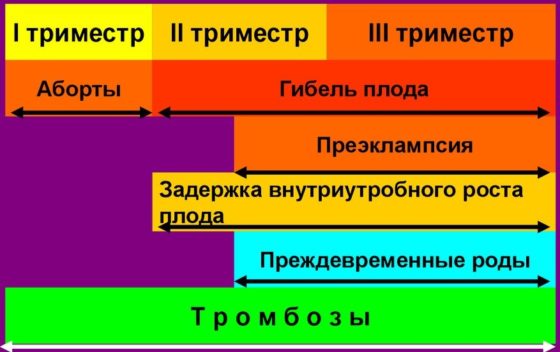
Потеря беременности является частым осложнением АФС в акушерской практике, кроме того, обращает на себя внимание тот факт, что преэклампсия и эклампсия часто встречаются при сочетании АФС и СКВ. HELLP-синдром в сочетании с циркуляцией АКЛА протекает тяжелее и часто встречается во II, а не III триместре. Риск развития инфаркта печени у пациентов с HELLP-синдромом, ассоциированным с АКЛА, увеличивается в 30 раз по сравнению с таковым при серонегативном варианте HELLP-синдрома [2]. Кроме того, при АФС часто развиваются другие множественные тромботические осложнения, которые требуют более агрессивного лечения, чем у пациентов с традиционным течением HELLP-синдрома. Сама по себе беременность является фактором риска развития гиперкоагуляции, и при появлении АФС вероятность тромбозов у матери существенно увеличивается. В редких случаях во время беременности может формироваться катастрофический АФС: в проанализированных работах было выявлено 15 случаев, характерной особенностью которых явился тот факт, что почти половина пациенток до этого имела в анамнезе латентно протекающий АФС [3]. Пациентки могут иметь и другие гематологические осложнения АФС, такие как выраженная тромбоцитопения во II и III триместрах беременности.
Наиболее распространенными нежелательными явлениями, связанными с АФС у беременных, являются преждевременные роды и задержка внутриутробного развития. Преждевременные роды наиболее часто встречаются у пациенток, у которых есть сочетание АФС и СКВ, а заболеваемость колеблется от 10 до 40%. В одном исследовании авторы попытались определить причины неблагоприятных неонатальных исходов (преждевременные роды, задержка внутриутробного развития, низкая оценка по шкале Апгар). Такими факторами явились присутствие ВАК, АКЛА, АБ2ГП антител, наличие в анамнезе сосудистых тромбозов перед беременностью. При отсутствии этих факторов (даже при наличии предшествующего отягощенного акушерского анамнеза) отмечался более благоприятный неонатальный исход [4].
В редких случаях у плода или новорожденного формируются тромбозы вследствие трансплацентарного транспорта АФА. В таких случаях речь может идти о наличии неонатального АФС [5]. Риск тромбозов в данной когорте пациентов уменьшается вместе со снижением концентрации материнских АФА, однако в дальнейшем отмечаются затруднение обучаемости, снижение памяти и других когнитивных функций. В настоящее время существуют регистры (European registry to babies born to mothers with antiphospholipid syndromе) по наблюдению за отдаленными нейропсихическими последствиями неонатального АФС [6].
ВАК, по-видимому, является наиболее важным фактором риска неблагоприятного исхода беременности, в т. ч. ее потери. В настоящее время способы определения концентрации ВАК являются нестандартизованными в отличие от тестов, связанных с определением антикардиолипинов и бета-2 гликопротеина I. В настоящее время завершается многоцентровое проспективное наблюдательное исследование PROMISSE, основная цель которого – наблюдение за АФС-позитивными и СКВ-ассоциированными беременными женщинами. Недавний анализ промежуточных данных установил, что только уровень ВАК является единственным лабораторным маркером АФС, связанным с такими неблагоприятными исходами беременности, как интранатальная гибель плода, задержка внутриутробного развития и преждевременные роды [7]. С другой стороны, появляются данные о том, что только совокупность ВАК, АКЛА и АБ2ГП у конкретной пациентки является предиктором интранатальной гибели плода [8]. Эта информация несколько обнадеживает тех пациенток, которые имеют низкий или умеренный титр АКЛА, АБ2ГП. Для своевременной оценки риска тромбозов у пациенток с АФС необходимо проводить тщательный скрининг на наличие маркеров наследственной тромбофилии (гены фибринолиза: PAI-I, PLAT; гены тромбоцитарных рецепторов: ITGA2, ITGB3, Gplba; гены системы свертывания крови: Fl, F2, F5, F7), наличие гипергомоцистеинемии [8–10]. В последнее время появляются данные о взаимосвязи изменения уровня комплемента в сыворотке во время беременности и неблагоприятных исходов. Интерпретация этого феномена представляется весьма затруднительной: при эклампсии и первичном АФС возможно повышение титра, а при СКВ и вторичном АФС – гипокомплементемия. Комплемент является важным прогностическим фактором неблагоприятного исхода беременности и смертности в мышиной модели АФС [11], представляется вероятным, что активация системы комплемента играет такую же негативную роль и в человеческой популяции.
Рекомендации по ведению беременных женщин с АФС
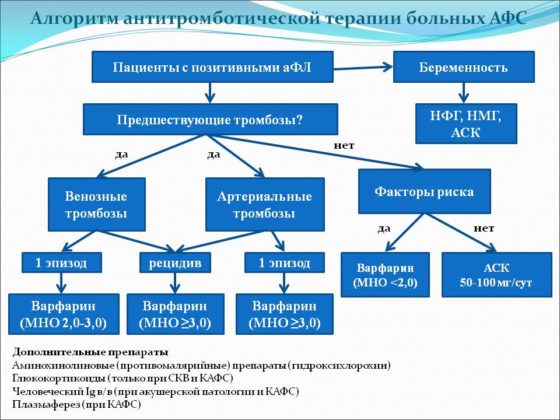
Своевременное становление лечения акушерского АФС относится к 1980–1985 гг., когда пациентки с наличием АКЛА, ВАК и акушерскими неудачами стали получать ГКС (преднизолон) и ацетилсалициловую кислоту (АСК) в небольших дозах. Более того, дозу ГКС постепенно увеличивали вплоть до достижения ВАК или другими маркерами АФС приемлемых уровней. В 1990-х гг. исследования показали, что низкие дозы гепарина в сочетании с малыми дозами АСК оказались столь же эффективными, как ГКС, но с гораздо меньшим количеством побочных эффектов. На сегодняшний момент комбинация антитромбоцитарных препаратов и прямых антикоагулянтов является стандартной: дозировка низкомолекулярного гепарина (НМГ) обычно – 40 мг эноксапарина ежедневно, некоторые специалисты используют 30 мг 2 р./сут, доза для нефракционированного гепарина (НФГ) обычно – 5000 ЕД 2 р./сут [12].
Исследования показывают, что сочетание низких доз гепарина и низких доз АСК более эффективно, чем монотерапия АСК [13], с успешностью около 75% против 40%. Не получено принципиальных отличий между малыми и высокими дозами антикоагулянтов, а также НФГ и НМГ гепарина [14, 15]. Такой вид терапии относится к первой линии и является наиболее эффективным в плане профилактики потери беременности на ранних сроках [16].
Терапия второй линии включает в себя применение внутривенного человеческого иммуноглобулина (ВВИГ). Некоторые эксперты на этом этапе рекомендуют увеличение дозы гепарина до общетерапевтических доз. В единственном контролируемом исследовании с использованием ВВИГ не было получено достоверного улучшения исходов беременности. Однако существует значительное количество неконтролируемых исследований, опубликованных клинических случаев с блестящим эффектом при комбинированном применении ВВИГ, низких доз АСК и НМГ. При дальнейшем повышении уровня АКЛА, ВАК с успехом может применяться плазмаферез. Наиболее перспективными методами лечения АФС в будущем являются ингибирование комплемента [11], а также применение средств генно-инженерной биологической терапии [17].
Лечение средними/высокими дозами ГКС в настоящее время практически не применяется из-за отсутствия доказательств их эффективности и негативного воздействия на организм как матери, так и плода. Применение ГКС оправданно, только если АФС развивается на фоне какого-то заболевания (СКВ, болезни Шегрена и др.). Использование ГКС в этих случаях направлено на лечение не АФС, а основного заболевания.
В послеродовом периоде антикоагулянтная терапия должна быть продолжена на срок от 6 до 8 нед. даже у пациенток без тромбозов в анамнезе.
Тактика ведения беременных с АФС, режим дозирования во многом зависят от предшествующего анамнеза (наличия/отсутствия неплацентарных тромбозов, количества спонтанных абортов, предшествующей терапии). В связи с этим можно выделить следующие подгруппы:
1. Пациентки только с серологическими маркерами АФС (без предшествующей беременности, с одним эпизодом необъяснимого спонтанного аборта до 10 нед. гестации), без тромбозов в анамнезе.
Тактика ведения этой категории женщин заключается в применении малых доз АСК, которая назначается на весь период беременности и в течение 6 мес. после родоразрешения.
При наличии у беременных высокопозитивных АКЛА (более 65 ЕД GPL) целесообразно назначение НМГ. Риск развития тромботических осложнений высок не только во время беременности, но и в послеродовом периоде (в течение 6 мес. после родов). При родоразрешении естественным путем целесообразно возобновление лечения НМГ в послеродовом периоде. В случае проведения кесарева сечения введение НМГ отменяется за 2—3 дня и возобновляется в послеродовом периоде с последующим переходом на прием непрямых антикоагулянтов.
2. Пациентки с АФС без неплацентарных тромбозов в анамнезе и женщины с серологическими маркерами АФС и двумя или более необъяснимыми спонтанными абортами (до 10 нед. гестации) в анамнезе.
Тактика ведения данной категории беременных заключается в сочетанном применении малых доз АСК (50–150 мг/сут) с момента зачатия до родоразрешения и НФГ (эноксапарина и др.) или НФГ (5000–10 000 ЕД каждые 12 ч) с момента документированной беременности и до родов. Через 12 ч после родов необходимо возобновить лечение НМГ, НФГ (или варфарином).
Длительная терапия гепарином у беременных женщин может приводить к развитию остеопороза. Вследствие этого все беременные, получающие гепаринотерапию, обязательно должны принимать препараты кальция (1500 мг/сут) и витамина D3 (не менее 1000 МЕ/сут).
3. Пациентки с АФС и неплацентарными тромбозами в анамнезе (получавшие варфарин до беременности).
Необходимо до 6 нед. беременности отменить варфарин. В последующем беременная принимает АСК в низких дозах в сочетании с НФГ.
4. При неэффективности стандартной терапии в период следующей беременности применяют иммуноглобулин в/в 0,4 г/кг в течение 5 сут каждый месяц беременности.
Источник
Несмотря на то что клинические рекомендации по диагностике, лечению антифосфолипидного синдрома разработаны ревматологами, к акушерству он имеет прямое отношение. Антифосфолипидный синдром при беременности приводит к привычному невынашиванию, что влечет за собой бездетность пары.
Что это за болезнь
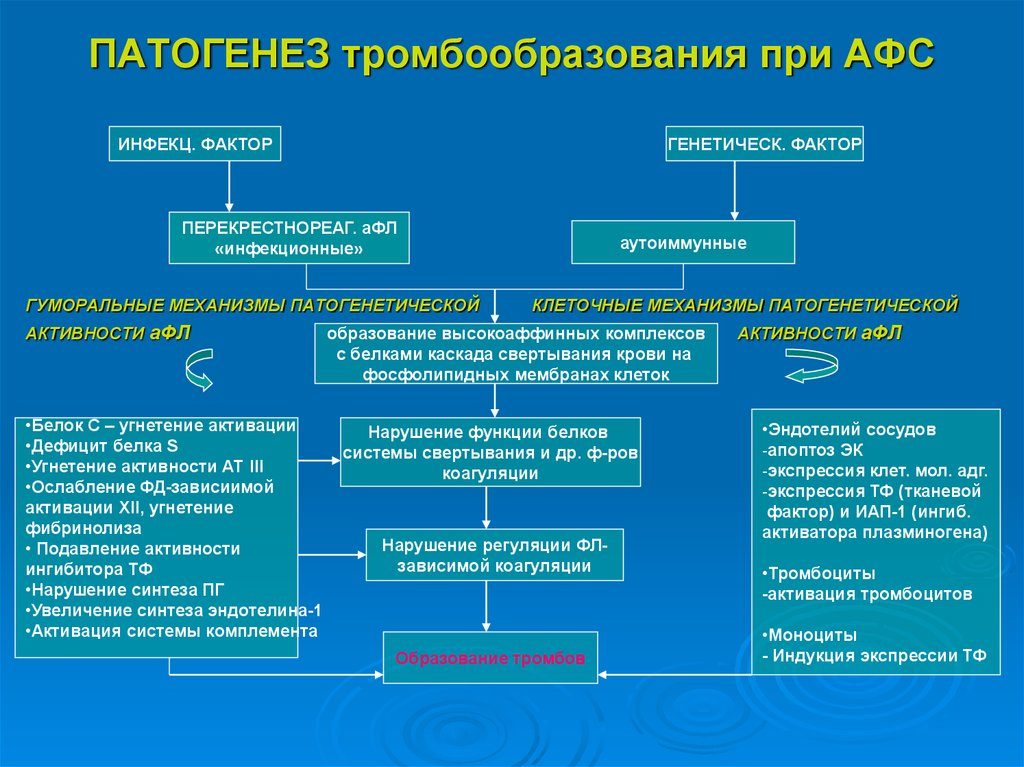
Антифосфолипидный синдром, или АФС – это патология, которая характеризуется повторяющимися тромбозами венозного, артериального, микроциркуляторного русла, патологией беременности с потерей плода и синтезом антифосфолипидных антител (афла): кардиолипиновых антител (аКЛ) и/или волчаночного антикоагулянта (ВА), и/или антител к бета2-гликопротеин Ⅰ. АФС – вариант часто приобретенной тромбофилии.
Код по МКБ 10 пересмотра – Д68.8.
Основой патогенеза антифосфолипидного синдрома является атака антителами мембран клеток. Чаще всего антифосфолипидный синдром развивается у женщин – в 5 раз чаще, чем у мужчин.
Манифестация синдрома происходит возникновением тромбозов, невынашиванием беременности. Часто до развития гестации женщины не подозревали о наличии этой патологии и присутствии антител в крови.
Классификация
Существует несколько вариантов антифосфолипидного синдрома. Основная классификация их такова:
- Первичный – связан с наследственными дефектами гемостаза.
- Вторичный АФС возник на фоне аутоиммунных болезней (ревматоидный артрит, системная красная волчанка), васкулитов, органоспецифичных патологий (сахарный диабет, болезни Крона), онкологических процессов, лекарственного воздействия, инфекций (ВИЧ, сифилис, малярия), при конечной стадии почечной недостаточности.
- Другие варианты АФС:
- серонегативный
- катастрофический
- другие микроангиопатические синдромы (ДВС-синдром, HELLP).
Причины невынашивания беременности

Патогенез развития акушерской патологии при АФС.
Доказано влияние АФС в развитии таких осложнений беременности:
- бесплодие неясного генеза;
- ранние преэмбриональные потери;
- неудачные ЭКО;
- выкидыши на разных сроках;
- внутриутробная гибель плода;
- послеродовая гибель плода;
- синдром задержки развития плода;
- преэклампсия и эклампсия;
- тромбозы во время беременности и после родов;
- пороки развития плода.
В послеродовом периоде у ребенка также возникают последствия антифосфолипидного синдрома: тромбозы, нейроциркуляторные расстройства с формированием аутизма в будущем. 20% детей, рожденных от матерей с АФС, в крови присутствуют антифосфолипидные антитела без симптомов, что говорит о внутриутробной передаче аФЛ.
Патогенетической основой развития всех проявлений АФС при беременности является плацентарная децидуальная васкулопатия, что вызывается недостатком продукции простагландина, тромбозами плаценты и нарушением механизма имплантации. Все эти механизмы препятствуют беременности.
Критерии диагноза
Выделяют критерии, по которым устанавливается диагноз «Антифосфолипидный синдром». Среди клинических критериев выделены следующие:
- Сосудистый тромбоз любой локализации: как венозный, так и артериальный, подтвержденный визуальными методами исследования. При использовании гистологического исследования в биоптатах должны отсутствовать признаки воспаления сосудистой стенки.
- Осложнения беременности:
- один или более эпизод гибели нормально развивающегося плода после 10 недель гестации или
- один или больше эпизодов преждевременных родов до 34 нед из-за значительной преэклампсии, эклампсии, плацентарной недостаточности или
- три или больше случаев подряд спонтанных абортов в сроке менее 10 недель, при отсутствии патологий анатомии матки, генетических мутаций, половых инфекций.
Лабораторные критерии таковы:
- В крови выявлены антитела к кардиолипину иммуноглобулины классов G и M в средних и высоких титрах, по крайней мере, 2 раза за 12 месяцев.
- Антитела к b2-гликопротеину I классов G и/или M в средних или высоких титрах, по крайней мере, 2 раза за год.
- Определен волчаночный антикоагулянт ВА в плазме в 2 более лабораторных исследованиях в промежутке хотя бы 12 месяцев. Заподозрить наличие ВА в крови можно при увеличении АЧТВ в коагулограмме в 2 и более раза.
Высокопозитивным считается анализ на антитела – 60 МЕ/мл, среднепозитивный ответ – 20-60 МЕ/мл, низкопозитивный – менее 20 МЕ/мл.
Для постановки диагноза «Антифосфолипидный синдром» необходимо присутствие одного клинического и одного лабораторного критерия.
Симптомы

Основным симптомом антифосфолипидного синдрома является тромбоз. У женщин эта патология проявляется невынашиванием беременности. Кроме таких очевидных признаков, у женщин могут проявляться дополнительные клинические критерии:
- сетчатое ливедо;
- наличие в анамнезе мигреней, хореи;
- трофические язвенные дефекты нижних конечностей;
- эндокардит и прочее.
Очень тяжело протекает катастрофическая форма антифосфолипидного синдрома. Она сопровождается клиникой острой почечной недостаточности, респираторным дистресс-синдромом, печеночной недостаточностью, нарушением мозгового кровотока, тромбозом крупных сосудов, в том числе и легочной артерии. Без срочной помощь прожить с этой формой длительно невозможно.
Лечение
Лечением АФС занимаются многие специалисты: ревматологи, гематологи, акушеры и гинекологи, кардиологи, кардиохирурги и прочие.
Первая группа пациентов
Пациенты, которые не имеют лабораторно выраженных признаков или клинических симптомов, не нуждаются в постоянном лабораторном контроле и непрерывной антикоагулянтной терапии. В этой группе пациентов проводят стандартную профилактику венозных тромбозов.
Вторая группа
У пациентов с высоким титром волчаночного антикоагулянта и/или антифосфолипидных антител более 10 МЕ/мл без тромбоза требуется назначение специфической профилактики – Аспирин в дозировке 75-100 мг один раз в день.
Третья группа
У этих людей результаты анализов на антитела отрицательны, но имеется подтвержденные случаи тромбоза и высокий риск их образования. У этих больных проводится лечение антикоагулянтами низкомолекулярного гепарина в терапевтических дозах. Сразу после постановки диагноза используют:
- Дальтепарин 100 МЕ/кг 2 раза в сутки;
- Надропарин 86 МЕ/кг или 0,1 мл на 10 кг 2 раза в день подкожно;
- Эноксапарин 1 мг/кг 2 раза в день подкожно;
- Со второго дня назначают Варфарин с 5 мг в сутки.
У пациентов этой группы проводят гепаринотерапию не менее 3 месяцев. В начале терапии выполняют контроль МНО каждые 4-5 дня для поддержания целевого значения в 2,0-3,0.
Четвертая группа
В эту группу входят люди, у которых тромбозы происходят на фоне повышенных титров волчаночного антикоагулянта и антифосфолипидного антитела. У этой категории больных назначается Варфарин и низкие доза (75-100 мг) Ацетилсалициловой кислоты. Пациенты с высоким уровнем риска должны получать пожизненно антикоагулянтную терапию.
Прегравидарная подготовка
Подготовка к беременности при АФС проводится в 2 последовательных этапа. На первом проводят оценку коагулограммы, определяют антигенный компоненты крови, удаляют и санируют инфекционные очаги.
Второй этап – это непосредственная подготовка к беременности и ее ведение. Для этого необходима антикоагулянтная терапия. Она проводится индивидуально в течение 1-2 менструальных циклов. Для этого нужно отнести женщину в одну из следующих групп:
- Серонегативный вариант АФС с наличием в анамнезе акушерских проявления синдрома. В сыворотке могут быть обнаружены только антитела к бета2-гликопротеину I. В этой группе проводят подготовку с помощью таких препаратов:
- один из препаратов низкомолекулярного гепарина 1 раз/сутки подкожно (дальтепарин (Фрагмин)120 антиХа МЕ/кг или эноксапарин (Клексан) 100 антиХа МЕ/кг;
- рыбий жир по 1-2 капсулы 3 раза/сутки;
- фолиевая кислота 4 мг/сутки;
- Если отсутствует волчаночный антикоагулянт, но присутствует АФЛА без тромбозов и акушерских клинических проявлений:
- при умеренном титре АФЛА назначается Аспирин 75-100 мг/сутки, а при развитии беременности он отменяется с заменой на дипиридомол 50-75 мг/сутки;
- при высоком и умеренном титре антифосфолипидного антигена комбинируют Ацетилсалициловую кислоту 75 мг/сутки и низкомолекулярный гепарин один раз в сутки подкожно;
- рыбий жир по 1-2 капсуле 3 раза в день;
- фолиевая кислота 4 мг/сутки.
- Если нет в крови волчаночного антикоагулянта, но есть в высоком или умеренном количестве антифосфолипидный антиген и имеется клиника тромбозов и акушерские осложнения:
- один из НМГ (Клексан, Фрагмин, Фраксипарин) 1 раз в сутки подкожно;
- Аспирин 75 мг/сутки с отменой его при развитии беременности и назначением Дипиридамола 50-75 мг/сутки;
- рыбий жир 1-2 капсулы 3 раза в день;
- фолиевая кислота 4 мг/сутки.
- В плазме женщины обнаружены АФЛА и определяется волчаночный антикоагулянт ВА от 1,5 до 2 усл.ед. До нормализации ВА следует воздержаться от беременности. Для нормализации ВА менее 1,2 усл.ед применяют:
- Клексан 100 антиХа МЕ/кг или Фрагмин 120 антиХа МЕ/кг один раз в сутки подкожно;
- рекомендован иммуноглобулин человеческий внутривенно 25 мл через день 3 дозы, повторяют введение препарата в 7-12 недель беременности, в 24 недели и последнее введение перед родами;
- после установления ВА в пределах нормы назначают Ацетилсалициловую кислоту 75 мг/сутки до наступления беременности;
- Клексан или Фрагмин один раз в день подкожно в прежних дозировках;
- рыбий жир 1-2 кап. 3 раза в день;
- фолиевая кислота 4 мг/кг.
- Если ВА в крови более 2 усл.ед, то зачатие откладывается минимум на 6-12 месяцев. Риск развития тромбоза у таких женщин очень велик. Целевое значение ВА – 1,2 усл.ед. Терапия проводится не менее 6 месяцев.
Лабораторная диагностика и обследование при планировании беременности обязательно включает такие показатели свертывания крови:
- тромбоциты – 150-400*109/л;
- фибриноген – 2-4 г/л;
- МНО – 0,7-1,1;
- продукты деградации фибриногена и фибрина – менее 5 мкг/мл;
- д-димеры – менее 0,5 мкг/мл;
- растворимые фибринмономерные комплексы должны отсутствовать;
- протеин С – 69,1-134,1%;
- антитромбин Ⅲ – 80-120%;
- агрегационная активность тромбоцитов с солью аденозиндифосфата – 50-80%, с гидрохлоридом адреналина – 50-80%;
- антикардиолипиновые антитела – все классы иммуноглобулинов менее 10 МЕ/мл;
- ВА – отрицательный или менее 0,8-1,2 усл.ед;
- гипергомоцистеинемия – отрицательная;
- мутация FV (Leiden) гена, ответственного за синтез фактора V, или мутация G20210A гена, ответственного за синтез фактора II – отсутствует;
- общий анализ мочи для определения гематурии;
- контроль за развитием инфекционных болезней: лимфоциты, СОЭ.
Ведение беременности при АФС
Чтобы во время беременности не возникало тромбозов и потери плода, необходима профилактика – немедикаментозная и медикаментозная.
Немедикаментозная:
- физическая активность стимулирует собственный тканевой плазминоген;
- эластичный медицинский трикотаж 1-2 класс компрессии;
- диета с большим количеством растительных масел, свеклы, чернослива, инжира, бананов, поскольку эти продукты обладают слабительным эффектом – это важно, чтобы при дефекации не создавать повышенное давление на стенки вен.
Медикаментозная профилактика тромбозов при беременности
Существует несколько вариантов профилактики в зависимости от течения антифосфолипидного синдрома.
- Отсутствуют серологические маркеры ВА и антикардиолипиновый антиген, тромботические осложнения, могут определяться антитела к бета2-гликопротеину I.
- В первом триместре назначают Клексан или Фрагмин в дозировке для оптимального поддержания д-димеров и фолиевая кислота 4 мг/кг.
- Второй и третий триместры – Фригмин или Клексан до нормальных цифр д-димеров, рыбий жир, Аспирин 75-100 мг/кг при повышенной агрегации тромбоцитов, СЗП 10 мл/кг или концентрат антитромбина при снижени антитромбина 3 менее 80%.
- Перед родами Аспирин отменяют за 3-5 суток, вечернюю дозу НМГ меняют на СЗП 10мг/кг с гепарином 1-2 Ед на каждый мл СЗП.
- При родоразрешении – нормальный уровень д-димеров СЗП 10 мг/кг, при высоком уровне перед операцией – СЗП 5 мл/кг плюс гепарин 1 Ед на 1 мл СЗП или концентрат антитромбина 3, во время операции СЗП 5 мл/кг.
- При наличии в крови АФЛА и тромбозами или без них, отсутствует волчаночный антикоагулянт.
- 1 триместр – Клесан или Фрагмин для поддержания нормального уровня д-димеров+фолиевая кислота 4 мг/сутки.
- 2 и 3 триместры – Клексан или Фрагмин в индивидуальных дозировках+Аспирин 75 мг/сутки+рыбий жир 1-2 кап 3 раза в день, при снижении антитромбина 3 менее 80% активности – СЗП 10 мл/кг или концентрат антитромбина Ⅲ – 10-50 МЕ/кг, при повышении д-димеров более 0,5 мкг/мл – повышении дозировки НМГ.
- Перед родами – отмена Аспирина за 3-5 дней, НМГ заменяют на СЗП 10 мл/кг+НФГ 1-2 ЕД на каждый мл СЗП, при повышении антифосфолипидных антител назначается Преднизолон (Метилпред) 1-1,5 мг/кг внутривенно.
- При родоразрешении если нормальные D-димеры – СЗП 10 мл/кг; если повышены д-димеры, то до операции СЗП 5 мл/кг+НФГ 1 ед на каждый мл CPG или концентрат антитромбина 3, во время операции – СЗП 5 мл/кг, при значительном повышении антител – Преднизолон 1,5-2 мл/кг внутривенно.
- При повышении ВА от 1,5 до 2 усл.ед.
- 1 триместр – базовый прием Фрагмин или Клексана в дозе, как в прошлом варианте+фолиевая кислота+иммуноглобулин человеческий 25 мл через день 3 дозы в 7-12 нед. Если имеется повышение ВА более 1,5 усл.ед в первом триместре, то беременность стоить прервать.
- 2 и 3 триместр – Фрагмин и Клексан в дозировке для нормального поддержания д-димеров+Аспирин 75 мг+рыбий жир 1-2 кап 3 раза в день, при сниженном антитромбине – СЗП 10 мл/кг или концентрат антитромбина Ⅲ 10-50 МЕ/кг в/в, при повышении Д-димеров – повысить дозировку НМГ, иммуноглобулин 25 мл через 1 день 3 раза в 24 недели, если повышен ВА от 1,2 до 2 усл.ед – Преднизолон 30-60 мг/сут в/в, с 13 до 34 недели возможен перевод на Варфарин под контролем МНО.
- Перед родами если был Варфарин, то его отменяют за 2-3 нед, переводят на НМГ, Аспирин отменяется за 3-5 дней до родов, СЗП 10 мл/кг+НФГ 2 ед на каждый мл плазмы, Преднизолон – 1,5-2 мл/кг в/в, при сниженном антитромбине Ⅲ – концентрат антитромбина Ⅲ 10-30 МЕ/кг.
- При родах – до операции СЗП 500 мл+НФГ 1000 ЕД, во время операции – СЗП 10 мл/кг, Преднизолон 1,5-2 мг/кг в/в.
- При повышении ВА более 2 усл.ед беременность следует прерывать.
Если у женщины развился катастрофический антифосфолипидный или HELLP-синдром, то может быть назначен плазмоферез или плазмофильтрация.
Послеродовый период
После родоразрешения возобновить профилактику тромбоэмболии следует уже спустя 8-12 часов Фраксипарином (Надропарином) – 0,1 мл/10 кг, Клексан (Эноксапарин) 100 МЕ/кг, Фрагмин (Дальтепарин) 120 МЕ/кг, если нет кровотечения.
Если у женщины были отмечены тромбозы в анамнезе, то назначаются терапевтические дозы этих средств Фраксипарин – 0,1 мл/10 кг 2 раза в день, Клексан – 100 МЕ/кг 2 раза в день, Фрагмин – 120 МЕ/кг 2 раза в день.
Применение НМГ необходимо продолжать не меньше 10 дней. А если был эпизод доказанной тромбоэмболии, то антикоагулянты используются не менее 3-6 месяцев.
Повышение концентрации антигенов в крови требует консультации гематолога или ревматолога для решения вопроса о гормональной терапии.
Цена на анализы
Чтобы выявить АФС, можно пройти диагностику на платной основе. Многие частные лаборатории предлагают панель для определения антифосфолипидных антител. В лаборатории Инвитро в Москве цены на конец 2018 года таковы:
- обнаружение иммуноглобулинов G и M к кардиолипину стоит 1990 руб;
- диагностика вторичного АФС – цена 3170 руб;
- развернутое серологическое исследование на АФС – 4200 руб;
- лабораторные критерии АФС – 3950 руб.
В лаборатории Синэво в Москве цены на анализы этой панели несколько разняться:
- иммуноглобулинов G и M к кардиолипину – 960 руб;
- антитела к бета2-гликопротеиду I – 720 руб;
- антитела класса G к фосфолипидам – 720 руб;
- антитела класса M к фосфолипидам – 720 руб.
Примерно такие цены могут предложить и другие частные лаборатории в городах России.
Источник
