Срк синдром избыточного бактериального роста


Синдром избыточного бактериального роста (СИБР) сейчас очень «модный» диагноз. Что же это такое?
Проявления СИБР — всем известные симптомы: вздутие живота, метеоризм, газы. Причина этой болезни – изменения в составе микрофлоры кишечника, а именно тонкой кишки, когда она заселяется несвойственными ей бактериями (кишечной палочкой, клостридиями, компилобактером и другими).
Тонкая кишка человека находится в проекции пупка и вокруг него, она делится на 3 части. Это двенадцатиперстная кишка, тощая кишка и подвздошная кишка. Двенадцатиперстная кишка подковообразной формы, она находится непосредственно после желудка.
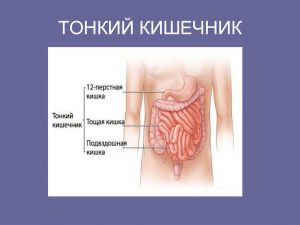
Пища, измельченная в желудке, попадает в двенадцатиперстную кишку и подвергается там воздействию соков поджелудочной железы и желчи. Сок поджелудочной железы расщепляет сложные молекулы белков, жиров и углеводов на более простые, чтобы легче можно было транспортировать их через стенку кишечника.
Формируется пищевой комок, который называется химус. Он проходит дальше по тонкой кишке, где всасываются питательные вещества. Тонкая кишка действительно очень длинная и тонкая. Общая протяженность тонкой кишки у людей от 2.4 метров до 4.5 метров, у мужчин длиннее, чем у женщин. Внутренняя поверхность кишки выстлана ворсинками, и даже поверхности клеток, тоже ворсинчатые, чтобы увеличить площадь всасывания.
Что нужно знать о бактериях тонкой кишки
В тонкой кишке живут бактерии. Они живут не просто так, а «сидят» на гликокаликсе — слое, состоящем из молекул полисахаридов, покрывающем стенку кишки. Гликокаликс, в переводе с латинского «сахарная шкура» есть у всех клеток растений и животных. У человека он наиболее развит в кишечнике. Функция гликокаликса тонкого кишечника очень важна. Он «просеивает», как сито, питательные вещества, к нему прикрепляются полезные бактерии, на нем прикреплены молекулы ферментов которые продолжают «отщипывать» кусочки от крупных молекул питательных веществ.
Состав полезных бактерий разный, но это, в основном, лактобактерии, которые помогают нам справляться с молочной пищей. Бифидобактерии, которые синтезируют витамины, помогают всасываться железу и кальцию, защищают стенку кишечника от вредных микробов. Если туда попадает из толстой кишки кишечная палочка или клостридии, то есть анаэробные микробы (им для жизни не нужен кислород), они начинают выделять газы – метан, углекислый газ, сероводород, и, вместе с ними, токсичные вещества – этанол, ацетат.
Сами по себе кишечные палочки — комменсалы, то есть пользы и вреда от них нет, просто они живут в кишечнике, а некоторые их виды даже приносят пользу. Но есть и вредные виды, которые могут проникнуть в органы женской половой системы, дыхательной системы у ослабленных людей и вызвать там воспаление. В больших количествах, определенные штаммы кишечных палочек (по-латински «эшерихия коли»), могут вызвать эшерихиозы – пищевые отравления, вплоть до сепсиса. Что касается клостридий, то у них есть опасные родственники. Эти виды клостридий вызывают ботулизм и столбняк. Есть клостридии, живущие в толстом кишечнике, они усиливают моторику, расщепляют белки. Но когда их становится много, могут вызвать заболевание, которое трудно вылечить – псевдомембранозный колит.
Симптомы СИБР
Таким образом и развивается СИБР, когда эти бактерии попадают в несвойственное им место. Часто такой дисбаланс в микрофлоре протекает без видимых симптомов. У пациента могут быть проявления интоксикации, быстрая утомляемость, слабость, в таком случае трудно понять, что виноваты бактерии в тонком кишечнике. С другой стороны, может быть и очень яркая клиника – чередование запоров и диареи, вздутие живота, и все это длительно и мучительно. Снижается всасывание витаминов В12 и фолиевой кислоты, что приводит к нарушению кроветворения, а значит В12 и фолиево-дефицитной анемии. Эритроциты в костном мозге не могут делиться, становятся большими, недоразвитыми, а значит потом быстро разрушаются в селезенке.
Наряду с этим, нарушается всасывание жиров, что приводит к диарее и ухудшению всасывания других питательных веществ.
Что вызывает заселение этих микробов в тонкую кишку
Причин здесь может быть несколько.
- Снижение кислотности желудочного сока. Желудочный сок в процессе пищеварения расщепляет питательные вещества. Также он расщепляет вредные бактерии и дезинфицирует содержимое пищевого комка. Если кислотность желудочного сока снижена, то бактерии легко проникают из ротовой полости или верхних дыхательных путей и заселяются в тонкий кишечник. Это относится и к длительному приему препаратов группы ингибиторов протонной помпы (омепразол, рабепразол), как одно из побочных действий этой группы лекарств.
- Нарушение правильного выделения желчи. При задержке желчи, что случается, когда излишне спазмированы желчевыводящие пути, или если желчь синтезируется неполноценная, например, при циррозе, стеатогепатите. В норме у желчи есть бактерицидные свойства и она губительна для бактерий, которые не должны проживать в тонком кишечнике.
- Недостаточность илеоцекального клапана. Есть клапан, который разграничивает содержимое тонкого и толстого кишечника, он закрывает просвет тонкой кишки и флора, которая живет в толстом кишечнике, не может пробраться в более высокие отделы. Если это клапан работает плохо, то бактерии из толстого кишечника попадают в тонкий и размножаются там.
- Заболевания кишечника, нарушающие моторику тонкого кишечника. Нарушение моторики может быть гипо- и гипермоторное, то есть моторика может быть снижена или кишка может находиться в повышенном тонусе. При вялой, слабой работе тонкого кишечника пища застаивается в одном месте. Если кишечник излишне спазмирован, пища также застаивается. Моторика тонкой кишки регулируется центральной нервной системой, но больше автономной нервной системой кишечника, гормонами и медиаторами, веществами, которые вырабатываются в желудке и самом кишечнике.
- Хронические иммунодефицитные состояния. Это вирусные инфекции – ВИЧ, хронические и острые гепатиты В и С. Состояния после лечения токсическими для организма препаратами, а также препаратами, снижающими иммунитет – противоопухолевыми, цитостатиками. Сюда же входит состояние кишечника при алкоголизме, употреблении наркотиков.
- Лечение длительным курсом антибиотиков, как правило, тоже приводит к нарушению флоры. Бифидо- и лакто-бактерии, как и любые другие, уничтожают при длительных курсах, или нескольких повторных курсах антимикробных и антибиотических препаратов. А те бактерии, которые остаются устойчивы к антибиотикам потом разрастаются и выделяют газы и токсины.
Когда врач ставит диагноз СИБР?
Самое лучшее исследование на СИБР, так называемый, «золотой стандарт», это посев содержимого тонкой кишки, но у нас в стране эндоскопические аппараты, которые можно для этого использовать, единичны. И выращивание бактерий тоже зависит от многих факторов. Поэтому могут быть ложные положительные и отрицательные результаты.
Существует водородный дыхательный тест, чтобы определить СИБР. Это анализ в выдыхаемом воздухе содержания газов (водорода и метана), которые вырабатывают бактерии. К тесту требуется определенная подготовка в течение месяца. За месяц нельзя тревожить бактерий – пить антибиотики, проводить обследование кишечника – колоно- и ирригоскопию. За неделю нельзя принимать слабительные. За один день убирают все газообразующие продукты из рациона. Тест проводят натощак, после 12 часов голодания. Водородный тест считается показательным, абсолютно не инвазивным. Хорошо использовать у детей.
Пациент дышит в аппарат, засекается исходный уровень содержания газов, потом дается нагрузка с лактулозой и определяется разница. Если она соответствует определенным показателям, значит есть нарушения в микрофлоре тонкой кишки. Но и этот тест делают не везде.
Существует анализ кала на дисбактериоз, но он не очень информативен и зависит от условий сдачи анализа. Здесь тоже требуется специальная подготовка. Больше, конечно, он показывает флору толстого кишечника, но можно судить по косвенным признакам о нарушениях и в тонком кишечнике.
Чаще всего врач ставит диагноз СИБР на основе клинических данных, жалоб на вздутие живота, изменение стула. Конечно, без подтверждения диагноза мы можем лечить только эмпирически, или примерно.
Лечение СИБР
- Диета – прежде всего, с повышенным содержанием продуктов, которые восстанавливают среду тонкой кишки. Это пищевые волокна, они укрепляют гликокаликс. К таким диетам надо относиться избирательно, потому что основные продукты, богатые клетчаткой –бобовые, капуста, кукуруза – могут усилить вздутие, раздражают желудок и кишечник.
- Лекарственные средства, которые улучшают среду обитания бактерий — пребиотики. Они не травмируют стенку желудка и кишки, поэтому не могут усилить воспаление. К таким лекарственным средствам относится лактулоза (дюфалак) или препараты из африканского подорожника псиллума (мукофальк, фитомуцил). Они лечат запоры, но в половинных дозировках хорошо помогают при нарушении среды обитания бактерий. Все они исследованы и все хорошо работают для восстановления микрофлоры. Их можно принимать взрослым и детям. Если есть переносимость, хорошо принимать кисломолочные продукты, но дозировано, и обязательно свежие. При СИБР ни в коем случае нельзя йогурты с пищевыми добавками и красителями, как бы хорошо о них ни отзывалась реклама.
- Лечение основного заболевания, которое привело к СИБР. Это может быть гастрит или гастродуоденит, цирроз печени, гепатит, жировая болезнь печени, дискинезия желчевыводящих путей. Паразиты, которые живут в желчевыводящих путях, плохо влияют на моторику (лямблии, описторхи). Также к СИБР могут привести хронический панкреатит, последствия операций на кишечнике.
- Деконтаминация (или уничтожение) разросшейся флоры тонкого кишечника, т. е. врач может назначить противомикробные препараты или антибиотики, способные убрать излишне разросшихся бактерий при СИБР. Без назначения пить такие лекарства нельзя, потому что вместо пользы можно причинить вред своему здоровью, и сделать микробов резистентными (устойчивыми) к антибиотикам. Потом очень трудно будет справиться с такими микробами.
- Восстановление нормальной флоры после СИБР. В этом нам помогут препараты, содержащие бактерии. Сейчас фармакологическая индустрия предлагает множество форм таких лекарств или БАДов. Препараты могут содержать, в основном, лактобактерии – линекс, хилак-форте, или бифидобактерии – бибиформ, лактофильтум. Препараты, которые содержат питательные вещества для бактерий и сами бактерии – бактистатин. Комбинированные препараты – пробиолог, бак-сет, натума-бактофлор, примадофилус и другие.
- Можно использовать физиотерапевтические методы лечения, если нет противопоказаний. При СИБР это может быть электрофорез со спазмолитиками, противовоспалительными препаратами, лазерная терапия, магнит.
Вздутие живота и метеоризм чаще всего дает СИБР. Газы вырабатываются анаэробными бактериями, которые разрастаются в двенадцатиперстной кишке, тонкой и подвздошной кишках и создают дискомфорт. Кроме газов, они вырабатывают токсины, отчего мы чувствуем слабость, вялость. Диагностика и борьба с синдромом избыточного роста избавит нас от метеоризма и вздутия.
Но надо помнить, что этот синдром часто сочетается с язвенной болезнью, синдромом раздраженного кишечника, желудочным и пищеводным рефлюксом. Поэтому лечить все эти заболевания надо в комплексе и только после тщательной диагностики. Желудочно-кишечный тракт, особенно его флора, моторика и внутренняя среда, восстанавливаются длительно, поэтому нужно приготовиться к длительной работе над здоровьем пищеварительной системы с методичным приемом всех назначенных лекарственных препаратов.
Гастроэнтеролог Логинова Мария Павловна
Источник
Академик РАМН Ивашкин В.Т.: – Следующее сообщение: Алексей Олегович Буеверов расскажет о синдроме раздраженной кишки и синдроме избыточного бактериального роста. И он нащупал точки соприкосновения. Сейчас мы о них узнаем.
Профессор Буеверов А.О.: – Уважаемые коллеги! Елена Александровна в своем сообщении уже коснулась очень живо и активно обсуждаемой сейчас темы – изменения кишечной микрофлоры и ее роли в патогенезе синдрома раздраженного кишечника. Следует сказать, что среди четырех, выделяемых согласно Римским критериям, типам синдромов раздраженного кишечника (СРК), практически все из них, как я покажу далее, могут сопровождаться изменением кишечной микрофлоры. В меньшей степени, конечно, это касается СРК с преобладанием запоров, но, тем не менее, имеются и такие исследования, хотя и с относительно небольшим количеством пациентов, в них вошедших, демонстрирующих изменение микрофлоры.
Почему эту проблему следует отнести к числу важных и актуальных? И почему до сих пор не нащупано каких-то унифицированных методов оценки микрофлоры у пациентов с СРК? По-видимому, важную роль играет то, что тот самый синдром, постинфекционный синдром раздраженной кишки, который выделяется многими авторами, но, тем не менее, он не вошел в Римские критерии, он имеет довольно расплывчатый диагностический критерий. А это в свою очередь, можно связать с тем, что методы изучения кишечной микрофлоры крайне гетерогенны, и постепенно наблюдается эволюция от более простых, и, соответственно, менее надежных методов исследования, к более сложным, более дорогим, более длительным, но, соответственно, более точно определяющим микробный пейзаж кишечника. В качестве диагностических критериев так называемого постинфекционного синдрома раздраженной кишки, большинство авторов отмечают: наличие острой кишечной инфекции, которая предшествует дебюту СРК, обнаружение маркеров острой кишечной инфекции в биологических средах пациента, изменение кишечной микрофлоры – вот это самый сложный, самый скользкий момент в диагностике данного состояния. Возможно также наличие признаков симптома избыточного бактериального роста в тонкой кишке, и, безусловно, эффект препаратов, которые влияют на кишечную микрофлору. Речь идет об антибактериальных препаратах, пребиотиках и пробиотиках.
Какие микроорганизмы рассматриваются в качестве возможных этиологических факторов постинфекционного варианта СРК? Рассматривается Campylobacter jejuni, безусловно, Shigella, Salmonella, Yersinia – хорошо известные возбудители кишечных инфекций, а также во многих случаях отмечают наличие смешанной микрофлоры.
Следует отметить, что для постинфекционной формы СРК доминирующим симптомом чаще всего является именно диарея. И большинство авторов отмечает, что также у этих пациентов, по сравнению, например, с пациентами с СРК с преобладанием запоров, реже наблюдаются психические расстройства.
Роль кишечной макрофлоры в патогенезе развития синдрома раздраженной кишки подтверждают, во-первых, причинно-следственные отношения между перенесенной острой кишечной инфекцией и дебютом синдрома раздраженной кишки, изменение кишечной микрофлоры у пациентов с СРК, и, наконец, то, о чем уже упоминалось, – уменьшение выраженности симптомов СРК под воздействием препаратов, которые влияют на кишечную микрофлору.
Если изменения микробного пейзажа в тонкой кишке при правильной диагностике обозначается общепринятым термином «синдром избыточного бактериального роста», то изменения микрофлоры в толстой кишке пока не нашли своего отражения. Это связано с тем, что долгое время применялся культуральный метод, который привел к тому, что очень многие пациенты с патологией пищеварительного тракта записывались автоматически, особенно в нашей стране, в группу пациентов с так называемым дисбактериозом, что, естественно, запутывало врачей, и не позволяло проводить диагностический поиск в правильном направлении, и маскировало действительные диагнозы у таких пациентов. Тем не менее, можно определить патогенетическую цепь от изменений кишечной микрофлоры у, безусловно, предрасположенного организма, возможно, генетически предрасположенного, через воспаления. И это все приводит к развитию той симптоматики, которая является обоюдной в отношении и кишечника, и центральной нервной системы, что убедительно показала Елена Александровна в своем сообщении. Но что касается деталей этой патогенетической цепи, они, конечно, безусловно, подлежат дальнейшему изучению.
Что касается диагностики синдрома избыточного бактериального роста в тонкой кишке, то методы его диагностики весьма многочисленны, но, тем не менее, они хорошо отработаны. Прямым методом и золотым стандартом служит бактериологическое исследование тонкокишечного аспирата. Понятно, что этот метод труден для выполнения, там должны быть созданы условия для предотвращения ретроградного попадания, ретроградного заноса толстокишечной микрофлоры через Баугиниеву заслонку. Поэтому, чаще всего в клинической практике используются непрямые методы, к которым относится водородный дыхательный тест с глюкозой, водородный дыхательный тест с лактулозой, которые, в частности, применяются в тех исследованиях, которые используются в нашей клинике, определение короткоцепочных жирных кислот, в тонкокишечном аспирате, определение неконъюгированных желчных кислот тоже в тонкокишечном аспирате, гликохолатный тест с меченым углеродом, и D-ксилозный тест, который применяется в 2-х вариантах: определение D-ксилозы в моче и определение D-ксилозы в выдыхаемом воздухе, опять же с меченым углеродом.
Методы изучения микробного пейзажа в толстой кишке в данной таблице расположены по мере возрастания их с одной стороны сложности, с другой стороны – надежности.
Хорошо известный культуральный метод, он доступен, прост в выполнении, но, тем не менее, все авторы сходятся на том, что он ненадежно оценивает микробный пейзаж.
Существенно более точной методикой является полимеразная цепная реакция, совмещенная с электрофорезом в геле, который предусматривает термальную или химическую сепарацию цепи ДНК с последующим электрофорезом. Этот метод позволяет надежно дифференцировать изменение в популяции микроорганизмов, но, тем не менее, он медленный, так как идентификация видов микроорганизмов требует выполнения полного цикла.
Флюоресцентный метод гибридизации in situ предусматривает гибридизацию с помощью, так называемых, олигонуклеотидных зондов, что позволяет оценить пространственную организацию микрофлоры. Но, опять же, этот метод выполняется в течение длительного времени, и определяет только зондируемые бактерии, то есть, только тех, к которым направлен этот полинуклеотидный зонд.
Количественная ПЦР позволяет определять малые количества бактерий, причем с оценкой их видовой, родовой принадлежности, при использовании специфических праймеров, но метод трудоемкий и дорогой.
Ну и, наконец, наверное, наиболее точный метод – это секвенирование 16s-единиц рибосомальной ДНК бактериальных тел, который дает возможность дать развернутую характеристику индивидуальных видов микроорганизмов. Но этот метод очень трудоемкий и дорогой, и применяется только в отдельных центрах с научной целью.
Если посмотреть на эту таблицу, сводную, которая представляет различные исследования, посвященные оценке изменений микрофлоры у пациентов с синдромом раздраженной кишки, можно увидеть, что эти изменения оказываются весьма разнонаправленными. Ну, в частности, в исследовании Matto, которое было выполнено в 2005 году, отмечено повышение уровня клостридиума у пациентов с разными вариантами СРК, в то время, как в исследовании Kassinen было отмечено наоборот снижение уровня клостридиума. Такие же разнонаправленные изменения можно отметить и в отношении, например, лактобактерий. И, кроме того, следует отметить, что, в общем-то, небольшое количество пациентов было включено в каждое из этих исследований. Как вы видите, применялись различные методы оценки: и культуральный, и количественная ПЦР, и гибридизация с помощью олигонуклеотидных зондов. Ну, и, наконец, разные типы СРК включались в это исследование. Может быть, с этим и связаны такие разнонаправленные типы изменения кишечной микрофлоры.
Тем не менее, в одном из последних обзоров, посвященных данной проблеме, были четко обозначены общие тенденции изменения общей кишечной микрофлоры у пациентов с синдромом раздраженной кишки. У больных СРК, независимо от варианта, микрофлора кала – это подчеркивают, практически, все исследователи, – значимо отличается от таковой у здоровых лиц. И основные тенденции заключаются в уменьшении количества лактобактерий при СРК с преобладанием диареи, увеличении количества вейлонелл при СРК с преобладанием запоров, и уменьшение количества бифидобактерий при любом типе СРК. Опять же, следует учитывать различия дизайна исследования, и методики оценки микрофлоры, а также особенности питания пациента.
Что касается воздействия на кишечную микрофлору, то все чаще взгляды и исследователей, и практикующих врачей, обращаются к довольно давно и хорошо изученному кишечному антибиотику рифаксимину, который интересен тем, что при высокой эффективности, отличается хорошей переносимостью и низким риском развития резистентности, даже при длительном его приеме, что ярко продемонстрировано у пациентов с печеночной энцефалопатией. Показания к назначению рифаксимина, выпускаемого под названием «Альфа Нормикс», относятся: острая кишечная инфекция, «диарея путешественников», синдром избыточного бактериального роста, в независимости от причины, которая его вызвала, неосложненный дивертикулит, профилактика инфекций после операций на толстой кишке и печеночной энцефалопатии.
Данная таблица демонстрирует ряд исследований, посвященных применению рифаксимина у пациентов с различными формами СРК. Как вы видите, в большинство исследований было включено небольшое количество пациентов. Единственное исключение – это исследование Pimentel идет, в 2011 году опубликованное, на котором я остановлюсь более подробно. Также, разными методами, преимущественно дыхательными тестами оценивалось по косвенным признакам изменение кишечной микрофлоры. Как вы видите, в последнем столбце во всех исследованиях рифаксимин продемонстрировал большую эффективность, по сравнению с плацебо, либо с препаратом сравнения, к которым относился, в частности, активированный уголь. И во всех случаях рифаксимин характеризовался хорошей переносимостью, сопоставимой с таковой у плацебо.
Исследование Pimentel, оно интересно, во-первых, тем, что в него было включено очень солидное количество пациентов, там общее количество дало 1260 человек. И результаты его были опубликованы в одном из наиболее авторитетных медицинских журналов New England Journal of Medicine.
Здесь представлен дизайн исследования. Если коротко говорить, то оно представляло собой 2 исследования, 2 рукава. Общее количество пациентов составило 1260, минимальное количество пациентов выпало из исследования по тем или иным причинам. И в каждой группе больные были разделены на получавших рифаксимин в стандартной дозировке 1200 мг в день, и которых получали плацебо.
Были оценены так называемые первичные результаты и вторичные результаты применения рифаксимина. И, следует сказать, что включались больные с разными типами синдрома раздраженной кишки. В любом случае, это было СРК без преобладания запоров. В качестве первичного результата исследователи оценили то, что у значительно большего количества пациентов достигнуто уменьшение симптомов СРК и метеоризма. Эти симптомы оценивались отдельно в течение первых четырех недель наблюдения, после двухнедельного применения рифаксимина, по сравнению с плацебо. Вторичный результат свидетельствовал о том, что после окончания курса рифаксимина в течение последующих 3-х месяцев наблюдения при ежедневной оценке значительно реже наблюдались такие симптомы, как абдоминальная боль, вздутие и дискомфортное для пациента изменение консистенции стула, по сравнению с плацебо. Кроме того, отмечается, что значительных различий в переносимости рифаксимина и плацебо у пациентов не наблюдалось, что соответствует результатам других исследований.
Вот так графически здесь представлены первичные результаты исследования с рифаксимином. Вы видите, левая группа столбиков – это пациенты, эти 2 «рукава» исследования, и светло-розовый столбик демонстрирует кумулятивные результаты, правая группа столбиков – это плацебо. Соответственно, левая часть слайда – это динамика симптомов СРК через 2 недели, правая часть слайда – это динамика метеоризма. Как вы видите, во всех случаях различия между применением рифаксимина и применением плацебо были статистически достоверными.
Вторичные результаты исследования демонстрируют 2 кривые – это последующие 10 недель наблюдения за пациентами, которые уже не получали никакой терапии. И, как вы видите, на протяжении всего общего трехмесячного периода наблюдения, также сохранялось достоверное различие между группами больных, которые получали рифаксимин и которые получали плацебо.
Еще одно исследование Lauritano, опубликованное ранее, в 2005 году, демонстрирует эффективность рифаксимина у пациентов с подтвержденным синдромом избыточного бактериального роста. В качестве метода оценки эрадикации патогенной флоры применялся дыхательный тест с глюкозой. И, как вы видите, если назначалась дозировка 600 мг и 800 мг рифаксимина, то различия между ними были статистически недостоверными, а вот назначение рифаксимина в стандартной дозировке 1200 мг приводило к значительной, 60% эрадикации патогенной флоры.
Ну и, наконец, еще одно исследование, постмаркетинговое, одна из целей которого была оценка возможности применения более высоких, двойных, дозировок рифаксимина у пациентов с разными вариантами СРК: СРК с диареей и СРК с констипацией. Видите, что достоверных различий между дозировками 1200 мг и 2400 мг «Альфа Нормикса» авторы не отметили. Но, тем не менее, в обсуждении они подчеркивают, что рифаксимин может быть более эффективен у пациентов в двойной дозировке, у отдельных, у которых стандартная дозировка не приводит к выраженному улучшению клинической симптоматики.
Ну и, наконец, то, что уже упоминала Елена Александровна, хочу сказать, что у нас тоже накапливается опыт под руководством Владимира Трофимовича. Сейчас инициировано исследование, посвященное патогенетическому клиническому значению кишечной микрофлоры у пациентов с синдромом раздраженного кишечника. Там принимает участие профессор А.А. Шептулин, Е.А. Полуэктова, доктор Кучумова. Исследование уже начато, первые результаты пока находятся в стадии обработки. В качестве методов изучения кишечной микрофлоры у пациентов с синдромом раздраженной кишки, применяется дыхательный тест с лактулозой, секвенирование ДНК микроорганизмов в образцах кала, секвенирование ДНК микроорганизмов в биоптатах тонкой кишки, полученных при ЭГДС с биопсией постбульбарного отдела. Ожидаются результаты, которые, есть надежда, что внесут существенный вклад в изучение этого сложного вопроса – изменение кишечной микрофлоры у пациентов с синдромом раздраженной кишки и возможности терапевтического воздействия на них. Спасибо!
Источник
