Soph синдром что это такое
 | Республика Саха (Якутия), расположенная на северо-востоке Российской Федерации, является одним из интереснейших регионов мира по своеобразию процессов формирования генофонда коренного населения. Территория республики составляет 18% от территории Российской Федерации, но в силу суровых природных и климатических условий слабо заселена. Коренное население Якутии неоднородно по антропологической и языковой принадлежности, культуре, традициям, типам хозяйства. |
Считается, что при проведении работ по картированию моногенных заболеваний человека предпочтение следует отдавать изолированным популяциям, с так называемым «эффектом основателя» (SefBeld et al., 1998; Пу-зырев, 2003; Peltonen et al., 2006; Наследственные болезни…, 2002; Гинтер, 1978; Зинченко и др., 2007; Кириллов, 2008). Якутское население относится именно к таким популяциям и является удобным объектом для картирования и идентификации новых генов наследственных заболеваний.
В настоящее время территориальные группы якутов отличаются по антропологическому составу, по языковым диалектам, выражена генетическая гетерогенность территориальных групп, по-разному проявляющаяся для разных классов маркеров. Высокий уровень генетической дифференциации якутских популяций, подтвержден данными о фамильной структуре сельских популяций Якутии, о полиморфизме аутосомных локусов и (СТС)п-участка гена БМРК, о неравномерности распространенности наследственной патологии (Ноговицына, 2001; Максимова, 2002; Хшринская и др., 2003; Данилова и др., 2005; Тарская и др., 2004; Федорова и др., 2005; Кучер и др., 2007). В то же время низкий уровень генетического разнообразия в популяциях якутов, по сравнению с другими популяциями Евразии, был выявлен при анализе линий митохондриальной ДНК, У-хромосомы и на основании данных о полиморфизме (СГС)п-повторов гена ВМРК в популяциях Якутии (Попова и др., 2002; Пузырев и др., 2003; Ракепс1огГ е1 а!., 2003, 2006; Федорова и др., 2005; Харьков и др., 2008; Федорова, 2008).
Проведенные ранее в Якутии генетико-эпидемиологические исследования выявили высокую частоту и широкий спектр наследственной патологии, а также накопление отдельных форм моногенной патологии: спиноцеребеллярной атаксии 1-го типа, миотоническойдистрофии, наследственной энзимопенической метгемоглобинемии I типа и т.д. (Ноговицына, 2001; Назаренко и др., 2001; Тарская, 2004; Брахфогель, 2000; Платонов и др., 2004; Захарова, 1982; Банщикова, 2002; Сухомясова, 2005; Га-леева и др., 20Об; Барашков, 2007; Яковлева, 2008). Следующим этапом более глубокого изучения частоты и спектра наследственной патологии в регионе, особенно редких форм наследственных заболеваний, является длительное и динамическое наблюдение за больными и их семьями при помощи территориального генетического регистра наследственной и врожденной патологии (Гинтер, 2003; Наследственные болезни …, 2002; Пузырев и др., 2000). В якутской популяции имеется накопление некоторых форм редкой аутосомно-рецессивной, Х-сцепленной рецессивной и аутосомно-доминантной наследственной патологии.
На основании проведенных при непосредственном участии директора МИП «Генодиагностика» Н.Р.Максимовой исследований выявлено пять этноспецифических наследственных заболеваний у якутов, которым присвоено название «якутские наследственные болезни»: спинально-бульбарнаяамиотрофия Кеннеди, атаксия Фридрейха, окулофарингеальная миодистрофия, якутский синдром низкорослости, и ранее не описывавшийся синдром низкорослости с колбочковой дисфункцией, атрофиейзрительных нервов и пельгеровской аномалией лейкоцитов, разработана и внедрена в практику методика молекулярной диагностики этих заболеваний.
| Название(OMIM) | Тип наследования | Ген | Мутация у якутов | Частота на 100 тысяч человек | Ссылка | |
| У якутов | В мире | |||||
| Спиноцеребеллярная атаксия 1 типа (164400) | АД | ATXN1 | Экспансия CAG-повторов | 36,8 | 1,0-2,0 | (Платонов, 2004; Иллариошкин, 2006) |
| Миотоническая дистрофия (160900) | АД | DMPK | Экспансия CTG-повторов | 21,3 | 4,0-5,0 | (Сухомясова, 2005; Harper, 2004; ) |
| Наследственная энзимопеническая метгемоглобинемия(250800) | АР | DIA1 | Pro269Leu | 14,9 | 1,0 | (Тарская, 2004; Галеева, 2006) |
| Окулофарингеальная мышечная дистрофия (164300) | АД | PABPN1 | Экспансия 10 GCG-повторов* | 8,8 | 1,0 | (Bouchard et al., 1997 ) |
| Спинально — бульбарная амиотрофия Кеннеди | Х-сц. рец. | AR | Экспансия CAG-повторов | 2,8 | 2,5 | (Andrew et al., 1997) |
| Атаксия Фридрейха (229300) | АР | FRDA | Экспансия GAA-повторов | 2,78 | 2-5 | (Palau et Espinos, 2006) |
| 3-М синдром (273750) | АР | CUL7 | 4582insT* | неизвестно | ||
| SOPH синдром (низкорослости с атрофией зрительных нервов, пельгеровской аномалией лейкоцитов) | АР | NAG | R1914H* | 9,95 | неизвестно | |
Распространенность ОФМД (И на 100 тыс. нас.) и болезни Кеннеди в отдельных улусах республики (408,7 и 106,6 на 100 тыс. мужчин) превышает мировые значения в десятки раз. Показатели распространенности синдрома ЯСН и SCOP синдрома получены в мире впервые (12,72 и 9,95 на 100 тыс. нас., соответственно) и позволяют отнести оба редких в мире заболевания к частым наследственным заболеваниям у якутов. АФ зарегистрирована в популяции якутов, относящихся к азиатской расе, где ранее не было описано случаев болезни. Молекулярно-генетическими причинами болезней, вызванных динамическими мутациями у якутов являются экспансии (GCG)i0 в гене PABPN1 при ОФМД, (CAG)n в гене AR при болезни Кеннеди и (GAA)n в гене FRDA при АФ. Основными причинами (40%) низкорослости в якутской популяции якутов являются 3-М синдром и новый синдром низкорослости с колбочковой дисфункцией, атрофией зрительныхнервов и пельгеровской аномалией лейкоцитов. Распространенность обоих форм низкорослости в якутской популяции — 22,7 на 100 тыс. населения, среди детей — 67,5 на 100 тыс. населения.Клиника ЯСН у якутских больных сходна с клиникой ранее описанных больных с 3-М синдромом, за исключением дистресс-синдрома у новорожденных. Мутации 4582insT в гене CUL7 и G5741—>А в гене NAG являются единственными молекулярно-генетическими причинами двух форм низкорослости, особенно часто встречающихся в якутской популяции. Основными популяционными механизмами накопления наследственных заболеваний в якутской популяции являются дрейф генов и эффект основателя подробнее
Источник
В статье представлены современные представления о патогенезе, диагностике и лечении синдрома Сусака — иммуноопосредованного заболеваниям нервной системы.
В последние годы отмечается рост распространенности иммуноопосредованных заболеваний нервной системы. Одним из таких синдромов, заслуживающих внимания врачей, является синдром Сусака.
Ретинокохлеоцеребральная васкулопатия была описана в 1979 г. группой авторов под руководством Джона Сусака [1] у лиц молодого возраста с классической клинической триадой: подострой энцефалопатией, окклюзией ветвей артерии сетчатки и нейросенсорной тугоухостью. Как следствие четко очерченной клинической составляющей, в зарубежных статьях можно встретить соответствующие ей аббревиатуры: SICRET (Small Infarcts of Cochlear, Retina and Encephalic Tissue — мелкие инфаркты слухового нерва, сетчатки и ткани мозга) и RED-M (Retinopathy, Encephalopathy, Deafness microangiopathy — ретинопатия, энцефалопатия, глухота, обусловленные микроангиопатией) [2, 3].
Первое популяционное исследование по распространенности синдрома Сусака было проведено в Австрии. Дебют заболевания описан с 9 до 72 лет, чаще у женщин в возрасте 20–40 лет [4]. При этом с учетом выявленной распространенности синдрома в соотношении 0,15 на 100 тыс. населения на сегодняшний день описано чуть более 300 случаев.
Этиология синдрома Сусака
Этиология синдрома до конца не установлена, однако, как и у большинства других аутоиммунных заболеваний, отмечается его появление после беременности, перенесенной вирусной инфекции, применения заместительной гормональной терапии.
Согласно современным представлениям, в основе болезни лежит микроангиопатия головного мозга, сетчатки, внутреннего уха. Предполагается, что у таких пациентов развивается иммунообусловленная эндотелиопатия в микроваскулярном русле. При этом в отдельных сосудах паренхимы отмечаются утолщение и гиалиноз, эндотелиальные клетки гипертрофированы, что в итоге и ведет к окклюзии артериол. В результате этого возникает периваскулярное воспаление с последующей ишемией тканей головного мозга, сетчатки. Действительно, в сыворотке крови пациентов с синдромом Сусака выявлены антитела к эндотелию сосудов, которые могут вызывать развитие микроангиопатии [5], определяющей размер характерных для
синдрома очагов (в среднем около 5 мм). В результате возникает дегенерация нейроглиального комплекса. При этом иммуногистохимические исследования показывают воспаление с превалированием CD8-клеток. Как известно, CD8 являются поверхностными маркерами субпопуляции цитотоксических Т-лимфоцитов и Т-супрессоров. Экспрессия этого гликопротеина у человека происходит в основном на Т-киллерах, а также на части натуральных киллеров (NK). Это, в свою очередь, определяет аутоиммунную составляющую синдрома, дает возможность диагностировать его с помощью иммуногистохимических исследований, а также назначать таргетную терапию.
Клиническая картина синдрома Сусака
Установлено, что для синдрома Сусака характерно полиорганное поражение с развитием ретикулокохлеоцеребральных расстройств. Такие пациенты, как правило, госпитализируются в офтальмологические, отоларингологические и неврологические отделения стационаров. Однако в дебюте заболевания классическая триада возникает в полном объеме довольно редко (не более 20% случаев). Почти всегда синдром дебютирует с нарушения зрительной функции. Так, пациенты вне церебрального синдрома могут предъявлять жалобы на преходящее или стойкое нарушение зрения в виде появления пелены перед глазами, диплопии, фотопсий или парацентральных скотом. В половине случаев отмечается одно- или двустороннее снижение слуха, зачастую сопровождающееся шумом в ушах и головокружением. Иногда наблюдается нарастающая головная боль с тошнотой. При этом некоторые авторы особо подчеркивают, что при развитии головной боли у иммуноскомпрометированных лиц молодого возраста уже необходимо задуматься о синдроме Сусака. Также отмечаются сонливость, нарушение сознания, расстройства речи, концентрации внимания, памяти или ходьбы. Клинические проявления синдрома могут включать амнезию, агрессию, депрессию, в редких случаях — судороги [6–13].
Диагностика синдрома Сусака
Для синдрома Сусака нехарактерно изменение параметров крови. Имеются данные об умеренном повышении уровня белка в ликворе и незначительном лимфоцитарном плеоцитозе. Ультразвуковая диагностика с допплеровским картированием при данном синдроме не выявляет специфических маркеров.
Офтальмологическое исследование (электроокулография, электроретинография, офтальмоскопия, зрительные вызванные потенциалы) выявляет картину ретинального васкулита: расширение артериол сетчатки, телеангиэктазии, микроаневризмы. По данным ангиографии с флуоресцеином определяются множественные периферические инфаркты сетчатки с обеих сторон [5, 14, 15]. Оптическая когерентная томография сетчатки выявляет выраженное пятнистое истончение слоя нервных волокон, тогда как при рассеянном склерозе это истончение имеет диффузный характер.
В диагностике нарушений слуха эффективно применение слуховых вызванных потенциалов, отоакустической эмиссии.
В дифференциальной диагностике синдрома Сусака важное значение придается нейрорадиологическим исследованиям [16]. Патогномоничным считается выявление с помощью магнитно-резонансной томографии (МРТ) головного мозга множественных гиперинтенсивных сигналов в центральной части мозолистого тела. При введении парамагнетика происходит обогащение патологических очагов, выявляемых на Т2-взвешенных изображениях. Помимо типичных изменений в виде маленьких или больших «снежных шаров» или линейных дефектов в центральной части мозолистого тела (рис. 1а, б) [17] у 70% больных имеется поражение серого вещества, а у 33% — оболочек мозга [18]. По данным МРТ (диффузионно-взвешенный режим) в этой области выявляются очаги высокой интенсивности. Режим 3D-FLAIR также выявляет вовлечение в патологический процесс мягкой мозговой оболочки [19]. Необходимо помнить, что, в отличие от рассеянного склероза, для синдрома Сусака образование патологических очагов в спинном мозге нехарактерно. МРТ головного мозга позволяет проводить раннюю диагностику синдрома Сусака и, соответственно, своевременную патогенетическую терапию [5, 11, 20].![Рис. 1. a. «Снежные шары» в центральной части мозолистого тела по данным Т2-режима МРТ (стрелки); б. Перивентрикулярные очаги на аксиальном срезе головного мозга (стрелки) (по Vishnevskia-Dai V. et. al., 2016 [17]) Рис. 1. a. «Снежные шары» в центральной части мозолистого тела по данным Т2-режима МРТ (стрелки); б. Перивентрикулярные очаги на аксиальном срезе головного мозга (стрелки) (по Vishnevskia-Dai V. et. al., 2016 [17])](https://www.rmj.ru/upload/medialibrary/477/10-1.png)
Дифференциальная диагностика синдрома Сусака
Дифференциальную диагностику синдрома Сусака проводят с аутоиммунными демиелинизирующими заболеваниями (рассеянным склерозом и острым рассеянным энцефаломиелитом), инфекционными энцефалитами, первичными и вторичными васкулитами центральной нервной системы (ЦНС), болезнью Меньера, токсической лейкоэнцефалопатией, редким осложнением злоупотребления кокаином [21]. Также синдром следует дифференцировать с паранеопластическими синдромами, характерными для группы пациентов, находящихся на терапии иммуносупрессорами и таргетными противоопухолевыми препаратами.
Сложность выявления синдрома Сусака состоит в том, что клиническая триада, характерная для данного заболевания, может развиваться в течение нескольких лет. Показано, что из 10 пациентов с установленным позднее диагнозом синдрома Сусака только у 2 в дебюте выявлялись подострая энцефалопатия, окклюзия ветвей артерии сетчатки и нейросенсорная тугоухость [17]. У остальных больных триада патогномоничных для синдрома Сусака проявлений развивалась в течение последующих 3 лет. В этой связи было предложено различать варианты: случаи, подозрительные на синдром Сусака, полный и неполный синдромы Сусака. Согласно диагностическим критериям, разработанным группой европейских экспертов, следует выделять возможный и определенный синдромы Сусака [11]. Исследователи рассмотрели, как они отмечают, 32 несомненных случая синдрома и на основании этого выделили критерии его диагностики. Думается, что создание классификации, необходимой для клинической практики, требует дальнейшего накопления материала.
Клинические наблюдения
Тем не менее при существующем интересе к синдрому Сусака на сегодняшний день официально зарегистрировано лишь два продолжающихся исследования по его изучению, направленных на определение характерных для него биомаркеров (NCT01273792, Германия) и выявление эпидемиологической составляющей, клинических и этиологических факторов (NCT01481662, Франция). При этом если результаты первого исследования ожидаются в декабре 2018 г., то отчет второго исследования (с учетом заявленной группы из 100 пациентов с выполнением диффузионно-тензорной МРТ), начатого в 2011 г., ожидается лишь в середине 2021 г.
Причины развития синдрома Сусака окончательно неясны. К примеру, обсуждается сходство его иммунопатогенеза с ювенильным дерматомиозитом, при этом отмечен положительный эффект проведения терапии, используемой при тяжелых формах этого заболевания у подростков [18, 22, 23].
Углубленное обследование 9 пациентов (женщин — 7, мужчин — 2) и анализ 92 прежде сообщенных случаев синдрома Сусака (средний возраст — 30,4 года; срок наблюдения — 6,4 года) показало, что дебют заболевания чаще отмечался весной или осенью у 68% пациентов [24]. Полная триада симптомов в начале болезни выявлялась только у 1 из 9 больных. У всех обследованных имелись головная боль и клинические проявления энцефалопатии. При исследовании ликвора у 5 пациентов выявлены плеоцитоз и повышение уровня белка. Вовлечение внутреннего уха в патологический процесс в дебюте болезни отмечалось только у 2 больных, у других это расстройство появилось в течение последующих 11 мес. (в 3 случаях сначала одностороннее, в дальнейшем у всех обследованных — двустороннее); улучшение слуха на фоне лечения не отмечено. Поражение зрения в начале болезни отмечалось у 8 больных, спустя 3 года — еще у 1 пациента. У всех обследованных выявлялась множественная билатеральная окклюзия ветвей ретинальных артерий и/или обнаруживалась краска с гиперфлюоресценцией на артериальной стенке при ангиографии с флуоресцеином. В дальнейшем у 3 больных эти показатели нормализовались.
В период наблюдения за пациентами у 3 женщин были выявлены 4 беременности: в 2 случаях состояние пациенток потребовало прерывания беременности, 1 беременность протекала без особенностей, у 1 женщины после родов отмечалось обострение синдрома Сусака с проявлениями энцефалопатии, достаточно эффективно подвергавшейся коррекции на фоне применения кортикостероидов и антикоагулянтов.
Особый интерес в литературе вызывают описания синдрома Сусака у детей и подростков. У 14-летней девочки дебют заболевания характеризовался головной болью, развитием слабости в левых конечностях, недержанием мочи и когнитивным дефицитом. МРТ головного мозга выявила множественные очаги с высокоинтенсивным сигналом на Т2-взвешенном изображении в белом и сером веществе [15]. Сходная клиническая картина и изменения белого вещества ткани мозга могут быть при развитии рассеянного склероза или острого рассеянного энцефаломиелита в детском или подростковом возрасте. На глазном дне у пациентов с этими демиелинизирующими заболеваниями обычно находят побледнение височных дисков зрительных нервов, иногда выявляется картина ретробульбарного синдрома. Однако офтальмологическое обследование у данной больной обнаружило двустороннюю окклюзию артерий сетчатки. Через 12 мес. у девочки развилась утрата слуха.
При этом обследование на инфекции было отрицательным, иммунологические тесты не отличались от нормальных показателей. При синдроме Сусака лабораторные данные свидетельствуют о наличии микроангиопатии прекапиллярных артериол мозга, сетчатки, внутреннего уха. При ангиографии с флуоресцеином патогномоничным считаются окрашивание артериол сетчатки, проксимальных по отношению к окклюзированным, и окрашивание неокклюзированных артериол.
Болезнь часто протекает с повторными атаками, возможно развитие спонтанных ремиссий, что сходно с течением рецидивирующе-ремиттирующего типа течения рассеянного склероза. Однако при синдроме Сусака часто остаются последствия в виде утраты слуха и неврологических расстройств. Это не характерно для детей и подростков с рассеянным склерозом, у которых быстро наступает ремиелинизация очагов поражения, а динамика клинических и нейровизуализационных признаков часто является положительной [14].
Нарушение слуха может быть ранним симптомом при синдроме Сусака. При обследовании 23 таких пациентов у 43,5% больных отмечались эпизоды снижения слуха, у 61% — шум в ушах, у 56,5% — головокружение, поэтому госпитализация проводилась в отделения ЛОР-патологии [25]. У 52% пациентов клинические проявления носили односторонний характер, у 48% — двусторонний. Только у 26,5% обследованных больных выявлялось 100% распознавание слов. Одному из пациентов с синдромом Сусака авторами исследования проведена двусторонняя кохлеарная имплантация с хорошим результатом.
Лечение и прогноз при синдроме Сусака
Относительно прогноза синдрома Сусака мнения исследователей расходятся. Существует возможность спонтанного разрешения симптоматики без активных лечебных мероприятий. В литературе описано монофазное и полициклическое течение с рецидивом спустя 23 года [26]. При наблюдении за 9 больными с синдромом Сусака под влиянием кортикостероидной терапии в течение 6,4 года было отмечено улучшение неврологического статуса, однако корреляции между клиническими проявлениями и уменьшением числа патологических очагов, обнаруживаемых по данным МРТ головного мозга, выявлено не было [24]. При этом гормональная терапия не снижала выраженность расстройств слуха и зрения. У больного, в свое время описанного М.Л. Чухловиной [27], была выявлена выделенная Сусаком триада симптомов: подострая энцефалопатия, окклюзия артерий сетчатки и нейросенсорная тугоухость в сочетании с наличием линейных дефектов в мозолистом теле и лакунарных кист в стволе мозга и таламуса по данным МРТ. Пульс-терапия преднизолоном привела к улучшению состояния: несколько снизился мышечный тонус, увеличилась сила в нижних конечностях, уменьшились проявления атаксии в руках. От лечения цитостатиками пациент отказался.
Изолированное применение пульс-терапии метил-преднизолоном, как правило, оказывается неэффективным. В 2008 г. группой специалистов во главе с R.M. Rennebohm [18] высказано предположение о необходимости назначения таким пациентам агрессивной иммуносупрессивной терапии, включающей, наряду с введением кортикостероидов, применение цитостатиков и внутривенных иммуноглобулинов, как это проводится при дерматомиозите. С учетом этиопатогенеза существует мнение о необходимости подключения к основной схеме лечения непрямых антикоагулянтов и блокатора кальциевых каналов (нимодипин).
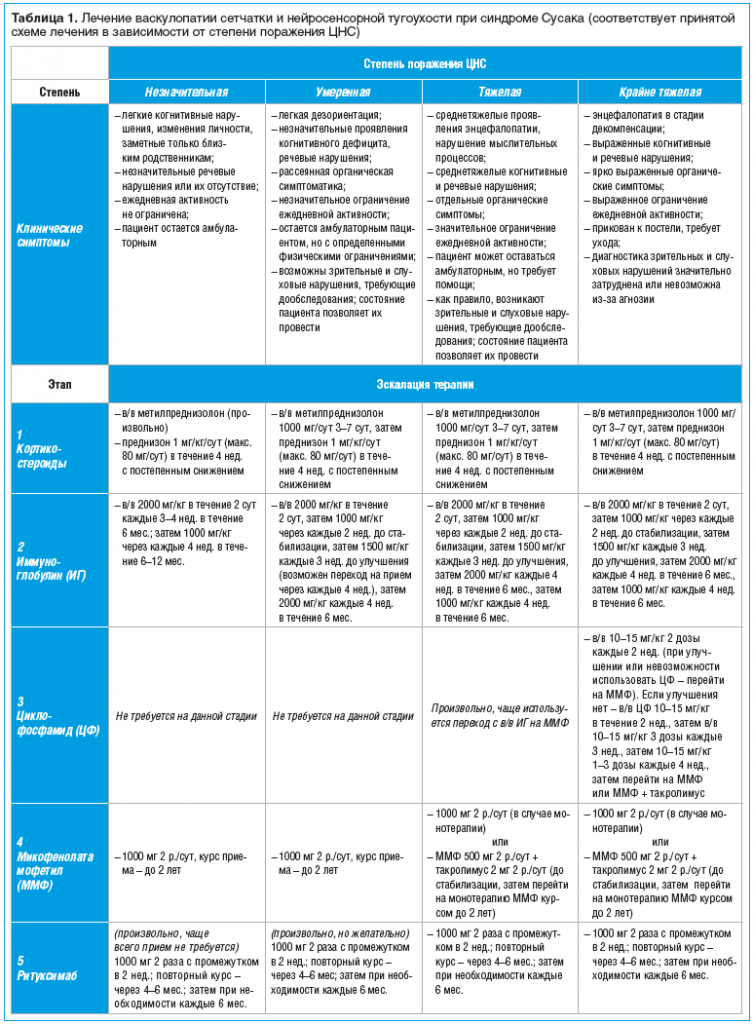
В настоящее время на базе клинического опыта зарубежных специалистов может использоваться схема терапии в зависимости от степени вовлеченности ЦНС в патологический процесс (табл. 1) [адаптировано из 28].
Заключение
Несмотря на то, что с момента описания синдрома Сусака прошло более 30 лет, патогенез заболевания остается недостаточно изученным, необходимы дальнейшие исследования в этом направлении. В то же время четко очерченная клиническая картина в сочетании с данными офтальмологического исследования и МРТ головного мозга позволяет проводить раннюю диагностику и своевременно назначать рациональную терапию. Успехи в совершенствовании дифференциальной диагностики и лечения аутоиммунных заболеваний, паранеопластических синдромов, осложнений современной терапии возможны только при совместных усилиях неврологов, офтальмологов, оториноларингологов, гематологов, онкологов, ревматологов и нейрорадиологов.
Источник
