Сколько живут с синдромом хантера

Синдром Хантера — наследственное заболевание обмена веществ с Х-сцепленным рецессивным типом наследования, характеризующееся дефицитом лизосомального фермента идуронат-2-сульфатазы и накоплением мукополисахаридов в тканях. При синдроме Хантера отмечается задержка роста, макроцефалия, деформация костно-суставного аппарата, поражение кожи, сердечно-сосудистой и дыхательной системы, гепатоспленомегалия, нарушение слуха, умственная отсталость. С целью диагностики синдрома Хантера проводится консультация генетика, определение экскреции гликозаминогликанов, рентгенография костей и суставов. Пациентам с синдромом Хантера показана пожизненная ферментозамещающая терапия препаратом элапраза.
Общие сведения
Синдром Хантера (мукополисахаридоз II типа) — редкое генетическое заболевание, сцепленное с Х-хромосомой, при котором вследствие ферментной недостаточности происходит неполное разрушение и накопление кислых мукополисахаридов (гликозаминогликанов) в различных тканях. Частота рождения детей с синдромом Хантера составляет примерно 1:100000-150000 новорожденных. В настоящее время в мире насчитывается не более 2000 больных синдром Хантера; по России официальная статистика отсутствует. Синдром Хантера относится к группе орфанных заболеваний, лечение которых, согласно действующему законодательству, должно осуществляться за счет средств федерального и регионального бюджета.

Синдром Хантера
Причины синдрома Хантера
Развитие синдрома Хантера связано с мутацией гена идуронатсульфатазы (IDS), кодирующего лизосомный фермент идуронат-2-сульфатазу. Ген IDS картирован в локусе Xq28 на длинном плече Х-хромосомы; в настоящее время известно более 150 различных его мутаций (точечные мутации, мелкие и крупные делеции, вставки, перестройки и пр.).
В силу сцепленности наследования с Х-хромосомой, синдромом Хантера, как правило, страдают исключительно мальчики (XY). Гетерозиготные женщины в подавляющем большинстве случаев являются носителями мукополисахаридоза II типа без клинических проявлений, однако описаны несколько случаев синдрома Хантера у девочек, связанных с новой мутацией или инактивацией второй, нормальной Х-хромосомы.
Мутации в гене IDS сопровождаются дефицитом или отсутствием фермента iduronate-2-sulfatase (I2S), неполным расщеплением и накоплением в лизосомах клеток практически всех тканей и органов гликозаминогликанов (ГАГ) — дерматансульфата и гепарансульфата.
Классификация синдрома Хантера
Степень выраженности клинических проявлений синдрома Хантера (среднетяжелая, тяжелая) зависит от типа мутации в гене IDS. Так, крупные делеции и сложные перестройки, как правило, обусловливают развитие тяжелых форм синдрома Хантера. Для тяжелой степени (мукополисахаридоза типа IIА) характерно ранее развитие клинических симптомов (преимущественно в возрасте 18-36 месяцев), быстро прогрессирующее течение, выраженная умственная отсталость, полиорганное поражение. Пациенты с тяжелой формой синдрома Хантера погибают на втором десятилетии жизни.
Среднетяжелая форма (мукополисахаридоз типа IIВ) составляет примерно 1/3 всех случаев патологии. Клинические проявления синдрома Хантера обычно возникают у детей в 3-8 (иногда 10-13) лет; интеллект обычно сохранен; продолжительность жизни при благоприятных условиях может достигать 50-60 лет. Пациенты с легкой формой синдрома Хантера могут успешно реализовать себя в профессиональной сфере и иметь здоровое потомство.
Симптомы синдрома Хантера
На момент рождения дети с синдромом Хантера выглядят клинически здоровыми. Основная симптоматика развивается в среднем в 2-4 года. До этого возраста проявления заболевания неспецифичны: у детей могут отмечаться повторные риниты, шумное дыхание, пупочные и паховые грыжи, гидроцеле.
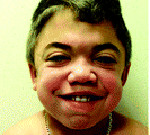
Ранним характерным признаком синдрома Хантера служит постепенное изменение внешности ребенка: черты лица становятся грубыми (гаргоилизм); язык, губы и ноздри – большими; кожа – толстой. Облик больного с синдромом Хантера дополняется низкорослостью, увеличением размеров головы (макроцефалией), короткой шеей, аномалиями зубных рядов (редкими зубами). Дети с синдромом Хантера внешне очень похожи друг на друга и напоминают братьев.
Другие ранние признаки мукополисахаридоза II типа включают хриплый низкий голос, увеличение живота, гепатоспленомегалию. Дети с синдромом Хантера склонны к частой заболеваемости ОРВИ, отитами, ларингитом, трахеитом, пневмониями; нередко у них отмечается обструктивное апноэ сна, хроническая диарея. Следствием отложения гликозаминогликанов и липидов в дерме служит возникновение узелково-папулезных высыпаний на коже плеч, бедер, лопаток. Возможно появление «монгольских пятен» в пояснично-крестцовой области, гипертрихоза.
Уже в дошкольном возрасте у детей с синдромом Хантера появляются признаки поражения опорно-двигательного аппарата, выражающиеся в тугоподвижности суставов, развитии кифосколиоза, деформации кистей по типу «когтистой лапы». Движения становятся затруднительными, походка неуклюжей; к юношескому возрасту больные с синдромом Хантера нередко делаются беспомощными инвалидами, прикованными к постели.
Неврологические нарушения, возникающие при синдроме Хантера, включают синдром гипервозбудимости, судороги, сообщающуюся гидроцефалию, спастическую параплегию, задержку речевого развития, прогрессирующую тугоухость. Со стороны зрительной системы обнаруживается помутнение роговицы, атипичный пигментный ретинит. К наиболее поздним признакам мукополисахаридоза II типа относятся кардиологические нарушения: появление шумов в сердце, приобретенные пороки сердца (чаще митральная недостаточность), кардиомиопатия и др.
У ребенка могут наблюдаться изменения психики: обидчивость, агрессивность. В зависимости от типа синдрома Хантера интеллектуальный дефект может быть небольшим или значительно выраженным. Летальный исход у больных с синдромом Хантера обычно наступает от прогрессирующей сердечной или легочной недостаточности.
Диагностика синдрома Хантера
В практике педиатра синдром Хантера встречается исключительно редко. Тем не менее, мукополисахаридоз II типа может быть заподозрен на основании клинических признаков (внешних изменений, манифестации заболевания на 2-4 году жизни, прогредиентного течения и др.). Для подтверждения диагноза дети нуждаются в консультации генетика, анализе клинико-генеалогических данных, проведении молекулярно-генетических исследований.
Важным биохимическим маркером синдрома Хантера служит повышение экскреции мукополисахаридов (дерматансульфата, гепарансульфата) с мочой, дефицит фермента идуронат-2-сульфатазы. Рентгенологические исследования костей черепа, суставов, трубчатых костей, позвоночника демонстрируют дизостоз, остеоартрит, множественные изменения позвонков.
Для обнаружения морфофункциональных изменений со стороны внутренних органов и ЦНС проводится УЗИ органов брюшной полости, ЭКГ, ЭхоКГ, электроэнцефалография, МРТ головного мозга. Морфологическое исследование тканей, полученных в результате биопсии кожи, печени, миокарда и пр., выявляет однотипные изменения — клетки, заполненные гликолипидами.
В семьях с известным генотипом и высоким риском рождения ребенка с синдромом Хантера может проводиться инвазивная пренатальная диагностика – биопсия ворсин хориона, амниоцентез или кордоцентез с определением активности идуронат-2-сульфатазы в полученном материале.
Дифференциальную диагностику синдрома Хантера следует проводить с другими формами мукополисахаридозов (прежде всего, синдромом Гурлера), а также с другими лизосомными болезнями накопления.
Лечение синдрома Хантера
Детям с синдрома Хантера необходимо пожизненное проведение ферментозаместительной терапии. На сегодняшний день единственным препаратом, зарегистрированным в США, Европе и России для лечения больных с синдромом Хантера, является идурсульфаза. Пациенты с мукополисахаридозом II типа должны получать идурсульфазу еженедельно путем внутривенного капельного введения в дозе 0,5 мг/кг массы тела.
Кроме патогенетического лечения, детям с синдромом Хантера проводятся регулярные медикаментозные курсы симптоматической и корригирующей терапии гепатопротекторами, витаминами, антиоксидантами, цитопротекторами. В комплексную терапию синдрома Хантера целесообразно включать ЛФК, физиотерапию (электрофорез лидазы на суставы, парафиновые аппликации, магнитотерапию, лазеропунктуру), занятия с дефектологом и логопедом.
Прогноз и профилактика синдрома Хантера
Синдром Хантера типа В имеет более благоприятное течение и прогноз; при своевременном и регулярном лечении продолжительность жизни больных может достигать 50-60 лет. При тяжелых формах мукополисахаридоза II типа пациенты обычно погибают до 20 лет от сердечно-сосудистой недостаточности. На сегодняшний день серьезную проблему для больных с синдромом Хантера представляет своевременное получение жизненно необходимого препарата идурсульфазы из-за его высокой стоимости.
Дети с синдромом Хантера нуждаются в наблюдении различных специалистов: детского генетика, педиатра, детского кардиолога, детского невролога, эпилептолога, детского офтальмолога, детского отоларинголога, детского хирурга, детского ортопеда.
Основным методом профилактики синдрома Хантера является медико-генетическое консультирование супружеских пар, имеющих вероятность рождения больного ребенка, а также проведение дородовой диагностики. Следует знать, что у больных с синдромом Хантера рождаются здоровые сыновья, а дочери выступают облигантыми носителями мутантного гена.
Источник
Медицинский эксперт статьи

х
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Синдром Хантера является генетическим дефектом внутриклеточного катаболизма углеводов (гликозаминогликанов), который передается детям мужского пола путем X-сцепленного рецессивного наследования и вызывает аномалии скелета, внутренних органов и умственную отсталость.
Данный синдром также называют мукополисахаридозом II типа и относят к болезням лизосомного накопления. Согласно МКБ-10, эта врожденная ферментопатия отнесена к классу нарушений обмена веществ и имеет код Е76.1.
 [1], [2], [3], [4]
[1], [2], [3], [4]
Код по МКБ-10
E76.1 Мукополисахаридоз, тип II
Эпидемиология
По оценкам зарубежных экспертов, по всему миру насчитывается всего около двух тысяч живых пациентов, страдающих синдромом Хантера. 500 из них проживают в США, 70 – в Корее, 20 – на Филиппинах, 6 – в Ирландии. По одному живущему пациенту насчитали в Чили, Пакистане, Индии, Палестине, Саудовской Аравии, Иране и Новой Зеландии.
Исследование заболеваемости среди британских мужчин, показало, что ее уровень составляет приблизительно один случай на 130 тыс. мальчиков, родившихся живыми.
По другим сведениям, в европейских странах синдром Хантера выявляется у одного мальчика на каждые 140-156 тыс. живорожденных детей мужского пола.
У детей женского пола спорадические случаи данного заболевания бывают крайне редко.
 [5], [6], [7], [8], [9]
[5], [6], [7], [8], [9]
Причины синдрома Хантера
Генетики установили, что причины синдрома Хантера заключаются в мутациях гена IDS (находящегося на Х-хромосоме, локус Xq28), который кодирует фермент I2S.
Мукополисахариды, также известные как гликозаминогликаны (GAG), являются углеводным компонентом макромолекул сложных белков протеогликанов, заполняющих пространство между клетками и образующих матрикс. Матрикс окружает клетки и, по сути, является «каркасом» тканей. Но, как и многие другие биохимические компоненты организма, протеогликаны подвергаются метаболизму. В частности, из молекул двух видов GAG – дерматансульфата и гепарансульфата – с помощью фермента I2S должен удаляться сульфат, находящийся в их составе в виде сульфатированной альфа-L-идуроновой кислоты.
Дефицит указанного фермента при синдроме Хантера приводит к неполному гидролизу дерматан- и гепарансульфата, и они накапливаются в лизосомах клеток практически всех тканей (кожи, хрящей, сухожилий, межпозвоночных дисков, костей, стенок сосудов и др.). Такое нарушение катаболизма гликозаминогликанов влечет за собой патологические изменения в структуре тканей, а это, в свою очередь, вызывает формирование анатомических дефектов и функциональные расстройства различных систем и органов.
 [10], [11], [12], [13], [14], [15], [16]
[10], [11], [12], [13], [14], [15], [16]
Факторы риска
Очевидные факторы риска наследования мукополисахаридоза II типа ребенком мужского пола: наличие дефектного гена на Х-хромосоме матери, которая здорова (у нее есть вторая Х-хромосома, компенсирующая мутацию гена), но является носителем измененного гена IDS.
 [17], [18], [19], [20], [21]
[17], [18], [19], [20], [21]
Патогенез
Исследуя патогенез синдрома Хантера, эндокринологи выявили у пациентов с данным заболеванием недостаток одного из внутриклеточных ферментов класса лизосомных гидролаз – идуронатсульфатазы (I2S), обеспечивающего процесс расщепления мукополисахаридов.
 [22], [23], [24], [25], [26], [27]
[22], [23], [24], [25], [26], [27]
Симптомы синдрома Хантера
Скорость перехода заболевания от начальной стадии до клинически тяжелой формы варьируется в широких пределах, и симптомы синдрома Хантера – то есть их наличие и степень проявления – в каждом конкретном случае различаются.
Это врожденное заболевание относится к прогрессирующим патологиям, даже когда диагноз формулируется как ослабленная или мягкая форма. Очевидно, что форма проявления мукополисахаридоза II типа зависит от характера генетических мутаций и определяет как возраст манифестации заболевания, так и тяжесть патологии. Признаки тяжелой формы синдрома Хантера (тип А) в среднем отмечаются возрасте двух с половиной лет и очень быстро усиливаются. У пациентов с ослабленной формой (тип В) симптомы могут появиться в пять-восемь лет (в среднем по статистике – в 4,5 года) или даже в подростковом возрасте.
Следует иметь в виду, что первые признаки синдрома Хантера при рождении ребенка не проявляют себя, а начинают становиться заметными после первого года жизни. Симптомы эти неспецифичные – частые инфекции верхних дыхательных путей, воспаления ушей, паховые или пупочные грыжи, поэтому сразу поставить диагноз затруднительно.
По мере того, как накопление гликозаминогликанов в клетках различных тканей продолжается, появляются такие клинические симптомы синдрома Хантера, как:
- укрупнение и огрубление черт лица из-за множественных дизостозов (полные губы, большие округлые щеки, широкий нос с уплощенной переносицей, утолщенный язык);
- большая голова (макроцефалия);
- укорочение шейного отдела позвоночника;
- увеличенный размер живота;
- низкий хриплый голос (из-за расширения голосовых связок);
- стридорозное (свистящее) дыхание;
- апноэ (остановки дыхания во сне);
- неправильное формирование зубного ряда (большие межзубные расстояния, утолщенные десны);
- утолщение и снижение эластичности кожи;
- папулезные поражения кожи цвета слоновой кости в форме сетчатой структуры между лопатками на спине, по бокам грудной клетки, на руках и ногах (данные признаки являются практически патогномоничными для синдрома Хантера);
- прогрессирующее ухудшение слуха;
- увеличение печени и селезенки (гепатоспленомегалия);
- отставание в росте (особенно заметное поле трех лет);
- приводящее к атаксии ограничение подвижности суставов (сгибательные контрактуры из-за дезостозов мультиплекса и наущений в структуре хрящей и сухожилий);
- задержка умственного развития;
- психические нарушения в виде дефицита внимания, приступов агрессии и беспокойства, нарушений сна, компульсивных расстройств и др.
 [28], [29], [30], [31]
[28], [29], [30], [31]
Осложнения и последствия
Последствия и осложнения дальнейшего накопление GAG в лизосомах клеток затрагивают:
- функции сердца (вследствие утолщения клапанов и миокарда развиваются кардиомиопатии и клапанные аномалии);
- дыхательные пути (развитие обструкции из-за накопления гепаран и дерматансульфата в тканях трахеи);
- слух (полная глухота);
- опорно-двигательный аппарат (деформация позвоночника, дисплазия таза или головки бедренной кости, костей запястья, ранний остеоартрит, проблемы с передвижением);
- интеллект и когнитивные функции (с необратимым регрессом умственного развития);
- ЦНС и психику (поведенческие проблемы).
При синдроме Хантера типа B может быть патологически изменен какой-то один орган, а интеллектуальные способности почти не затрагиваются: чаще всего нарушаться может овладение вербальными навыками и обучение чтению. Средний возраст летального исхода легкой степени болезни составляет 20-22 года, но бывает продолжительность жизни около 40 лет и более.
Тяжелая форма синдрома приводит к более ранней смертности (12-15 лет) – в результате кардиореспираторных осложнений.
 [32], [33], [34], [35]
[32], [33], [34], [35]
Диагностика синдрома Хантера
На сегодняшний день диагностика синдрома Хантера включает:
- осмотр и выявление видимых признаков заболевания;
- анализы: мочи на уровень гликозаминогликанов и крови на активность фермента I2S;
- биопсия кожи на наличие идуронатсульфатазы в фибробластах и определение ее функциональной полноценности.
Генетический анализ (пренатальную диагностику) проводят в случаях семейной истории данного синдрома, для чего делают пункцию плодного пузыря и исследуют ферментативную активность I2S в амниотической жидкости. Также существуют способы определения активности этого фермента в пуповинной крови плода или в ткани ворсин хориона (путем кордоцентеза и биопсии).
Проводится инструментальная диагностика:
- рентгенография всех костей (для определения аномалий окостенения и костных деформаций);
- УЗИ органов брюшной полости;
- спирометрия;
- ЭКГ (для выявления нарушений сердечной деятельности);
- ЭЭГ, КТ и МРТ головного мозга (с целью обнаружения церебральных изменений).
 [36], [37], [38]
[36], [37], [38]
Дифференциальная диагностика
Дифференциальная диагностика призвана отличить синдром Хантера от прочих видов мукополисахаридозаов (синдромов Херлера, Шейе, Гурлера и др.), липохондродистрофией (гаргоилизмом), множественным дефицитом сульфатазы (мукосульфатидозом) и т.д.
Лечение синдрома Хантера
Из-за врожденной природы патологии лечение синдрома Хантера сосредоточено на паллиативной терапии – чтобы уменьшить последствия ухудшения многих функций организма. То есть поддерживающее и симптоматическое лечение часто фокусируется на сердечно-сосудистых осложнениях и проблемах с дыхательными путями. Например, оперативное лечение в виде удаление миндалин и аденоидов может открыть дыхательные пути ребенка и помочь облегчить респираторные осложнения. Однако болезнь прогрессирует, и ткани не становятся нормальными, так что проблемы могут вернуться.
В течение долгого времени наиболее эффективным подходом была трансплантация костного мозга трансплантата или гемопоэтических стволовых клеток – как нового источника недостающего фермента I2S. Пересадка костного мозга может улучшить или остановить прогрессирование некоторых физических симптомов на начальных стадиях заболевания, но при прогрессирующей когнитивной дисфункции данный метод бесполезен. Поэтому такие операции при синдроме Хантера проводятся редко.
Сейчас упор делается на ферментозаместительную терапию, то есть длительное (а в данном случае пожизненное) введение экзогенного фермента I2S. Основное лекарство при данном синдроме – препарат Элапраза (ELAPRASE), который содержит аналогичный эндогенному рекомбинатный лизосомальный фермент идурсульфазу. Это лекарственное средство прошло клинические испытания в 2006 году и одобрено FDA.
Пациентам детского и подросткового возраста Элапразу необходимо вводить инфузионно в вену раз в неделю – из расчета 0,5 мг на каждый килограмм массы тела. Возможные побочные действия проявляются кожными реакциями, головными болями и головокружением, тремором, приливами жара к голове, скачками артериального давления, нарушениями ЧСС, одышкой, спазмами бронхов, болями в суставах и абдоминальной области, отечностью мягких тканей и др.
Важной частью лечения синдрома Хантера является физиотерапевтическое лечение: правильно подобранный комплекс ЛФК способствует сохранению подвижности суставов на ранних стадиях болезни, а электрофорез и магнитотерапия помогают снизить интенсивность суставных болей. Также назначаются симптоматические средства и витамины для поддержания работы сердечно-сосудистой системы, легких, печени, кишечника и т.д.
Профилактика
Профилактика врожденных синдромов, к которым относятся мукополисахаридозы, возможна только путем пренатальной диагностики, а также генетического обследования будущих родителей при планировании беременности и консультирование семей, где уже есть больной ребенок.
Для некоторых детей с синдромом Хантера профилактикой или задержкой развития серьезных последствий патологии может быть раннее диагностирование, хотя даже ферментозаместительная терапия не может вылечить генетический дефект.
 [39], [40], [41], [42], [43]
[39], [40], [41], [42], [43]
Прогноз
Хотя лечение может увеличить продолжительность жизни детей с данной патологией и улучшить ее качество, больные, имеющие синдром Хантера в тяжелой форме, умирают, не дожив до 15 лет. А при отсутствии психических симптомов такие пациенты с тяжелой инвалидностью могут прожить вдвое дольше.
 [44], [45], [46]
[44], [45], [46]
Источник
