Синдромы при остром лимфобластном лейкозе
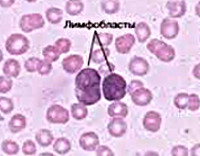
Острый лимфобластный лейкоз – злокачественное поражение системы кроветворения, сопровождающееся неконтролируемым увеличением количества лимфобластов. Проявляется анемией, симптомами интоксикации, увеличением лимфоузлов, печени и селезенки, повышенной кровоточивостью и дыхательными расстройствами. Из-за снижения иммунитета при остром лимфобластном лейкозе часто развиваются инфекционные заболевания. Возможно поражение ЦНС. Диагноз выставляется на основании клинических симптомов и данных лабораторных исследований. Лечение – химиотерапия, радиотерапия, пересадка костного мозга.
Общие сведения
Острый лимфобластный лейкоз (ОЛЛ) – самое распространенное онкологическое заболевание детского возраста. Доля ОЛЛ составляет 75-80% от общего количества случаев болезней системы кроветворения у детей. Пик заболеваемости приходится на возраст 1-6 лет. Мальчики страдают чаще девочек. Взрослые пациенты болеют в 8-10 раз реже детей. У пациентов детского возраста острый лимфобластный лейкоз возникает первично, у взрослых нередко является осложнением хронического лимфоцитарного лейкоза. По своим клиническим проявлениям ОЛЛ схож с другими острыми лейкозами. Отличительной особенностью является более частое поражение оболочек головного и спинного мозга (нейролейкоз), при отсутствии профилактики развивающееся у 30-50% пациентов. Лечение осуществляют специалисты в области онкологии и гематологии.
В соответствии с классификацией ВОЗ различают четыре типа ОЛЛ: пре-пре-В-клеточный, пре-В-клеточный, В-клеточный и Т-клеточный. В-клеточные острые лимфобластные лейкозы составляют 80-85% от общего количества случаев заболевания. Первый пик заболеваемости приходится на возраст 3 года. В последующем вероятность развития ОЛЛ повышается после 60 лет. Т-клеточный лейкоз составляет 15-20% от общего количества случаев болезни. Пик заболеваемости приходится на возраст 15 лет.

Острый лимфобластный лейкоз
Причины острого лимфобластного лейкоза
Непосредственной причиной острого лимфобластного лейкоза является образование злокачественного клона – группы клеток, обладающих способностью к неконтролируемому размножению. Клон образуется в результате хромосомных аберраций: транслокации (обмена участками между двумя хромосомами), делеции (утраты участка хромосомы), инверсии (переворота участка хромосомы) или амплификации (образования дополнительных копий участка хромосомы). Предполагается, что генетические нарушения, вызывающие развитие острого лимфобластного лейкоза, возникают еще во внутриутробном периоде, однако для завершения процесса формирования злокачественного клона нередко требуются дополнительные внешние обстоятельства.
В числе факторов риска возникновения острого лимфобластного лейкоза обычно в первую очередь указывают лучевые воздействия: проживание в зоне с повышенным уровнем ионизирующей радиации, радиотерапию при лечении других онкологических заболеваний, многочисленные рентгенологические исследования, в том числе во внутриутробном периоде. Уровень связи, а также доказанность наличия зависимости между различными лучевыми воздействиями и развитием острого лимфобластного лейкоза сильно различаются.
Так, взаимосвязь между лейкозами и лучевой терапией в наши дни считается доказанной. Риск возникновения острого лимфобластного лейкоза после радиотерапии составляет 10%. У 85% пациентов болезнь диагностируется в течение 10 лет после окончания курса лучевой терапии. Связь между рентгенологическими исследованиями и развитием острого лимфобластного лейкоза в настоящее время остается на уровне предположений. Достоверных статистических данных, подтверждающих эту теорию, пока не существует.
Многие исследователи указывают на возможную связь между ОЛЛ и инфекционными заболеваниями. Вирус возбудителя острого лимфобластного лейкоза пока не выявлен. Существуют две основные гипотезы. Первая – ОЛЛ вызывается одним пока не установленным вирусом, однако болезнь возникает только при наличии предрасположенности. Вторая – причиной развития острого лимфобластного лейкоза могут стать разные вирусы, риск развития лейкоза у детей повышается при недостатке контактов с патогенными микроорганизмами в раннем возрасте (при «нетренированности» иммунной системы). Пока обе гипотезы не доказаны. Достоверные сведения о наличии связи между лейкозами и вирусными заболеваниями получены только для Т-клеточных лейкозов у взрослых больных, проживающих в странах Азии.
Вероятность развития острого лимфобластного лейкоза повышается при контакте матери с некоторыми токсическими веществами в период гестации, при некоторых генетических аномалиях (анемии Фанкони, синдроме Дауна, синдроме Швахмана, синдроме Клайнфельтера, синдроме Вискотта-Олдрича, нейрофиброматозе, целиакии, наследственно обусловленных иммунных нарушениях), наличии онкологических заболеваний в семейном анамнезе и приеме цитостатиков. Некоторые специалисты отмечают возможное негативное влияние курения.
Симптомы острого лимфобластного лейкоза
Болезнь развивается стремительно. К моменту постановки диагноза суммарная масса лимфобластов в организме может составлять 3-4% от общей массы тела, что обусловлено бурной пролиферацией клеток злокачественного клона на протяжении 1-3 предыдущих месяцев. В течение недели количество клеток увеличивается примерно вдвое. Различают несколько синдромов, характерных для острого лимфобластного лейкоза: интоксикационный, гиперпластический, анемический, геморрагический, инфекционный.
Интоксикационный синдром включает в себя слабость, утомляемость, лихорадку и потерю веса. Повышение температуры может провоцироваться как основным заболеванием, так и инфекционными осложнениями, которые особенно часто развиваются при наличии нейтропении. Гиперпластический синдром при остром лимфобластном лейкозе проявляется увеличением лимфоузлов, печени и селезенки (в результате лейкемической инфильтрации паренхимы органов). При увеличении паренхиматозных органов могут появляться боли в животе. Увеличение объема костного мозга, инфильтрация надкостницы и тканей суставных капсул могут становиться причиной ломящих костно-суставных болей.
О наличии анемического синдрома свидетельствуют слабость, головокружения, бледность кожи и учащение сердечных сокращений. Причиной развития геморрагического синдрома при остром лимфобластном лейкозе становятся тромбоцитопения и тромбозы мелких сосудов. На коже и слизистых выявляются петехии и экхимозы. При ушибах легко возникают обширные подкожные кровоизлияния. Наблюдаются повышенная кровоточивость из ран и царапин, кровоизлияния в сетчатку, десневые и носовые кровотечения. У некоторых больных острым лимфобластным лейкозом возникают желудочно-кишечные кровотечения, сопровождающиеся кровавой рвотой и дегтеобразным стулом.
Иммунные нарушения при остром лимфобластном лейкозе проявляются частым инфицированием ран, царапин и следов от уколов. Могут развиваться различные бактериальные, вирусные и грибковые инфекции. При увеличении лимфатических узлов средостения отмечаются нарушения дыхания, обусловленные уменьшением объема легких. Дыхательная недостаточность чаще обнаруживается при Т-клеточном остром лимфобластном лейкозе. Нейролейкозы, спровоцированные инфильтрацией оболочек спинного и головного мозга, чаще отмечаются во время рецидивов.
При вовлечении ЦНС выявляются положительные менингеальные симптомы и признаки повышения внутричерепного давления (отек дисков зрительных нервов, головная боль, тошнота и рвота). Иногда поражение ЦНС при остром лимфобластном лейкозе протекает бессимптомно и диагностируется только после исследования цереброспинальной жидкости. У 5-30% мальчиков появляются инфильтраты в яичках. У пациентов обоих полов на коже и слизистых оболочках могут возникать багрово-синюшные инфильтраты (лейкемиды). В редких случаях наблюдаются выпотной перикардит и нарушения функции почек. Описаны случаи поражений кишечника.
С учетом особенностей клинической симптоматики можно выделить четыре периода развития острого лимфобластного лейкоза: начальный, разгара, ремиссии, терминальный. Продолжительность начального периода составляет 1-3 месяца. Преобладает неспецифическая симптоматика: вялость, утомляемость, ухудшение аппетита, субфебрилитет и нарастающая бледность кожи. Возможны головные боли, боли в животе, костях и суставах. В период разгара острого лимфобластного лейкоза выявляются все перечисленные выше характерные синдромы. В период ремиссии проявления болезни исчезают. Терминальный период характеризуется прогрессирующим ухудшением состояния больного и завершается летальным исходом.
Диагностика острого лимфобластного лейкоза
Диагноз выставляют с учетом клинических признаков, результатов анализа периферической крови и данных миелограммы. В периферической крови пациентов с острым лимфобластным лейкозом выявляются анемия, тромбоцитопения, повышение СОЭ и изменение количества лейкоцитов (обычно – лейкоцитоз). Лимфобласты составляют 15-20 и более процентов от общего количества лейкоцитов. Количество нейтрофилов снижено. В миелограмме преобладают бластные клетки, определяется выраженное угнетение эритроидного, нейтрофильного и тромбоцитарного ростка.
В программу обследования при остром лимфобластном лейкозе входят люмбальная пункция (для исключения нейролейкоза), УЗИ органов брюшной полости (для оценки состояния паренхиматозных органов и лимфатических узлов), рентгенография грудной клетки (для обнаружения увеличенных лимфоузлов средостения) и биохимический анализ крови (для выявления нарушений функции печени и почек). Дифференциальный диагноз острого лимфобластного лейкоза проводят с другими лейкозами, отравлениями, состояниями при тяжелых инфекционных заболеваниях, инфекционным лимфоцитозом и инфекционным мононуклеозом.
Лечение и прогноз при остром лимфобластном лейкозе
Основой терапии являются химиопрепараты. Выделяют два этапа лечения ОЛЛ: этап интенсивной терапии и этап поддерживающей терапии. Этап интенсивной терапии острого лимфобластного лейкоза включает в себя две фазы и длится около полугода. В первой фазе осуществляют внутривенную полихимиотерапию для достижения ремиссии. О состоянии ремиссии свидетельствуют нормализация кроветворения, наличие не более 5% бластов в костном мозге и отсутствие бластов в периферической крови. Во второй фазе проводят мероприятия для продления ремиссии, замедления или прекращения пролиферации клеток злокачественного клона. Введение препаратов также осуществляют внутривенно.
Продолжительность этапа поддерживающей терапии при остром лимфобластном лейкозе составляет около 2 лет. В этот период больного выписывают на амбулаторное лечение, назначают препараты для перорального приема, осуществляют регулярные обследования для контроля над состоянием костного мозга и периферической крови. План лечения острого лимфобластного лейкоза составляют индивидуально с учетом уровня риска у конкретного больного. Наряду с химиотерапией используют иммунохимиотерапию, радиотерапию и другие методики. При низкой эффективности лечения и высоком риске развития рецидивов осуществляют трансплантацию костного мозга. Средняя пятилетняя выживаемость при В-клеточном остром лимфобластном лейкозе в детском возрасте составляет 80-85%, во взрослом – 35-40%. При Т-лимфобластном лейкозе прогноз менее благоприятен.
Источник
Мазок аспирата костного мозга человека с В-клеткой предшественником ВСЕ. Большие фиолетовые клетки это лимфобласты.
Острый лимфобластный лейкоз — злокачественное заболевание системы кроветворения, характеризующееся неконтролируемой пролиферацией незрелых лимфоидных клеток (лимфобластов). Острый лимфобластный лейкоз является самым распространённым злокачественным заболеванием в детском и юношеском возрасте[1]. Пик заболеваемости приходится на возраст от 1 года до 6 лет. Чаще болеют мальчики[2]. Заболевание протекает с поражением костного мозга, лимфатических узлов, селезёнки, вилочковой железы, а также других органов. Поражение центральной нервной системы более характерно при рецидивах после химиотерапии.
Классификация острых лимфобластных лейкозов (ОЛЛ) (ВОЗ, 1999)[править | править код]
- Пре-пре-B-ОЛЛ
- Пре-B-ОЛЛ
- B-ОЛЛ
- T-ОЛЛ
Эпидемиология[править | править код]
На долю В-клеточного лимфобластного лейкоза приходится примерно 80—85 % всех случаев ОЛЛ, на долю Т-клеточного —15—20 %[3]. Пик заболеваемости В-клеточным ОЛЛ приходится примерно на трёхлетний возраст, что совпадает по времени с максимальной активностью производства В-клеток в костном мозге[1]. Второй, более низкий, пик заболеваемости приходится на возраст старше 60 лет[2]. Критическим периодом в случае Т-клеточного ОЛЛ является возраст около 15 лет, примерно в это же время тимус достигает максимального размера. По неизвестным причинам мужчины более подвержены острым лимфобластным лейкозам, чем женщины, в случае Т-клеточного ОЛЛ соотношение заболевших составляет примерно 2:1[1][2]. Шанс развития ОЛЛ у человека возрастом до 15 лет составляет 1:2000[4].
Этиопатогенез[править | править код]
Точные причины возникновения ОЛЛ неизвестны. Предполагают, что, как и в случае других злокачественных заболеваний, болезнь развивается в результате неблагоприятного сочетания воздействия окружающей среды, наследственной предрасположенности и шанса. Изучение этиологии ОЛЛ усложняется разнообразием подтипов болезни, каждый из которых может иметь свои причины[4].
Возникновение злокачественного клона[править | править код]
Считают, что в случае детского В-ОЛЛ предлейкозный клон возникает в организме ребёнка ещё в ходе внутриутробного развития. При В-ОЛЛ, ассоциированном с мутацией гена MLL, злокачественное перерождение B-клетки, по всей видимости, завершается до рождения. Это подтверждается тем, что если он возникает у одного из монозиготных близнецов с общей или монохориональной плацентой, то возникает и у второго с вероятностью практически 100 % и проявляется вскоре после рождения. Пик заболеваемости В-ОЛЛ с другими цитогенетическими характеристиками приходится на более поздний возраст — 2—5 лет. Эти виды лейкоза развиваются у обоих близнецов только в 10—15 % случаев. Это может говорить о том, что, хотя предлейкозный клон возникает во время внутриутробного развития, для его окончательной трансформации нужны дополнительные события[4].
Возможные причины и факторы риска[править | править код]
В качестве возможных причин ОЛЛ рассматривают[4]:
- ионизирующую радиацию — ионизирующая радиация была выявлена как причина ОЛЛ и других видов лейкоза при изучении последствий атомных бомбардировок Японии. Повышенная частота развития ОЛЛ была обнаружена у людей, работавших с радиографическим оборудованием до установления современного уровня безопасности. Люди, прошедшие курс радиотерапии, имеют повышенный риск развития так называемых вторичных лейкозов, в том числе и ОЛЛ. Рентгеновская пельвиметрия во время беременности немного увеличивает риск развития ОЛЛ у ребёнка, при этом риск растёт пропорционально числу процедур. Некоторые исследователи предполагают, что естественная радиация и космическое излучение могут быть причинами ОЛЛ, но эта точка зрения является спорной[4][5];
- инфекции — возбудитель детского ОЛЛ до сих пор не был обнаружен. Существует несколько гипотез на этот счёт, но они сходятся в том, что развитие лейкоза является результатом аномального иммунного ответа на присутствие инфекционного агента. По гипотезе Кинлена, причиной детского ОЛЛ является неизвестный возбудитель, скорее всего вирус, к которому у большинства детей развивается естественный иммунитет, однако у небольшой части особенно чувствительных детей этот возбудитель вызывает лейкоз[6]. По гипотезе Гривса, причиной детского ОЛЛ может быть множество неспецифических возбудителей (например, вирусы гриппа), которые вызывают спонтанные мутации в B-клетках детей, имевших мало контактов с патогенами на первом—втором годах жизни (например, не посещавших ясли)[4][6][7];
- генетическую предрасположенность — мутации, вызывающие ОЛЛ с высокой пенетрантностью, пока не обнаружены. Однако широкомасштабные исследования генома заболевших выявили, что некоторые аллельные варианты генов IKZF1, ARID5B, CEBPE и CDKN2A ассоциированы с повышенным риском развития ОЛЛ. Такие аллели имеют аддитивный эффект. Продукты перечисленных генов вовлечены в дифференцировку и пролиферацию кровяных клеток. Также риск развития ОЛЛ резко повышен у больных синдромом Дауна — примерно в 40 раз у детей в возрасте до четырёх лет[4].
Морфология[править | править код]
В образцах костного мозга и периферической крови, окрашенных по Романовскому—Райту, обнаруживаются лимфобласты двух морфологических типов: L1 и L2 по французско-американо-британской классифиикации (англ.)русск.[8]. Лимфобласты типа L1 характреризуются малыми размерами, высоким соотношением объёмов ядра и цитоплазмы и незаметными ядрышками. Лимфобласты типа L2 более крупные, с выраженной цитоплазмой и ядрышками. Иногда встречаются и необычные формы лимфобластов[9].
Иммунофенотипирование[править | править код]
Иммунофенотипирование лимфобластов имеет большое значение в диагностике ОЛЛ потому, что позволяет делать заключение о прогнозе и наиболее подходящей схеме лечения. В зависимости от того, какие белковые маркеры синтезируются В-лимфобластами, их разделяют на ранние про-В-, поздние про-В- и пре-В-лимфобласты, что соответствует стадиям дифференцировки нормальных В-клеток. Ранние про-В-клетки экспрессируют CD19, CD34 и цитоплазматический CD22, так же они могут содержать терминальную деоксинуклеотидилтрансферазу. Поздние про-В-клетки характеризуются присутствием терминальной деоксинуклеотидилтрансферазы, CD10, CD79a и, в ряде случаев, CD20 и поверхностного CD22. Отличительной особенностью пре-В-клеток является присутствие в цитоплазме тяжёлых цепей иммуноглобулинов класса μ. Мембранные формы иммуноглобулинов, за редким исключением, не характерны для В-клеточных ОЛЛ. В некоторых случаях лимфобласты могут экспрессировать нетипичные для В-клеток маркеры, такие как CD13, CD15 и CD33, и это, как правило, сопряжено с хромосомными перестройками t(9;22) и t(4;11)[9].
Острые Т-клеточные лимфобластные лейкозы делят на 5 иммунофенотипов: про-Т-, пре-Т-, кортикальные Т-, зрелые αβ или γδ Т-клеточные ОЛЛ. Клетки всех пяти иммунофенотипов экспрессируют цитоплазматический CD3. Про-Т-лимфобласты отличаются присутствием CD7, пре-Т-лимфобласты — CD2 и/или CD5. Кортикальные Т-клетки, в отличие от всех остальных, синтезируют CD1a. Зрелые Т-клеточные ОЛЛ классифицируют в зависимости от того, какой вариант Т-клеточного рецептора они несут на своей мембране[10].
Генетические особенности[править | править код]
Характерные генетические аномалии обнаруживаются примерно в 80 % случаев детского В-клеточного лимфобластного лейкоза и в 60—70 % случаев у взрослых[9]. Эти аномалии выявляются при помощи анализа метафазных хромосом, метода FISH и ПЦР. Выявление типичных мутаций важно с диагностической точки зрения, так как позволяет выбрать оптимальную схему лечения и сделать прогноз. Кроме того, знание мутаций может оказаться полезным для контроля эффективности лечения путём выявления минимальной остаточной болезни.
Характерным количественными хромосомными мутациями при B-ОЛЛ являются гипердиплоидия по более чем пяти хромосомам (чаще всего X, 4, 6, 10, 14, 17, 18 и 21) и гиподиплоидия с общим количеством хромосом меньше сорока четырёх[4]. Также при B-ОЛЛ обнаруживают следующие распространённые хромосомные перестройки:
- t(9;22)(q34;q11.2), филадельфийская хромосома (Ph) — реципрокная транслокация между хромосомами 9 и 22. В результате этой транслокации происходит объединение 5′-концевой части гена BCR и 3′-концевой части гена ABL1 образованием мутантного гена BCR-ABL1. Его продуктом является конститутивно активная тирозинкиназа BCR-ABL1, обладающая онкогенным действием[11]. Данная цитогенетическая аномалия встречается примерно в 3 % случаев детского В-ОЛЛ и в 20—50 % случаев В-ОЛЛ взрослых[12]. Данный вид ОЛЛ характеризуется агрессивным течением, высока вероятность возникновения очагов болезни в центральной нервной системе[13]. До начала клинического применения ингибиторов тирозинкиназ, таких как иматиниб, дазатиниб и нилотиниб (англ.)русск., прогноз для пациентов с такой мутацией был неблагоприятным. Сегодня благодаря применению этих препаратов шансы пациентов на достижение полной ремиссии существенно улучшились[13][14].
- t(12;21)(p13;q22), данная транслокация приводит к образованию слитого гена ETV6-RUNX1 (TEL-AML1). Эта мутация часто бывает криптической, и поэтому, как правило, обнаруживается методами FISH и ПЦР. Данное хромосомное нарушение характерно примерно для 25 % случаев детского В-ОЛЛ, но редко встречается у взрослых[15]. Прогноз благоприятный[9].
- t(1;19)(q23;p13)/der(19)t(1;19) — сбалансированная (реципрокная, без потери генетического материала) или несбалансированная (с потерей генетического материала) транслокация, характерная примерно для 5 % случаев детского B-ОЛЛ, у взрослых встречается реже (1—2 %)[16]. В результате этой транслокации формируется химерный онкоген E2A-PBX1 (TCF3-PBX1), продуктом которого является фактор транскрипции с аномальной активностью[17]. В более чем 90 % случаев иммунофенотип соответствует пре-В-клеткам (cytIgμ+, surfIgμ—)[18]. Ранее прогноз был неблагоприятным, но улучшился с появлением современных протоколов лечения. Тем не менее, некоторые исследователи до сих пор относят пациентов с данной транслокацией к группе повышенного риска и рекомендуют более интенсивное лечение[17].
Прогноз[править | править код]
Прогноз у детей значительно лучше, чем у взрослых. Пятилетняя выживаемость при B-ОЛЛ составляет соответственно 90 % и 30—40 %[19][20][21]. Наихудший прогноз при T-лимфобластном лейкозе.
Примечания[править | править код]
- ↑ 1 2 3 H. Franklin Bunn, Jon C. Aster. Chapter 21: Acute Leukemias // Pathophysiology of Blood Disorders. — The McGraw-Hill Companies, Inc., 2011. — С. 244—259. — ISBN 9780071713788.
- ↑ 1 2 3 Dores G. M., Devesa S. S., Curtis R. E., Linet M. S., Morton L. M. Acute leukemia incidence and patient survival among children and adults in the United States, 2001-2007 // Blood. — Т. 119, вып. 1. — С. 34—43. — doi:10.1182/blood-2011-04-347872. — PMID 22086414.
- ↑ Graux C. Biology of acute lymphoblastic leukemia (ALL): clinical and therapeutic relevance. — 2011. — Т. 44, вып. 2. — С. 183—189. — PMID 21354375.
- ↑ 1 2 3 4 5 6 7 8 Inaba H., Greaves M., Mullighan C. G. Acute lymphoblastic leukaemia // Lancet. — 2013. — Т. 381, вып. 9881. — С. 1943—55. — doi:10.1016/S0140-6736(12)62187-4. — PMID 23523389.
- ↑ Greaves M. F. Aetiology of acute leukaemia // Lancet. — 1997. — Т. 349, вып. 9048. — С. 344—9. — PMID 9024390.
- ↑ 1 2 Kinlen L. J. Epidemiological evidence for an infective basis in childhood leukaemia // Br J Cancer. — 1995. — Т. 71, вып. 1. — С. 1—5. — PMID 7819022.
- ↑ Urayama K. Y., Buffler P. A., Gallagher E. R., Ayoob J. M., Ma X. A meta-analysis of the association between day-care attendance and childhood acute lymphoblastic leukaemia // Int J Epidemiol. Jun;():. doi:. — 2010. — Т. 39, вып. 3. — С. 718—32. — doi:10.1093/ije/dyp378. — PMID 20110276.
- ↑ Bennett J. M., Catovsky D., Daniel M. T., Flandrin G., Galton D. A., Gralnick H. R., Sultan C. Proposals for the classification of the acute leukaemias. French-American-British (FAB) co-operative group // Br J Haematol.. — 1976. — Т. 33, вып. 4. — С. 451—458. — PMID 188440.
- ↑ 1 2 3 4 Zhou Y., You M. J., Young K. H., Lin P., Lu G., Medeiros L. J., Bueso-Ramos C. E. Advances in the molecular pathobiology of B-lymphoblastic leukemia // Hum Pathol.. — 2012. — Т. 43, вып. 9. — С. 1347—1362. — PMID 22575265.
- ↑ Kraszewska M. D., Dawidowska M., Szczepański T., Witt M. T-cell acute lymphoblastic leukaemia: recent molecular biology findings // Br J Haematol.. — 2012. — Т. 156, вып. 3. — С. 303—315. — PMID 22145858.
- ↑ Huettner C. S., Zhang P., Van Etten R. A., Tenen D. G. Reversibility of acute B-cell leukaemia induced by BCR-ABL1 // Nat Genet.. — 2000. — Т. 24, вып. 1. — С. 57—60. — PMID 10615128.
- ↑ Ribera J. M. Optimal approach to treatment of patients with Philadelphia chromosome-positive acute lymphoblastic leukemia: how to best use all the available tools // Leuk Lymphoma. — 2012. — PMID 22762547.
- ↑ 1 2 Ravandi F. Managing Philadelphia chromosome-positive acute lymphoblastic leukemia: role of tyrosine kinase inhibitors // Clin Lymphoma Myeloma Leuk.. — 2011. — Т. 11, вып. 2. — С. 198—203. — doi:10.1016/j.clml.2011.03.002. — PMID 21575924.
- ↑ Hunger S. P. Tyrosine kinase inhibitor use in pediatric Philadelphia chromosome-positive acute lymphoblastic anemia // Hematology Am Soc Hematol Educ Program.. — 2011. — Т. 2011, вып. 1. — С. 361—5. — doi:10.1182/asheducation-2011.1.361. — PMID 22160058.
- ↑ Stams W. A., den Boer M. L., Beverloo H. B., Meijerink J. P., van Wering E. R., Janka-Schaub G. E., Pieters R. Expression levels of TEL, AML1, and the fusion products TEL-AML1 and AML1-TEL versus drug sensitivity and clinical outcome in t(12;21)-positive pediatric acute lymphoblastic leukemia // Clin Cancer Res.. — 2005. — Т. 11, вып. 8. — С. 2974—2980. — doi:10.1158/1078-0432.CCR-04-1829. — PMID 15837750.
- ↑ Bicocca V. T., Chang B. H., Kharabi Masouleh B., Muschen M., Loriaux M. M., Druker B. J., Tyner J. W. Crosstalk between ROR1 and the Pre-B Cell Receptor Promotes Survival of t(1;19) Acute Lymphoblastic Leukemia // Cancer Cell. — 2012. — Т. 22, вып. 5. — С. 656—667. — doi:10.1016/j.ccr.2012.08.027. — PMID 23153538.
- ↑ 1 2 Andersen M. K., Autio K., Barbany G., Borgström G., Cavelier L., Golovleva I., Heim S., Heinonen K., Hovland R., Johannsson J.H., Johansson B., Kjeldsen E., Nordgren A., Palmqvist L., Forestier E. Paediatric B-cell precursor acute lymphoblastic leukaemia with t(1;19)(q23;p13): clinical and cytogenetic characteristics of 47 cases from the Nordic countries treated according to NOPHO protocols // Br J Haematol.. — 2011. — Т. 155, вып. 2. — С. 235—243. — doi:10.1111/j.1365-2141.2011.08824.x. — PMID 21902680.
- ↑ Hunger S. P. Chromosomal translocations involving the E2A gene in acute lymphoblastic leukemia: clinical features and molecular pathogenesis // Blood. — 1996. — Т. 87, вып. 4. — С. 1211—1224. — PMID 8608207.
- ↑ Использование педиатрических протоколов лечения острого лимфобластного лейкоза у взрослых — Zdrav.ru
- ↑ Neri L. M., Cani A., Martelli A. M., Simioni C., Junghanss C., Tabellini G., Ricci F., Tazzari P. L., Pagliaro P., McCubrey J. A., Capitani S. Targeting the PI3K/Akt/mTOR signaling pathway in B-precursor acute lymphoblastic leukemia and its therapeutic potential // Leukemia. — 2013. — Вып. Jul 29. — doi:10.1038/leu.2013.226. — PMID 23892718.
- ↑ Paul S., Kantarjian H., Jabbour E. J. Adult Acute Lymphoblastic Leukemia. (англ.) // Mayo Clinic proceedings. — 2016. — Vol. 91, no. 11. — P. 1645—1666. — doi:10.1016/j.mayocp.2016.09.010. — PMID 27814839. [исправить]
Литература[править | править код]
- Патологическая анатомия. Курс лекций. Под ред. В. В. Серова, М. А. Пальцева. — М.: Медицина, 1998
- Шулутко Б. И., Макаренко С. В. Стандарты диагностики и лечения внутренних болезней. 3-е изд. СПб.: «Элби-СПБ», 2005
См. также[править | править код]
- Гемобластозы
- Лейкозы
- Острые лейкозы
Источник
