Синдромы при гипоксически ишемическая энцефалопатии
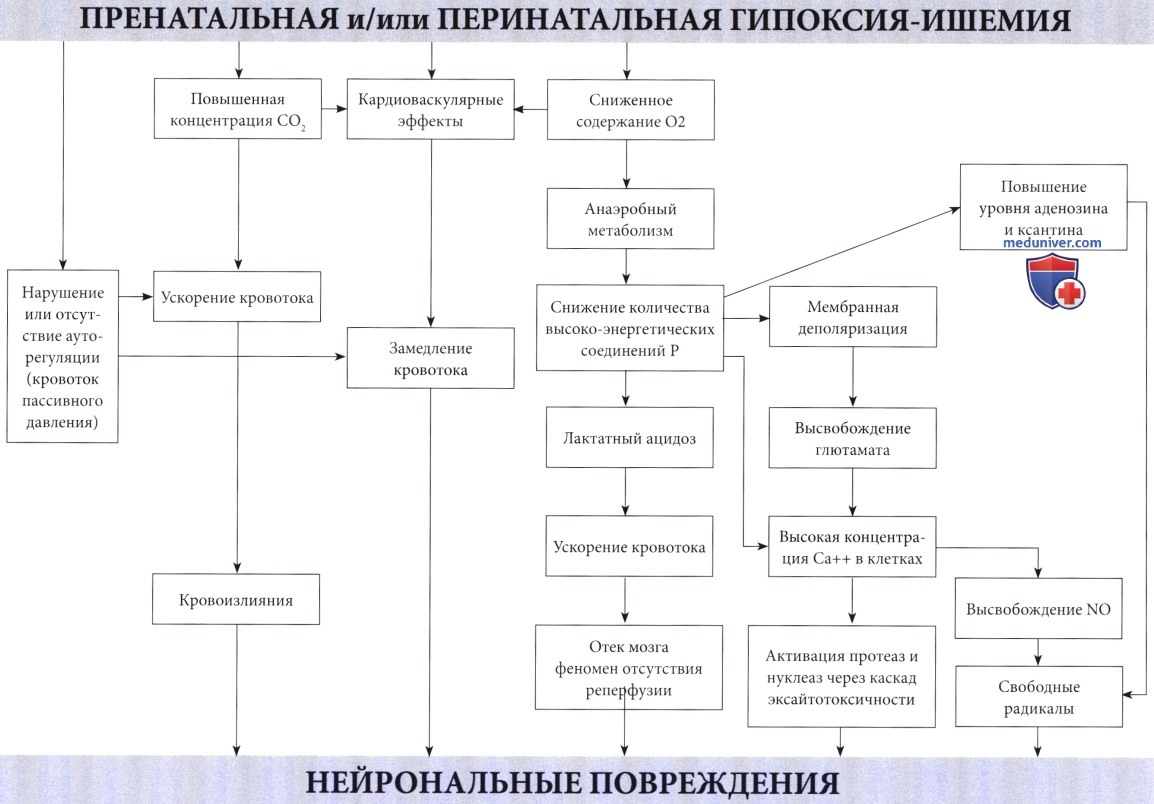
Гипоксически-ишемическая энцефалопатия у новорожденного (ГИЭ, неонатальная энцефалопатия) — причины, патогенезГипоксически-ишемическая энцефалопатия (ГИЭ) встречается примерно у 1-6 из 1000 живорожденных и является самой важной проблемой неонатальной неврологии (Levene et al., 1985, Volpe, 2001, Ferriero, 2004). Гипоксически-ишемическая энцефалопатия (ГИЭ) относится к серьезным состояниям, при котором 15-20% пострадавших детей умирает в течение неонатального периода, а у 25% развиваются стойкие неврологические последствия (Volpe, 2008). Более двадцати лет назад было отмечено завышенное значение перинатальной гипоксии в этиологии задержки умственного развития и церебрального паралича (Freeman и Nelson, 1988, Вах и Nelson, 1993). Badawi et al. (1998) обнаружили, что многие новорожденные подвергались антенатальным факторам риска, таким как лечение материнского бесплодия или заболеваний щитовидной железы, тогда как другие имели и анте-, и интранатальные факторы риска. Хотя не исключается возможность наличия пренатальных факторов риска, вероятно повышающих чувствительность ребенка к проблемам родового периода, в проспективном исследовании результатов MPT Cowan et al. (2003) было отмечено, что у большинства новорожденных (n=351) с неонатальной энцефалопатией повреждение мозга возникало в момент рождения или незадолго до этого. Определение гипоксически-ишемической энцефалопатии (ГИЭ) сложное и роль асфиксии в родах трудно точно установить, так что и сам термин ставится под сомнение; вместо него предлагается неопределенное понятие «неонатальная энцефалопатия» (Nelson и Leviton, 1991, Leviton и Nelson, 1992, Badawi et al, 1998). Диагноз ГИЭ не должен устанавливаться без серьезной клинической основы и тщательного анализа альтернативных вариантов, потому что они могут играть роль в терапии и этиологии. Патофизиология. Недостаточное поступление кислорода, вызывающее развитие гипоксической-ишемической энцефалопатии (ГИЭ), может возникнуть по двум механизмам: гипоксемия, т.е. ограниченный доступ кислорода в кровь; и ишемия, т.е. сниженная перфузия головного мозга. В большинстве случаев оба механизма связаны с асфиксией в виде гипоксии, сопровождающейся гиперкарбией (Altman et al., 1993). Обычно присутствующий при гипоксии ацидоз в значительной степени связан с повышенным образованием лактата. Преобразование глюкозы в молочную кислоту менее эффективно, чем окисление в цикле Кребса и митохондриальной системе транспорта электронов. В результате окисления каждой молекулы глюкозы, переработанной в анаэробных условиях, образуется только две молекулы аденозина дифосфата (АДФ) по сравнению с 38 молекулами при аэробных условиях. Несмотря на значительное повышение скорости гликолиза и усиление мозгового кровотока из-за ацидоза и гиперкапнии (Laptook et al., 1988), потребности ткани мозга в кислороде не могут быть удовлетворены. Повышенная скорость гликолиза приводит к падению уровня глюкозы в мозге. Предупреждение этого состояния предварительным введением глюкозы повышает выработку АТФ и улучшает выживаемость (Vannucci и Yager, 1992). Однако избыточный уровень глюкозы в то же время приводит к повышенному образованию лактата, вредного для мозговой ткани взрослого, но, по-видимому, полезного для ЦНС новорожденного (Hattori и Wasterlain, 1990). В итоге, в результате нехватки кислорода в клетках мозга снижается количество фосфокреатина и АТФ, конечных акцепторов электронов. Эти изменения были продемонстрированы у новорожденных с использованием фосфорной МРС (магнитно-резонансная спектроскопия) (Younkin et al., 1988, Laptook et al., 1989). Падение уровня высокоэнергетических соединений фосфата наблюдалось даже при стабилизации кардиопульмональной функции (Hope et al., 1984). В экспериментах на животных снижение уровня АТФ более чем на 30% происходило за 6 минут (Raichle, 1983). Также было отмечено накопление лактата, сохранявшееся в течение длительного периода времени (Groenendaal et al, 1994, Robertson et al., 1999).
В действительности, нарушению мозговой функции предшествует сбой в энергетическом метаболизме (см. Volpe, 2001). При угрозе перебоев организм отвечает угнетением нейрональной активности по неопределенному механизму, но при длительной гипоксии этого недостаточно. Однако мозг новорожденного чрезвычайно устойчив к гипоксии. При экспериментах на плодах обезьян потребовалось снижение сатурации кислорода на 90% в течение не менее 25 минут, чтобы вызвать повреждение ткани мозга. В результате, любой, достаточно тяжелый для повреждения мозга эпизод асфиксии вызывает нарушения и других органов, особенно сердца, и при таких условиях ишемия постоянна. Ишемия оказывает влияние, подобное асфиксии (Painter, 1989). Процесс гликолиза ускоряется, но поглощению глюкозы препятствует нарушение кровотока, соответственно запасы высокоэнергетических фосфатов истощаются, и накапливается лактат. Влияние гиперлактатемии многопланово. Первоначально оно благотворно, поскольку повышает приток крови к мозгу, но затем становится вредным, так как хотя бы отчасти влияет на отек мозга, который в свою очередь может сдавить капиллярное русло и вызвать ишемию (Myers, 1972). В то же время он нарушает ауторегуляцию церебрального кровообращения, приводя к мозговому кровотоку пассивного давления (Lou, 1988), что делает мозг более чувствительным к изменениям системного давления крови. Сочетание отека мозга и системной недостаточности кровообращения, вероятно, играет существенную роль в происхождении гипоксического повреждения ЦНС. Гипоксия обычно повышает долю сердечного выброса, предназначенную для головного мозга. По мере усиления степени гипоксии наблюдается уменьшение сердечного выброса с последующей неспособностью поддерживать артериальное давление на необходимом уровне. Но показатели частоты сердечных сокращений и артериального давления остаются неизменными до тех пор, пока артериальная сатурация не снизится более, чем на 65%, а затем также линейно снижаются. Это снижение может поддерживаться на протяжении часов без развития энцефалопатии, если содержание кислорода в артериальной крови не упадет более, чем на 85% (Fenichel, 1997). Механизм отека мозга и гипоксического повреждения у плодов до конца неясен. Levene et al. (1989) выявили хорошую корреляцию между высокой скоростью мозгового кровотока—предположительно отражающей церебральную гиперемию, которая, в свою очередь, может отвечать за повышение внутричерепного давления — и неблагоприятным течением. Lupton et al. (1988) показали, что отек в большей степени является следствием, чем причиной, нейрональных некрозов, объясняя, таким образом, ограниченную эффективность противоотечного лечения новорожденных с ГИЭ (Levene et al., 1987). Не было замечено различий в степени внутричерепной гипертензии у детей с ГИЭ в группе выживших и умерших (Goitein et al, 1983). Последние данные подтверждают основную роль апоптоза в развитии гипоксически-ишемического повреждения мозга новорожденных, возможно, даже большую, чем некроз после повреждения. Во время неонатального поражения мозга токсичность возбуждающих медиаторов, оксидативный стресс и воспаление способствуют ускоренной гибели клеток, главным образом, посредством апоптоза или некроза, что зависит от области поражения и тяжести повреждения. В настоящее время известно, что ГИЭ состоит из двух последовательных стадий, с окончательным повреждением с отсрочкой на несколько часов во время второй из них, определяемой как вторичная недостаточность энергии. Тем не менее, профилактика возможна, как только появляется терапевтическое окно. Механизмы повреждения и некроза клеток при гипоксии и ишемии не просто итог энергетической недостаточности. Это вторичные пусковые факторы каскада разрушительных событий при достижении критического уровня дефицита энергии. Такие события происходят в течение нескольких часов. Избыточная мембранная деполяризация и высвобождение возбуждающих аминокислотных нейротрансмиттеров, в первую очередь глютамата (Lipton и Rosenberg, 1994), приводит к массивному входу кальция через NMDA и АМРА мембранные рецепторы (Morley et al., 1994) и к накоплению кальция в цитозоле. Кальций, в свою очередь, активирует различные липазы, протеазы и нуклеазы с последующим разрушением основных клеточных белков. Свободные радикалы прямо или косвенно вызваны повышенным уровнем кальция в цитозоле (McCord, 1985) и оксида азота (Dawson et al., 1992), играющего главную роль в их образовании. Этот каскад возбуждающих медиаторов в конечном счете приводит к повреждению мембраны, разрушению цитоскелета и, наконец, к дезинтеграции клетки. Теоретически существует возможность предотвращения многих процессов, поэтому проводились исследования с различными средствами, в том числе блокаторами кальциевых каналов (Miller, 1993, Palmer и Vanucci, 1993); антагонистами возбуждающих аминокислот (Hattori et al., 1989), особенно магнезией (Marret et al., 1995, Nelson и Grether, 1995); ингибиторами синтеза оксида азота (Dawson et al., 1992); акцепторами свободных радикалов (Palmer и Vannucci, 1993) и веществами, подавляющими образование свободных радикалов типа аллопуринола (Palmer et al., 1990, van Bel et al., 1998, Benders et al., 2006). — Также рекомендуем «Нейропатология при гипоксически-ишемической энцефалопатии у новорожденного (ГИЭ, неонатальной энцефалопатии)» Редактор: Искандер Милевски. Дата публикации: 25.11.2018 |
Источник
Постгипоксическая энцефалопатия – состояние, которое характеризуется изменением структуры мозговой ткани и нарушением функций мозга вследствие перенесенного кислородного голодания. Прогрессирование дегенеративных изменений в мозговом веществе коррелирует с задержкой умственного и физического развития детей. Последствия повреждения тканей ЦНС в перинатальный период – основная причина развития неврологических нарушений у пациентов раннего детского возраста. Одно из осложнений – ДЦП (церебральный паралич). Распространенность ПЭП (перинатальная энцефалопатия) гипоксического генеза составляет около 5% случаев среди общего числа новорожденных.
Характеристика патологии
Перинатальная ишемическая энцефалопатия – повреждение мозга органического типа, связанное с дефицитом кислорода в клетках нервной ткани. Чаще кислородное голодание спровоцировано недостаточностью мозгового кровотока. Последствия патологического процесса не ограничиваются характерной симптоматикой в первые месяцы жизни.
Кислородное голодание мозговой ткани в период внутриутробного развития или в ходе родового процесса сказывается на функционировании мозга в дальнейшем. У детей, перенесших состояние гипоксии, часто возникают неврологические нарушения и изменение структуры мозговой ткани, что обнаруживается в ходе нейровизуализации.
Распространенное последствие – синдром церебральной гипертензии (стойкое повышение значений внутричерепного давления). Тяжесть последствий определяется характером и степенью повреждения мозга. При незначительных изменениях структуры мозгового вещества, нарушения у новорожденных детей в будущем могут проявляться неусидчивостью, невозможностью концентрировать внимание, гиперактивностью. При повреждениях тяжелой степени высока вероятность развития ДЦП.
Гипоксическая энцефалопатия у взрослых развивается на фоне перенесенных эпизодов кислородного голодания, которые ассоциируются с кратковременной остановкой дыхания или сердечной деятельности (терминальные состояния). Апноэ (кратковременное прекращение дыхания) возникает на фоне бронхиальной астмы или коклюша. Гипоксическое состояние у взрослых часто развивается при недостаточности мозгового кровотока, спровоцированной патологиями сердца или питающих мозг артерий.
Распространенные этиологические факторы, вызывающие гипоксические состояния у взрослых: асфиксия (удушье) из-за попадания в дыхательные пути инородных тел, утопление, паралич мускулатуры дыхательной системы вследствие отравления ядами или наркотическими веществами. Спровоцировать гипоксическое состояние может аллергическая реакция, сопровождающаяся отеком Квинке и сужением дыхательных путей.
Причины возникновения
Выявление причин гипоксии в перинатальный период сопряжено с трудностями. Обычно возникновение патологии связывают с осложнением течения беременности или родов. В 30% случаев новорожденным детям с гипоксически-ишемическими изменениями головного мозга ставят ошибочный диагноз.
Гипоксия ассоциируется с изменением реологических характеристик крови и с повреждением всех структур мозга, в том числе клеток нервной ткани и элементов кровеносной системы. Паталогические процессы приводят к масштабным органическим повреждениям, которые чаще носят диффузный характер.
Возникшие нарушения влияют на адаптацию организма младенца к окружающей среде, определяют степень тяжести течения заболевания и прогноз. Фетоплацентарная недостаточность, протекающая в хронической форме, и маловодие становятся причиной патологии в 15% случаев. Причины перинатальной энцефалопатии гипоксического генеза в 85% случаев связаны с болезнями, перенесенными матерью в период гестации:
- Анемия (дефицит гемоглобина, транспортирующего кислород в ткани), протекающая в хронической форме.
- Респираторно-вирусные инфекции.
- Артериальная гипертензия, носящая устойчивый характер.
- Соматические болезни, патологии ЦНС, протекающие в хронической форме.
В патогенезе немаловажную роль играет наследственная предрасположенность. В большинстве случаев у родителей и родственников грудничков с признаками поражения мозга гипоксической этиологии выявлялись цереброваскулярные патологии разных форм и генеза, в анамнезе многих из них значился инсульт.
Основные факторы, провоцирующие перинатальные поражения ЦНС у детей грудного возраста: внутриутробные инфекции (10%), эндокринные нарушения (8%), повреждения травматической природы (7%). Среди этиологических факторов, влияющих на развитие патологии у новорожденных, особое место занимает асфиксия, связанная с внутриутробной инфекцией, внутричерепным повреждением или родовой травмой.
Родовые травмы чаще ассоциируются с неправильным предлежанием плода или слабостью родовой деятельности (недостаточность интенсивности, длительности, периодичности сокращения мышц, выстилающих стенки матки). Токсико-гипоксическая энцефалопатия у взрослых и детей развивается на фоне отравления фармакологическими средствами и другими токсическими веществами.
Симптоматика
Симптомы ГИЭ у новорожденного обнаруживаются при помощи тестирования по шкале Апгар. Нередко в околоплодных водах обнаруживаются следы мекония (первые фекалии). Умеренная степень гипоксии может проявляться у новорожденного незначительно. Позже изменения, в том числе неврологический дефицит, обнаруживаются во время осмотра неврологом или планового УЗИ-исследования.
В некоторых случаях младенцу сразу требуется интенсивная терапия. Обычно наблюдаются клинические синдромы:
- Угнетения. Вялость, апатия, гиподинамия, мышечная гипотония, ослабление рефлексов.
- Коматозный. Врожденные рефлексы не возникают на болевые, световые и другие раздражители, атония (отсутствие тонуса мышц), отсутствие двигательной активности.
- Судорожный. Судороги тонико-клонического или тонического типа.
Признаки гипоксически-ишемической энцефалопатии у новорожденных выявляются в ходе инструментальной диагностики и визуального осмотра. Течение заболевания варьируется у разных пациентов. Обычно патология сопровождается оживлением рефлексов, повышенной нервной возбудимостью (спонтанная моторная активность, оживление коленных рефлексов, тремор конечностей). Параллельно выявляются признаки церебральной гипертензии:
- Набухание, выпирание родничка.
- Запрокидывание головы в направлении назад.
- Беспричинный, частый плач.
- Снижение аппетита, отказ от еды.
- Нарушение сна.
- Увеличение диаметра черепа.
- Горизонтальный нистагм.
- Косоглазие сходящегося (зрительная ось отклонена в направлении к носу) типа.
- Мышечная дистония (патологическое сокращение мышц, сопровождающееся непроизвольными движениями).
Для пациентов характерны периоды остановки дыхания во время сна (эпизоды апноэ), апатия, вялость. Пониженная концентрация гемоглобина, характерная для гипоксически-ишемического поражения головного мозга у новорожденных, усугубляет течение церебральной гипертензии. Длительно текущий патологический процесс провоцирует развитие тканевого отека. Клиническая картина (по данным нейросонографии) включает:
- Кровоизлияния перивентрикулярной (в области желудочковой системы) локализации (40% случаев).
- Расширение желудочков (20% случаев).
- Ишемическое поражение подкорковых (базальных) ядер (10% случаев).
- Изменения диффузного типа в мозговой ткани – ишемическое поражение мозгового вещества в области желудочковой системы, отек паренхимы (структуры, образованные нейронами).
Перивентрикулярное кровоизлияние в сочетании с ишемическим поражением подкорковых ядер выявляется с частотой около 16%. Перивентрикулярное кровоизлияние в сочетании с гидроцефалией и ишемией базальных ядер диагностируется с частотой 14%. Подобные нарушения свидетельствуют о функциональной недостаточности мозга и нарушении мозгового кровотока.
Гипоксическое состояние, спровоцированное отравлением фармацевтическими средствами, нейротропными ядами и другими токсическими веществами, у детей и взрослых сопровождается симптомами, обусловленными специфическим действием ядов и нарушением нервной регуляции на фоне повреждения нервных структур.
Основные признаки: расстройство сознания, протекающее по типу психоза, сбои в работе вегетативной системы, психомоторное возбуждение, судорожный синдром. Первичное нарушение сознания стремительно прогрессирует, трансформируясь в дефицитные формы (сопор, кома). Обычно при этом ослаблена или отсутствует реакция зрачка на свет.
Диагностика
Уровень сознания взрослых пациентов, перенесших гипоксию токсического генеза, оценивают по шкале Глазго, тяжесть нарушения интеллекта по шкале MMSE. Состояние и функциональность нервной системы определяется при помощи неврологических тестов и методов инструментальной диагностики. Лабораторные анализы показывают повышенную концентрацию малонового диальдегида и молочной кислоты в сыворотке крови. Для диагностики перинатальной гипоксически-ишемической энцефалопатии применяют инструментальные методы:
- УЗИ, нейросонография.
- Эхоэнцефалография, электроэнцефалография.
- МРТ, КТ.
- Реоэнцефалография.
- Церебральная ангиография.
В ходе инструментальной диагностики выявляются внутрижелудочковые кровоизлияния, повреждение мозговой ткани ишемического генеза преимущественно перивентрикулярной локализации, отек мозга. Анализ крови показывает снижение уровня гемоглобина – анемию разной степени тяжести.
Методы лечения
Лечение острого периода гипоксии у новорожденных предполагает проведение интенсивной терапии, которая включает аппаратную вентиляцию легких, применение препаратов антиоксидантного действия, корректоров тканевого метаболизма, антиконвульсантов. Параллельно проводится медикаментозная терапия, направленная на снижение проницаемости сосудистой стенки и устранение эффекта дегидратации.
Хирургическое лечение (перивентрикулярное шунтирование) показано при выраженном гидроцефальном синдроме в сочетании с перивентрикулярными кровоизлияниями. Восстановительное лечение младенцев проводится методом индуцированной гипотермии. Процедура представляет собой терапевтическое воздействие на показатели температуры тела новорожденного.
Основная цель – уменьшение риска развития ишемических процессов после перенесенного состояния кислородного голодания, связанного с эпизодом недостаточности кровообращения. Клинические исследования подтвердили уменьшение проявлений неврологической симптоматики после индуцированной гипотермии. Порядок проведения процедуры:
- Поддержание температуры тела новорожденного ребенка на уровне 33,5°С.
- Длительность воздействия – 72 часа.
- Начало процедуры – спустя 6 часов после рождения.
Один из передовых методов лечения, направленных на предотвращение ПЭП – внутривенное введение стволовых клеток (мононуклеарная фракция), полученных из пуповинной крови. Терапия способствует восстановлению клеток нервной ткани, стимулирует работу иммунной системы.
Лечение взрослых пациентов с диагнозом токсико-гипоксическая энцефалопатия на фоне отравления ядовитыми веществами проводится с учетом вида химического соединения, которое спровоцировало нарушения. Особое место занимает экстренная детоксикационная терапия, в том числе гемосорбция, гемофильтрация, плазмаферез, гемодиализ.
Прогноз и профилактика
Из-за серьезных последствий для здоровья ребенка большое значение приобретает профилактика гипоксически-ишемических процессов в период внутриутробного развития и профилактика асфиксии во время родов. Прогноз при гипоксических состояниях зависит от степени тяжести повреждений мозговых структур и выраженности неврологических нарушений.
Диагноз ГИЭ в младенческом возрасте коррелирует с такими патологиями, как мозговая дисфункция, ДЦП, эпилепсия. У взрослых постгипоксическая энцефалопатия становится причиной развития неврологического дефицита, ухудшения когнитивных способностей, слабоумия.
Просмотров: 779
Источник
