Синдромы нарушения эритропоэза и лейкопоэза у животных
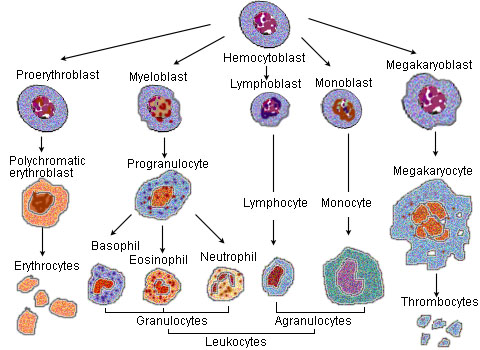
Эритропоэз (от греч. «erythro — «красный», и греч. poiesis — «делать») — это одна из разновидностей процесса гемопоэза (кроветворения), в ходе которой образуются красные кровяные клетки (эритроциты). Эритропоэз стимулируется уменьшением доставки кислорода к тканям, которое детектируется почками. Почки в ответ на тканевую гипоксию или ишемию выделяют гормон эритропоэтин, который стимулирует эритропоэз[2]. Этот гормон стимулирует пролиферацию и дифференциацию клеток-предшественников красного кровяного ростка, приводя тем самым к ускоренному эритропоэзу в кроветворных тканях и к увеличению выхода эритроцитов в кровь[2]. У птиц и млекопитающих (включая человека) после рождения гемопоэз — и в том числе эритропоэз — осуществляется в костном мозге, который и является единственной кроветворной тканью в норме после рождения[2]. У ранних эмбрионов и плодов гемопоэз происходит в мезодермальных клетках желточного мешка. Начиная с третьего месяца беременности, у человека гемопоэз (и в частности эритропоэз) начинает происходить в фетальной печени и фетальной селезёнке[3]. После 7-го месяца беременности гемопоэз у плода происходит преимущественно в костном мозге. Повышение физической активности (то есть повышение потребности тканей в кислороде), а также кровопотеря, курение (то есть пониженная доставка кислорода тканям из-за хронического воздействия угарного газа), пребывание в горах (то есть в местности с пониженным парциальным давлением кислорода), некоторые сердечно-сосудистые заболевания (например, сердечная недостаточность) и лёгочные заболевания (например, хроническая бронхообструктивная болезнь), приводящие к нарушению доставки кислорода тканям, могут способствовать усилению эритропоэза. Напротив, при почечной недостаточности с нарушением выработки эритропоэтина, при дефиците белков, витамина B12 или фолиевой кислоты, железа и других нутриентов, при хронических инфекциях, при злокачественных опухолях, при ряде интоксикаций, при ряде заболеваний костного мозга (например, таких, как миелодиспластический синдром или лейкоз) — наблюдается нарушение или угнетение эритропоэза, приводящее к снижению уровня гемоглобина и эритроцитов — к развитию анемии[4]. У людей с некоторыми заболеваниями и у некоторых видов животных при некоторых обстоятельствах гемопоэз, и в том числе эритропоэз, может также происходить и вне пределов костного мозга, в печени и/или селезёнке. Это называется «экстрамедуллярный (внекостномозговой) гемопоэз».
Костный мозг практически всех костей тела человека участвует в выработке клеток крови (гемопоэзе) приблизительно до 5 лет. Кости бедёр и голеней прекращают вносить существенный вклад в гемопоэз приблизительно к 25 годам. Костный мозг, расположенный в костях позвонков, грудины, таза и рёбер, а также кости черепа продолжают вносить вклад в гемопоэз в течение всей жизни человека.
Дифференциация эритроцитов[править | править код]
В процессе созревания эритроцитов клетка кровяного ростка в костном мозгу проходит несколько последовательных стадий деления и созревания (дифференциации), а именно:
- Гемангиобласт, первичная стволовая клетка — общий прародитель клеток эндотелия сосудов и кроветворных клеток, превращается в
- Гемоцитобласт, или плюрипотентную гемопоэтическую стволовую клетку, превращается в
- CFU-GEMM, или общего миелоидного предшественника — мультипотентную гемопоэтическую клетку, а затем в
- CFU-E, унипотентную гемопоэтическую клетку, полностью коммиттированную в эритроидную линию, а затем в
- пронормобласт, также называемый проэритробластом или рубрибластом, а затем в
- Базофильный или ранний нормобласт, называемый также базофильным или ранним эритробластом или прорубрицитом, а затем в
- Полихроматофильный или промежуточный нормобласт/эритробласт, или рубрицит, а затем в
- Ортохроматический или поздний нормобласт/эритробласт, или метарубрицит. В конце этой стадии клетка избавляется от ядра, прежде чем стать
- Ретикулоцитом, или «юным» эритроцитом.
После завершения 8-й стадии получившиеся клетки — то есть ретикулоциты — выходят из костного мозга в общее кровеносное русло. Таким образом, среди циркулирующих красных кровяных клеток около 1 % составляют ретикулоциты. После 1—2 дней пребывания в системном кровотоке ретикулоциты заканчивают созревание и становятся, наконец, зрелыми эритроцитами.
Все эти стадии развития сопровождаются соответствующими морфологическими изменениями внешнего вида клетки при окраске по Райту и рассмотрении в световой микроскоп, а также определёнными биохимическими и иммунофенотипическими изменениями.
В частности, в процессе созревания базофильный пронормобласт, крупная клетка с огромным ядром, имеющая объём в среднем 900 фемтолитров, превращается в безъядерный диск объёмом в 10 раз меньше — в среднем приблизительно 95 фемтолитров. На стадии ретикулоцита клетка уже избавилась от ядра, но всё ещё способна накапливать и производить дополнительный гемоглобин, поскольку имеет «оборудование» для производства белка — рибосомы. Зрелые же эритроциты лишены не только ядра, но и рибосом, и поэтому нового гемоглобина не накапливают, а лишь транспортируют и используют уже имеющийся в течение отведённого им срока жизни. По этой же причине зрелые эритроциты, в отличие от ретикулоцитов, лишены поверхностных рецепторов к трансферрину (то есть не способны более захватывать и усваивать дополнительное железо).
Критически необходимым для созревания красных кровяных клеток (эритроцитов) является достаточное поступление витамина B12 (кобаламина) и фолиевой кислоты, а также витамина B6 (пиридоксина) и витамина B2 (рибофлавина), особенно первых двух. Дефицит любого из них вызывает нарушение процессов созревания эритроцитов, что клинически проявляется анемией (снижением содержания в крови эритроцитов и гемоглобина), макроцитозом (аномально крупными размерами эритроцитов), мегалобластозом костного мозга или, иначе говоря, мегалобластным типом кроветворения (аномально крупными размерами проэритробластов и эритробластов, называемых в этом случае соответственно промегалобластами и мегалобластами) и ретикулоцитопенией (аномально низким количеством ретикулоцитов в крови). При этом каждый отдельный эритроцит не только крупнее обычного, но и — компенсаторно — обычно содержит гемоглобина больше, чем в норме. Цветной показатель крови при этом может быть больше единицы («гиперхромная анемия») или нормален («нормохромная анемия»), но самих эритроцитов образуется меньше, чем нужно, поскольку витамин B12 и фолиевая кислота критически необходимы для деления клеток-предшественников эритроцитарного ростка. Это называется мегалобластной анемией.
Для синтеза гемоглобина клеткам-предшественникам эритроцитов необходимо железо. Дефицит железа вызывает снижение как общего содержания гемоглобина в крови, так и его содержания в каждом отдельном эритроците (то есть, в противоположность предыдущему случаю, гемоглобина в каждом отдельном эритроците не больше, а меньше нормы), а также может вызывать уменьшение размеров эритроцитов («микроцитоз», «микроцитарная анемия»). Либо же размеры эритроцитов не изменяются, но количество гемоглобина в них ниже нормы («нормоцитарная» гипохромная анемия, то есть с обычных размеров, но более бледными эритроцитами). Может также наблюдаться некоторое (меньшее, чем при дефиците витамина B12 или фолиевой кислоты) уменьшение количества эритроцитов. Цветной показатель крови при этом либо нормален и не изменен («нормохромная анемия»), либо снижен («гипохромная анемия»). И опять-таки отмечается аномально низкое количество ретикулоцитов в крови — ретикулоцитопения.
После кровопотери или при гипоксии (например, при подъёме в горы или переезде в горную местность или развитии легочного либо сердечно-сосудистого заболевания с гипоксией), или при стимулировании эритроцитарного ростка костного мозга экзогенно введённым эритропоэтином, или в фазе восстановления после химиотерапии, или при назначении больному с дефицитом B12, фолиевой кислоты или железа препаратов, компенсирующих эти дефициты, напротив, количество ретикулоцитов в крови временно возрастает — развивается ретикулоцитоз, который служит признаком усиления эритропоэза. Ретикулоцитоз при этом сохраняется до компенсации анемии (восстановления нормального уровня гемоглобина и эритроцитов) и устранения причины анемии.
Изменения характеристик клеток-предшественников эритроцитов в процессе эритропоэза[править | править код]
В процессе созревания клеток эритроцитарного ростка изменяется их ряд морфологических характеристик. В частности:
- Уменьшаются размеры клетки;
- Цитоплазматический матрикс увеличивается в количестве;
- Окраска клетки меняется с голубой (базофильной) на розоватую, розовую и затем красную вследствие уменьшения содержания в клетке РНК и ДНК и накопления гемоглобина;
- Уменьшаются размеры ядра клетки, причём в конце созревания оно не только уменьшается в размерах, но и становится характерно «сморщенным», а затем выталкивается из клетки, которая лишается ядра на стадии ретикулоцита;
- У незрелых клеток эритроидного ряда ядро содержит открытый, рыхло упакованный хроматин, в процессе созревания хроматин становится всё более плотно упакованным, конденсированным[5].
Регуляция эритропоэза[править | править код]
Продукция эритроцитов, то есть интенсивность процессов эритропоэза, регулируется петлёй отрицательной обратной связи при участии гормона эритропоэтина. Эта система саморегулируется таким образом, чтобы в нормальном, здоровом состоянии организма скорость производства костным мозгом новых эритроцитов приблизительно соответствовала скорости разрушения «пожилых» (уже деформировавшихся от старости и потому захваченных и разрушенных клетками ретикулоэндотелиальной системы и в частности макрофагами селезёнки), то есть чтобы уровень гемоглобина и эритроцитов в крови оставался приблизительно постоянным. А уровень этот поддерживается таким, чтобы количество гемоглобина и эритроцитов было достаточным для обеспечения адекватного снабжения тканей (и в частности печени и почек) кислородом, но при этом чтобы это количество эритроцитов также не было чрезмерным, вызывающим чрезмерное «сгущение крови», повышение её вязкости, агглютинацию («склеивание») эритроцитов в кровяном русле, чрезмерное увеличение объёма крови и повышение артериального давления, развитие тромбозов, инфарктов или инсультов. Эритропоэтин выделяется в печени и почках в ответ на пониженное содержание в их тканях кислорода (то есть на ухудшение кислородного снабжения ткани печени или почек, чем бы оно ни было вызвано — анемией, спазмом сосудов почек или печени, недостаточным содержанием кислорода в воздухе, заболеванием лёгких или сердца, сосудов — не суть важно, механизм сработает). Кроме того, циркулирующий в крови эритропоэтин связывается циркулирующими эритроцитами, поэтому низкое содержание эритроцитов в крови приводит к повышению количества свободного (не связанного с эритроцитами) эритропоэтина, что приводит к стимуляции производства эритроцитов костным мозгом и к повышению их содержания в крови. Вследствие этого кислородное снабжение печени и почек улучшается (так как эритроцитов и гемоглобина в крови стало больше), снижается продукция ими эритропоэтина, а уровень свободного (несвязанного) эритропоэтина снижается из-за связывания увеличившимся количеством эритроцитов. Таким образом система предотвращает чрезмерное нарастание количества эритроцитов в ответ на стимуляцию и негативные последствия этого чрезмерного нарастания, и самобалансируется.
Кроме того, как продукция эритропоэтина почками и печенью, так и продукция красных кровяных клеток костным мозгом находятся под контролем и ряда других гормонов. В частности, стрессовый гормон кортизол также способен как увеличивать продукцию эритропоэтина почками и печенью, так и непосредственно стимулировать эритроцитарный росток костного мозга. Физиологическое значение этого заключается в том, что для реализации стрессовых реакций по типу «бей или беги» повышенная продукция эритроцитов и улучшение кислородного снабжения тканей (особенно мышц, мозга, миокарда) предоставляет преимущество. Значение при патологии — в том, что при недостаточности коры надпочечников (болезни Аддисона) нередко отмечается анемия, а при гиперкортицизме (болезни Кушинга) — нередко чрезмерный эритроцитоз.
Также на продукцию эритроцитов положительно влияют половые гормоны, особенно мужские (поэтому содержание гемоглобина и эритроцитов у мужчин выше, чем у женщин), гормоны щитовидной железы, соматотропин, инсулин. Физиологическое значение этого заключается в том, что в период роста и созревания организма ребёнка или подростка, параллельно общему росту, увеличивается и интенсивность процессов эритропоэза. Значение при патологии — в том, что при ряде эндокринных недостаточностей, например, сахарном диабете, гипотиреозе, нередко наблюдается умеренно выраженная анемия, а при состояниях, сопровождающихся гиперпродукцией гормонов (например, тиреотоксикозе), иногда бывает умеренный эритроцитоз.
Последние исследования показывают также, что пептидный гормон гепсидин может играть важную роль в регуляции продукции гемоглобина и тем самым в регуляции эритропоэза. Гепсидин производится печенью и регулирует все аспекты обмена железа — скорость абсорбции железа в желудочно-кишечном тракте, скорость высвобождения железа из клеток ретикулоэндотелиальной системы, в частности макрофагов костного мозга, скорость продукции железосвязывающих белков печенью, экскрецию железа почками. А поскольку для того, чтобы эритроциты были способны производить гемоглобин, макрофаги костного мозга должны их снабдить высвобождаемым из них железом, то гепсидин, тем самым, регулирует и скорость образования гемоглобина. Регулятором для уровня гепсидина является содержание железа в печени и в крови.
Утрата функции эритропоэтинового рецептора или белка JAK2 в мышиных клетках вызывает нарушение эритропоэза, поэтому продукция красных кровяных клеток у эмбриона мыши нарушается и вместе с этим нарушается нормальный рост и развитие эмбриона. И напротив, если отключить механизм отрицательной обратной связи (супрессоры цитокиновых сигналов) и позволить неограниченную продукцию эритропоэтина, это вызывает у мышей гигантизм (развитие необычно крупных мышек). Нарушения в экспрессии гепсидина в ту или другую сторону приводят к мышкам с врождённой тяжёлой железодефицитной анемией или, наоборот, с гемосидерозом (болезнью накопления железа)[6][7].
См. также[править | править код]
- Анемия: состояние, характеризующееся аномально низким уровнем функционально активного (способного транспортировать кислород) гемоглобина в крови;
- Истинная полицитемия: состояние, характеризующееся аномально высоким содержанием эритроцитов и гемоглобина в крови.
Примечания[править | править код]
- ↑
Le, Tao; Bhushan, Vikas; Vasan, Neil. (неопр.). — USA: The McGraw-Hill Companies, Inc., 2010. — С. 123. — ISBN 978-0-07-163340-6. - ↑ 1 2 3 Sherwood, L, Klansman, H, Yancey, P: Animal Physiology, Brooks/Cole, Cengage Learning, 2005
- ↑ Palis J., Segel G. B. Developmental biology of erythropoiesis (англ.) // Blood Rev. (англ.)русск. : journal. — 1998. — June (vol. 12, no. 2). — P. 106—114. — doi:10.1016/S0268-960X(98)90022-4. — PMID 9661799.
- ↑
Le, Tao; Bhushan, Vikas; Vasan, Neil. First Aid for the USMLE Step 1: 2010 20th Anniversary Edition (англ.). — USA: S&P Global, 2010. — P. 124. — ISBN 978-0-07-163340-6. - ↑ Textbook of Physiology by Dr. A. K. Jain reprint 2006—2007 3rd edition
- ↑ Nicolas G., Bennoun M., Porteu A., Mativet S., Beaumont C., Grandchamp B., Sirito M., Sawadogo M., Kahn A., Vaulont S. Severe iron deficiency anemia in transgenic mice expressing liver hepcidin (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2002. — April (vol. 99, no. 7). — P. 4596—4601. — doi:10.1073/pnas.072632499. — PMID 11930010.
- ↑ Michael Föller, Stephan M. Huber , Florian Lang. Erythrocyte programmed cell death (неопр.) // IUBMB Life. — 2008. — August (т. 60, № 10). — С. 661—668. — doi:10.1002/iub.106. — PMID 18720418. (недоступная ссылка)
Ссылки[править | править код]
- Microscopic Hematology
- More information on erythropoiesis
Источник
Количество образующихся форменных элементов крови точно соответствует количеству рузрушающихся. Этот баланс регулируется нервными и гуморальными механизмами. Симпатическая иннервация стимулирует кроветворение, а парасимпатическая – тормозит.
Органы кровотворения содержат большое количество рецепторов, раздражение которых вызывает различные реакции.
Образование красных кровяных телец в костном мозгу называется эритропоэзом, который регулируется гуморальными факторами. Так гормоны передней доли гипофиза (СТГ, АКТГ), коры надпочечников, щитовидной железы, андрогены стимулируют, а эстрогены тормозят эритропоэз.
Нервные и эндокринные воздействия важны для кроветворения, но они действуют не прямо, а за счет специфических посредников – гемопоэтинов. Среди них различают эритро-, лейко-, тромбопоэтины.
Эритропоэтины являются специфическими регуляторами эритропоэза. Они образуются в почках и представляют собой предшественника (эритрогенин) — гликопротеина с небольшой молекулярной массой , который становится активным после образования комплекса с альфа-глобулинами плазмы.
Действуя на костный мозг, эритропоэтины стимулируют дифференциацию стволовых клеток в сторону эритробластического ряда, ускоряя деление и созревание номобластов.
Количество эритропоэтинов резко возрастает при гипоксии различного происхождения (при кровопотере,массивном гемолизе эритроцитов, продолжительном пребывании на высокогорье и т.д.)
Образование эритроцитов зависит от достаточного поступления железа и белков, необходимых для синтеза гемоглобина, а также других веществ (например витаминов группы В и особенно В-12). Недостаток этих веществ может приводить к снижению (анемия) или увеличению (полицитемия) количества эритроцитов.
Полицитемия (болезнь Вакеза-Ослера)
Хроническое заболевание, характеризующееся стойким абсолютным увеличением числа эритроцитов и общего объема крови, с расширением кровеносного русла, увеличением селезенки и повышенной активностью костного мозга, которая касается не только эритропоэза, но и лейко- и тромбопоэза. Тюрк обратив на это внимание назвал болезнь эритремией.
Полицитемию следует отличатьот полиглобулии или эритроцитозов, которые также характеризуются увеличением количества эритроцитов в единице объма крови.
Различают:
Ложную полиглобулию (эритроцитоз) возникающую в результате уменьшения жидкой части крови (усиленное потоотделение, обильный диурез, длительный понос, рвота, наростании отеков и др.) Подобная полиглобулия исчезает при устранении причины, вызвавший сгущение крови.
Истенная, или симптоматическая полиглобулия может быть:
Относительной,когда количество эритроцитов увеличивается за счет их перераспределения (выхождение депонированной крови)
Абсолютнойв связи с длительным гипоксическим состоянием (жители высокогорья, при врожденных и приобретенных пороках сердца,пневмосклерозе, эмфиземе и других заболеваниях легких)..Полицитемия развивается в пожилом возрасте, с хроническим течением и поражением ЦНСп очти 15% больныхпогибают из-за тромбоза мозговых сосудов вызванных повышением вязкости крови, переполнением кровью сосудов, хроническим диссеминированным внутрисосудистым свертыванием. Кровоизлияние может быть обусловлено нарушением функциональных свойств тромбопластина и тромбоцитов, а также тромбообразования.
При полицитемии тромбозы возникают в мозговых артериях, венах и венозных синусах. Кровоизлияния могут быть внутримозговые, эпидуральные, субдуральные и субарахноидальные. Для полушарныхинсультов характерно острое развитие гемипареза, гемианестезии, гемианопсии(выпадение полей зрения), для стволовых инсультов – бульбарных расстроиств или комы.
В качестве редких осложнений полицитемии известны хорея, периферическая невропатия, спинальный инсульт.
АНЕМИИ
Анемии это состояния, характеризующиеся уменьшением количества эритроцитов, или гемоглобина, или эритроцитов и гемоглобина в единице объема крови.
Классификация анемий:
1. При сравнительной оценке снижения количества эритроцитов и количества Hb основным тестом является цветовой показатель (ЦП) — среднее содержание Hb в одном эритроците. По этому признаку различают следующие виды анемий:
а) Нормохромная — с нормальным (0.9-1.0) цветовым показателем. Этот вариант анемии свидетельствует о пропорциональном, равномерном снижении Hb и эритроцитов в единице объема крови.
б) Гипохромная — со снижением (менее 0.9) ЦП. Этот вид анемии свидетельствует о том, что количество Hb снижено в большей степени, чем эритроцитов
в) Гиперхромная — с повышением (более 1.0) ЦП. Этот вид анемии встречается в тех случаях, когда общее количество эритроцитов снижено в большей степени, чем общее количество Hb или в крови присутствуют клетки эмбрионального типа кровотворения (мегалоциты).
2. По регенераторной способности костного мозга:
а) регенераторные;
б) гиперрегенераторные;
в) гипорегенераторные;
г) арегенераторные.
3. По размеру эритроцитов:
а) нормоцитарные;
б) макроцитарные;
в) микроцитарные.
4. По типу кроветворения:
а) нормобластическая — с эритробластическим типом кроветворения,
б) мегалобластическая — с мегалобластическим типом кроветворения,
5. По этиологии:
а) постгеморрагические — вследствии кровопотерь,
б) гемолитические — вследствии повышенного кроворазрушения,
в)вследствии нарушения кровообразования — B12-дефицитная и фолиеводефицитная анемии, железодефицитная анемия и др.
Постгеморрагические анемии могут быть острыми и хроническими.
Острая постгеморрагическая анемия возникает после одномоментной, быстрой массивной кровопотери. Такая ситуация возникает при ранении крупных сосудов, кровотечениях из внутренних органов и выделяют следующие стадии:
В первые часы после острой кровопотери наблюдается относительно равномерное уменьшение количества эритроцитов и Hb, цветовой показатель (ЦП) в пределах нормы (нормохромная анемия).
На 2-3 сутки количество эритроцитов уменьшается за счет поступления тканевой жидкости в сосуды ( относительная эритропения) и разрушения эритроцитов в клетках системы мононуклеарных фагоцитов (абсолютная эритропения).
На 4-5 день усиливается эритропоэз за счет выработки эритропоэтина. В периферической крови увеличивается количество полихроматофильных эритроцитов (ретикулоцитов), появляются нормобласты (регенераторня анемия), ЦП снижается (гипохромная анемия), т.к. ускореннная регенерация опережает созревание клеток, которые не успевают потерять признаки своей незрелости (ядро, гранулы) и насытиться Hb. Острая кровопотеря приведет к дефициту железа и снижению синтеза гема.
Хронические постгеморрагические анемии возникают при небольших по объему, но частых и длительных кровотечениях (при язвенной болезни желудка, геморрое, гиперполименорее и т.д.), при нарушении гемостаза (геморрагический диатез). К этой категории анемии относится также анкилостомная анемия, развивающаяся при инвазии паразитами из класса нематод. Паразит прикрепляется к стенке тонкой кишки и питается кровью хозяина. Это вызывает травматизацию кишечной стенки и кровотечение.
Основным гематологическим признаком хронической постгемаррогической анемии является выраженная гипохромия эритроцитов, которая свидетельствует о резком снижениии синтеза Hb из-за дефицита железа. Хронические потери крови приводят к истощению депо железа, поэтому хронические постгемаррогические анемии всегда железодефицитные. Для такой анемии характерен микроцитоз. При угнетени кроветворения эта анемия может быть гипо — и арегенераторной.
Гемолитические анемии — характеризуются преобладанием процессов разрушения эритроцитов над процессом их образования. Усиление распада эритроцитов может быть обусловлено:
приобретенными или наследственными изменениями метаболизма и структуры мембраны, стромы эритроцитов или молекул Hb;
повреждающим действием физических, химическхе, биологических гемолитических факторов на мембрану эритроцитов;
замедлением движения эритроцитов в межсинусовых пространствах селезенки, что способствует их разрушению макрофагоцитами;
усилением активности макрофагоцитов.
● Наследственные гемолитические анемии:
1. Эритроцитопатии:
a) нарушение структуры оболочки с изменением формы (наследственный микросфероцитоз или анемия.Минковского-Шоффара, наследственный овалоцитоз);
б) энзимопатии – дефицит ферментов пентозофосфатного цикла, гликолиза и др. (глюкозо-6-фосфат-дегидрогеназы).
2. Гемоглобинопатии:
а) наследственный дефект синтеза цепей глобина (d- и b-талассемия);
б) наследственный дефект первичной структуры глобина (серповидноклеточная анемия).
● Приобретенные гемолитические анемии:
а) токсическая (гемолитические яды: соединения мышьяка, свинца; токсины возбудителей инфекций: гемолитический стрептококк, анаэробный малярийный плазмодий);
б) имунная (переливание несовместимой крови, Rh-несовместимость матери и плода; образование аутоантител против собственных эритроцитов при изменении их антигенных свойств под влиянием лекарств, вирусов);
в) механическая (механическое повреждение эритроцитов при протезировании сосудов, клапанов);
г) приобретенная мембранопатия (соматическая мутация под действием вирусов, лекарств с образованием патологической популяции эритроцитов, у которых нарушена структура мембраны).
При наследственных гемолитических анемиях.отмечается усиленная регенерация эритроидного ростка, но эритропоэз часто может быть не эффективным (когда в костном мозге разрушаются ядерные формы эритроцитов). В мазке крови, наряду с регенеративными формами (высокий ретикулоцитоз, полихроматофилия, единичные ядерные формы эритроцитов),находится дегенеративно измененные клетки (например, микросфероциты при болезни Минковского-Шоффара).
При приобретенных гемолитических анемиях. степень уменьшения количества эритроцитов и гемоглобина зависит от интенсивности гемолиза. В мазках крови обнаруживают клетки физиологической регенерации и дегенеративно измененные эритроциты (пойкилоцитоз, анизоцитоз).
Приобретенная гемолитическая анемия может быть по типу кроветворения нормобластической, по регенераторной способности костного мозга — регенераторный, по ЦП — нормо — или гипохромной.
Источник
