Синдромы множественных врожденных пороков развития

О множественных врожденных пороках развития (МВПР) говорят тогда, когда отмечается нарушение структуры и функционирования минимум двух органов или систем. Обычно такие изменения сильно отражаются на жизнедеятельности, нередко становятся причиной внутриутробной гибели плода или неонатальной смерти. Некоторые множественные врожденные пороки развития (МВПР) не сокращают продолжительность жизни, но снижают ее качество, требуют постоянного контроля со стороны специалистов или определенных условий содержания.
Причины множественных врожденных пороков развития
Все этиологические факторы МВПР можно разделить на две группы:
- эндогенные — включают в себя генные, геномные и хромосомные мутации, заболевания эндокринной системы, метаболические нарушения, возраст родителей;
- экзогенные — физические (травмы), химические (лекарственные препараты, промышленная и бытовая химия) и биологические (вирусы, бактерии) агенты.
Эти причины приводят к хромосомным, генным и геномным нарушениям, влияют на процессы клеточного и тканевого развития. Большое число множественных врожденных пороков (МВПР) отличаются типом наследования, патогенезом, клиническими проявлениями, прогнозом для пациента.
Примеры множественных врожденных пороков развития (МВПР)
- Синдром Дауна. Развивается в результате трисомии по 21-й хромосоме. Пациенты имеют характерные черты лица, страдают задержкой умственного и речевого развития, у них нередко выявляется мышечная гипотония, катаракта, пороки сердца. Средняя продолжительность жизни составляет около 50 лет.
- Синдром Эдвардса. Данная разновидность множественных врожденных пороков развития (МВПР) обусловлена трисомией по 18-й хромосоме. У пациентов выявляется нарушение строения черепа, отсутствие или сужение слухового прохода, широкая грудная клетка, пороки сердечно-сосудистой системы, гипоплазия мозжечка, слабый тонус мускулатуры, судороги, тяжелая умственная отсталость. Характеризуется высокой летальностью.
- Синдром Марфана. Возникает при мутации в гене, который кодирует образование фибриллина. Данное соединение входит в состав практически всех эластичных волокон, поэтому у пациентов отмечается патология опорно-двигательного аппарата, органов зрения, сосудов. При регулярном и правильном лечении продолжительность жизни не снижается.
Другие виды множественных врожденных пороков развития (МВПР) оказывают существенное влияние на жизнедеятельность человека. При этом лечение возможно только симптоматическое, так как изменить дефекты в генах или хромосомах невозможно.
Методы диагностики
Диагностика множественных врожденных пороков развития (МВПР) может осуществляться дородовыми и послеродовыми способами. В первом случае проводятся скрининговые исследования, которые включают в себя УЗИ плода и анализ крови на специфические белки. Такое сочетание позволяет выявить большое количество множественных врожденных пороков развития (МВПР). Врач также может назначать дополнительные методы диагностики: биопсию ворсин хориона и амниоцентез. В этом случае получают не кровь матери, а материал плода, который затем отправляют на генетическое исследование.
Послеродовые методики также подразумевают генетические тесты, которые позволяют выявлять мутации в генах или определять кариотип. Пройти такое исследование можно в медико-генетическом центре «Геномед».
Источник
Полувековой практикой клинической генетики и цитогенетики доказано, что для большинства хромосомных болезней, обусловленных численными или структурными аномалиями хромосом, характерны множественные врожденные пороки развития (МВПР). Если среди всех врожденных пороков на долю хромосомного дисбаланса приходится около 6 % [534], то среди МВПР удельный вес хромосомных болезней может достигать 51 % [181]. Именно поэтому цитогенетические исследования являются ведущими при выяснении причин МВПР.
Между тем МВПР могут быть следствием не только хромосомных, но и генных мутаций, а также результатом воздействия различных тератогенов, либо сочетанным эффектом этих факторов. Общепринятой классификации нехромосомных синдромов МВПР не существует, и при их описании используются различные подходы. Отечественные синдромологи выделяют несколько групп нехромосомных МВПР [28, 97].
- Моногенные синдромы — многочисленная группа (40 % от всех нехромосомных синдромов), представленная как доминантными, так и аутосомно-рецессивными формами, в том числе Х-сцепленными.
- Синдромы с неуточненным типом наследования, к которым могут относиться и мультифакториальные болезни с полигенным наследственным компонентом.
- Синдромы, вызванные действием внешних факторов. Так, около 5 % МВПР обусловлено внутриутробными инфекциями и заболеваниями матери [534].
- Неклассифицированные комплексы МВПР (сочетание пороков, не выделенных в синдромы), которые представляют отдельную группу нехромосомных синдромов.
Если при хромосомных синдромах для диагностики достаточно анализа кариотипа, то цитогенетические исследования при других формах МВПР лишь отвергают хромосомную природу данного комплекса пороков развития, но не позволяют точно установить диагноз. Что касается диагностики нехромосомных синдромов, то за последние десятилетия на биологических моделях лабораторных животных достигнут значительный прогресс в понимании структуры и функций генов, ответственных за изолированные пороки у человека [894]. Определенные надежды вселяют успехи в изучении на экспериментальных объектах семейств генов SOX, HOX, PAX, которые принимают участие в регуляции раннего эмбрионального развития у млекопитающих (см. главу 11).
Как известно, большинство врожденных пороков развития, в том числе и МВПР, являются следствием новых мутаций. Так, с мутациями de novo связано более 90 % случаев хромосомных синдромов и свыше 80 % синдромов с аутосомно-доминантным типом наследования [31]. При этом фенотипическая гетерогенность характерна для всех МВПР, независимо от их этиологической причины.
Следует иметь в виду, что в клинической генетике врачам приходится иметь дело с уже сформировавшимися пороками и синдромами, то есть с конечными фенотипическими эффектами геномных, хромосомных и генных мутаций. Естественно ожидать, что более полная информация о контроле процессов онтогенеза может быть получена при исследовании особенностей фенотипического проявления мутаций на более ранних стадиях развития человека, то есть еще до рождения.
Цитогенетические исследования в эмбриогенезе представляют большой интерес еще и потому, что многие хромосомные нарушения у человека, летальные на ранних стадиях, уже не встречаются в более поздние сроки и у новорожденных (см. главу 5). Предполагалось, что сравнительные цитогенетические и патоморфологические исследования позволят выяснить роль хромосомного дисбаланса не только в эмбриональной гибели, но и в формировании врожденных пороков развития, как совместимых, так и несовместимых с жизнью.
70-е годы ХХ века были ознаменованы крупномасштабными исследованиями спонтанных абортусов человека. Патоморфологическому описанию были подвергнуты тысячи эмбрионов и зародышевых оболочек, у которых были выявлены практически все типы геномных мутаций и многие структурные хромосомные аберрации. Так, было показано, что хромосомный дисбаланс приводит к различным по характеру и выраженности патологическим изменениям — бласто-, эмбрио- и фетопатиям, которые проявляются на клеточном, тканевом и органи- зменном уровнях [77, 91, 93]. Эти исследования сыграли важную роль в понимании специфичности и неспецифичности пороков развития, в формировании представлений о клеточном синдроме как патоморфологической основе хромосомных болезней [46, 47, 93, 96].
Вместе с тем, уже первые исследования спонтанных абортов обнаружили безусловную ограниченность такого подхода, связанную с особенностями исследуемого материала. Главная трудность заключалась в дифференциации первичных нарушений морфогенеза от вторичных, посмертных изменений. Между тем такая дифференциация имеет принципиальное значение при определении стадии, на которой прекратилось развитие, и тех изменений, которые привели к этой остановке [47]. Аутолиз тканей абортусов создает также определенные трудности при культивировании клеток, полученных из абортивного материала [93]. Успешное кариотипирование обычными методами возможно только у 46 % спонтанных абортусов. Установить кариотип у остальных можно только на интерфазных клетках с использованием молекулярно-цитогенетических методов анализа [100]. Естественно, что по своей точности «интерфазная» цитогенетика значительно уступает стандартному метафазному анализу.
Реальные возможности прижизненного изучения эмбрионов человека с хромосомными аберрациями появились только с разработкой методов исследования плода с помощью ультразвукового сканирования в сочетании с их кариотипированием на образцах материала, полученных на разных стадиях внутриутробного развития.
За последнее десятилетие ультразвуковые исследования стали неотъемлемой частью обследования плода. Ультразвуковая диагностика применяется как в качестве рутинного клинического метода определения сроков беременности и жизнеспособности плода, так и для выявления различных аномалий развития. Следует отметить, что изначально УЗИ с целью выявления пороков развития у плода применяли, главным образом, во II триместре беременности [879].
В настоящее время разрешающая способность ультразвуковых приборов и большой опыт многих тысяч УЗ-исследований позволяет подробно анализировать фенотипические особенности плода и в I триместре беременности [152, 178].
Такие исследования очень быстро привели к формированию представлений об ультразвуковых маркерах хромосомных болезней (sonogram indicators). Термин УЗ-маркеры используется для обозначения отклонений биометрических параметров и анатомических структур, позволяющих предполагать наличие хромосомной болезни у плода [749]. Изначально к таким ультразвуковым маркерам (УЗМ) относили синдром ВЗРП, некоторые аномалии скелета и лицевого черепа. По мере накопления знаний и совершенствования техники число УЗМ, рекомендуемых для скрининговых УЗИ, постоянно пополняется. При этом прогностическая значимость для диагностики хромосомной патологии у плода каждого из УЗМ различна и зависит от срока беременности. Однако, если спектр выявляемых аномалий во втором триместре достаточно велик, то основными УЗМ хромосомных болезней у плода с 10-й по 14-ю недели беременности являются толщина воротникового пространства (ТВП) и состояние оссификации носовых костей, толщина и число сосудов пуповины, размеры нижней челюсти. Увеличение ТВП является ультразвуковым маркером не только хромосомных болезней, но и таких достаточно частых аномалий как пороки сердца и магистральных сосудов, лимфатической и мочевыделительной систем и некоторых других [133, 152].
Дальнейшее совершенствование УЗ-техники (цветное сканирование, допплерометрия, трехмерное изображение и пр.) значительно увеличивает возможности детального прижизненного анализа анатомии плода практически на любой стадии развития и даже позволяет получить ценную информацию о состоянии и функциях некоторых органов и систем плода в развитии. Не случайно на сегодняшний день именно ультразвуковое исследование является наиболее эффективным методом изучения фенотипа плода в норме и при патологии.
Вполне закономерна, хотя реально весьма уязвима, наметившаяся в последние годы тенденция постановки диагноза конкретного наследственного синдрома исключительно по результатам УЗИ [40, 152, 178]. Действительно, некоторые пороки развития органов и систем и/или транзиторные состояния, не соответствующие сроку развития, чаще встречаются у плодов с определенными хромосомными болезнями. Однако строгой специфичности УЗМ по отношению к хромосомной патологии у плода вообще и, тем более, патогномоничных для определенных хромосомных синдромов не выявлено. Синдромологический подход в УЗ-диагностике, равно как и в клинической генетике и патологической анатомии, позволяет зарегистрировать аномалию развития, в первую очередь — изолированные и множественные пороки, и с той или иной вероятностью заподозрить наличие хромосомной патологии. Очевидно, что постановка диагноза хромосомной патологии у плода реально возможна только путем его кариотипирования. Кроме того, следует учитывать, что у многих плодов с хромосомным дисбалансом пороки развития отсутствуют, а фенотипические признаки столь невыразительны, что вполне могут оказаться не зарегистрированными в качестве УЗМ. Наконец, разграничение эхографических признаков на ВПР и УЗМ хромосомных болезней, учитывая транзиторный характер не только многих УЗМ, но и некоторых пороков развития, коррекция которых осуществляется за счет компенсаторных механизмов в процессе дальнейшего внутриутробного развития, также неубедительно. На наш взгляд, термин УЗМ хромосомных болезней может быть использован применительно к любым отклонениям в развитии, в том числе и порокам, независимо от степени их тяжести. Исключениями из этого правила являются лишь некоторые, в основном, изолированные пороки развития (например, анэнцефалия или дефекты заращения нервной трубки), при которых хромосомные нарушения у плода являются случайными находками. Это утверждение отнюдь не противоречит факту существования пороков развития, включая МВПР, хромосомной и генной этиологии. Анализ мутаций в генах-регуляторах эмбрионального развития, роль которых в возникновении ВПР доказана на модельных объектах, обсуждается в качестве перспективного направления профилактики врожденной и наследственной патологии (см. главы 9 и 11). Следовательно, кариотипирование является способом дифференциальной диагностики хромосомных и нехромосомных ВПР.
Таким образом, существующие представления об аномалиях эмбрионального развития плодов с хромосомным дисбалансом основаны на информации, полученной преимущественно при изучении спонтанных абортусов или новорожденных с МВПР Инвазивные методы позволяют провести пренатальное кариотипирование практически на любом сроке беременности (см. главу 9). При помощи УЗ-сканирования, ставшего неотъемлемой частью комплексных исследований состояния плода человека в рамках пренатальной диагностики, могут быть получены сведения об анатомических и функциональных особенностях развивающегося плода. Прижизненные особенности развития, дополненные патоморфологическими исследованиями абортного материала, который не подвергся аутолизу, помогают воссоздать картину фенотипического проявления хромосомного дисбаланса на разных сроках развития. Между тем, данные УЗ- и патоморфологического исследований, как правило, разрозненны, нередко противоречивы. Учитывая эти обстоятельства, очевидно, что полная информация может быть получена при тесном союзе специалистов по клинической генетике, ультразвуковой диагностике, патологической анатомии и физиологии. Возможно, такой альянс окажется продуктивным для решения целого ряда актуальных задач генетики развития. Так, до сих пор дискуссионным остается патогенез многих ВПР, не изучена динамика их формирования. Неясными остаются генез сочетанных пороков при возникновении достаточно устойчивых комплексов МВПР, их роль в реализации хромосомных эмбриолета- лей, в том числе крайне низкой жизнеспособности плодов с полным или мозаичным вариантом синдрома Шерешевского-Тернера и т. д.
Следует отметить, что такой комплексный анализ, включающий прижизненное фенотипирование плодов с хромосомными аномалиями, позволяет получить новую информацию, важную как для фундаментальной науки, так и для практической медицины. С одной стороны, выяснение взаимосвязи между дисбалансом отдельных хромосом или их сегментов и отклонениями в развитии плода способствует пониманию роли структурных и регуляторных генов в процессах раннего онтогенеза человека. С другой — выявление пороков или УЗМ у плода после кариотипирования позволяет оценить информативность изолированных и сочетанных УЗМ в качестве маркеров хромосомной патологии, что способствует повышению эффективности пренатальной диагностики.
Рассмотрение принципов патоморфологического анализа с целью точной диагностики ВПР выходит за рамки настоящей главы. Мы не касаемся также возможностей и эффективности ультразвуковой диагностики, подробно рассмотренных в специальной литературе [40, 133,152, 153, 178]. Отметим, однако, что не только срок беременности и уровень УЗ-обследования, но и квалификация врача УЗД существенно влияют на частоту и характер выявленных фенотипических признаков (маркеров), а знание эмбриологии человека и основ медицинской генетики — на своевременность и эффективность инвазивной пренатальной диагностики хромосомных болезней, более детально рассмотренной в главе 9.
Источник
Врожденные пороки развития
Классификация ВПР (ВПР чрезвычайно разнообразны, несколько тысяч нозологических единиц):
По этиологии:
А) наследственные – ВПР в результате мутаций: гаметические и зиготические, генные и хромосомные
Б) экзогенные – ВПР, обусловленные повреждением тератогенными факторами непосредственно эмбриона или плода
В) мультифакториальные – ВПР от совместного действия генетических и экзогенных факторов.
По последовательности возникновения:
А) первичные – вследствие непосредственного воздействия тератогенного фактора (ТФ)Б) вторичные – осложнения первичных пороков {гидроцефалия вследствии атрезии водопровода мозга}
В) аномалады – комплексы, включающие первичный и несколько вторичных пороков.
По уровню, на котором возник ВПР:
А) гаметопатии – пороки, обусловленные поражениями половых клеток
Гаметопатии — наследственно обусловленные пороки развития, в основе которых лежат мутации в половых клетках родителей. Следовательно, все пороки развития наследственной природы — следствие гаметопатий. Они могут быть причиной гибели зародыша (летальные мутации), самопроизвольных выкидышей в ранние сроки беременности, грубых ВПР, сопровождающихся значительным нарушением функций, хромосомных синдромов.
Б) бластопатии – пороки, возникающие в первые 15 дней после оплодотворения
Бластопатии — пороки развития, индуцированные воздействием повреждающих факторов на зародыш в первые 15 суток после оплодотворения. Чаще всего они служат причиной самопроизвольных выкидышей, могут проявляться внематочной беременностью. Следствием бластопатий являются такие пороки, как сросшаяся двойня, циклопия.
В) эмбриопатии – повреждения эмбриона от 16 дня беременности до конца 8-й недели
Эмбриопатии — врожденные пороки развития, индуцированные воздействием повреждающих факторов на эмбрион (с 16–го дня после оплодотворения до конца 8–й недели). Формирование внутренних органов может быть нарушено различными тератогенами (алкоголь, наркотики, лекарственные средства, сахарный диабет у матери, внутриутробные инфекции и др.). Эмбриопатии могут быть причиной гибели зародыша и самопроизвольных выкидышей. Классический пример данной патологии — алкогольная эмбриопатия, известная под названием «алкогольный синдром плода». Она проявляется врожденными пороками развития многих органов и систем.
Г) фетопатии – пороки вследствие поражения плода с 9-й недели до рождения.
Фетопатии — все виды патологии, обусловленные воздействием повреждающих факторов на плод (с 9–й недели внутриутробного развития до родов). Пороки развития этой группы относительно редки, так как закладка и формирование внутренних органов и внешних частей тела зародыша уже произошли. Но процесс роста и развития их продолжается. Под влиянием неблагоприятных факторов возможны уменьшение массы и/или размеров органов (гипоплазия), их недоразвитие. Примером фетопатий является крипторхизм – неопущение яичек.
По распространенности в организме:
А) изолированные (одиночные, локальные) – локализованные в одном органе
Б) системные – ВПР в пределах одной системы органов {хондродисплазия}
В) множественные
В зависимости от органа (системы) с ВПР:
1. ВПР ЦНС и органов чувств
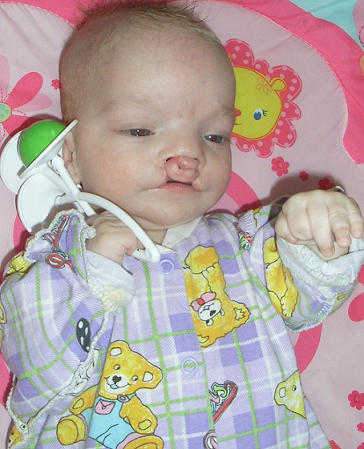
2. ВПР лица и шеи
3. ВПР сердечно сосудистой системы
4. ВПР дыхательной системы
5. ВПР органов пищеварения
6. ВПР костно — мышечной системы
7. ВПР мочевой системы
8. ВПР половых органов
9. ВПР эндокринных желез
10. ВПР кожи и придатков
11. ВПР последа
12. Прочие
Множественные врожденные пороки развития (МВПР) – наличие пороков развития в органах двух и более систем:
1. Синдромы МВПР:
а) хромосомные
б) менделирующие (генные)
в) формального генеза
г) экзогеннные
Неклассифицированные (неуточненные) комплексы – уникальные сочетания ВПР, не выделенные в синдромы МВПР.
Синдром МВПР – зафиксированные у нескольких больных устойчивые сочетания двух и более первичных (т. е. не индуцируемых друг другом) пороков органов разных систем: Хромосомные синдромы – МВПР в результате изменения количества и структуры хромосом:
а) синдром Дауна (трисомия 21): брахицефалия, монголоидный разрез глаз, эпикант, плоская спинка носа, деформированные ушные раковины, короткие широкие кисти, куриная грудь, пятна Брушвильда (жемчужные пятна на границе наружной и средней трети радужки), ВПР сердца, сосудов и т. д.
б) синдром Патау (трисомия 13): низко расположенные деформированные ушные раковины, хейлосхиз, палатосхиз, микрогения, полидактилия кистей и/или стоп, ВПР внутренних органовв) Синдром Эдвардса (трисомия 18): пренатальная гипоплазия, долихоцефалия с западением лобных костей в области родничка, флексорная положение кистей, палатосхиз, ВПР внутренних органовг) синдром «кошачьего крика» (5p-): микроцефалия, гипертелоризм, микрогения, эпикант, лунообразное лицо, пороки гортани.
Менделирующие (моногенные) синдромы – МВПР в результате изменения структуры гена:
а) синдром Марфана (аутосомно-доминантное наследование): высокий рост; длинные, тонкие дистальные отделы конечностей; привычные вывихи бедра, надколенника, ключицы; аномалии глаз; ВПР сердца и сосудов, недостаточность митрального клапана
б) синдром Блума (аутосомно-рецессивное наследование) – врожденная телеангиэктатическая эритема с задержкой роста; низкий рост, узкое лицо, массивный нос, телеангиэктатическая эритема в виде бабочки.
Синдромы формального генеза – синдромы неустановленной этиологии и неуточненного типа наследования (Видемана-Беквита, Гольденхара, де Ланге).
Экзогенные синдромы – обусловленные действие тератогенов (диабетическая эмбрио — и фетопатия, алкогольный).
Источник
