Синдрома пустого сердца что это такое
Иное название этого понятия — «Синдром разбитого сердца»; о значениях «Разбитое сердце» см. Разбитое сердце (значения).
Японские ловушки осьминогов, в честь которых названо заболевание.
Кардиомиопа́тия такоцу́бо (от яп. 蛸壺, такоцубо — ловушка для осьминога), транзито́рное шарообра́зное расшире́ние верху́шки ле́вого желу́дочка[2], стре́ссовая кардиомиопа́тия — вид неишемической кардиомиопатии, при котором развивается внезапное преходящее снижение сократимости миокарда (сердечной мышцы). В связи с тем, что слабость миокарда может вызываться эмоциональным стрессом, например, смертью любимого человека, состояние также называется «синдромом разбитого сердца»[3].
Общая информация[править | править код]
Стрессовая кардиомиопатия — хорошо распознаваемая причина острой сердечной недостаточности, летальных желудочковых аритмий и разрыва стенки желудочка.[4] В типичных случаях кардиомиопатия такоцубо проявляется внезапным развитием сердечной недостаточности или болей в груди, сочетающихся с изменениями на ЭКГ, характерными для переднего инфаркта миокарда.
В ходе наблюдения за пациентами, часто отмечается выбухание верхушки левого желудочка с гиперкинезом его основания. Картина выбухания верхушки сердца, сочетающегося с сохранённой функцией его основания, дала синдрому японское название тако цубо («ловушка осьминога»).[5]
В качестве причины рассматривается повышение содержания в крови катехоламинов (преимущественно адреналина). В план обследования пациентов включается коронарография, при которой не выявляется гемодинамически значимых стенозов, способных привести к левожелудочковой дисфункции. При благоприятном исходе начального приступа функция левого желудочка восстанавливается в течение 2 месяцев. Обычно кардиомиопатия такоцубо наблюдается у женщин в постменопаузе. [6] Часто в анамнезе больных отмечается недавний тяжёлый эмоциональный или физический стресс.[6]
Этиология[править | править код]
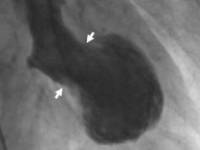
Вентрикулограмма левого желудочка во время систолы, демонстрирующая характерное шарообразное расширение и неподвижность верхушки сердца у пациента с кардиомиопатией такоцубо.
Этиология кардиомиопатии такоцубо ясна не полностью, однако предполагается несколько механизмов.
- Заворачивающаяся левая передняя нисходящая артерия (англ. wraparound LAD). Левая передняя нисходящая артерия кровоснабжает переднюю стенку левого желудочка у большинства пациентов. Если эта артерия заворачивается вокруг верхушки сердца, она может отвечать также за кровоснабжение верхушки и нижней стенки сердца. Некоторые исследователи отмечали корреляцию между кардиомиопатией такоцубо и этим типом левой передней нисходящей артерии.[7] Вместе с тем, другие исследователи показали, что этот анатомический вариант недостаточно типичен для объяснения причины кардиомиопатии такоцубо.[8] Эта теория также не объясняет встречающиеся случаи акинеза межжелудочковой перегородки и основания сердца.
- Транзиторный вазоспазм. Некоторые первые исследователи кардиомиопатии такоцубо предполагали, что множественные одновременные спазмы коронарных артерий способны вызывать снижение кровотока, достаточное для развития преходящего сбоя в работе миокарда.[9] Другие исследования показали, что вазоспазм значительно менее распространён, чем считалось первоначально.[10][11][12] Также было отмечено, что вазоспазмы, даже многих артерий, не коррелировали по расположению с зонами гипокинеза миокарда.[13]
- Микрососудистая дисфункция. Эта теория предполагает, что развивается дисфункция мелких ветвей коронарных артерий, которые невозможно визуализировать посредством коронарографии. Изменения могут проявляться как микрососудистым вазоспазмом, так, возможно, и микроангиопатией, подобной наблюдаемой при сахарном диабете. В этих условиях мелкие артерии неспособны обеспечивать адекватную оксигенацию миокарда.
Вероятно, в развитии стрессовой кардиомиопатии имеют значение многие факторы — вазоспазм, недостаточность микроциркуляции и патологический катехоламиновый ответ.[14] При наблюдении больших групп пациентов указывается, что у некоторых из них кардиомиопатия такоцубо развивалась после эмоционального стресса или, в иных случаях, после предшествующего физического стресса (астматического статуса или внезапного заболевания).
Примерно у одной трети пациентов стрессовый фактор отсутствовал.[15] Наблюдение больших групп пациентов в Европе показало, что кардиомиопатия такоцубо имеет несколько бо́льшую частоту встречаемости в зимнее время. Это может быть обусловлено двумя возможными патофизиологическими причинами: спазмом мелких ветвей коронарных артерий, преобладающим в холодную погоду, и вирусными инфекциями, например Parvovirus B19, которые чаще наблюдаются в зимний сезон.[16]
Диагностика[править | править код]
(A) Эхокардиограмма, демонстрирующая дилятацию левого желудочка в острую стадию. (B) Восстановление функции левого желудочка при повторной эхокардиографии через 6 дней.
Кардиомиопатия такоцубо обнаруживалась у 1,7—2,2 % пациентов с острым коронарным синдромом.[16] Хотя первые случаи описаны у пациентов в Японии, кардиомиопатия такоцубо в последнее время отмечалась и у пациентов в США и Западной Европе. Вероятно, синдром не диагностировался до тех пор, пока не был детально описан в японской литературе.
Диагностика кардиомиопатии такоцубо может быть затруднена клинической картиной. Изменения на ЭКГ часто ошибочно трактуют как проявления переднего инфаркта миокарда.[6][17] Картина описывается острым началом преходящей дисфункции подвижности верхушки (выбухание) в сочетании с болью в груди, диспноэ, элевацией ST-сегмента, инверсией T-зубца или удлинением QT-интервала на ЭКГ. Подъём ферментов миокарда в худшем случае умеренный; отсутствует выраженная коронарная недостаточность.[16]
Диагноз устанавливается на основании патогномоничных изменений подвижности сердечной стенки — нормального сокращения или гиперкинеза основания левого желудочка в сочетании с акинезом или дискинезом остальных его отделов. Это сопровождается отсутствием признаков выраженной коронарной недостаточности, которая могла бы объяснить указанные нарушения сократимости. Хотя классическое ангиографическое описание кардиомиопатии такоцубо включает шарообразное расширение верхушки, встречаются и другие варианты — выбухание межжелудочковой перегородки или, в более редких случаях, выбухание других сегментов.[16][18][19][20][21]
Паттерны выбухания были классифицированы Симидзу и др. как тип такоцубо с апикальной акинезией и базальной гиперкинезией; обратная такоцубо с базальной акинезией и апикальной гиперкинезией; перегородочный тип с перегородочным выбуханием в сочетании с базальной и апикальной гиперкинезией; локальный тип с выбуханием других сегментов левого желудочка и клинической картиной такоцубоподобной левожелудочковой дисфункции.[19]
Патоморфология[править | править код]
Есть сообщения, что патоморфологические изменения при этом виде кардиомиопатии представлены фокальным миоцитолизом; ассоциированных микробиологических агентов не выявляется. В некоторых случаях обнаруживалась инфильтрация малыми мононуклеарами; эти патологические находки позволяют предположить, что стрессовая кардиомиопатия является вариантом воспалительного заболевания сердца, а не коронарной патологией. Также имеются сообщения о гистологическом повреждении миокарда без ишемической болезни сердца.[22]
Лечение[править | править код]
Терапия кардиомиопатии такоцубо в большинстве случаев поддерживающая. У пациентов с артериальной гипотензией используется поддержка инотропными препаратами или внутриаортальная баллонная контрпульсация. Стандартно назначают ацетилсалициловую кислоту[23], ингибиторы АПФ или антагонисты рецепторов ангиотензина I с целью снижения артериального давления, а также β-адреноблокаторы для контроля ЧСС и нитраты для устранения спазма коронарных артерий.[24] У многих пациентов функция левого желудочка восстанавливается в течение 2 месяцев.[25][26]
Прогноз[править | править код]
Несмотря на грозные исходные клинические проявления у некоторых больных, большинство пациентов переживают начальный приступ с очень низким уровнем больничной летальности или осложнений. После перенесённой острой стадии заболевания пациентов ожидает благоприятный исход с хорошим долгосрочным прогнозом.[5][16][18] Даже при тяжёлой систолической дисфункции в начале заболевания, сократительная способность миокарда начинает восстанавливаться уже в первые несколько суток и нормализуется в течение нескольких месяцев.[16][10][11][12] В 5 % случаев[24] возникает рецидив заболевания, вероятно, провоцируемый ассоциированным пусковым механизмом.[15][16]
См. также[править | править код]
- Разбитое сердце
- Сердечная недостаточность
Примечания[править | править код]
- ↑ Monarch Disease Ontology release 2018-06-29sonu — 2018-06-29 — 2018.
- ↑ Eshtehardi P., Koestner S.C., Adorjan P., Windecker S., Meier B., Hess O.M., Wahl A., Cook S. Transient apical ballooning syndrome—clinical characteristics, ballooning pattern, and long-term follow-up in a Swiss population (англ.) // International Journal of Cardiology (англ.)русск. : journal. — 2009. — July (vol. 135, no. 3). — P. 370—375. — PMID 18599137.
- ↑ Mayo Clinic Research Reveals ‘broken Heart Syndrome’ Recurs In 1 Of 10 Patients
- ↑ Akashi Y.J., Nef H.M., Mollmann, H., Ueyama T. Stress Cardiomyopathy (англ.) // Annual Reviews. — 2010. — Vol. 61. — P. 271—286. — doi:10.1146/annurev.med.041908.191750.
- ↑ 1 2 Gianni, M; Dentali F., Grandi AM et al. Apical ballooning syndrome or takotsubo cardiomyopathy: a systematic review (англ.) // European Heart Journal (англ.)русск. : journal. — Oxford University Press, 2006. — December (vol. 27, no. 13). — P. 1523—1529. — doi:10.1093/eurheartj/ehl032. — PMID 16720686.
- ↑ 1 2 3 Azzarelli S., Galassi A.R., Amico F., Giacoppo M., Argentino V., Tomasello S.D., Tamburino C., Fiscella A. Clinical features of transient left ventricular apical ballooning (англ.) // Am J Cardiol. : journal. — 2006. — Vol. 98, no. 9. — P. 1273—1276. — doi:10.1016/j.amjcard.2006.05.065. — PMID 17056345.
- ↑ Ibáñez B., Navarro F., Farré J., et al. [Tako-tsubo syndrome associated with a long course of the left anterior descending coronary artery along the apical diaphragmatic surface of the left ventricle.] (Spanish; Castilian) // Revista española de cardiología. — 2004. — Т. 57, № 3. — С. 209—216. — doi:10.1016/S1885-5857(06)60138-2. — PMID 15056424.
- ↑ Inoue, M; Shimizu M., Ino H et al. Differentiation between patients with takotsubo cardiomyopathy and those with anterior acute myocardial infarction (англ.) // Circ. J. : journal. — 2005. — Vol. 69, no. 1. — P. 89—94. — doi:10.1253/circj.69.89. — PMID 15635210.
- ↑ Kurisu S., Sato H., Kawagoe T et al. Tako-tsubo-like left ventricular dysfunction with ST-segment elevation: a novel cardiac syndrome mimicking acute myocardial infarction (англ.) // American Heart Journal (англ.)русск. : journal. — 2002. — Vol. 143, no. 3. — P. 448—455. — doi:10.1067/mhj.2002.120403. — PMID 11868050.
- ↑ 1 2 Tsuchuhashi K et al. JACC 2001
- ↑ 1 2 Kawai et al. JPJ 2000
- ↑ 1 2 Desmet et al. Heart 2003
- ↑ Abe et al. JACC 2003
- ↑ Wittstein I.S., Thiemann D.R., Lima J.A., et al. Neurohumoral features of myocardial stunning due to sudden emotional stress (англ.) // The New England Journal of Medicine : journal. — 2005. — February (vol. 352, no. 6). — P. 539—548. — doi:10.1056/NEJMoa043046. — PMID 15703419.
- ↑ 1 2 Elesber, A.A. Four-Year Recurrence Rate and Prognosis of the Apical Ballooning Syndrome (англ.) // J Amer Coll Card : journal. — 2007. — July (vol. 50, no. 5). — P. 448—452. — doi:10.1016/j.jacc.2007.03.050.
- ↑ 1 2 3 4 5 6 7 Eshtehardi P., Koestner S.C., Adorjan P., Windecker S., Meier B., Hess O.M., Wahl A., Cook S. Transient apical ballooning syndrome—clinical characteristics, ballooning pattern, and long-term follow-up in a Swiss population (англ.) // International Journal of Cardiology (англ.)русск. : journal. — 2009. — July (vol. 135, no. 3). — P. 370—375. — PMID 18599137.
- ↑ Bybee K.A., Motiei A., Syed I.S., Kara T., Prasad A., Lennon R.J., Murphy J.G., Hammill S.C., Rihal C.S., Wright R.S. Electrocardiography cannot reliably differentiate transient left ventricular apical ballooning syndrome from anterior ST-segment elevation myocardial infarction (англ.) // Journal of Electrocardiology (англ.)русск. : journal. — 2006. — PMID 17067626.
- ↑ 1 2 Pilgrim T.M., Wyss T.R. Takotsubo cardiomyopathy or transient left ventricular apical ballooning syndrome: A systematic review (англ.) // International Journal of Cardiology (англ.)русск. : journal. — 2008. — March (vol. 124, no. 3). — P. 283—292. — PMID 17651841.
- ↑ 1 2 Shimizu M., Kato Y., Masai H., Shima T., Miwa Y. Recurrent episodes of takotsubo-like transient left ventricular ballooning occurring in different regions: a case report (англ.) // J. Cardiol. : journal. — 2006. — August (vol. 48, no. 2). — P. 101—107. — PMID 16948453.
- ↑ Hurst R.T., Askew J.W., Reuss C.S., Lee R.W., Sweeney J.P., Fortuin F.D., Oh J.K., Tajik A.J. Transient midventricular ballooning syndrome: a new variant (англ.) // Journal of the American College of Cardiology (англ.)русск. : journal. — 2006. — August (vol. 48, no. 3). — P. 579—583. — PMID 16875987.
- ↑ Yasu T., Tone K., Kubo N., Saito M. Transient mid-ventricular ballooning cardiomyopathy: a new entity of Takotsubo cardiomyopathy (англ.) // International Journal of Cardiology (англ.)русск. : journal. — 2006. — June (vol. 110, no. 1). — P. 100—101. — PMID 15996774.
- ↑ Dhar S., Koul D., Subramanian S., Bakhshi M. Transient apical ballooning: sheep in wolves’ garb (англ.) // Cardiology in Review (англ.)русск.. — 2007. — Vol. 15, no. 3. — P. 150—153. — PMID 17438381.
- ↑ Medics can ‘mend a broken heart’
- ↑ 1 2 A. John Camm, Thomas F. Luscher, Patrick Serruys. The ESC Textbook of Cardiovascular Medicine. — Wiley-Blackwell, 2006. — 1136 с.
- ↑ Akashi Y.J., Nakazawa K., Sakakibara M., Miyake F., Koike H., Sasaka K. The clinical features of takotsubo cardiomyopathy (англ.) // QJM: An International Journal of Medicine (англ.)русск.. — 2003. — Vol. 96, no. 8. — P. 563—573. — doi:10.1093/qjmed/hcg096. — PMID 12897341.
- ↑ Nyui N., Yamanaka O., Nakayama R., Sawano M., Kawai S. ‘Tako-Tsubo’ transient ventricular dysfunction: a case report (неопр.) // Jpn Circ J. — 2000. — Т. 64, № 9. — С. 715—719. — doi:10.1253/jcj.64.715. — PMID 10981859.
Ссылки[править | править код]
- Шарообразное расширение верхушки левого желудочка или «takotsubo» кардиомиопатия — Д.В. Дупляков Кардиология 2004;11:97-9
- Что такое «синдром разбитого сердца» и кому он грозит
Источник
Ваше сердце может пострадать после какого-либо печального события, и ответственным за ваше «разбитое сердце», вероятнее всего, будет ваш мозг, пишет BBC.
Фото: pixabay.com
Швейцарские ученые проводят исследование, посвященное так называемому синдрому разбитого сердца.
Психологический стресс может вызывать острую преходящую дисфункцию левого желудочка. Синдром проявляется внезапным развитием сердечной недостаточности или болей в груди, сочетающихся с изменениями на ЭКГ, характерными для инфаркта миокарда передней стенки левого желудочка.
Чаще всего этот синдром развивается на фоне стрессовых ситуаций, вызывающих сильные (чаще резко негативные) эмоции. Такими событиями могут быть смерть близкого человека или расставание.
Полной ясности, как это происходит, у ученых пока нет. В публикации ученых в медицинском журнале European Heart Journal высказывается предположение, что синдром провоцируется реакцией мозга на стресс.
Впервые «синдром разбитого сердца» был описан японским ученым Хикару Сато в 1990 году и получил название «кардиомиопатия такоцубо» (от японского «takotsubo» — керамический горшок с круглым основанием и узким горлышком).
Этот синдром отличается от «обычного» сердечного приступа, когда блокируется приток крови к сердечной мышце. Блокировка тока крови к сердцу происходит при наличии в коронарных артериях тромба.
Однако симптомы синдрома разбитого сердца и сердечного приступа во многом схожи: в первую очередь это затрудненное дыхание и боль в груди.
Часто какое-то печальное событие является своеобразным триггером, провоцирующим возникновение синдрома. Однако к развитию синдрома разбитого сердца могут привести и радостные события, вызывающие сильные эмоции. Например, свадьба или получение новой работы.
Синдром разбитого сердца может быть временным явлением, в этом случае сердечная мышца восстановится через несколько дней, недель или месяцев, а в некоторых случаях развитие синдрома может привести к смертельному исходу.
В Британии синдром разбитого сердца выявляется приблизительно у 2500 пациентов каждый год.
Точная причина возникновения синдрома разбитого сердца ученым неизвестна. Однако предполагается, что этот синдром может быть связан с повышением уровня гормонов стресса — например, адреналина.
Елена Гадри из Университетской клиники Цюриха вместе со своими коллегами изучила активность головного мозга 15 пациентов, у которых был диагностирован синдром разбитого сердца.
Данные томографии показали значительные отличия активности мозга этих пациентов от картины, которая наблюдалась у 39 участников контрольной группы, которые были здоровы.
Была отмечена гораздо меньшая связь между областями мозга, отвечающими за контроль над эмоциями, и бессознательными (автоматическими) реакциями организма (такими, как сердцебиение).
«Эмоции формируются в головном мозге, поэтому вполне возможно, что болезнь формируется в мозге. А потом мозг посылает соответствующие сигналы сердцу», — говорит Гадри.
Для того чтобы понять механизм формирования синдрома, необходимы дальнейшие исследования.
Природа синдрома
У швейцарских ученых, проводивших исследование, не было данных томографического исследования пациентов до того, как у них был выявлен синдром разбитого сердца. Поэтому исследователи не могут утверждать, что сокращение связей между различными отделами головного мозга стало следствием развития синдрома или же синдром развился из-за сокращения связей.
«Это очень важная часть исследования, это поможет нам лучше понять природу этого синдрома, которую часто оставляют без внимания, и она продолжает оставаться для нас загадкой», — говорит глава британской организации «Кардиомиопатия» Джоэл Роуз.
«Эти исследования помогут нам понять, какую роль в формировании синдрома играет мозг и почему некоторые люди подвержены этому заболеванию, а другие нет», — говорит Джоэл Роуз.
«Эти наблюдения подтверждают наши давние предположения — об особой роли связи между мозгом и сердцем в формировании кардиомиопатии такоцубо», — говорит исследователь из британского фонда British Heart Foundation Дана Доусон.
Источник
Кардиомиопатия такоцубо — это преходящая острая сердечная недостаточность, сопровождающаяся расширением верхушки левого желудочка. Основные клинические проявления включают резкую загрудинную боль, одышку, тахикардию. Иногда развиваются пресинкопальные состояния и обмороки. Для диагностики назначают лабораторные анализы (определение уровня креатинкиназы, тропонина, ПНП), инструментальные неинвазивные (ЭКГ, ЭхоКГ, МРТ сердца) и инвазивные методы (коронарография, сцинтиграфия). При синдроме такоцубо показано медикаментозное лечение — гипотензивные средства, антикоагулянты, транквилизаторы. При кардиогенном шоке проводится внутриаортальная контрпульсация.
Общие сведения
Кардиомиопатия такоцубо имеет множество синонимов: синдром «разбитого сердца» (СРС), стресс-индуцированная кардиомиопатия, синдром верхушечного баллонирования. Необычное название «такоцубо» происходит от японского слова tako-tsubo, что в переводе означает «ловушка для осьминога». Это приспособление имеет широкое основание и узкое горлышко — похожую форму приобретает левый желудочек во время приступа. Кардиомиопатия такоцубо выявляется у 1-2% пациентов с острым коронарным синдромом. Более 90% больных — женщины в постменопаузальном периоде.

Кардиомиопатия такоцубо
Причины
Точные этиологические факторы развития кардиомиопатии такоцубо неизвестны. В качестве ведущих рассматриваются две рабочие гипотезы:
- Стрессовая. Основная теория заключается во влиянии стрессовых ситуаций на выработку гормонов, что приводит к транзиторным нарушениям работы миокарда. Триггерами начала болезни «разбитого сердца» бывают как эмоциональные потрясения (смерть близких, насилие, попадание в чрезвычайную ситуацию), так и медицинские причины — операция, астматический приступ.
- Наследственная. В последние годы разрабатывается теория о генетической предрасположенности к синдрому такоцубо. Описано несколько случаев появления кардиомиопатии у близких родственников. Предположительно, такие эпизоды вызваны наличием мутаций в генах, которые отвечают за чувствительность рецепторов к катехоламинам и эстрогенам. У страдающих стресс-индуцированной кардиомиопатией наблюдается функциональный полиморфизм этих генов.
Факторы риска
Среди способствующих факторов наиболее важны неуправляемые — пол и возраст. Кардиомиопатии такоцубо преимущественно встречается у женщин после 60 лет, что обусловлено большей чувствительностью к эмоциональным стрессам и гормональными перестройками в периоде постменопаузы. Фактором риска является наличие хронической сердечно-сосудистой патологии, которая увеличивает процент осложненного течения синдрома такоцубо. К управляемым факторам принадлежат: избыточный вес, частые стрессы дома или на работе, вредные привычки.
Патогенез
В клинической кардиологии выделяют несколько патогенетических механизмов развития синдрома. Характерное расширение верхушки сердца обусловлено аномальным расположением левой нисходящей артерии, которая кровоснабжает этот отдел сердца. Переходящий сбой в сократительной способности миокарда, вероятно, связан с одновременным вазоспазмом нескольких коронарных артерий и транзиторной ишемией сердечной стенки.
Другая патогенетическая теория предполагает множественную дисфункцию микрососудистого русла. Мелкие ветви коронарных артерий подвергаются спазму или дегенеративно-дистрофическим изменениям, в результате чего нарушается оксигенация миокарда левого желудочка. Важную роль в патогенезе кардиомиопатии играет чрезмерная активация симпатической системы и выделение катехоламинов, которые влияют на состояние сосудистого русла.
Классификация
Заболевание подразделяется на варианты в зависимости от локализации анатомических изменений. В 75-80% случаев развивается апикальное расширение желудочка, у 10-15% больных диагностируют срединно-левожелудочковый вариант кардиомиопатии. Более редкие разновидности поражения: инвертированный (менее 5%), бивентрикулярный (до 0,5%), правожелудочковый. Кардиологи чаще пользуются классификацией по клиническому течению, которая включает:
- Первичный синдром такоцубо. Расстройство возникает у здорового человека и зачастую имеет конкретные триггерные факторы. Тяжелые клинические симптомы служат причиной для обращения за экстренной медицинской помощью.
- Вторичный синдром такоцубо. Состояние наблюдается у пациентов, которые госпитализированы по поводу хирургической, акушерской или другой патологии. Кардиомиопатия осложняет течение основного заболевания, что обуславливает особые подходы к диагностике и лечению.
Симптомы
Основное проявление стресс-индуцированной формы кардиомиопатии — внезапная загрудинная боль. Приступ кардиалгии чаще возникает на фоне сильного эмоционального потрясения или испуга. Человек испытывает сжимающую или острую боль в области проекции сердца, которая может иррадиировать в плечо, лопатку. Характерным признаком синдрома такоцубо является «волна давления», которая поднимается от груди к шее и голове.
Болевой синдром обычно сопровождается повышенной потливостью, тревожностью. Одновременно с болью появляются одышка, чувство нехватки воздуха. Человек ощущает сильное сердцебиение, слабость в ногах. При этом кожа бледнеет, становится холодной и влажной. Часто появляется головокружение, потемнение в глазах. Тяжело протекающий приступ кардиомиопатии заканчивается обмороком вследствие снижения сердечного выброса.
Осложнения
Ранее кардиомиопатия такоцубо рассматривалась как доброкачественное заболевание без последствий. Но при несвоевременном обращении или неправильной лечебной тактике осложнения возникают у 52% больных. Среди острых последствий синдрома «разбитого сердца» выделяют: поражение правого желудочка (18-34%), митральную регургитацию (14-25%), обструкцию выходного тракта левого желудочка (10-25%).
В первые дни после манифестации кардиомиопатии сохраняется высокий риск фибрилляции предсердий (5-15%). У пациентов с отягощенным преморбидным фоном в 4% случаев наблюдаются желудочковые аритмии, в 1,5% — кардиогенный шок. Летальность при тяжелом течении синдрома составляет около 1%. У 5% больных, перенесших острый приступ, наступает рецидив, обусловленный теми же пусковыми механизмами.
Диагностика
По клинической картине индуцированная стрессом кардиомиопатия напоминает приступ стенокардии или инфаркт миокарда, что требует от врача-кардиолога проведения дифференциальной диагностики. Обследование необходимо выполнить в максимально короткие сроки. Диагностическая программа включает ряд лабораторно-инструментальных исследований:
- Электрокардиографию. Типичные изменения на ЭКГ регистрируют у 95% пациентов в острой фазе СРС. Основные признаки заболевания: изменение положения сегмента ST относительно изоэлектрической линии, блокада ножки пучка Гиса. Через сутки после развития кардиомиопатии наблюдается удлинение интервала QT.
- Определение биомаркеров. Первично определяются уровни сердечного тропонина и креатинкиназы, количество которых незначительно повышено. В остром периоде кардиомиопатии выявляют увеличение концентрации предсердного натрийуретического пептида (ПНП).
- Эхокардиография. Трансторакальная ЭхоКГ выполняется всем больным с предположительным диагнозом стресс-индуцированной кардиомиопатии. При УЗИ сердца выявляют большую площадь дисфункции миокарда, симметричные нарушения сокращения стенок левого желудочка.
- Коронарная ангиография. Назначение исследования в ургентном порядке целесообразно для исключения инфаркта миокарда. При кардиомиопатии такоцубо визуализируются неизмененные коронарные сосуды с сохраненным кровотоком. Для уточнения диагноза рекомендована левожелудочковая вентрикулография.
- Высокоспециализированные методы. Для разграничения кардиомиопатии такоцубо и других кардиологических болезней применяется МРТ сердца, отображающая участки поражения миокарда в трехмерном режиме. При невозможности проведения исследования показана перфузионная сцинтиграфия миокарда.

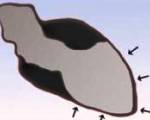
Вентрикулография. Типичная для кардиомиопатии такоцубо форма расширения верхушки левого желудочка.
Лечение
Консервативная терапия
Кардиомиопатия такоцубо относится к неотложным состояниям, поэтому медицинскую помощь оказывают в условиях специализированного кардиологического стационара или в отделениях интенсивной терапии. Обычно назначается поддерживающая лечебная схема, которая обеспечивает постепенное восстановление функциональной активности миокарда. Для лечения используют следующие группы лекарственных препаратов:
- Кальциевые сенсибилизаторы. Рекомендованы при резком снижении фракции выброса и динамической обструкции кровотока из левого желудочка. Медикаменты (в основном — левосимендан) улучшают показатели перфузии и микроциркуляции, предотвращают развитие кардиогенного шока.
- Гипотензивные препараты. Средства из этой группы используются при легком варианте течения кардиомиопатии для устранения возможных провоцирующих факторов. Назначаются бета-адреноблокаторы, антагонисты кальция, диуретики.
- Антикоагулянты. Применяются для профилактики образования апикальных тромбов и растворения уже имеющихся кровяных сгустков. Показано профилактическое введение низкомолекулярных гепаринов в терапевтических дозах, прием ацетилсалициловой кислоты.
- Транквилизаторы. Препараты целесообразно использовать, если появлению симптомов кардиомиопатии такоцубо предшествовал сильный стресс. Помимо влияния на психоэмоциональное состояние транквилизаторы обладают дополнительным анальгетическим эффектом.
Хирургическое лечение
Если кардиомиопатия такоцубо осложняется кардиогенным шоком, используют современный малоинвазивный метод — внутриаортальную баллонную контрпульсацию. Процедура предполагает механическое нагнетание крови в большой круг кровообращения с помощью небольшого медицинского насоса, установленного в аорте. Методика внутриаортальной контрпульсации улучшает гемодинамические показатели.
Прогноз и профилактика
При своевременной медицинской помощи большинство пациентов переживают острый приступ кардиомиопатии без отдаленных осложнений. Долгосрочный прогноз, как правило, благоприятный. Даже у больных с хроническими сердечно-сосудистыми заболеваниями сократительная способность миокарда после приступа индуцированной стрессом кардиомиопатии восстанавливается почти полностью. Специфическая профилактика патологии не разработана.
Источник
