Синдром позвоночной артерии на уздг
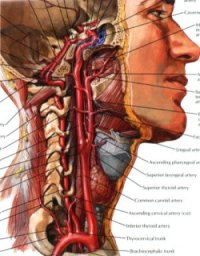
Синдром позвоночной артерии

Название синдрома и различные его проявления настолько часто употребляются во врачебных записях и разных медицинских публикациях, что настало время разъяснить пациентам, о чем идет речь.
В широком клиническом понимании синдром позвоночной артерии — это нарушение притока крови к головному мозгу в бассейне одной или обеих позвоночных артерий. Вообще, головной мозг кровоснабжается из 2-х бассейнов. К первому — каротидному — относятся сонные артерии. Они (вернее, их основные ветви — внутренние сонные артерии) обеспечивают до 70-85% притока крови и несут ответственность за все основные нарушения кровообращения, в первую очередь инсульты. Им традиционно уделяется особое внимание при обследовании, их атеросклеротическое поражение и его осложнения — объект особого внимания кардиологов, неврологов, сосудистых хирургов.
Позвоночные артерии (правая и левая) относятся к вертебро-базиллярному бассейну, кровоснабжают задние отделы мозга и обеспечивают, по разным данным, около 15-30% притока крови. Их поражение не приводит к таким тяжелым осложнениям, как инсульт, но могут надолго испортить пациенту жизнь и сделать его инвалидом.
Поражение артерий проявляется в виде
- выраженных головокружений,
- потери сознания,
- нарушений координации,
- слуха, зрения.
При этом все причины поражения позвоночных артерий можно разделить на 2 группы.
- Первая группа — невертеброгенные (не связанные с позвоночником) поражения. Они обусловлены либо атеросклерозом (он встречается значительно реже, чем в сонных артериях), либо врожденными аномалиями размеров и хода артерий. Эти аномалии обычно не имеют самостоятельного значения, но при присоединении других причин сдавления артерий обеспечивают неблагоприятный фон.
- Вторая группа — вертеброгенные (связанные с патологией позвоночника) поражения. Это нарушения, обусловленные заболеваниями позвоночника. Они могут проявляться еще в подростковом возрасте при диспластической и посттравматической нестабильности шейного отдела позвоночника. Но наиболее выраженные изменения развиваются у взрослых при развитии остеохондроза.
Дело в том, что часть своего пути к черепу артерия проходит в костном канале, образованном поперечными отростками шейных позвонков (начиная с 6-го и заканчивая 1-м позвонком). При остеохондрозе развивается деформация боковых (крючковидных) отростков тел позвонков, так называемый унковертебральный артроз, и нестабильность позвонков, обусловленная разрушением межпозвонковых дисков. Все эти причины приводят сначала к спазму, а затем к сдавлению артерии на протяжении костного канала или у входа в него и выхода из него позвоночной артерии с развитием кратковременных нарушений кровообращения, возникающих при поворотах и наклонах головы, изменении положения туловища.
Диагностика
В настоящее время основным методом диагностики нарушений кровообращения в сосудах, кровоснабжающих головной мозг, общепризнанно является ультразвуковая допплерография (УЗДГ).
Исследование артерий каротидного и вертебро-базиллярного бассейнов носит название УЗДГ ветвей дуги аорты или УЗДГ эстракраниальных сосудов. Однако, при проведении стандартного УЗДГ основное внимание традиционно уделяется сонным артериям, а исследование позвоночных артерий выполняется лишь частично. Это обусловлено также отсутствием единых стандартов, различием между разными школами специалистов. Часто артерия не осматривается на всем протяжении, а лишь в начальном и конечном сегментах, не проводятся функциональные пробы, заключение о патологии позвоночных артерий делается по косвенным данным, не указываются конкретные причины и уровень сдавления.
На кафедре ультразвуковой диагностики Уральской государственной медицинской академии дополнительного образования разработана оригинальная технология ультразвукового исследования, сочетающая УЗДГ ветвей дуги аорты по стандартной методике и проведение УЗИ шейного отдела позвоночника с использованием 2-х дополнительных запатентованных доступов. Это позволяет одновременно осмотреть артерию во всех ее сегментах, как в костном канале, так и вне его, оценить соотношение артерии и позвонков, причем, не только в покое, но и при различных функциональных пробах, что дает возможность непосредственно установить уровень, причину и степень компрессии сосуда.
Возможность проведения такого сочетанного исследования дает использование современной высококлассной ультразвуковой аппаратуры. Методика неизменно вызывает большой интерес на различных съездах специалистов по ультразвуковой диагностике, авторы ее стали лауреатами многих конкурсов научных работ, результаты работы были опубликованы в ведущих научных журналах, вошли в учебные пособия, изданные в нашей стране и за рубежом.
В настоящее время методика внедрена в практику работы Медицинского центра УЗИ профессора Кинзерского А.Ю., который является клинической базой кафедры УЗД УГМАДО, где она проводится на эксклюзивной основе под руководством и с разрешения авторов (ряд этапов исследования защищены Патентом РФ и их несанкционированное применение в других учреждениях является нарушением Закона РФ об авторских и смежных правах).
Приглашаем в наш центр для прохождения УЗДГ ветвей дуги аорты и других видов ультразвуковых исследований.
Источник
Этиологическими факторами патологии позвоночной артерии (ПА) являются: 1 — окклюзирующие заболевания артерий (атеросклероз, тромбозы, эмболии, артерииты различного генеза); 2 — экстравазальные компрессии артерий (сдавление их костными аномалиями, ребрами, мышцами, остеофитами и суставными отростками шейных позвонков, рубцами, опухолями и пр.); 3 — деформации артерий (смотреть фото: виды патологических извитостей артерий).
Подробнее о деформациях ПА. Различают следующие виды деформаций ПА: удлинение, извитость, перегибы, а также петлеобразование и спиралевидное скручивание. Наибольшее значение для клиники имеют извитость и перегибы (примерно 1/3 случаев среди всех деформаций), так как они приводят к временному или стойкому нарушению проходимости артерий с образованием септального стеноза. По данным Н.В. Верещагина, перегибы ПА обнаруживают на аутопсии у 33% больных с нарушением мозгового кровообращения. Они, как правило, избирательно локализуются в сегменте V3, который реже и менее других поражается атеросклерозом [читать о сегментах ПА]. У 20% больных с патологией вертебро-базилярной системы аномалии ПА обнаруживаются: аплазия или гипоплазия ПА (гипоплазия одной из артерий отмечается примерно в 5 — 10% случаев, аплазия – в 3%); высокое вхождение артерий в костный канал (в 10,5% случаев на уровне С3 — С4 — С5), аномалии отхождения ПА (при латеральном смещении устья ПА). S.Powers и соавт. описали новый синдром – перемежающаяся компрессия ПА (3 — 4% случаев) при отхождении ПА от задней поверхности подключичной артерии и редком двукорневом варианте отхождения ПА от дуги аорты и левой подключичной артерии (2% случаев).
Подробнее о гипоплазии ПА. Гипоплазия ПА — это уменьшение внутреннего диаметра артерии менее 2 мм (однако единой договоренности в отношении диаметра сосуда нет, и в некоторых работах признаком гипоплазии ПА считалось уменьшение наружного диаметра ПА менее 3 мм). Контралатеральную гипоплазированной ПА принято называть доминантной артерией. В литературе гипоплазию ПА рассматривают как проявление недифференцированной дисплазии соединительной ткани, развивающейся в результате различных наследственных форм поражения соединительной ткани (однако отсутствуют данные о ее частоте у людей с наследственной патологией соединительной ткани), или как следствие воздействия разнообразных неблагоприятных факторов на плод в период его внутриутробного развития, что приводит к дефекту формирования соединительнотканного каркаса сосудистой стенки (гипоплазия ПА приобретенного генеза). ! Гипоплазия ПА, изолированно или в сочетании с патологическими деформациями и/или извитостями внутренней сонной артерии, может быть одним из факторов риска развития нарушения кровообращения в вертебрально-базилярной системе.
Методами выявления патологии ПА являются: ультразвуковое исследование (УЗИ), магнитно-резонансная ангиография (МРА), КТ-ангиография (КТА: компьютерная томография + ангиография) и др., например, имеются исследования, посвященные изучение морфометрических параметров горизонтальной части ПА в атланто-окципитальном синусе с помощью спиральной компьютерной томографии (СКТ).
Преимуществом ультразвукового исследования является неинвазивность, безопасность исследования. Однако ультразвуковые методики требуют высокого навыка работы, правильности выполнения исследования. Ультразвуковая допплерография (УЗДГ; если УЗДГ применяется для исследования внутричерепного отдела артерии, то ее называют ТКДГ – транскраниальная доплерография) в чистом виде позволяет лишь косвенно оценить состояние церебрального кровотока. Ультразвуковое (дуплексное) сканирование позволяет выявлять с высокой степенью достоверности имеющиеся нарушения кровообращения в экстра- и интракраниальных отделах ПА. Метод позволяет визуализировать ПА преимущественно во втором (V2) ее сегменте (на уровне поперечных отростков шейных позвонков), где и наблюдается ее вертеброгенная компрессия. В норме при ультразвуковом дуплексном сканировании (В-режим) визуализируется прямой ствол ПА. При стандартном исследовании используют линейные датчики с частотой от 7,5 МГц, сканируя по передней и боковой поверхности шеи. При этом проводят качественную и количественную (спектральный анализ) оценку кровотока в сосудах. Качественный анализ включает оценку диаметра (норма – 2,8 — 3,8 мм) и формы сосуда (наличие загибов, петель и др.: при вертеброгенной компрессии ПА в В-режиме можно визуализировать дугообразное смещение ПА над остеофитом [см. в начале абзаца] (в ряде случаев также возможна визуализация локального уменьшения диаметра артерии).
Возможностью дуплексного сканирования является также оценка спектральных характеристик кровотока в ПА, расчет количественных показателей кровотока. При проведении стандартного спектрального анализа позвоночных артерий измеряют (чаще всего в промежутке между V и VI шейными позвонками) систолическую (норма – 31-51 см/с), среднюю (норма – 15-26 см/с), диастолическую (норма – 9 — 16 см/с) и объемную (норма 60-125 мл/мин) линейную скорость кровотока (ЛСК), а также пульсовой (норма – 1,1 — 2,0) и резистентный (норма – 0,63 — 0,77) импульсы. Также ультразвуковое исследование ПА выполняют на уровне CI и CVII позвонков. Следует отметить, что понятие нормальной скорости кровотока для позвоночных (и сонных) артерий несколько условно, т.к. нельзя точно определить угол локации артерии. Однако, на основании большого количества исследований (в т.ч. зарубежных) установлено, что ошибка в измерении угла колеблется в пределах 5% (показатели нормы средней ЛСК для позвоночных артерий колеблется в зависимости от возраста и составляют 11 — 19 см/с).
Кроме того, достоинством ультразвукового дуплексного сканирования (в т.ч. и в детской практике) является также возможность проведения функциональных (позиционных) проб с ротацией или наклонами головы, что позволяет выявить наличие не только статической, но и «скрытой» компрессии позвоночных артерий. Также функциональные пробы могут быть рекомендованы в качестве скрининговой, как для определения объема дальнейшего обследования пациента, так и для выделения групп риска по развитию нарушений мозгового кровообращения в вертебро-базиллярном бассейне (также целесообразно использование этих проб в качестве средства контроля восстановления кровотока в ходе лечения, как наиболее доступного метода диагностики). Однако по данным Никитина Ю.М. и Труханова А.И. (2004) представление отдельных врачей о том, что изменение показателей ЛСК по позвоночной артерии при поворотах головы в стороны служит признаком функциональной компрессии ПА или ее стеноза является глубоко ошибочным. В этих случаях изменения линейной скорости кровотока (ЛСК) обусловлены всего лишь изменением угла локации позвоночной артерии, возникающим при поворотах головы, а не появлением функционального стеноза или закрытием просвета артерии. Попытки доказать возможность вертеброгенной компрессии ПА при движениях в шейном отделе позвоночника, как правило, методически несостоятельны.
В последнее десятилетие стала использоваться триплексная допплерография, которая позволяет произвести трехмерную реконструкцию любого сосуда в «реальном времени» (при триплексной доплерографии применяются три метода допплерографии одновременно: В-режим, цветовая допплерография и импульсно-волновая допплерография). Современные аппараты для ультразвуковой диагностики высшего и эксперт-класса позволяют визуализировать сосуды диаметром менее 1 мм, определять патологические изменения в них или окружающих тканях. Это очень важно при обследовании пациентов с патологией ПА.
Далее диагностика поражений позвоночных артерий по данным национальных рекомендаций по ведению пациентов с сосудистой артериальной патологией (Российский согласительный документ) «Часть 3. Брахиоцефальные артерии» [Российское общество ангиологов и сосудистых хирургов Ассоциация сердечно-сосудистых хирургов Москва, 2012]:
Симптомы вертебробазилярной недостаточности (ВБН) не являются специфическими. Они могут быть проявлением множества других заболеваний, в связи с чем для диагностики поражений ПА требуется тщательное изучение жалоб пациента и истории заболевания, а также физикальное и инструментальное обследование.
Скрининговыми инструментальными методами выявления поражений ПА является УЗДГ, ТКДГ и ЦДС (цветовое дуплексное сканирование). Фактически единственным УЗ-критерием окклюзии ПА является отсутствие кровотока в месте локации. Стенотическое поражение ПА можно заподозрить при асимметрии средней скорости кровотока более 30% (для одностороннего поражения). Снижение средней скорости кровотока до 2 — 10 см/с несомненно свидетельствует о наличии стеноза ПА. Если при одностороннем стенозе можно учитывать оба критерия (асимметрия кровотока и снижение его средней скорости), то при двухстороннем стенозе приходится ориентироваться только на абсолютные показатели скорости кровотока. При сочетании стеноза одной и окклюзии другой ПА диагностика стеноза становится еще менее достоверной вследствие компенсаторного увеличения кровотока по стенозированной ПА. В настоящее время в результате применения ЦДС точность определения поражений ПА значительно возросла и составляет 93%.
Для определения степени компенсации кровотока в ВББ и проведения дифференциальной диагностики могут использоваться отоневрологическое исследование в сочетании с электрофизиологическими данными о слуховых вызванных потенциалах, характеризующих состояние стволовых структур мозга, а также определение индекса фотомоторной реактивности.
Косвенные данные о вертеброгенном влиянии на ПА могут быть получены также при обычной рентгено- графии шейного отдела позвоночника, выполненной с функциональными пробами.
Для уточнения причины ВБН могут быть использованы такие диагностические методы, как КТ и МРТ; МРА (МР-ангиография) является исключительно ценным методом диагностики поражений магистральных артерий головы. Однако, в отличие от литературы, посвященной визуализации сонных артерий, данные, опубликованные по неинвазивной визуализации ПА, крайне редки и неоднозначны. Систематический обзор позволил выявить 11 исследований, посвященных неинвазивной визуализации ПА. КТА и МРА показали более высокую чувствительность (94%) и специфичность (95%), чем применение ДС (чувствительность 70%), причем КТА имела большую достоверность. Технические трудности при выполнении ДС делают данный метод менее информативным при изучении заболеваний данного анатомического региона. Учитывая тот факт, что ни при МРА, ни при КТА не всегда возможно четко визуализировать устье ПА, необходимо использование рентгеноконтрастной ангиографии у больных с симптомами ВББ перед реваскуляризацией. Проведение рентгеноконтрастной ангиографии показано только при наличии симптомов ВБН и доказанном с использованием неинвазивных методов исследования поражении позвоночных артерий. Дигитальная субтракционная ангиография с контрастированием может быть полезна, когда селективная катетеризация ПА невыполнима, однако точность данного метода сравнима с КТА.
Дополнительная информация:
1. [читать] статья «Возможности ультразвуковой диагностики при синдроме позвоночной артерии» Сафронова О.А., Ненарочнов С.В., Морозов В.В.; Центр новых медицинских технологий Института химической биологии и фундаментальной медицины Сибирского отделения РАН, Новосибирск; журнал «Фундаментальные исследования» №10, 2011;
2. [читать] статья «Сравнительная оценка инструментальных методов исследования позвоночной артерии» И.В. Андреева Н.В. Калина, Луганский государственный медицинский университет, Украина; Научные ведомости, серия «Медицина. Фармация» 2013, № 18 (161), выпуск 23;
3. [читать] лекция «Современные аспекты диагностики аномалий и деформаций позвоночной артерии» Л.П. Метелина, Н.В. Верещагин; ГУ НИИ неврологии РАМН, Москва; журнал «Нейрохирургия» № 4, 2005;
4. [читать] статья «Анатомо-физиологические предпосылки развития синдрома позвоночной артерии» А.В. Логвиненко, Харьковская медицинская академия последипломного образования, Украина (Международный медицинский журнал, №4, 2016)
Источник
Широкая распространенность вертебробазилярных нарушений на сегодняшний день является одной из актуальнейших проблем сосудистой патологии головного мозга. По различным данным, частота дисгемий в вертебробазилярном бассейне (ВББ) составляет от 25 до 30 % всех нарушений мозгового кровообращения, в том числе до 70 % транзиторных ишемических атак [4, 9, 11]. В структуре причин, вызывающих нарушение кровотока в вертебробазилярном бассейне, значительное место занимают атеросклеротические поражения позвоночных артерий (ПА), гипоплазия, аномалии костного ложа, поражение краниовертебрального перехода, патологическая извитость и смещение устья позвоночной артерии [1, 4, 11].
Наиболее существенным этиопатогенетическим фактором развития данных нарушений является патология шейного отдела позвоночника, в последние годы имеющая значительную распространенность, в особенности у лиц молодого возраста [2, 10]. Ведущее место в патогенезе данных нарушений отводится дегенеративно-дистрофическим процессам шейного отдела позвоночного столба и аномальным процессам со стороны атланта, которые нарушают кровоток в позвоночных артериях, вызывают нарушения мозгового кровообращения [7, 8]. Данные изменения относятся к группе компрессионных сужений позвоночных артерий, возникающих под влиянием многих внесосудистых факторов, и объединяются термином «синдром позвоночной артерии» (СПА) [9].
Термин «СПА» в определенной степени является собирательным понятием и объединяет комплекс церебральных, сосудистых, вегетативных синдромов, возникающих вследствие поражения симпатического сплетения ПА, деформации ее стенки или изменения просвета [1, 5, 9].
Этиологические факторы СПА можно разделить на 3 основные группы:
1. Окклюзирующие заболевания артерий (атеросклероз, тромбозы, эмболии, артерииты различного генеза).
2. Деформации артерий (патологическая извитость, перегибы, аномалии структуры и хода).
3. Экстравазальные компрессии артерий (сдавление их костными аномалиями, ребрами, мышцами, остеофитами и суставными отростками шейных позвонков, рубцами, опухолями и пр.) [5, 9].
Клиническая классификация синдрома позвоночной артерии [5]:
1. Патогенетические факторы СПА (по характеру компрессионного воздействия на ПА).
1. Подвывих суставных отростков позвонков.
2. Патологическая подвижность (нестабильность, гипермобильность) позвоночно-двигательного сегмента.
3. Сдавление остеофитами.
4. Спазм сосуда в результате раздражения периартериального нервного сплетения.
5. Сдавление в области атланта (аномалия Клиппеля — Фейля, аномалия Киммерли, аномалии атланта, платибазия).
6. Унковертебральный артроз.
7. Артроз дугоотростчатых суставов.
8. Блокады и нестабильность суставов.
9. Грыжи межпозвонковых дисков.
10. Рефлекторные мышечные компрессии.
2. Клинические стадии СПА.
2.1. По степени гемодинамических нарушений.
2.1.1. Дистоническая (функциональная).
2.1.2. Ишемическая (органическая).
2.2. По характеру гемодинамических нарушений.
2.2.1. Компрессионная.
2.2.2. Ирритативная.
2.2.3. Ангиоспастическая.
2.2.4. Смешанная.
3. Клинические варианты СПА.
3.1. Синдром Барре — Льеу (заднешейный симпатический синдром).
3.2. Базилярная мигрень.
3.3. Вестибулоатактический синдром.
3.4. Кохлеовестибулярный синдром.
3.5. Офтальмический синдром.
3.6. Синдром вегетативных нарушений.
3.7. Транзиторные ишемические атаки.
3.8. Синдром Унтерхарншайдта (синкопальный вертебральной синдром).
3.9. Приступы drop attack.
Диагностика СПА достаточно сложна в связи с полиморфизмом жалоб и клинической симптоматики. В клинической практике мы часто сталкиваемся как с гипер-, так и гиподиагностикой СПА. Для уточнения характера процесса необходимо установить факт компрессионного воздействия на ПА, что достигается при использовании дуплексного сканирования или ультразвуковой допплерографии [6].
По нашему мнению, для установления диагноза вертеброгенного СПА необходимо наличие 3 клинико-диагностических критериев [5]:
1. Клиническая симптоматика (наличие 1 из 9 вышеописанных клинических вариантов или их сочетание).
2. Наличие изменений, выявляемых при проведении магнитно-резонансной или спиральной компьютерной томографии в сочетании с функциональной рентгенографией шейного отдела позвоночника (остеохондроз, деформирующий спондилез в области унковертебральных сочленений, подвывих суставных отростков позвонков, нестабильность и гипермобильность, аномалии костного ложа ПА, краниовертебрального перехода и др.).
3. Наличие изменений, выявляемых при проведении дуплексного сканирования ПА и/или при проведении вертебральной допплерографии с применением функциональных нагрузок с ротацией, сгибанием и разгибанием головы (компрессия позвоночной артерии, асимметрия линейной скорости кровотока (ЛСК) в позвоночных артериях, вазоспастические реакции в позвоночной и основной артериях, гиперреактивность на функциональные пробы).
Многообразие клинических проявлений СПА во многом обусловливает широкий спектр лечебных методик, применяемых при данной патологии. Рациональная терапия СПА должна включать в себя методы воздействия на механический субстрат компрессионного синдрома, т.е. патогенетическое лечение вертебральной патологии, воздействие на просвет позвоночной артерии, т.е. сосудистое лечение, а также всевозможные вспомогательные и дополнительные способы лечения [5, 11].
Принципы лечения синдрома позвоночной артерии [5]:
1. Противоотечная и противовоспалительная терапия.
2. Нормализация кровотока в ПА.
3. Нейропротективная терапия.
4. Метаболическая терапия.
5. Симптоматическая терапия.
6. Воздействие на механические факторы компрессии ствола ПА и вегетативных сплетений.
7. Восстановительная терапия.
Цель исследования. Целью данной работы явилось допплерографическое изучение кровотока в сосудах вертебробазилярного бассейна у пациентов с различными вариантами СПА и возможности медикаментозной коррекции выявленных изменений.
Материалы и методы
Было исследовано 48 больных молодого возраста (18–35 лет), 27 женщин и 21 мужчина, с клинической картиной СПА на фоне нестабильности шейного отдела позвоночника. Синдром проявлялся в виде вестибулоатактических нарушений у 25 больных, кохлеарного синдрома— у 14, заднешейного симпатического синдрома (Барре— Льеу)— у 9 больных. Всем пациентам проводилась функциональная рентгенография шейного отдела позвоночника со сгибанием и разгибанием, а также транскраниальная допплерография («Ангиодин» производства фирмы БИОСС (Россия)) с применением функциональных нагрузок с ротацией, сгибанием и разгибанием головы (по авторской методике). Производилось сопоставление показателей ЛСК в основной артерии (ОА) в покое и при проведении функциональных проб.
Результаты и обсуждение
При анализе жалоб пациентов с СПА выявились следующие закономерности.
У пациентов с вестибулоатактическим синдромом (25 человек) отмечалось головокружение, как правило, несистемного характера, в 19 случаях сопровождавшееся пошатыванием при ходьбе, у 9 пациентов оно имело стойкий характер с элементами атаксии, как правило, при подъемах артериального давления. Шум и звон в ушах отмечались у пациентов с кохлеарным синдромом (14 человек). Односторонняя приступообразная головная боль в шейно-затылочной области, иррадиирующая в гомолатеральные височную и лобно-орбитальную области, была характерна для пациентов с синдромом Барре — Льеу. Кроме данных основных жалоб, у пациентов субъективно отмечались и другие симптомы, выраженные в меньшей степени: повышенная утомляемость и снижение работоспособности— 15 человек, диффузные головные боли — 12 человек, периодические сердцебиения — 9 человек, нарушения сна — 8 человек, периодические фотопсии — 7 человек.
В неврологическом статусе отмечались: умеренно выраженные атактические расстройства (20 больных), оживление сухожильных рефлексов (18 больных), координаторные нарушения (13 больных), вегетативная лабильность (18 больных), астенический синдром (15 больных), вегетативные расстройства (14 больных), тремор рук и век (13 больных), эмоциональная лабильность (11 больных), асимметрия лицевой иннервации (4 больных), симптом Маринеску — Радовичи (3 больных).
По данным рентгенологического исследования, признаки лестничной нестабильности в ПДС C2–С6 были выявлены у 18 пациентов, изолированная нестабильность в ПДС С2–С3 — у 7, С3–С4 — у 6, С4–С5— у 11, С5–С6— у 6 пациентов.
При исследовании ЛСК в артериях асимметрия кровотока (25–30 %) в ПА отмечалась у 27 больных. Вазоспазм в одной ПА наблюдался у 15 человек, в обеих ПА — у 6, вазоспазм в ОА отмечался у 11 пациентов, в ОА и одной ПА — у 12, в ОА и обеих ПА — у 4 человек.
У всех пациентов с лестничной нестабильностью (18 чел.) отмечалась гиперреактивность на пробы со сгибанием (12 чел.) и разгибанием (16 чел.), ротацией (11 чел.). Изолированная нестабильность отмечалась у 30 пациентов. При изолированной нестабильности гиперреактивность наблюдалась: в 17 случаях — при ротационных нагрузках, в 21– при разгибании, в 9 — при сгибании. Более чем у 2/3 пациентов с изолированной нестабильностью отмечалось совпадение результатов функциональных проб (сгибание и/или разгибание), при которых выявлялись нестабильность в ПДС и гиперреактивность в ОА.
Следующей задачей данного исследования явилось изучение возможности коррекции измененных показателей гемодинамики посредством медикаментозной терапии.
В качестве препарата для монотерапии был избран Трентал. Выбор Трентала для исследования воздействия на показатели кровотока в ВББ основан на имеющихся в его фармакотерапевтическом спектре эффектах. Трентал— широко известное средство из группы вазодилататоров. В качестве активного действующего вещества Трентал содержит пентоксифиллин, который обладает спазмолитическим действием на гладкую мускулатуру мозговых артерий за счет ингибирования фосфодиэстеразы и накопления цАМФ. Пентоксифиллин является производным ксантина и по химической структуре близок к теобромину и теофиллину. Он также обладает антиагрегантным и ангиопротекторным действием, улучшает микроциркуляцию и реологические свойства крови, повышает концентрацию АТФ в головном мозге, благоприятно влияет иммунную систему. Снижает вязкость крови, вызывает дезагрегацию тромбоцитов. Улучшает микроциркуляцию в зонах нарушенного кровоснабжения. Установлена также достоверная эффективность Трентала, оказывающего комплексное реологическое действие, направленное не только на уменьшение агрегационной способности тромбоцитов, но и на улучшение деформируемости мембран эритроцитов и нормализацию микроциркуляции в целом. Трентал широко используется при нарушениях кровообращения различного генеза. Доказано нормализующее действие Трентала на мозговой кровоток. Он улучшает мозговое, коронарное и периферическое кровообращение, уменьшает возбудимость вестибулярного аппарата и повышает устойчивость тканей к гипоксии [2].
Нами проведено допплерографическое изучение влияния Трентала на показатели гемодинамики в сосудах ВББ.
Трентал применялся в виде внутривенных капельных инфузий по 5 мл (100 мг вещества) в количестве 10 введений с последующим переходом на пероральный прием в дозе 1 табл. (100 мг) 3 раза в день — 3–4 недели.
На фоне проведенного лечения у 72 % пациентов отмечалось значительное уменьшение интенсивности головокружения в первые дни приема вплоть до практически полного исчезновения в течение 2–3 недель. В 44,7% случаев нивелировалось ощущение неустойчивости и пошатывания при ходьбе. Регресс звона и шума в ушах отмечался у 36,8 % больных. Также влияние терапии на субъективную симптоматику проявлялось в виде регресса головной боли (30,2 %), улучшения работоспособности (31%), памяти (27,7 %), нормализации сна (16,5 %). У 34,2 % пациентов с синдромом Барре — Льеу отмечено уменьшение частоты и интенсивности пароксизмов головной боли. Динамика объективной неврологической симптоматики проявлялась в виде нормализации статики и координации (60,4%), нивелирования тремора (37,8%), сухожильной анизорефлексии (24,1 %), симптомов вегетативной лабильности (27,6 %) (рис. 1).
По данным УЗДГ отмечался регресс асимметрии кровотока у 66,4 % больных. Эффективность Трентала прослеживалась у всех пациентов с вазоспазмом в обеих ПА, а также в ОА и обеих ПА, у 63,2 % пациентов с вазоспазмом в ОА. Несколько меньшая эффективность Трентала в устранении вазоспастических реакций отмечалась при изменениях в одной ПА (40 % пациентов), а также в ОА и одной ПА (57,1 %) (рис. 2).
Можно предположить, что изолированные гемодинамические изменения в одной ПА в большей степени связаны с механизмом экстравазальной компрессии (в отличие от сочетанного поражения ПА и ОА по типу вертебральной ирритации) и требуют механической коррекции патологической вертебральной фиксации. У данных групп пациентов на фоне терапии Тренталом были использованы методы мануальной терапии, постизометрической релаксации, лечебной гимнастики, что в конечном итоге привело к регрессу гемодинамических нарушений.
Выводы
1. Синдром позвоночной артерии объединяет комплекс церебральных, сосудистых и вегетативных синдромов, возникающих вследствие поражения симпатического сплетения ПА, деформации ее стенки или изменения просвета.
2. При ультразвуковом допплерографическом исследовании синдром позвоночной артерии чаще всего проявляется в виде асимметрии линейной скорости кровотока в позвоночных артериях в сочетании с вазоспастическими реакциями в одной позвоночной и/или основной артериях.
3. Гиперреактивность на функциональные пробы с ротацией, сгибанием и разгибанием шейного отдела позвоночника является важнейшим допплерографическим критерием синдрома позвоночной артерии и коррелирует с наличием нестабильности шейного отдела позвоночника.
4. Применение Трентала при синдроме позвоночной артерии является эффективным и патогенетически обоснованным как в качестве монотерапии, преимущественно при ирритативных вариантах синдрома, так и в сочетании с методами мануального воздействия при доминировании экстравазального компрессионного синдрома.
5. Необходимым является применение в амбулаторной неврологической и ортопедической практике комплексного лучевого обследования (функциональная рентгенография, магнитно-резонансная и спиральная компьютерная томография, ультразвуковая диагностика) всех пациентов с вертебральными жалобами и клиническими проявлениями синдрома позвоночной артерии.
Литература1. Абдуллаєв Р.Я., Марченко В.Г., Кадирова Л.А. Допплерографія в неврологічній практиці. — Х.: Право, 2003.— 108 с.2. Бадалян О.Л., Бурд С.Г., Погосян А.С. и др. Применение Трентала во вторичной профилактике инсульта и при хронической недостаточности мозгового кровообращения // РМЖ. — 2008. — Т. 16, № 26. — С. 1783-1785.3. Вейн А.М., Колосова О.А., Яковлев Н.А., Каримов Т.К. Головная боль. — М., 1994. — 286 с.4. Верещагин Н.В. Патология вертебробазилярной системы и нарушения мозгового кровообращения. — М.: Медицина, 1980.— 420 с.5. Калашников В.И. Синдром позвоночной артерии: клинические варианты, классификация, принципы диагностики и лечения // Международный неврологический журнал. — 2010.— № 1(31). — С. 93-99.6. Евтушенко С.К., Гришина А.Б. Трентал как иммуномодулятор и ангиопротектор в терапии рассеянного склероза // Международный неврологический журнал. — 2009. — № 4. — С. 44-52.7. Кадырова Л.А., Марченко В.Г., Абдуллаев Р.Я., Артемен-ко И.П. Учет морфофункциональных особенностей краниовертебрального перехода в вопросах клиники и реабилитации // Проблеми медичної науки та освіти. — 2002.— № 1. — С. 45-48.8. Камчатнов П.Р., Гордеева Т.Н., Кабанов А.А. Кровоток в системах сонных и позвоночных артерий у больных с синдромом вертебробазилярной недостаточности // Труды Междунар. конф. «Современные подходы к диагностике и лечению нервных и психических заболеваний». — СПб.: РосВМедА, 2000. — С. 300.9. Попелянский Я.Ю. Болезни периферической нервной системы: Руководство для врачей. — М.: Медицина, 1989.— 463 с.10. Ратнер А.Ю. Шейный остеохондроз и церебральные нарушения. — Казань: 1992 г. Изд-во Казанского университета.— 231 с.11. Шток В.Н. Фармакотерапия в неврологии: Практическое руководство. — М.: ООО «Медицинское информационное агентство», 2003. — 301 с.
Источник
