Синдром левой сма что это такое

Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 16 марта 2020;
проверки требуют 5 правок.
Спина́льная мы́шечная атрофи́я (СМА; англ. spinal muscular atrophy, SMA) — разнородная группа наследственных заболеваний, протекающих с поражением / потерей двигательных нейронов передних рогов спинного мозга. Генетическое заболевание, при котором возможны все типы наследования: аутосомно-доминантный, аутосомно-рецессивный, Х-сцепленный, связанный с мутациями в генах SMN1 и SMN2, кодирующих белок, участвующий в синтезе сплайсосомы[2].
Для спинальных (их причина находится в спинном мозге) мышечных атрофий характерно нарушение работы поперечнополосатой мускулатуры ног, а также головы и шеи. У больных отмечаются нарушения произвольных движений — ползания младенцев, ходьбы, удержания головы, глотания. Мышцы рук обычно не страдают. Для спинальных амиотрофий характерно сохранение чувствительности, а также отсутствие задержки психического развития.
Общая информация[править | править код]
- СМА — одна из наиболее частых причин детской смертности, вызванной наследственными заболеваниями.
- Спинальные мышечные атрофии детского возраста наследуются по аутосомно-рецессивному типу.
- Ген спинальной мышечной атрофии картирован на 5-й хромосоме, q11.2 — 13.3[3].
- Ген СМА был идентифицирован в 1995 г., его обозначение SMN (survival motor neuron).
- В среднем один из 6000 — 10000 детей рождается со СМА, в разных странах частота сильно различается[4].
- 50 % детей с СМА не доживают до двух лет (это дети преимущественно с 1-й формой заболевания).
- SMA может проявиться в любом возрасте, «мягкие» формы проявляются в среднем и пожилом возрасте.
- В среднем каждый 50-й человек имеет рецессивный ген, способный вызывать СМА[4].
- В соответствии с менделевским расщеплением ребёнок двух носителей поражается СМА с вероятностью 25 %. В этом случае оба родителя несут одиночный дефектный ген, но защищены присутствием второго, нормального гена, который является вообще достаточным для нормальной функции организма. Две дефектных копии гена приводят к генному нарушению, так как не обеспечивается синтез необходимого белка.
- В ходе медико-генетического обследования нескольких российских и среднеазиатских популяций (1,8 млн человек) выявлено 33 больных спинальной мышечной атрофией (СМА): 29 с детской проксимальной СМА (СМА I—III) и 4 c редкими формами. Выявлено «перекрывание» проявлений разных типов СМА I—III (I—II и II—III) у части больных, внутрисемейные различия типов в 3 из 6 семейных случаев, клинико-генетический полиморфизм редких форм СМА. (Г. Е. Руденская, Р. А. Мамедова).
История и патогенез[править | править код]
Спинальная мышечная атрофия у детей впервые была описана Г. Верднигом (G. Werdnig) в 1891 году. Г. Вердниг представил описание патоморфологических изменений различных групп мышц, периферических нервов и спинного мозга, отметив симметричную атрофию клеток передних рогов спинного мозга и передних корешков. В 1892 г. J. Hoffmann обосновал нозологическую самостоятельность заболевания. В дальнейшем Г. Вердниг и Дж. Хоффман (1893) доказали, что заболевание сопровождается дегенерацией клеток передних рогов спинного мозга. В 1956 г. Е. Kugelberg и L. Welander выделили новую нозологическую форму спинальной мышечной атрофии, которая характеризуется более поздним началом и относительно доброкачественным течением по сравнению с описанной G. Werdnig и J. Hoffmann.
СМА вызвана мутацией в гене SMN1, который в норме производит белок SMN. Из-за мутации гена, у людей с СМА производится меньшее количество белка SMN, что приводит к потере моторных нейронов.
Классификация типов СМА[править | править код]
Выделяют четыре формы проксимальной спинальной амиотрофии на основе возраста начала, тяжести течения и продолжительности жизни[5].
| Тип | Эпоним | Обычный возраст начала | Описание | OMIM |
|---|---|---|---|---|
| I: Младенческий | СМА I, болезнь Верднига-Хоффмана[6] | 0-6 мес. | Наиболее неблагоприятная форма СМА. Дети испытывают недостаток моторного развития, имеют трудности с дыханием, затруднения с сосанием и глотанием, не держат голову, не сидят самостоятельно. | 253300 |
| II: Промежуточный | СМА II, болезнь Дубовица | 7-18 мес. | Больные этой формой спинальной амиотрофии дети могут есть, сидеть, но никогда не достигают способности ходить самостоятельно. Прогноз в этих случаях зависит от степени вовлечения в патологический процесс респираторных мышц. | 253550 |
| III: Юношеский | СМА III, болезнь Кюгельберга-Веландер | >18 мес. | Наименее опасная форма СМА детского возраста. Пациент способен стоять, но испытывает сильную слабость, с тенденцией к инвалидизации (передвижение в коляске). | 253400 |
| IV: Взрослый | СМА IV или взрослая форма | после 35 лет | Значительно не влияет на продолжительность жизни. Слабость проксимальной мускулатуры, фасцикуляции, снижение сухожильных рефлексов. Больные не способны ходить самостоятельно. | 271150 |
Лечение[править | править код]
Радикального лечения не существует.
Так как спинальная мышечная атрофия — нарушение, которое проявляется в синапсах моторных нейронов, состояние может быть улучшено за счёт увеличения уровня SMN — белка. Цель современных исследований — поиск препаратов, увеличивающих уровни SMN. Основные результаты получены[источник не указан 2080 дней] пока в исследовательских группах США, Германии, Италии.
Предложено несколько препаратов (вальпроевая кислота, бутират натрия и др.), проводятся их клинические исследования в группах добровольцев. Сведений о результативном применении стволовых клеток пока нет.
Больные СМА нуждаются в специальном диетическом питании, поддерживающей терапии и многих других попечительских действиях, иначе отмечается усиление отрицательной динамики.
В декабре 2016 в США был одобрен первый специализированный препарат для лечения СМА любого типа — «Спинраза» (Spinraza, нусинерсен). Нусинерсен (nusinersen), разработанный «Байоджен» (Biogen) и «Айонис фармасьютикал» (Ionis Pharmaceuticals), представляет собой антисмысловой олигонуклеотид для альтернативного сплайсинга пре-мРНК гена SMN2, который почти идентичен SMN1, и потому синтез полноразмерного белка SMN усиливается. «Спинраза» вводится интратекально[7][8].
В мае 2019 года FDA одобрило «Золдженсма» (Zolgensma, онасемноген абепарвовек) — генную терапию спинальной мышечной атрофии с биаллельной мутацией гена выживаемости моторных нейронов 1 (SMN1) у детей в возрасте младше двух лет. Препарат подходит как симптоматическим пациентам, так и предсимптоматическим, выявляемым генетическим тестированием. Регуляторное разрешение выдано «Авексис» (AveXis), которую «Новартис» (Novartis) купила за 8,7 млрд долларов. Онасемноген абепарвовек (onasemnogene abeparvovec, AVXS-101) представляет собой генотерапевтическое лечение, после единственной дозы обеспечивающее замену отсутствующего или дефектного гена SMN1 на его функциональную копию. Итогом становится нормальная выработка белка SMN — и соответствующее исцеление спинальной мышечной атрофии. Во всяком случае однократное введение «Золдженсма» демонстрирует, что пациенты начинают не только избавляться от зависимости в ИВЛ, но и демонстрировать существенное улучшение моторных навыков (способность сидеть, вставать, ходить), в ряде случаев полностью отвечающих нормальному возрастному развитию[9].
«Рош» (Roche) продолжает разработку рисдиплама (risdiplam), который, работая по аналогии с нусинерсеном, характеризуется существенным преимуществом, поскольку сделан в пероральной рецептуре[10].
Профилактика[править | править код]
Возможна только пассивная профилактика — консультирование родителей с риском СМА о возможных последствиях и пренатальная ДНК-диагностика во время беременности[5] через биопсию ворсин хориона для принятия решения о рождении или прерывании беременности.
Другие формы спинальных мышечных атрофий[править | править код]
Кроме спинальных амиотрофий, обусловленных мутацией в генах SMN1 или SMN2 на длинном плече 5-й хромосомы (5q13.2), вызывающих поражение проксимальных мышц, существует множество схожих заболеваний, большинство из которых — с преимущественным поражением дистальных (то есть ближе к свободному концу конечности) мышц.
| Наименование и синонимы | OMIM | Ген | Локус | Тип наследования | Описание |
| X-сцепленная Спинальная амиотрофия 1-го типа (SMAX1), Spinal and bulbar muscular atrophy (SBMA), Kennedy’s disease (KD) | 313200 | NR3C4 | Xq12 | Х-сцепленный, рецессивный | Позднее начало (в 40-60 лет), медленное прогрессирование, участие в процессе бульбарной группы черепных нервов, нисходящее распространение параличей |
| X-сцепленная Спинальная амиотрофия 2-го типа (SMAX2), Arthrogryposis multiplex congenita — X-linked type 1 (AMCX1) | 301830 | UBA1 | Xp11.23 | Х-сцепленный, рецессивный | Врождённая гипотония и арефлексия вследствие дегенерации и потери двигательных нейронов передних рогов спинного мозга и ствола головного мозга. Часто сочетается с врождёнными контрактурами и/или переломами. Интеллектуальное развитие нормальное. Заболевание быстро прогрессирует, приводя к смерти пациентов до 3-месячного возраста. |
| X-сцепленная Спинальная амиотрофия 3-го типа (SMAX3), Distal spinal muscular atrophy — X-linked (DSMAX) | 300489 | ATP7A | Xq21.1 | Х-сцепленный, рецессивный | Поражены дистальные мышцы всех конечностей, почти всегда у мальчиков, медленно прогрессирующее. |
| Дистальная Спинальная амиотрофия (DSMA1), Spinal muscular atrophy with respiratory distress type 1 (SMARD1), Distal hereditary motor neuropathy type 6 (HMN6) | 604320 | IGHMBP2 | 11q13.3 | Аутосомно-рецессивный | Признаки проявляются с самого рождения, реже во внутриутробном периоде. Заболевание характеризуется преимущественным поражением мышц верхних конечностей и развитием тяжёлых респираторных осложнений из-за прогрессирующей дегенерации мотонейронов передних рогов спинного мозга. |
| Дистальная Спинальная амиотрофия 2-го типа (DSMA2), Distal hereditary motor neuropathy — Jerash type (HMN-J) | 605726 | ? | 9p21.1-p12 | Аутосомно-рецессивный | Медленно прогрессирующее, описано только в одной семье |
| Дистальная Спинальная амиотрофия 3-го типа (DSMA3), Distal hereditary motor neuropathy types 3 & 4 (HMN3, HMN4) | 607088 | ? | 11q13.3 | Аутосомно-рецессивный | Медленно прогрессирующее |
| Дистальная Спинальная амиотрофия 4-го типа (DSMA4) | 611067 | PLEKHG5 | 1p36.31 | Аутосомно-рецессивный | Медленно прогрессирующее, описано только в одной семье |
| Дистальная Спинальная амиотрофия 5-го типа (DSMA5) | 614881 | DNAJB2 | 2q35 | Аутосомно-рецессивный | Начинается в молодом взрослом возрасте, медленно прогрессирующее. |
| Дистальная Спинальная амиотрофия VA-типа (DSMAVA), Distal hereditary motor neuropathy type 5A (HMN5A) | 600794 | GARS | 7p14.3 | Аутосомно-доминантный | Преобладает поражение верхних конечностей. |
| Дистальная Спинальная амиотрофия VB-типа (DSMAVB), Distal hereditary motor neuropathy type 5B (HMN5B) | 614751 | REEP1 | 2p11 | Аутосомно-доминантный | Преобладает поражение верхних конечностей. |
| Дистальная Спинальная амиотрофия с преимущественным поражением голеней, Distal hereditary motor neuropathy type 2D (HMN2D) | 615575 | FBXO38 | 5q32 | Аутосомно-доминантный | Проявляется в юношестве или у взрослых, медленно прогрессирует, поражает проксимальные и дистальные мышцы, сначала проявляется слабость в голенях, которая распространяется и на руки. |
| Дистальная спинальная амиотрофия с преимущественным поражением голосовых связок, Distal hereditary motor neuropathy type 7A (HMN7A), Harper-Young myopathy. | 158580 | SLC5A7 | 2q12.3 | Аутосомно-доминантный | Проявляется у взрослых параличом голосовых связок, очень редкое заболевание. |
| Аутосомно-доминантная Спинальная амиотрофия, Distal hereditary motor neuropathy type 2A (HMN2A) | 158590 | HSPB8 | 12q24.23 | Аутосомно-доминантный | Проявляется у взрослых. Аллельный вариант болезни Шарко-Мари-Тутса (CMT2L) |
| Аутосомно-доминантная ювенильная Спинальная амиотрофия, Distal hereditary motor neuropathy type 1 (HMN1) | 182960 | ? | 7q34-q36 | Аутосомно-доминантный | Проявляется в юном возрасте |
| Врождённая дистальная Спинальная амиотрофия | 600175 | TRPV4 | 12q24.11 | Аутосомно-доминантный | Поражение двигательных нейронов спинного мозга, иннервирующих нижнюю часть тела. Проявляется непрогрессирующей мышечной атрофией, атрофией мышц бёдер, мышц-разгибателей стопы, слабостью в коленях. Формируются контрактуры в коленных суставах и деформируются стопы. У некоторых пациентов может наблюдаться паралич голосовых связок. |
| Лопаточно-малоберцовая Спинальная амиотрофия (SPSMA), Scapuloperoneal neurogenic amyotrophy | 181405 | TRPV4 | 12q24.11 | Аутосомно-доминантный или Х-сцепленный, доминантный | Поражает мышцы нижних конечностей. Очень редкое заболевание. Аллельный вариант Врождённой дистальная Спинальной амиотрофии. |
| Ювенильная сегментальная Спинальная амиотрофия (JSSMA) | 183020 | ? | 18q21.3 | ? | Начинается в юности, прогрессирует 2-4 года, после чего стабилизируется, влияет в первую очередь на руки, очень редкое. |
| Спинальная амиотрофия Финкеля, Finkel-type proximal spinal muscular atrophy (SMA-FK) | 182980 | VAPB | 20q13.32 | Аутосомно-доминантный | Средний возраст манифестации заболевания 37 лет (известны случаи в возрасте до 12 лет). Симметричная мышечная слабость и истощение мышц. Медленная потеря мышечной силы и прогрессирующая проксимальная атрофия, которая начинается в ногах и со временем распространяется на руки. Также у больных наблюдаются генерализованные фасцикуляции, гипоактивность или отсутствие глубоких сухожильных рефлексов. |
| Спинальная амиотрофия Джокела, Jokela-type spinal muscular atrophy (SMA-J) | 615048 | ? | 22q11.2-q13.2 | Аутосомно-доминантный | Позднее начало, медленно прогрессирование, поражает проксимальные и дистальные мышцы у взрослых. |
| Спинальная амиотрофия с преимущественным поражением нижних конечностей 1, Spinal muscular atrophy with lower extremity predominance 1 (SMALED1) | 158600 | DYNC1H1 | 14q32 | Аутосомно-доминантный | Поражает проксимальные мышцы у младенцев. |
| Спинальная амиотрофия с преимущественным поражением нижних конечностей 2, Spinal muscular atrophy with lower extremity predominance 2 (SMALED2) | 615290 | BICD2 | 9q22.31 | Аутосомно-доминантный | Врождённое или с ранним началом, поражающее преимущественно нижние конечности, не прогрессирует, очень редкое. |
| Спинальная амиотрофия с прогрессирующей миоклонической эпилепсией, Spinal muscular atrophy with progressive myoclonic epilepsy (SMA-PME), Jankovic-Rivera syndrome. | 159950 | ASAH1 | 8p22 | Аутосомно-рецессивный | Медленно прогрессирует, преимущественно поражает дистальные мышцы, сочетается с денервацией и миоклоническими приступами. |
| Спинальная амиотрофия с атрофия с врожденными переломами костей, Spinal muscular atrophy with congenital bone fractures (SMA-CBF) | 271225 | ? | ? | Аутосомно-рецессивный? | Тяжёлое истощение мышц (как при болезни Верднига-Гоффмана), сопровождается врожденными переломами костей. |
| Спинальная амиотрофия с понтоцеребеллярной гипоплазией, Spinal muscular atrophy with pontocerebellar hypoplasia (SMA-PCH), Pontocerebellar hypoplasia type 1A (PCH1A) | 607596 | VRK1 | 14q32 | Аутосомно-доминантный | Описано восемь типов понтоцеребеллярной гипоплазии. Частота заболеваний неизвестна. Все формы заболевания имеют общие признаки: аномальное развитие головного мозга, проблемы с двигательной активностью, задержку развития, умственную неполноценность, прогрессирующую микроцефалию и церебральные проявления различной степени. Заболевание проявляется с рождения, в ряде случаев первые признаки отмечаются уже внутриутробно. Пациенты, как правило, погибают в раннем детском возрасте. |
| Ювенильная асимметричная сегментальная Спинальная амиотрофия, Juvenile asymmetric segmental spinal muscular atrophy (JASSMA), Monomelic amyotrophy; Hirayama disease; Sobue disease | 602440 | ? | ? | ? | Болезнь мотонейронов, которая поражает молодых (15-25-летних) мужчин в Индии и Японии. Начинается с мышечной атрофии, которая стабилизируется в плато после 2-5 лет, симптоматика не меняется. Нет боли или потери чувствительности. В отличие от других более низких мотонейронных болезней, MMA, как полагают, не наследуется и редко проявляется фасцикуляциями. |
Ссылки[править | править код]
- Отдел по подготовке родителей детей с СМА, Милан, Италия
- Украинский Фонд для помощи пациентам с СМА, украинский реестр
- форум по СМА
- Российский Благотворительный фонд «Семьи СМА»
- Европейская сеть нервномышечных заболеваний (СМА, DMD, международный регистр)
- SMA Europe
- (англ. Фонд Великобритании) — Jennifer Trust
- (англ. Фонд Великобритании) — The SMA Trust
- (недоступная ссылка) (англ. Фонд США) — Families of Spinal Muscular Atrophy (недоступная ссылка)
- (англ. Фонд США) — Fight Spinal Muscular Atrophy
- Статья о конверсии между генами при СМА, северо-западный регион России
- Лопаточно-бедренная спинальная мышечная атрофия // Неврологический журнал, № 2, 1998)
- «Золдженсма»: генная терапия, которая вылечит спинальную мышечную атрофию. Все подробности
- Рисдиплам: год лечения спинальной мышечной атрофии
См. также[править | править код]
- Боковой амиотрофический склероз (OMIM 105400)
- Детский церебральный паралич
Литература[править | править код]
- А.Н. Бакланов, С.В. Колесов, И.А. Шавырин. Хирургическое лечение тяжелых нейромышечных сколиозов у пациентов, страдающих спинальной мышечной атрофией // Хирургия позвоночника. — 2011. — № 3. — С. 31-37. — ISSN 1810-8997.
Примечания[править | править код]
- ↑ 1 2 Disease Ontology release 2019-05-13 — 2019-05-13 — 2019.
- ↑ 600354/SURVIVAL OF MOTOR NEURON 1; SMN1 (англ.). OMIM. Johns Hopkins University. Дата обращения 3 июля 2017.
- ↑ Su Y. N., Hung C. C., Lin S. Y., Chen F. Y., Chern J. P., Tsai C., Chang T. S., Yang C. C., Li H., Ho H. N., Lee C. N. Carrier screening for spinal muscular atrophy (SMA) in 107,611 pregnant women during the period 2005-2009: a prospective population-based cohort study. (англ.) // Public Library of Science ONE. — 2011. — Vol. 6, no. 2. — P. e17067. — doi:10.1371/journal.pone.0017067. — PMID 21364876.
- ↑ 1 2 Sugarman E. A., Nagan N., Zhu H., Akmaev V. R., Zhou Z., Rohlfs E. M., Flynn K., Hendrickson B. C., Scholl T., Sirko-Osadsa D. A., Allitto B. A. Pan-ethnic carrier screening and prenatal diagnosis for spinal muscular atrophy: clinical laboratory analysis of >72,400 specimens. (англ.) // European journal of human genetics : EJHG. — 2012. — Vol. 20, no. 1. — P. 27—32. — doi:10.1038/ejhg.2011.134. — PMID 21811307.
- ↑ 1 2 Спинальная амиотрофия I, II, III, IV типа… // Центр молекулярной генетики Медико-генетического научного центра.
- ↑ vocabulary.ru: Болезнь Верднига-Хоффмана (Werdnig-Hoffmann Disease).
- ↑ Regulatory Applications for SMA Therapy Nusinersen Accepted in US, EU. BioNews Services, LLC.
- ↑ Grant, Charley. Surprise Drug Approval Is Holiday Gift for Biogen (27 декабря 2016).
- ↑ «Золдженсма»: генная терапия, которая вылечит спинальную мышечную атрофию. Все подробности, Mosmedpreparaty.ru.
- ↑ Рисдиплам: год лечения спинальной мышечной атрофии, Mosmedpreparaty.ru.
Источник
В статье рассматриваются варианты речевых нарушений и варианты изменений вещества головного мозга при инсульте в бассейне левой средней мозговой артерии
Введение
Для клиники левополушарных инсультов характерны речевые нарушения, среди которых наиболее значимой является афазия. Афазия, проявившаяся остро, указывает на нарушение кровообращения в бассейне средней мозговой артерии (СМА) [1].
Речевые процессы, как правило, обнаруживают значительную степень латерализации и у большинства людей зависят от ведущего (доминантного) полушария [2]. Необходимо учитывать, что в определении доминантного полушария, ответственного за речь, подход, связывающий доминантность только с праворукостью или леворукостью, является упрощенным. Профиль распределения функций между полушариями обычно многообразен [2, 3], что отражается на степени речевых нарушений и возможностях восстановления речи [4]. Многие люди проявляют лишь частичную и неодинаковую доминантность полушария в отношении разных функций [2]. Наряду с тем, что функция речи у правшей (≥90%) и большинства левшей (>50%) связана преимущественно с левым полушарием [1,4], существуют три исключения из этого правила:
1. Менее чем у 50% левшей функция речи связана с правым полушарием.
2. Аномическая (амнестическая) афазия может возникать при метаболических расстройствах и объемных процессах в головном мозге.
3. Афазия может быть связана с поражением левого таламуса [1].
Так называемую перекрестную афазию (афазию, вызванную ипсилатеральным к доминирующей руке церебральным поражением) в настоящее время относят только к правшам [4].
Область коры, ответственная за функцию речи, расположена вокруг Сильвиевой и Ролландовой борозд (бассейн СМА). Продукцию речи определяют четыре зоны этой области, тесно связанные между собой и расположенные последовательно вдоль заднепередней оси: зона Вернике (задняя часть верхней височной извилины), угловая извилина, дугообразный пучок (ДП) и зона Брока (задняя часть нижней лобной извилины) (рис. 1, 2) [1].


ДП представляет собой подкорковые волокна белого вещества, соединяющие зону Брока и зону Вернике. Есть сведения, что в левом полушарии ДП встречается в 100% случаев, тогда как в правом – только в 55% [5]. Ряд исследователей считают, что имеется несколько проводящих путей, участвующих в обеспечении речевой функции [6, 7]. Другие авторы получили достоверное подтверждение только роли ДП [8].
Патогенез дизартрических расстройств речи обусловливается различными по локализации очаговыми поражениями мозга. Нередко наблюдаются сложные формы дизартрии [9].
Цель исследования: изучить соотношение объема поражения головного мозга при инсульте в бассейне левой СМА и степени нарушения речи.
Материал и методы
В приемный покой КГБУЗ «Городская больница № 5» за 4-месячный период с подозрением на ОНМК поступили 356 человек. Все пациенты обследованы неврологом в приемном покое больницы, проведена оценка неврологического дефицита, отражено наличие/отсутствие нарушений речи. В дальнейшем, если состояние пациентов позволяло, им проводилось логопедическое исследование, в большинстве случаев – на следующий день после поступления в стационар.
В 124 случаях (каждый третий пациент) поставлен предварительный диагноз: ОНМК в бассейне левой средней мозговой артерии (ЛСМА). Данная локализация наиболее актуальна при изучении афазии у больных с ОНМК.
Всем пациентам при поступлении и большинству пациентов в динамике проводилась КТ головного мозга (томограф Bright Speed 16) с целью подтверждения/исключения очагового поражения головного мозга и уточнения объема поражения и локализации патологического участка.
По результатам КТ головного мозга у 32 (25,8%) человек из 124 выявлены типичные ишемические изменения в бассейне ЛСМА, из них у 7 при исследовании в динамике, т. е. при поступлении изменения еще не были явными (начальная стадия инсульта). В 5 (4,0%) случаях выявлены кровоизлияния: левосторонние медиальные гематомы и 1 случай субарахноидального кровоизлияния (САК). В 5 (4,0%) случаях из 124 выявлены инфаркты другой локализации (не в бассейне ЛСМА) (табл. 1).

В 22 (17,7%) случаях по данным КТ головного мозга не выявлено инфаркта в зоне интереса, но пациенты были госпитализированы в первичное неврологическое отделение для больных с ОНМК, т. к. у них выявлена значимая неврологическая симптоматика: явления атрофии вещества головного мозга, сосудистые очаговые изменения, сосудистый лейкоареоз, постинфарктные кисты. К этой группе отнесены также пациенты, у которых клиника была обусловлена транзиторной ишемической атакой.
В 60 (48,4%) случаях пациенты не были госпитализированы. В большинстве случаев ОНМК не подтвердилось (нет соответствующих изменений по данным КТ и в неврологическом статусе). В число не госпитализированных в отделение ОНМК вошли также пациенты с различными вариантами атрофии вещества головного мозга в сочетании со значимой неврологической симптоматикой, которые отказались от предложенной госпитализации. Единичные пациенты переведены в другие стационары, т. к. у них были выявлены травматические изменения черепа, головногомозга, новообразования. Часть пациентов переведена в дежурное отделение неврологии другого стационара, например, с диагнозом «остеохондроз».
У 64 пациентов, госпитализированных в отделение ОНМК с инсультом, имелись нарушения речи (табл. 2). Детальный характер речевых нарушений определен логопедом. В 20 (31,2%) случаях у пациентов выявлены дизартрия и отсутствие афазии. В 2 случаях дизартрии сопутствовали дисфония и дисфагия. Выявлена афазия у 44 (68,8%) человек, из них в 7 случаях она регрессировала к моменту консультации логопедом на следующий день (в 2 случаях при регрессе афазии выявлены ишемические инфаркты). У 3 человек из группы с сенсомоторным вариантом афазии отмечалась выраженная дизартрия, у 9 человек – дисфагия. У 4 человек из группы с моторной афазией отмечались также явления дизартрии, в 1 случае – выраженная дизартрия.
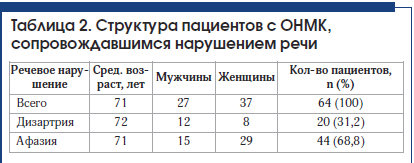
Двум пациентам-левшам, у которых первоначально подозревался инсульт в бассейне левой СМА, с учетом результатов КТ головного мозга был поставлен диагноз: «Инсульт в бассейне правой СМА». В одном случае имелась афазия, которая регрессировала за 24 ч, в другом случае отмечена дизартрия.
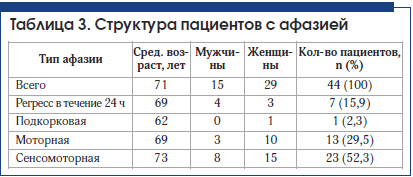
У пациентов с дизартрией без афазии выявлено 4 вида дизартрии: экстрапирамидная (3 случая), афферентная корковая (1 случай), бульбарная (1 случай), псевдобульбарная (8 случаев), в остальных случаях четко определить вид дизартрии было затруднительно, проявления были слабовыраженными (табл. 3).
В группах пациентов с дизартрией и регрессом афазии в течение 24 ч отмечается небольшое преобладание мужчин.
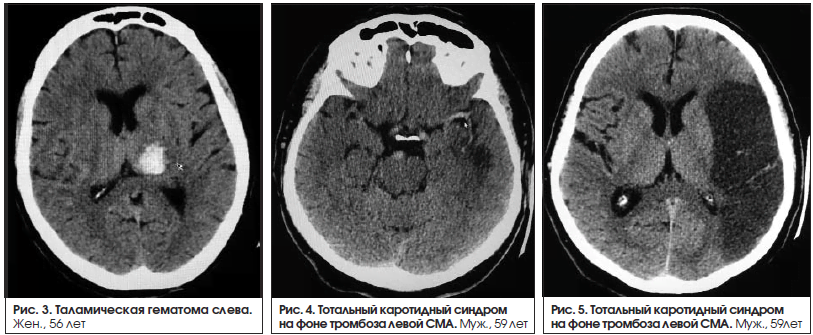
Афазии наблюдаются при поражениях коры головного мозга. В одном случае причиной афазии было поражение подкорковых структур левого полушария (медиальная внутримозговая гематома в таламусе (рис. 3). Нарушения речи в таких случаях не соответствуют ни одному из основных типов афазий. Поражение подкорковых структур можно заподозрить в тех случаях, когда амнестическая афазия сочетается с дизартрией или афазия – с гемипарезом. У данного пациента наблюдался правосторонний гемипарез 4 балла.
По классификации ишемических инсультов TOAST у госпитализированных пациентов с речевыми нарушениями выявлены следующие типы инсультов: в группе пациентов с сенсомоторной афазией наиболее частым был криптогенный вариант (47,6% случаев), на 2-м месте – кардиоэмболический (28,6%), на 3-м – атеротромботический (23,8%), отмечалась наибольшая частота повторных инсультов. В группе пациентов с моторной афазией также наиболее частым оказался криптогенный вариант, но в меньшем проценте случаев (41,7%), на 2-м месте – атеротромботический вариант (25,0%), на 3-м – кардиоэмболический (16,7%). В группе с дизартрией наиболее часто встречался лакунарный вариант (38,9% случаев), на 2-м месте – кардиоэмболический и криптогенный варианты (каждый по 22,2% случаев).
В группе больных с сенсомоторной афазией (23 человека) в 39,1% (9 человек) случаев у больных с сенсомоторной афазией был выявлен крупный инфаркт в бассейне ЛСМА доминантного полушария (рис. 4–6). В 47,8% (11 человек) случаев выявлен инфаркт малых размеров (рис. 7).

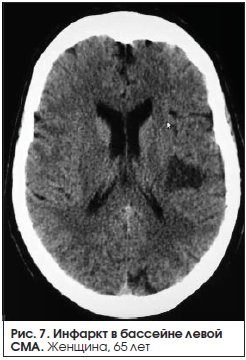
В 1 (4,3%) случае диагностировано САК вследствие разрыва аневризмы передней соединительной артерии, которое сочеталось с внутрижелудочковым кровоизлиянием. В 2 (8,7%) случаях КТ при поступлении и в динамике не выявила достоверного «свежего» участка инфаркта и постинфарктных изменений, у пациентов отмечены значительная атрофия вещества головного мозга, выраженный сосудистый лейкоареоз, клинический диагноз в обоих случаях: «Повторный ишемический инсульт в бассейне ЛСМА».
Основными группами сравнения стали 3 группы пациентов: с дизартрией (20 человек), моторной афазией (13 человек) и сенсомоторной афазией (23 человека). Критериями сравнения были объем и характер поражения, состояние сознания, сроки восстановления речи.
В таблице 4 в скобках указаны случаи соответствия локализации патологических изменений функционально-анатомическим зонам (при сенсомоторной афазии – обширной зоне вокруг Сильвиевой борозды; при моторной афазии – центру Брока; при дизартрии – локальным изменениям на уровне среднего мозга, подкорковых структур, коры).

Выявлены 3 медиальные гематомы слева, 2 из которых таламические (одна сопровождалась моторной афазией, другая – дизартрией), 1 – таламическая с распространением на внутреннюю капсулу (сопровождалась дизартрией). В одном случае в группе пациентов с дизартрией патологических изменений не выявлено, дизартрия регрессировала менее чем за 24 ч (табл. 5).

Случаев сопора и комы не было.
Достичь значительного улучшения речи у больных с сенсомоторной афазией в стационаре часто не удается (табл. 6). Поэтому логопед дает рекомендации каждому больному продолжать занятия в домашних условиях.
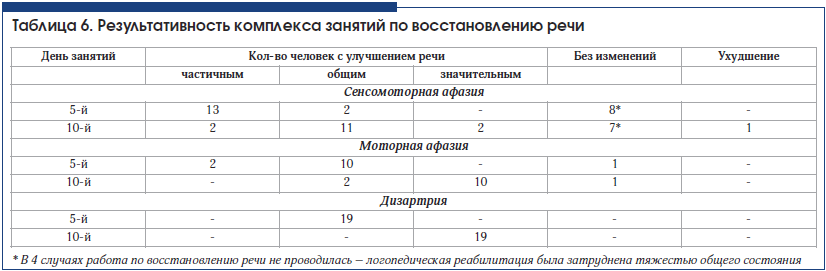
Результаты
Типичные «свежие» ишемические изменения, сопровождавшиеся афазией, по результатам КТ головного мозга выявлены у 30 человек. У половины из них диагностирована сенсомоторная афазия, и в свою очередь только у половины очаги поражения захватывали большую область вокруг Сильвиевой борозды. Не всегда локализация очагов поражения четко соответствовала локализации корковых речевых центров. Во всех 3 случаях медиальных гематом отмечены хорошая результативность восстановления речи (1 случай моторной афазии и 2 случая дизартрии), ее значительное улучшение.
Эти данные находят подтверждение в исследованиях афазического синдрома, проведенных во второй половине ХХ в., согласно которым у больных, переживших геморрагический инсульт, имеются возможности для восстановления речи, можно рассчитывать на благоприятный прогноз [10, 11]. В динамике степень нарушения речи, как правило, уменьшалась на фоне комплексного лечения, в т. ч. при сохранении гемодинамически значимого стеноза внутренней сонной артерии (по данным ультразвукового дуплексного сканирования), но при отсутствии рецидива инсульта или выраженной геморрагической трансформации.
Выводы
1. Сенсомоторная афазия при ишемическом инфаркте головного мозга может возникать как при поражении обширной области вокруг Сильвиевой борозды доминантного полушария, так и при локальном поражении в зоне одного из речевых корковых центров или зоне белого вещества между ними.
2. У больных с сенсомоторной афазией, вызванной инсультом, чаще, чем в других группах, отмечено оглушенное сознание, несмотря на то, что размер подтвержденного инфаркта более чем в половине случаев не был большим.
3. Фактические границы речевых центров индивидуально, по всей видимости, варьируют, поэтому не всегда обнаруживается совпадение точности предполагаемого анатомического поражения степени функциональных нарушений (афазии).
4. Полное соответствие объема выявленного инфаркта мозга объему речевых нарушений было отмечено в группе больных с сенсомоторной афазией, когда инфаркт был крупным.
5. Афазический синдром чаще встречается при криптогенном варианте ишемического инсульта, сенсомоторный вариант афазии часто возникает при повторных инсультах.
6. С учетом менее выраженной динамики восстановления речи в группе больных с сенсомоторной афазией этим больным следует продолжать логопедические занятия после выписки, чтобы достичь значительного/полного восстановления.
Источник
