Синдром лебера лечение и прогноз

 Синдром Лебера – это редкое врожденное заболевание, ассоциирующееся с нарушениями зрения. В основе лежит нарушение клеточных органелл, митохондрий. Заболевание встречается у 1 человека на несколько десятков тысяч здоровых людей.
Синдром Лебера – это редкое врожденное заболевание, ассоциирующееся с нарушениями зрения. В основе лежит нарушение клеточных органелл, митохондрий. Заболевание встречается у 1 человека на несколько десятков тысяч здоровых людей.
Наследственная оптическая нейропатия Лебера (англ.: Leber optic atrophy = Leber hereditary optic neuropathy, LHON) – это редкое наследственное заболевание, вызывающее нарушения зрения. Болезнь чаще всего встречается в возрасте 27-34 лет, преимущественно поражает мужчин.
Болезнь была впервые диагностирована немецким офтальмологом Альбрехтом фон Граефом в 1858 г, но название получила в честь его ассистента Теодора Лебера, позже описавшего клиническое течение заболевания у 15 пациентов. Атрофия Лебера – первое заболевание, связанное с материнской наследственностью и специфической точечной мутацией в митохондриальной ДНК (мтДНК).
Диагностика болезни затруднена из-за низкой заболеваемости, свидетельствующей о наличии этого расстройства в семье. Для исключения других причин нарушения зрения необходимо офтальмологическое обследование. Целесообразно выполнение генетического исследования для подтверждения мутации.
Патогенез, этиология, причины
Причина болезни Лебера – генетическая мутация в ДНК, происходящая в митохондриях.
Митохондрии – это органеллы в клетках, ответственные за клеточный энергетический обмен. При этой болезни практически исключительно затрагиваются RGB, формирующие зрительный нерв.
Одно из возможных объяснений селективного поражения RGB – их высокая потребность в непрерывной доставке АТФ (аденозинтрифосфата, англ.: ATP). Гистохимические исследования показали повышенное накопление митохондрий в области пластинки cribrosa sclerae, где немиелинизированные нервные волокна выступают из сетчатки, образуя зрительный нерв.
Эта область богата ферментами Na+/K+ATP, что делает локальное нервное ведение чрезвычайно сложным процессом, и может объяснить исключительную уязвимость волокон зрительного нерва. Дефект митохондриального метаболизма приводит к локальному застою аксоплазмы с отеком. В дальнейшем это способствует дегенерации слоя RGB и их аксонов, образующих зрительный нерв.
Вопреки этой теории, фоторецепторы, сохраняющиеся при заболевании, имеют более высокие окислительные потребности, чем RGB. Кроме того, другие митохондриальные заболевания с более тяжелым комплексным расстройством не всегда приводят к развитию атрофии зрительного нерва. Поэтому возможно, что RGB более чувствительны к незначительным отклонениям окислительно-восстановительного потенциала клеток и образованию радикалов кислорода, чем к дефициту АТФ.

Генетика: как, кому и когда передается болезнь

Митохондриальный шаблон наследования синдрома Лебера
Наследственная атрофия зрительных нервов Лебера опосредуется мутацией ДНК в митохондриях, которую человек (преимущественно, мужского пола) всегда получает от матери, поскольку только яйцеклетка передает свои митохондрии зарождающемуся эмбриону (митохондрии отцовской спермы не передаются).
Хотя подавляющее большинство пациентов с болезнью Лебера имеют гомоплазматические мутации, 10-15% мутаций – гетероплазматические. За отличия в межиндивидуальных фенотипах может быть ответственна тканеспецифичная сегрегация. Некоторые исследования показывают, что риск для пациентов минимален, если гетероплазма составляет менее 60%. Сыновья матерей, у которых уровни гетероплазмы ≤80%, с меньшей вероятностью будут страдать от болезни.
Обсуждаемый вопрос – появление синдрома Лебера у женщин-носителей мутаций, которые, в зависимости от генетического фона, имеют значительно меньшую пенетрантность, чем мужчины. Некоторые исследования предполагают, что причина дифференцированной пенетрантности – модифицирующий Х-связанный ген, приводящий к проявлению заболевания у женщин только в гомозиготном состоянии. Второй предполагаемый фактор – Х-инактивация «wild-type» Х-хромосомы.
Клиническая картина
Проявления нейропатии Лебера:
- внезапное безболезненное поражение обоих глаз;
- снижение остроты зрения;
- скотомы (темные пятна) в поле зрения;
- потеря цветового зрения;
- слепота;
- у женщин иногда наблюдаются симптомы, похожие на рассеянный склероз.
Шел 1994 год. В офтальмологическую клинику обратился 40-летний пациент с проблемой внезапной потери зрения на обоих глазах. При составлении анамнеза врачи определили, что изначально произошла потеря зрения на одном глазу, затем – на втором. Постепенная слепота не сопровождалась болью. Врачам пациент сообщил, что его брат (на 2 года младше) также несколько лет назад ослеп на один глаз.
Пациент прошел ряд обследований. Но все выводы были негативными, кроме выявления нарушения сердечного ритма. Также было исключено большинство офтальмологических диагнозов, которые могли бы объяснить безболезненную и быструю потерю зрения.
Так можно характеризовать клинический случай синдрома Лебера.
Диагностика и исследования
Подозрение на болезнь часто определяется окулистом или неврологом на основании анамнеза, оценки подробного осмотра глаз, состоящего из контроля остроты зрения, поля зрения, контрастной, цветовой чувствительности.
Золотой стандарт лабораторной диагностики – молекулярно-генетический анализ распространенных мутаций, проводимый из образцов крови или мазка из слизистых оболочек щек. Это обследование проводится у пациентов с уже развитыми нарушениями зрения в рамках дифференциальной диагностики синдрома Лебера, или у бессимптомных членов семьи, еще не подвергавшихся сложному диагностическому процессу. Но у бессимптомных пациентов молекулярно-генетическое тестирование не может предсказать развитие заболевания.
Для исключения распространенных мутаций целесообразно рассмотреть секвенирование генов мтДНК, кодирующих субъединицы в митохондриях, выделенных из мышечной биопсии.

Современные методы лечения
Лечение болезни Лебера – сложный процесс. Пациент должен отказаться от курения, максимально сократить употребление алкоголя, чтобы не повредить зрительный нерв. В терапии также используются некоторые витаминные и оксидазоснижающие соединения, но их эффект спорный.
До недавнего времени единственным вариантом облегчить течение болезни Лебера был коэнзим Q10, который посредством сукцинатдегидрогеназы обходит нефункциональный митохондриальный комплекс, увеличивая продукцию АТФ путем окислительного фосфорилирования.
Но это вещество обладает высокой липофильностью, и при пероральном введении его проникновение в митохондрии вызывает сомнения. Эффективность коэнзима Q10 никогда не была продемонстрирована в клинических исследованиях.

В последние годы было проведено несколько исследований для тестирования новых лекарственных средств. Предположительно, они положительно влияют на стабилизацию и восстановление зрительных функций. Особенно перспективны аналоги Убихинона с короткой цепью: Идебенон и α-токотриенолхинон (EPI-743), замещающие функцию дисфункционального комплекса.
Последствия и прогноз
Генетическая мутация приводит к нарушению функции зрительного нерва, вызывает нарушения зрения. Эти расстройства проявляются относительно рано – у старших подростков и молодых людей. Поражаются оба глаза, снижается острота зрения, в поле зрения могут появляться глазные капли с темными пятнами, переходящие в постоянное явление. Многие пациенты практически теряют зрение.
Профилактика
Поскольку атрофия зрительного нерва Лебера – это наследственная болезнь, ее профилактика сложная. В превентивных целях целесообразно вовремя лечить проблемы, способные стать причиной расстройства.
Следующий пункт – избегание любых ЧМТ, глазных травм. Важен также здоровый образ жизни, отказ от курения, потребления алкоголя.
Источник
Резкое двустороннее снижение остроты зрения может говорить о развитии опасной патологии — оптической нейропатии Лебера. Такое заболевание чаще затрагивает молодых людей мужского пола. Рассмотрим причины патологии, симптомы и особенности терапии в статье.
Впервые случаи заболевания, при котором острота зрения стремительно снижается из-за атрофии зрительного нерва, были описаны в 1871 году Теодором Лебером. Ученый наблюдал за развитием патологии у молодых людей из нескольких родственных семей, что указывало на наследственную причину заболевания. Механизм наследования болезни был тщательно изучен, поэтому удалось доказать, что патология передается по материнской линии преимущественно мужчинам.

До сих пор характер заболевания недостаточно хорошо изучен для того, чтобы удалось найти эффективные методы лечения такой болезни. Сейчас лечение больных заключается в поддерживающей терапии, но периодически группы ученых представляют новые методики генной терапии для клинических исследований, что, конечно, вселяет надежду людям с подобным диагнозом.
Оптическая нейропатия Лебера: симптомы, лечение болезни
Любые нарушения зрения, стремительно прогрессирующие, должны быть тщательно изучены и комплексно продиагностированы. Оптическая нейропатия Лебера редко сопровождается недомоганием, характерным для неврологических заболеваний, при этом зрение падает быстро, иногда даже не в течение нескольких месяцев, а за две-три недели. При такой остроте, зрение невозможно проверить по таблице Сивцева, потому что человек попросту не видит знаков, поэтому применяют аппаратную диагностику и метод «счета пальцев» на определенном расстоянии от лица пациента. Особенность заболевания в том, что зрительный нерв поражается из-за мутации гена. Вырабатывается избыточное количество токсичных молекул кислорода, что негативно сказывается на состоянии клеток нерва и зрение снижается.

Оптическая нейропатия Лебера — симптомы и особенности болезни:
молодой возраст пациентов — 18-35 лет;
болезнь чаще развивается у мужчин;
быстрая односторонняя, а затем и двусторонняя потеря зрения;
острота зрения снижается в течение нескольких недель;
нарушение цветового восприятия красного и зеленого цветов;
патология может сопровождаться симптомами, присущими митохондриальным болезням (судороги, нарушение проводимости сердца).
При атрофии зрительного нерва Лебера чаще всего процесс развития болезни начинается с одного глаза, но нередки случаи, когда поражаются сразу два глаза. Центральное зрение снижается постоянно. Это связано с постепенной смертью клеток зрительного нерва, передающего информацию об изображении в головной мозг. Иногда болезнь может сопровождаться симптомами, характерными для неврологических заболеваний. В этом случае больной человек страдает от дистонии, тремора, атаксии. Реже в начале развития патологии человек замечает искры, пятна, яркие вспышки перед глазами.
Причины наследственной оптической нейропатии Лебера
Причины нейропатии Лебера, при которой атрофируется зрительный нерв, — генетические. Болезнь, обусловленная специфической мутацией генов митохондрий, передается женщинами своему потомству. Мужчины и женщины наследуют патологию от матери. Почему так происходит? Огромное количество ДНК находится в ядре клеток и лишь небольшая его часть — в митохондриях. Гены ядра наследуются и от матери, и от отца, а вот гены митохондрии — только от матери. Мужчина, унаследовавший мутацию, не передаст ее своим потомкам.

У значительной части людей, которые являются носителем мутированного гена, болезнь не станет явной. Более 85% женщин и 50% мужчин, которые являются носителем гена синдрома LHON, болезнь не затронет. Причины, влияющие на прогрессирование заболевания, не ясны, но достоверно известно, что спровоцировать болезнь может неблагоприятная экологическая обстановка, стрессы, инфекции, токсическое воздействие табака и алкоголя.
Диагностика оптической нейропатии Лебера
Диагностика болезни осложнена схожестью ее симптомов с ишемической невропатией или с определенными патологиями — например, с рассеянным склерозом. Сложно отследить и анамнез, так как не у всех носителей мутировавшего гена развивается нейропатия Лебера. Расширенное офтальмологическое обследование может только установить наличие патологии, а вот для определения причины, понадобится генетическая диагностика.
Особенности диагностики наследственной оптической нейропатии Лебера:
общее клиническое обследование;
анализ митохондриальной ДНК;
исследование полей зрения;
осмотр глазного дна;
когерентная томография и электроретинография (необходимы, чтобы исключить патологии сетчатки).
Специалистам рекомендуется проводить дифференциальную диагностику синдрома LHON, сравнивая симптоматику и данные обследования с другими заболеваниями, поражающими глазной нерв. Например, с ишемической, токсической невропатией. Полное офтальмологическое обследование показывает, что диск зрительного нерва воспаленный, также заметны телеангиэктазии сосудов (расширение мелких капилляров).
Наследственная оптическая нейропатия Лебера — можно ли вылечить болезнь?
Пока наследственная нейропатия оптическая считается неизлечимым заболеванием, но учеными ведется постоянный поиск новых путей для терапии подобной патологии. Благодаря методам генной терапии можно существенно замедлить прогрессирование болезней и улучшить качество жизни пациентов.
Стремительное прогрессирование болезни Лебера приводит к быстрой потере зрения людьми, которые всю свою жизнь видели нормально и не имели проблем со зрением. Неутешительный диагноз, а также информация о том, что болезнь пока не лечится, серьезно сказываются на самочувствии таких пациентов, которые не были готовы к инвалидности. Многие из существующих методик лечения патологии оказались малоэффективными, в том числе и хирургическое вмешательство.

К счастью, ученые, занимающиеся редкими патологиями, прикладывают немало усилий к тому, чтобы найти средство излечения. Особую надежду специалисты возлагают на генную терапию, и у многих исследовательских групп уже есть неплохие результаты. Иногда препятствием к продолжению экспериментов является их этическая сторона, так как дальнейшие исследования предполагают использование разработанной методики на людях. Есть ли успехи хотя бы с использованием экспериментальных моделей? Да, генетикам уже удалось найти путь к решению проблемы.
Так, группа ученых из Майами, используя экспериментальные модели, доказала, что мутировавшие гены можно безопасно заменить здоровыми, это предотвратит ухудшение питания клеток зрительного нерва. Для исправления генетического дефекта в митохондрии необходимо ввести нормальную ДНК — это позволит исправить нарушение и восстановить зрительную функцию. Ученые сообщают, что такой подход будет эффективным и в отношении других заболеваний, вызванных митохондриальными мутациями, а также различных нарушений, связанных с процессами старения организма.
Нейропатия Лебера: лечение и поддерживающая терапия
На данный момент медики могут предложить поддерживающую терапию, которая замедляет прогрессирование патологии. Пациентам необходимо кардинально пересмотреть уклад жизни, снизить уровень стресса и влияние негативных факторов на здоровье, отказаться от курения и алкоголя.
О появившейся проблеме обычно сигнализирует отек слоя нервных волокон (диагностика с использованием когерентной томографии). Также обнаружить изменения помогут цветовые тесты, которые сообщают о проблеме с распознаванием зеленого и красного цветов. Людям, у которых в семье были случаи оптической нейропатии Лебера, необходимо не забывать о высоких рисках развития этой опасной патологии.
Существуют разные методы терапии заболевания и пока ни один из них не имеет доказанной эффективности. Лечение ведется специалистами с учетом степени нарушения, а также имеющихся сопутствующих заболеваний у пациента, поэтому используются комбинированные протоколы терапии.

Поддерживающая терапия при атрофии зрительного нерва:
стимуляция кровообращения в сохранившихся нервных волокнах;
применение сосудорасширяющих средств, стимуляторов;
лечение нейропротекторами (средствами, предупреждающими повреждение нейронов мозга);
применение препаратов, улучшающих обменные процессы на клеточном уровне;
физиотерапевтические процедуры, ультразвуковая терапия, электрофорез с лекарственными препаратами и травами, магнитотерапия, электростимуляция зрительного нерва;
сбалансированное питание — в рацион необходимо включить продукты с высоким содержанием витаминов С, B1, B12;
биостимуляторы (алоэ, экстракт стекловидного тела);
комплексные витаминные препараты, глазные капли с витаминами.
Что касается прогноза заболевания, то в каждом случае он индивидуален, зачастую все зависит от возраста пациента. Чем моложе заболевший человек, тем выше шансы на то, что зрение хотя бы частично восстановится. Полная слепота развивается в редких случаях. При таком заболевании важно соблюдать все предписания специалиста, ограничить воздействие токсинов на организм (отказаться от вредных привычек, исключить прием токсичных лекарственных препаратов, некоторых видов антибиотиков).
Сложности в поддерживающей терапией возникают обычно на местах, ведь многие врачи не учитывают генетическую причину болезни как основную и ставят ошибочные диагнозы. Повышение уровня информированности о таком заболевании, как оптическая нейропатия Лебера, значительно увеличивает шансы на то, что на эту проблему будет обращено внимание разных специалистов и ученых генетиков.
Источник

Амавроз Лебера – наследственное заболевание, характеризующееся врожденным поражением светочувствительных клеток сетчатки глаза и в некоторых случаях другими общими нарушениями (аномалии почек, ЦНС). При этой патологии в первые месяцы жизни ребенка или сразу после рождения появляется нистагм, ослабление или отсутствие реакции зрачка на свет. В дальнейшем ребенок может тереть глаза (симптом Франческетти), возникает дальнозоркость и светобоязнь, возможна полная потеря зрения. Диагностика основывается на данных осмотра пациента врачом-офтальмологом, электроретинографии, исследования наследственного анамнеза и генетических анализов. Специфическое лечение амавроза Лебера на сегодняшний день не разработано.
Общие сведения
Врожденный амавроз Лебера представляет собой гетерогенную группу заболеваний, причиной которых выступают мутации в 18 генах, кодирующих различные белки сетчатки, в том числе опсин. Впервые амавроз был описан еще в XIX веке (в 1867 году) Т. Лебером, указавшим основные проявления этого заболевания – маятниковый нистагм, слепота, появление пигментных пятен и включений на глазном дне. Средняя распространенность заболевания составляет 3:100000 населения. Основной механизм наследования заболевания – аутосомно-рецессивный, но есть также формы, передающиеся по аутосомно-доминантному принципу. Амавроз Лебера в равной мере поражает как мужчин, так и женщин. Заболевание составляет примерно 5% от всех наследственных ретинопатий. Современная генетика разрабатывает методики лечения данной патологии, имеются обнадеживающие результаты генной терапии одной из форм амавроза Лебера, обусловленной мутацией в гене RPE65.
Отдельно выделяют атрофию зрительных нервов Лебера, которая также характеризуется постепенной потерей остроты зрения и впоследствии полной слепотой. Однако это заболевание совершенно другой генетической природы и обусловлено повреждением митохондриальной ДНК, которая имеет свой уникальный тип наследования (по материнской линии).
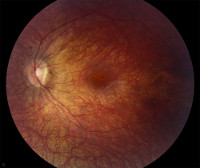
Амавроз Лебера
Причины амавроза Лебера
Основной механизм расстройства зрения при амаврозе Лебера – нарушение метаболизма в палочках и колбочках, которое ведет к летальным повреждениям фоторецепторов и их разрушению. Однако непосредственная причина таких изменений различается в зависимости от того, мутация какого именно гена вызвала заболевание.
Один из наиболее распространенных типов амавроза Лебера (тип 2, LCA2) обусловлен наличием мутантного гена RPE65 на первой хромосоме. Известно более 80-ти мутаций этого гена, некоторые из которых, помимо амавроза Лебера, вызывают и определенные формы пигментной абиотрофии сетчатки. Белок, кодируемый PRE65, отвечает за метаболизм ретинола в пигментном эпителии сетчатой оболочки глаза, поэтому при наличии генетического дефекта этот процесс нарушается с развитием побочных метаболических путей. В результате этого синтез родопсина в фоторецепторах прекращается, что и приводит к характерной клинической картине заболевания. Мутантные формы гена наследуются по аутосомно-рецессивному механизму.
Менее распространенная форма амавроза Лебера (тип 14) вызвана мутацией гена LRAT на 4-й хромосоме. Он кодирует белок лецитин-ретинол-ацилтрансферазу, который располагается в микросомах гепатоцитов и обнаружен в сетчатке глаза. Этот фермент участвует в метаболизме ретиноидов и витамина А, из-за наличия мутаций в гене полученный протеин не может полноценно выполнять свои функции, из-за чего развивается дегенерация фоторецепторов, которая клинически проявляется амаврозом Лебера или ювенильной пигментной абиотрофией сетчатки. Имеет аутосомно-рецессивный характер наследования.
Амавроз Лебера тип 8 наиболее часто приводит к врожденной слепоте, ответственный за развитие этой формы заболевания ген CRB1 располагается на 1-й хромосоме и имеет аутосомно-рецессивный характер наследования. При этом выяснено, что кодируемый данным геном белок принимает непосредственное участие в эмбриональном развитии фоторецепторов и пигментного эпителия сетчатки. Более точных данных по патогенезу данной формы амавроза Лебера на сегодняшний день не накоплено. Аналогичная ситуация с мутацией гена LCA5, расположенного в 6-й хромосоме и ассоциированного с 5-м типом амавроза. В настоящее время выявлен только белок, кодируемым данным геном – леберцилин, но его функции в сетчатке непонятны.
Также выявлено две формы амавроза Лебера, которые наследуются по аутосомно-доминантному механизму – тип 7, обусловленный мутацией гена CRX, и тип 11, ассоциированный с нарушением гена IMPDH1. Ген CRX кодирует белок, который обладает множеством функций – контроль развития фоторецепторов в эмбриональный период, поддержание их адекватного уровня во взрослом возрасте, участие в синтезе других протеинов сетчатки (является фактором транскрипции). Поэтому в зависимости от характера мутации гена CRX клиника амавроза Лебера 7-го типа может быть разнообразной – от врожденной слепоты до относительно позднего и вялотекущего ухудшения зрения. Инозин-5′-монофосфатдегидрогеназа 1, кодируемый геном IMPDH1, представляет собой фермент, регулирующий рост клеток и образование нуклеиновых кислот, однако это пока не позволяет прояснить патогенез того, как нарушения этого белка приводят к 11-му типу амавроза Лебера.
Классификация амавроза Лебера
В настоящее время полностью доказана взаимосвязь между клиническими проявлениями и мутациями определенных генов для 16-ти типов амавроза Лебера. Также имеются указания об открытии еще двух генов, повреждения в которых приводят к такому заболеванию, но пока в этом отношении проводятся дополнительные исследования.
- Тип 1 (LCA1, от английского Leber’s congenital amaurosis) – поврежденный ген GUCY2D на 17-й хромосоме, тип наследования аутосомно-рецессивный.
- Тип 2 (LCA2) – поврежденный ген RPE65 на 1-й хромосоме, аутосомно-рецессивное наследование, имеются первые положительные результаты по генной терапии этой формы амавроза Лебера.
- Тип 3 (LCA3) – поврежденный ген RDH12 на 14-й хромосоме, аутосомно-рецессивное наследование.
- Тип 4 (LCA4) – поврежденный ген AIPL1 на 17-й хромосоме, аутосомно-рецессивное наследование.
- Тип 5 (LCA5) – поврежденный ген LCA5 на 6-й хромосоме, аутосомно-рецессивное наследование.
- Тип 6 (LCA6) – поврежденный ген RPGRIP1 на 14-й хромосоме, аутосомно-рецессивное наследование.
- Тип 7 (LCA7) – поврежденный ген CRX на 19-й хромосоме, аутосомно-доминантное наследование. Характеризуется вариабельной клинической картиной.
- Тип 8 (LCA8) – поврежденный ген CRB1 на 1-й хромосоме, аутосомно-рецессивное наследование. Статистически чаще остальных типов приводит к врожденной слепоте.
- Тип 9 (LCA9) – поврежденный ген LCA9 на 1-й хромосоме, аутосомно-рецессивное наследование.
- Тип 10 (LCA10) – поврежденный ген CEP290 на 12-й хромосоме, аутосомно-рецессивное наследование.
- Тип 11 (LCA11) – поврежденный ген IMPDH1 на 7-й хромосоме, аутосомно-доминантное наследование.
- Тип 12 (LCA12) – поврежденный ген RD3 на 1-й хромосоме, аутосомно-рецессивное наследование.
- Тип 13 (LCA13) – поврежденный ген RDH12 на 14-й хромосоме, аутосомно-рецессивное наследование.
- Тип 14 (LCA14) – поврежденный ген LRAT на 4-й хромосоме, аутосомно-рецессивное наследование.
- Тип 15 (LCA15) – поврежденный ген TULP1 на 6-й хромосоме, аутосомно-рецессивное наследование.
- Тип 16 (LCA16) – поврежденный ген KCNJ13 на 2-й хромосоме, аутосомно-рецессивное наследование.
Кроме того, иногда в клинической классификации выделяют не только название поврежденного гена, но и характер мутации, поскольку это имеет значительное влияние на течение амавроза Лебера. Более того, различные типы мутаций в одном и том же гене могут приводить к совершенно разным заболеваниям – например, некоторые разновидности делеций в гене CRX могут приводить не к амаврозу, а к палочко-колбочковой дистрофии. Некоторые мутации генов RPE65, LRAT и CRB1 являются причиной различных форм пигментной абиотрофии сетчатки.
Симптомы амавроза Лебера
Симптоматика амавроза Лебера достаточно вариабельна и зависит от типа заболевания и характера мутации гена. В большинстве случаев при рождении ребенка патология не определяется – даже при осмотре глазного дна изменения наблюдаются лишь в нескольких процентах случаев. По мере его роста родители могут замечать, что ребенок не задерживает взгляд на предметах и окружающих, а в более старшем возрасте может болезненно реагировать на свет (появляется фотофобия), часто тереть глаза и указывать на них пальцем (симптом Франческетти, окулопальцевый синдром). Обнаруживается нистагм, который возникает еще в первые 2-3 месяца жизни и часто является одним из первых проявлений амавроза Лебера, замедленная реакция зрачка на свет или ее полное отсутствие.
В ряде случаев наблюдается врожденная слепота. Если же ребенок родился с относительно сохранной функцией зрения, то в первые годы жизни, помимо указанных симптомов, у его также развивается дальнозоркость, косоглазие, сильно страдает острота зрения. Обычно к 10-ти годам большинство больных с амаврозом Лебера полностью слепнут. В дальнейшем у них могут возникать и другие нарушения зрительного аппарата – кератоконус, катаракта, глаукома. При некоторых типах заболевания могут наблюдаться и сопутствующие нарушения – поражения ЦНС, глухота.
Диагностика амавроза Лебера
В современной офтальмологии диагностика амавроза Лебера производится на основании осмотра глазного дна, мониторинга динамики изменений в нем, данных электроретинографии. Немаловажную роль играет также изучение наследственного анамнеза, а для некоторых типов заболевания – генетическое секвенирование последовательности ключевых генов.
При осмотре глазного дна относительно долгое время (первые несколько лет жизни) никаких изменений может не регистрироваться. Первыми, но не специфическими офтальмологическими симптомами амавроза являются нистагм, косоглазие, замедленная или отсутствующая реакция зрачков на свет. Возникающие со временем изменения сетчатки сводятся к появлению пигментных или непигментированных пятен различного размера, сужения артериол, бледности диска зрительного нерва. К 8-10 годам практически у всех больных наблюдаются костные пигментные тельца, расположенные по периферии глазного дна. Характерным признаком является более быстрое прогрессирование изменений на сетчатке по сравнению с функциональными нарушениями зрения, которые развиваются относительно медленно. До развития слепоты острота зрения составляет 0,1 и менее, часто регистрируется дальнозоркость, светобоязнь.
У подростков и взрослых людей помимо указанных симптомов могут диагностироваться кератоконус и катаракта. Электроретинография при амаврозе Лебера, как правило, отражает сильное снижение амплитуды всех волн или их полное отсутствие. Генетические исследования позволяют выявить поврежденный ген и тип мутации только в 50-60% случаев (частота наиболее распространенных повреждений генов). Подавляющее большинство клиник производят секвенирование последовательностей с целью выявления мутаций только в отношении генов RPE65, CRX, CRB1, LCA5 и KCNJ13.
Дифференциальную диагностику производят с различными формами пигментной абиотрофии сетчатки (при ней сохраняется нормальная или немного сниженная амплитуда волн на электроретинограмме) и некоторыми типами атрофии зрительных нервов.
Лечение и прогноз амавроза Лебера
На сегодняшний день специфического лечения любого типа амавроза Лебера не существует. На этапе клинических испытаний находится генно-инженерное введение гена RPE65 в сетчатую оболочку глаза больных амаврозом 2-го типа, имеются первые данные о значительном улучшении зрения подопытных больных. В случае же остальных форм заболевания такого прогресса пока нет. Поддерживающее лечение сводится к витаминной терапии, внутриглазным инъекциям сосудорасширяющих средств. При дальнозоркости назначается ношение очков.
В плане сохранения зрения прогноз крайне неблагоприятный, практически 95% больных полностью теряют способность видеть к 10-му году жизни. Кроме того, это наследственное заболевание может осложняться проблемами с ЦНС, почками, эндокринной системой, что требует более тщательного медицинского мониторинга для своевременного выявления подобных нарушений.
Источник
