Синдром истощенных яичников клинические рекомендации
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Якимова А.В.
1
Надеев А.П.
1
Макаров К.Ю.
1
1 ГБОУ ВПО «Новосибирский государственный медицинский университет» Минздравсоцразвития РФ
Частота синдрома истощения яичников (СИЯ) в популяции составляет 1,5 %, а в структуре вторичной аменореи – до 10 %. Пациентка Б., 26 лет обратилась на консультацию в медицинский консультативный центра ГБОУ НГМУ с жалобами на отсутствие менструальной функции через год по окончании грудного вскармливания. По окончании лактационного периода имела избыточную массу тела (ИМТ 32), за год похудела на 26 кг без применения медикаментов, и на момент обращения за медицинской помощью ИМТ составил 27. При обследовании был выявлен гипергонадотропный гипогонадизм. Эстроген-дефицитное состояние сопровождалось вегетативными симптомами, характерными для патологического течения периода менопаузального перехода. При сборе семейного анамнеза было выяснено, что у матери менструальная функция прекратилась в 35 лет, у тетки по материнской линии – в 37. Была выполнена биопсия яичников и патоморфологическое исследование биоптатов. В результате обследования установлен диагноз синдрома истощения яичников. На фоне назначенной заместительной гормональной терапии самочувствие пациентки улучшилось, регулярно наблюдается менструально-подобная реакция. В развитии синдрома истощения яичников у описанной пациентки сыграли роль генетические факторы, учитывая данные семейного анамнеза.
синдром истощения яичников
гипергонадотропная аменорея
1. Боярский К.Ю. Роль антимюллерова гормона (АМГ) в норме и при различных гинекологических заболеваниях / К.Ю. Боярский, С.Н. Гайдуков // Журнал Акушерства и женских болезней. – 2009. – Т. 58, Вып. 3. – С. 74–83.
2. Марченко Л.А.Преждевременная недостаточность функции яичников: патогенез, диагностика и заместительная гормональная терапия / Л.А. Марченко, Г.В. Тагиева, Л.М. Ильина // Гинекология. – 2004. – № 6(6). – С. 315–319.
3. Сметник В.П. Неоперативная гинекология / В.П. Сметник, Л.Г. Тумилович. – М.: Медицинское информационное агентство, 2006. – 632 c.
4. Davis S.R. Premature Ovarian Failure // Мaturitas. – 1996. – № 23. – С. 1–18.
5. Hehenkamp W.J., Looman C.W., Themmen A.P., de Jong F.H., Te Velde E.R., Broekmans F.J. Anti-Müllerian hormone levels in the spontaneous menstrual cycle do not show substantial fluctuation // J Clin Endocrinol Metab. – 2006 Oct. – № 91(10). – Р. 4057–63.
6. La Marca A., Giulini S., Tirelli A., Bertucci E., Marsella T., Xella S., Volpe A. Anti-Müllerian hormone measurement on any day of the menstrual cycle strongly predicts ovarian response in assisted reproductive technology // Hum Reprod. – 2007 Mar. – № 22(3). – Р. 766–71.
7. La Marca A., Stabile G., Artenisio A.C., Volpe A. Serum anti-Mullerian hormone throughout the human menstrual cycle // Hum Reprod. – 2006 Dec. – № 21(12). – Р. 3103–7.
8. Rebair R.W. Clinical ferules of young women with hypergonadotropic amenorrhea / Rebair R.W., Conolly H.V. // Fertil. Stetil. – 1990. – № 53. – P. 804–810.
9. Wheeler C.A. Premature Ovarian Failure: treatment strategies // Journal of Reproduct. Immunol. – 1995. – № 76 (5). – P. 130–131.
Синдром истощения яичников (СИЯ) – это патологический симптомокомплекс, включающий вторичную аменорею, бесплодие, вегетососудистые нарушения у женщин моложе 40 лет с нормальной менструальной и репродуктивной функцией в прошлом. Частота СИЯ в популяции составляет 1,5 %, а в структуре вторичной аменореи – до 10 % [4, 9]. Существует ряд теорий, объясняющих причины истощения яичников: пре- и постпубертатная деструкция ооцитов яичников, хромосомные аномалии, аутоиммунные расстройства и др. Точная природа преждевременного выключения функции яичников неясна. Это состояние описывается как «многофакторный синдром», в развитии которого могут принимать участие генетические факторы (нарушения на коротком и длинном плече X хромосомы: дефект гена ZFX и генов, расположенных на участке Xq 21,3-q27; Xq-26,1-q27; Xq133-q21,1), ферментопатии (галактоземия), аутоиммунные, инфекционно-токсические, психогенные факторы внешней среды, а также дефекты в структурах гонадотропинов и/или их действия [3,8].
Собственное клиническое наблюдение
В медицинский консультативный центр Новосибирского государственного медуниверситета обратилась пациентка Б., 26 лет с жалобами на отсутствие менструальной функции через год по окончании грудного вскармливания. В анамнезе единственная беременность, закончившаяся родами в срок, беременность осложнилась артериальной гипертензией. Общая прибавка массы за беременность ‒ 20 кг. После родов менструальная функция не восстановилась. Грудное вскармливание продолжалось полтора года. По окончании лактационного периода имела избыточную массу тела (ИМТ 32), за год похудела на 26 кг без применения медикаментов, и на момент обращения за медицинской помощью ИМТ составил 27. Из анамнеза: менархе в 14 лет, менструальный цикл установился через полгода, продолжительностью 28 дней, менструации по 4–5 дней. Соматический анамнез отягощен только детскими инфекциями – инфекционным паротитом и ветряной оспой. При сборе семейного анамнеза было выяснено, что у матери менструальная функция прекратилась в 35 лет, у тетки по материнской линии – в 37. Пациентка также предъявляла жалобы на ощущения приливов жара до 10 раз за сутки и гипергидроз в течение 3 месяцев до обращения за медицинской помощью.
Материалы и методы исследования
Применяли тесты функциональной диагностики, исследование гормонов сыворотки крови, сыворотки крови на наличие антиовариальных антител, ультразвуковое исследование органов малого таза, гистологическое исследование биоптатов яичников, иммуно-гистохимическое исследование биоптатов яичников.
Результаты исследования и их обсуждение
По тестам функциональной диагностики получены свидетельства выраженной гипофункции яичников: симптом зрачка был отрицательным, базальная температура была монофазная. Путем проведения гормональной пробы маточная форма аменореи была исключена. При двукратном исследовании гормонов сыворотки крови был выявлен гипергонадотропный гипогонадизм: уровень эстрадиола составил (23,8 ± 1,9) нг/мл (при норме от 40 до 300 нг/мл). Уровень фолликуло-стимулирующего гормона (ФСГ) был повышен до 38 мЕд/л, а лютеинизирующего (ЛГ) – до 46 мЕд/л.
Также проводили определение антимюллерова гормона. Антимюллеров гормон (АМГ), другие названия – антимюллеровская субстанция или антимюллеровый фактор, является одним из наиболее интересных маркеров репродуктивной системы женщины, появившихся за последние годы. Измерение АМГ позволило изучить более глубокие процессы роста и созревания фолликулов и уточнить патогенез некоторых гинекологических заболеваний. Максимума уровень АМГ достигает к расцвету репродуктивной функции женщины в 20–30 лет, после чего постепенно снижается и к менопаузе равняется нулю [1]. Уровень АМГ в течение менструального цикла женщины остается постоянным и почти не зависит от колебаний гипофизарных гонадотропинов [5, 7]. Одиночное измерение АМГ в любой день менструального цикла дает полную клиническую информацию о состоянии овариального резерва [6]. В последние годы АМГ был предложен как показатель наличия фолликулов у пациенток с ПИЯ. Massin N. et al. (цит. по [1]), измерили уровень АМГ, и сравнили его с данными биопсии яичников у пациенток с СИЯ и нормальным кариотипом. Уровень АМГ был значительно выше у женщин, у которых при биопсии было обнаружено более 5 фолликулов. При иммуногистохимическом исследовании экспрессии АМГ клетками гранулезы фолликулов было обнаружено, что у пациенток с СИЯ уровень выделения АМГ преантральными фолликулами находится в пределах нормы, однако в антральных фолликулах он снижен. Соответственно, был сделан вывод о важности измерения АМГ как маркера наличия персистирующих фолликулов у пациенток с СИЯ. Возможно, АМГ является лучшим показателем овариального резерва, чем базальные уровни ФСГ и ингибина В [1]. Всё вышеописанное послужило основанием для определения АМГ у пациентки Б. Антимюллеров гормон у нее определялся в следовых количествах – 0,26 нг/мл. После введения эстрадиола наблюдали снижение ФСГ и ЛГ.
Высокий уровень гонадотропных гормонов и адекватная реакция на введение эстрадиола позволили нам предполагать, что у пациентки были сохранены резервные способности гипоталамо-гипофизарной системы, в то время как яичники, вероятно, лишены рецепторного аппарата для адекватного ответа на гонадотропную стимуляцию. Антитела к яичниковой ткани не обнаружены, следовательно, исключили аутоимунный генез патологического состояния. Лапароскопическим доступом была выполнена биопсия яичников, после чего провели иммуно-гистохимическое и патоморфологическое исследование биоптатов.
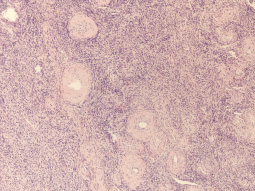
При гистологическом исследования биоптата яичника было установлено отсутствие примордиальных фолликулов (рис. 1), при окраске по Ван Гизону (метод окраски микропрепаратов, предназначенный для изучения структуры соединительной ткани. Красителем служит смесь кислого фуксина и пикриновой кислоты, причем первый компонент окрашивает коллагеновые волокна в ярко-красный цвет, а второй придает прочим структурам ткани жёлтую окраску) выявлен фиброз стромы, многочисленные артерии и вены (рис. 2). Результаты иммуногистохимического исследования на рецепторы эстрогена и прогестерона показали отрицательный результат.

Рис. 1. Яичник. Отсутствуют примордиальные фолликулы. (Окр.гематоксилин-эозин х100)
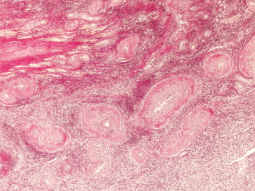
Рис. 2. Фиброз стромы яичника. (Окр. По Ван-Гизону 1х 200)
Вывод: результаты патоморфологического исследования яичников подтвердили клинически установленный диагноз синдрома истощения яичников (СИЯ).
Описываемый случай вызывает интерес необычно ранним дебютом заболевания, ведь, как правило, возраст пациенток с СИЯ колеблется в пределах 35–38 лет, а также появлением клинических симптомов после нормальных родов и лактационного периода. Преждевременный дефицит половых гормонов может способствовать более раннему появлению типичных климактерических расстройств, частота которых составляет 60–70 % [3], соответствующие симптомы эстрогенного дефицита и имели место в описываемом случае. Так как прямым следствием эстрогенного дефицита в молодом возрасте является возникновение тяжелых нейро-обменно-эндокринных нарушений, основная задача терапии сводится к профилактике таких нарушений, нормализации гормонального фона, профилактике остеопороза. Согласно исследованиям, опубликованным в последние 10 лет, основными принципами заместительной гормональной терапии (ЗГТ) у пациенток с ПНЯ являются:
• использование натуральных эстрогенов в минимальных эффективных дозировках, создающих концентрацию эстрадиола в плазме крови на уровне ранней фолликулярной фазы менструального цикла;
• поскольку пациентки по возрасту относятся к репродуктивному периоду, преимущественно используется циклический режим ЗГТ (двухфазные эстроген-гестагенные препараты), на фоне сохраняется менструально-подобная реакция [2, 3].
Нашей пациентке была назначена заместительная гормональная терапия в циклическом режиме. На фоне лечения самочувствие ее улучшилось, регулярно наблюдается менструально-подобная реакция. В развитии СИЯ в описываемом случае, вероятно, сыграли роль генетические факторы.
Результатом анализа приведенного клинического случая стало создание алгоритма диагностики СИЯ и ведения пациенток с указанным синдромом (рис. 3).
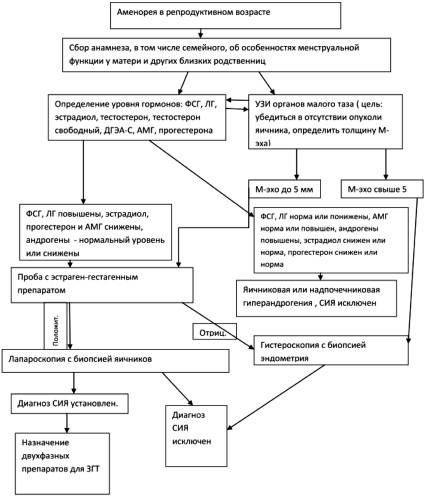
Рис. 3. Алгоритм диагностики синдрома истощения яичников (СИЯ) и ведения пациенток с указанным синдромом
Рецензенты:
Кливер Е.Э., д.м.н., профессор, ведущий научный сотрудник лаборатории патоморфологии и электронной микроскопии, ФГБУ «НИИПК им. ак. Е.Н. Мешалкина» Минздрава России, г. Новосибирск;
Киселева Т.В., д.м.н., врач акушер-гинеколог, МБУЗ НСО «Гинекологическая больница № 2», г. Новосибирск.
Работа поступила в редакцию 11.07.2013.
Библиографическая ссылка
Якимова А.В., Надеев А.П., Макаров К.Ю. КЛИНИЧЕСКИЙ СЛУЧАЙ: СИНДРОМ ИСТОЩЕНИЯ ЯИЧНИКОВ ПОСЛЕ ЛАКТАЦИОННОЙ АМЕНОРЕИ // Фундаментальные исследования. – 2013. – № 7-3. – С. 670-674;
URL: https://fundamental-research.ru/ru/article/view?id=32080 (дата обращения: 20.07.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
Синдром истощения яичников — комплекс патологических симптомов, обусловленных эстрогенной недостаточностью в результате преждевременного истощения фолликулярного аппарата яичников у женщин моложе 36—37 лет, у которых в прошлом были нормальные менструальная и репродуктивная функции.
Эпидемиология
Частота СИЯ в популяции составляет менее 1%.
Этиология и патогенез
СИЯ относится к гипергонадотропным аменореям.
Этиология и патогенез этого заболевания изучены недостаточно. Существует несколько теорий развития СИЯ:
■ генетические аномалии, приводящие к гибели овоцитов и фолликулов, число которых уже при рождении уменьшено;
■ аутоиммунные нарушения (СИЯ может сочетаться с такими аутоиммунными заболеваниями, как системная красная волчанка, тиреоидит Хашимото, аплазия тимуса);
■ вирусные инфекции, краснуха, гипо- и авитаминозы, воздействие радиации и химических агентов в антенатальном периоде и раннем детстве;
■ дефекты структуры гонадотропинов.
В результате воздействия одного или нескольких из перечисленных факторов в фолликулярном аппарате яичников преждевременно развиваются дегенеративные изменения, приводящие к их «выключению» и, как следствие, эстрогендефицитному состоянию.
Клинические признаки и симптомы
Первым симптомом СИЯ является ВА в возрасте моложе 36—37 лет.
В дальнейшем появляются симптомы, характерные для климактерического периода.
Смотри «Климактерический период и менопауза», «Урогенитальные расстройства в климактерическом периоде», «Остеопороз в постменопаузе».
Диагноз и рекомендуемые клинические исследования
Основные диагностические критерии СИЯ:
■ значительное повышение уровня гонадотропинов в сыворотке крови (особенно ФСГ);
■ резкое снижение содержания эстрогенов в сыворотке крови;
■ уменьшение размеров яичников и отсутствие в них фолликулов (по данным УЗИ).
Ценными для диагностики являются лапароскопия с биопсией яичников (выявляются небольшого размера морщинистые яичники, фолликулы отсутствуют).
Однако диагноз СИЯ можно с уверенностью поставить и без лапароскопии, на основании характерных клинических симптомов и указанных выше диагностических критериев.
Дифференциальный диагноз
Следует проводить с СРЯ (табл. 45.1).
Клинические рекомендации
Показано назначение ЗГТ до возраста естественной менопаузы и затем по показаниям. Предпочтение следует отдавать двух- и трехфазным эстроген-гестагенным ЛС в циклическом режиме:
Эстрадиола валерат внутрь 2 мг 1 р/сут, 9 сут
+
(после окончания курса)
Эстрадиола валерат/левоноргестрел внутрь 2 мг/0,15 мг 1 р/сут, 12 сут, затем перерыв 7 сут или
Эстрадиола валерат внутрь 2 мг, 11 сут
+
(после окончания курса)
Эстрадиола валерат/медроксипрогестерон внутрь 2 мг/10 мг 1 р/сут, 10 сут, затем перерыв 7 сут или
Эстрадиола валерат внутрь 2 мг 1 р/сут, 11 сут
+
(после окончания курса)
Эстрадиола валерат/ципротерон внутрь 2 мг/1 мг 1 р/сут, 10 сут, затем перерыв 7 сут.
Пациентки с СИЯ подлежат обязательному диспансерному наблюдению до возраста 45—50 лет.
Оценка эффективности лечения
Критерии эффективности лечения:
■ улучшение самочувствия женщины;
■ улучшение качества жизни;
■ улучшение данных денситометрии и нормализации липидного спектра крови (если отмечались нарушения).
Осложнения и побочные эффекты лечения
Побочные эффекты применения ЛС для ЗГТ приведены ранее.
Ошибки и необоснованные назначения
Лечение, направленное на стимуляцию функции яичников, нецелесообразно, т.к. фолликулярный аппарат яичников истощен.
Прогноз
У больных с СИЯ процесс необратим.
Прогноз в отношении восстановления менструальной и репродуктивной функций неблагоприятный. Теоретически беременность возможна при экстракорпоральном оплодотворении с использованием яйцеклетки донора.
Лечение позволяет предотвратить развитие остеопороза и преждевременное старение.
Учитывая наследственную предрасположенность к этому заболеванию, дочерям пациенток с СИЯ следует рекомендовать беременность и роды в молодом возрасте.
В.И. Кулаков, В.Н. Серов
Опубликовал Константин Моканов
Источник
Ñèíäðîì èñòîùåíèÿ ÿè÷íèêîâ (ÑÈß)
Ïàòîëîãè÷åñêèé ñèìïòîìîêîìïëåêñ, âêëþ÷àþùèé âòîðè÷íóþ àìåíîðåþ, áåñïëîäèå, âåãåòîñîñóäèñòûå íàðóøåíèÿ ó æåíùèí ìîëîæå 38 ëåò ñ íîðìàëüíîé â ïðîøëîì ìåíñòðóàëüíîé è ðåïðîäóêòèâíîé ôóíêöèåé.
Ýòèîëîãèÿ è ïàòîãåíåç.
Âåäóùåé ïðè÷èíîé ñ÷èòàþò õðîìîñîìíûå àíîìàëèè è àóòîèììóííûå ðàññòðîéñòâà, âûðàæàþùèåñÿ â ìàëûõ âðîæäåííûõ ÿè÷íèêàõ ñ äåôèöèòîì ôîëëèêóëÿðíîãî àïïàðàòà, ïðå è ïîñòïóáåðòàòíîé äåñòðóêöèè çàðîäûøåâûõ êëåòîê, ïåðâè÷íîì ïîðàæåíèè ÖÍÑ è ãèïîòàëàìè÷åñêîé îáëàñòè. ÑÈß ãåíåðàëèçîâàííûé àóòîèììóííûé äèàòåç.
 âîçíèêíîâåíèè ÑÈß èãðàåò ðîëü ìíîæåñòâî ôàêòîðîâ, â àíòå è ïîñòíàòàëüíîì ïåðèîäå ïðèâîäÿùèõ ê ïîâðåæäåíèþ è çàìåùåíèþ ãîíàä ñîåäèíèòåëüíîé òêàíüþ. Âèäèìî, íà ôîíå íåïîëíîöåííîãî ãåíîìà ëþáûå ýêçîãåííûå âîçäåéñòâèÿ (ðàäèàöèÿ, ðàçëè÷íûå ëåêàðñòâåííûå ïðåïàðàòû, ãîëîäàíèå, ãèïî è àâèòàìèíîç, âèðóñ ãðèïïà è êðàñíóõè) ìîãóò ñïîñîáñòâîâàòü ðàçâèòèþ ÑÈß. Ó áîëüøèíñòâà áîëüíûõ íåáëàãîïðèÿòíûå ôàêòîðû äåéñòâîâàëè â ïåðèîä âíóòðèóòðîáíîãî ðàçâèòèÿ (ãåñòîç, ýêñòðàãåíèòàëüíàÿ ïàòîëîãèÿ ó ìàòåðè). Íà÷àëî çàáîëåâàíèÿ ÷àñòî ñâÿçàíî ñ òÿæåëûìè ñòðåññîâûìè ñèòóàöèÿìè, èíôåêöèîííûìè çàáîëåâàíèÿìè.
ÑÈß ìîæåò èìåòü íàñëåäñòâåííûé õàðàêòåð: ó 46% áîëüíûõ ðîäñòâåííèöû îòìå÷àëè íàðóøåíèå ìåíñòðóàëüíîé ôóíêöèè îëèãîìåíîðåþ, ðàííèé êëèìàêñ.
Êëèíè÷åñêàÿ ñèìïòîìàòèêà.
Íà÷àëîì çàáîëåâàíèÿ ñ÷èòàåòñÿ àìåíîðåÿ èëè ãèïî, îïñî, îëèãîìåíîðåÿ ñ ïîñëåäóþùåé ñòîéêîé àìåíîðååé, êîòîðàÿ ñîïðîâîæäàåòñÿ òèïè÷íûìè äëÿ ïîñòìåíîïàóçû âåãåòàòèâíîñîñóäèñòûìè ïðîÿâëåíèÿìè ïðèëèâàìè, ïîòëèâîñòüþ, ñëàáîñòüþ, ãîëîâíîé áîëüþ ñ íàðóøåíèåì òðóäîñïîñîáíîñòè. Íà ôîíå àìåíîðåè ðàçâèâàþòñÿ ïðîãðåññèðóþùèå àòðîôè÷åñêèå ïðîöåññû â ìîëî÷íûõ æåëåçàõ è ïîëîâûõ îðãàíàõ. Áîëüíûå ñ ÑÈß ïðàâèëüíîãî òåëîñëîæåíèÿ, óäîâëåòâîðèòåëüíîãî ïèòàíèÿ. Îæèðåíèå íå õàðàêòåðíî.
Äèàãíîñòèêà îñíîâûâàåòñÿ íà äàííûõ àíàìíåçà è êëèíè÷åñêîé êàðòèíå. Ìåíàðõå ñâîåâðåìåííîå, ìåíñòðóàëüíàÿ è ðåïðîäóêòèâíàÿ ôóíêöèè íå íàðóøàþòñÿ â òå÷åíèå 1020 ëåò.
Ïîíèæåííàÿ ôóíêöèÿ ÿè÷íèêîâ îáóñëîâëèâàåò âûðàæåííóþ ñòîéêóþ ãèïîýñòðîãåíèþ: îòðèöàòåëüíûé ñèìïòîì «çðà÷êà», ìîíîôàçíóþ áàçàëüíóþ òåìïåðàòóðó, íèçêèå ïîêàçàòåëè ÊÏÈ (010%). Ãîðìîíàëüíûå èññëåäîâàíèÿ òàêæå ñâèäåòåëüñòâóþò î ðåçêîì ñíèæåíèè ôóíêöèè ÿè÷íèêîâ: óðîâåíü ýñòðàäèîëà ïðàêòè÷åñêè ñîîòâåòñòâóåò òàêîâîìó ó ìîëîäûõ æåíùèí ïîñëå îâàðèýêòîìèè. Óðîâåíü ãîíàäîòðîïíûõ ãîðìîíîâ (ÔÑà è ËÃ) ðåçêî ïîâûøåí: ÔÑà â 3 ðàçà ïðåâûøàåò îâóëÿòîðíûé ïèê è â 15 ðàç áàçàëüíûé óðîâåíü ó çäîðîâûõ æåíùèí òîãî æå âîçðàñòà; ñîäåðæàíèå Ëà ïðèáëèæàåòñÿ ê îâóëÿòîðíîìó ïèêó è â 4 ðàçà ïðåâûøàåò áàçàëüíûé óðîâåíü ó çäîðîâûõ æåíøèí. Àêòèâíîñòü ïðîëàêòèíà â 2 ðàçà íèæå, ÷åì ó çäîðîâûõ æåíùèí.
Ãèíåêîëîãè÷åñêîå è äîïîëíèòåëüíûå ìåòîäû èññëåäîâàíèÿ îáíàðóæèâàþò óìåíüøåíèå ìàòêè è ÿè÷íèêîâ. Ïðè ÓÇÈ, ïîìèìî óìåíüøåíèÿ ìàòêè, îòìå÷àåòñÿ ðåçêîå èñòîí÷åíèå åå ñëèçèñòîé îáîëî÷êè ìàòêè ïðè èçìåðåíèè Ìýõà. Ïðè ëàïàðîñêîïèè òàêæå îáíàðóæèâàþòñÿ ìàëåíüêèå, «ìîðùèíèñòûå» ÿè÷íèêè æåëòîâàòîãî öâåòà; æåëòîå òåëî îòñóòñòâóåò, ôîëëèêóëû íå ïðîñâå÷èâàþò. Öåííûé äèàãíîñòè÷åñêèé ïðèçíàê îòñóòñòâèå ôîëëèêóëÿðíîãî àïïàðàòà, ïîäòâåðæäåííîå ãèñòîëîãè÷åñêèì èññëåäîâàíèåì áèîïòàòîâ ÿè÷íèêîâ.
Äëÿ óãëóáëåííîãî èçó÷åíèÿ ôóíêöèîíàëüíîãî ñîñòîÿíèÿ ÿè÷íèêîâ èñïîëüçóþò ãîðìîíàëüíûå ïðîáû. Ïðîáà ñ öèêëè÷åñêèì íàçíà÷åíèåì ýñòðîãåíîâ (I ôàçà) è ãåñòàãåíîâ (II ôàçà) ñîïðîâîæäàåòñÿ ìåíñòðóàëüíîïîäîáíîé ðåàêöèåé ÷åðåç 35 äíåé ïîñëå çàâåðøåíèÿ ïðîáû è çíà÷èòåëüíûì óëó÷øåíèåì îáùåãî ñîñòîÿíèÿ.
Ïðèçíàêîâ îðãàíè÷åñêîãî ïîðàæåíèÿ ÖÍÑ íåò.
Ëå÷åíèå áîëüíûõ ñ ÑÈß íàïðàâëåíî íà ïðîôèëàêòèêó è òåðàïèþ ýñòðîãåíäåôèöèòíûõ ñîñòîÿíèé.
Ïðè áåñïëîäèè âîçìîæíî òîëüêî ïðèìåíåíèå âñïîìîãàòåëüíîé ðåïðîäóêòèâíîé òåõíîëîãèè ÝÊÎ ñ äîíîðñêîé ÿéöåêëåòêîé. Ñòèìóëÿöèÿ èñòîùåííîãî ôîëëèêóëÿðíîãî àïïàðàòà ÿè÷íèêîâ íåöåëåñîîáðàçíà è íåáåçðàçëè÷íà äëÿ çäîðîâüÿ æåíùèíû.
Áîëüíûì ñ ÑÈß ïîêàçàíà çàìåñòèòåëüíàÿ ãîðìîíîòåðàïèÿ äî âîçðàñòà åñòåñòâåííîé ìåíîïàóçû.
Источник
