Синдром гіпоплазії лівих відділів серця
Матеріал з Вікіпедії — вільної енциклопедії.
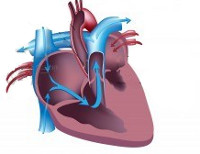
Синдро́м гіпоплазі́ї лі́вих ві́дділів се́рця (СГЛВС), або Гіпоплазія лівих відділів серця (англ. Hypoplastic left heart syndrome) — клінічний синдром, який характеризується наявністю таких вроджених вад серця, як помірна або виражена гіпоплазія або атрезія мітрального клапана, лівого шлуночка, аортального клапана та різноманітного ступеня гіпоплазія висхідної аорти.
Враховуючи те, що системний викид цілком залежить від правого шлуночка через відкриту артеріальну протоку (ВАП) в аорту, смерть пацієнтів настає внаслідок закриття ВАП у перші дні або тижні життя.[1]
Історичні відомості[ред. | ред. код]
| 1952 | Гіпоплазія аорти у поєднанні з такими вродженими вадами, як вентрикулосептальний дефект, аортальний стеноз або атрезія, мітральний стеноз або атрезія вперше була описана М. Левом (M. Lev).[2] |
| 1958 | ГЛВС вперше детально описана Дж. Нунаном (J. Noonan) та А. Надасом (A. Nadas), але лише як патологічний діагноз.[3] |
| 1983 | Американський хірург Білл Норвуд (Bill Norwood) з Дитячого Шпиталю м. Бостон вперше опублікував результати кардіохірургічних операцій у новонароджених із СГЛВС, які надали шанс на здорове життя цим пацієнтам. В подальшому цей тип операцій став носити його ім’я.[4] |
| 1991 | У Великій Британії лікарі Лондонського Guy’s Hospital на чолі з Д. Максвеллом (Maxwell D.) першими у світі здійснили Фетальну балонну вальвулопластику аортального клапана у 2 плодів в утробі матері з вираженим аортальним стенозом під контролем ехокардіографії. Цим самим вони відкрили перспективи лікування СГЛВС у ще ненароджених дітей.[5] |
| 2010 | Вперше в Україні бригада лікарів Національного інституту серцево-судинної хірургії ім. М.М. Амосова, очолювана Заслуженим лікарем України, доктором медичних наук, професором Василем Лазоришинцем провела успішне оперативне втручання (перший етап лікування СГЛВС — операція Норвуд І) немовляті віком 11 днів. [6] |
Епідеміологічні дані[ред. | ред. код]
Поширеність СГЛВС становить від 0,016 до 0,036% від усіх живих новонароджених дітей. Тільки в США щороку народжується близько 600 дітей із СГЛВС.[7]. Це становить від 1 до 3,8% від усіх вроджених вад серця.[8]
Патоморфологія[ред. | ред. код]
Гіпоплазія лівих віділів серця може бути різноманітною за своєю анатомічною характеристикою в залежності від недорозвинення тих чи інших морфологічних структур лівих відділів серця. Мітральний клапан може бути як стенотичним так і атрезованим. Те ж саме і з аортальним клапаном. Тому ГЛВС може бути поділена на 4 категорії в залежності від анатомічної характеристики клапанів лівих відділів серця[9]:
— СГЛВС з аортальним та мітральним стенозом; — СГЛВС з аортальною та мітральною атрезією; — СГЛВС з аортальною атрезією та мітральним стенозом; — СГЛВС з аортальним стенозом та мітральною атрезією.
Висхідна аорта у новонароджених з атрезією аортального клапана при СГЛВС має діаметр 2,5 мм, в той час як у новонароджених із стенозом аортального клапана при СГЛВС — 4-5 мм. Висхідна аорта завжди звужена і, як правило, звужена також дуга аорти. Стінка аорти витончена.
Коронарні артерії, як правило, в нормі.
Ліве передсердя, звичайно, мале за розмірами; в нього впадають 4 легеневі вени; спостерігається ендокардіальний фіброеластоз у вигляді потовщення ендокарду білого кольору.
Праве передсердя часто розширене, з товстими стінками.
Асоціація з іншими вродженими вадами серця[ред. | ред. код]
- Частковий дренаж легеневих вен
- Коарктація аорти
- Повна форма атріовентрикулярного септального дефекту
- Аномалії відходження коронарних артерій
- Додаткова ліва верхня порожниста вена
- Ендокардіальний фіброеластоз
Асоціація з хромосомними аномаліями[ред. | ред. код]
- 45,X (Синдром Тернера) OMIM 163950
- 47,XX/XY+13 (Синдром Патау)
- 47,XX/XY+18 (Синдром Едвардса)
- 47,XX/XY+21 (Синдром Дауна) OMIM 190685
- 46,XX/XYdel(22)(q11) (Синдром ДіДжорджа) OMIM 188400
- 46,XX/XYdel(11)q
Асоціація з генетичними захворюваннями та синдромами[ред. | ред. код]
- Синдром Холта-Орама (англ. Holt-Oram syndrome) OMIM 142900
- Синдром Сміта-Лемлі-Опітца (англ. Smith-Lemli-Opitz Genital abnormalities) OMIM 270400
- Синдром Елліса-ван Кревельда (англ. Ellis–van Creveld syndrome) OMIM 225500
- Синдром Салдіно-Нунана (англ. Saldino-Noonan Short) OMIM 263560
- Синдром Аперта (англ. Apert syndrome) OMIM 101200
- Синдром Беквітца (англ. Beckwith syndrome) OMIM 130650
- Синдром CHARGE (англ. CHARGE syndrome) OMIM 214800
Асоціація з іншими вадами розвитку та захворюваннями[ред. | ред. код]
- Вади розвитку Центральної нервової системи
- Діафрагмальні грижі (кили)
- Некротизуючий ентероколіт
Гемодинаміка[ред. | ред. код]
Гемодинаміка при синдромі гіпоплазії лівих відділів серця.
Лівий шлуночок не функціонує у пацієнтів з СГЛВС. Кров з легень легеневими венами потрапляє до лівого передсердя, далі через відкрите овальне вікно або атріосептальний дефект в праве передсердя. У рідких випадках, при наявності тотального дренажу легеневих вен кров з легеневих вен потрапляє відразу ж у праве передсердя. Кров з малого та великого кола кровообігу змішується в правому передсерді. Правий шлуночок підтримує обидва кола циркуляції (системний та легеневий одночасно) через стовбур легеневої артерії, яка дає гілки легеневих артерій (забезпечує легеневий кровотік) та відкриту артеріальну протоку (забезпечує системний кровотік). Кровотік ретроградно йде через відкриту артеріальну протоку до дуги аорти та її гілок (забезпечується кровопостачання верхньої частини тіла пацієнта), далі через висхідну аорту до коронарних артерій (забезпечення коронарного кровотоку). Кровопостачання нижньої частини тіла здійснюється антеградно через відкриту артеріальну протоку по ходу нисхідної аорти. Тому закриття відкритої артеріальної протоки спричинює зупинку системної циркуляції і смерть пацієнта.
Пренатальна діагностика[ред. | ред. код]
Фетальна Ехокардіографія (Ультразвукове дослідження серця плода) — дозволяє виявити СГЛВС вже на 18-20 тижні гестації плода.[10]
Так, наприклад, при аортальному стенозі можна навіть виявити кількість стулок аортального клапана (нормальний аортальний клапан має 3 стулки).
- Монокуспідальний клапан (1 стулка) — виявляється у 10% випадків
- Бікуспідальний клапан (2 стулки) — виявляється у 90% випадків
В Україні фетальне ехокардіографічне дослідження проводять у Науково-практичному медичному центрі дитячої кардіології та кардіохірургії МОЗ України. Напрямками цієї діяльності також займається Національний Інститут Серцево-судинної хірургії ім. М. М. Амосова АМН України та Інститут Педіатрії, Акушерства та Гінекології АМН України.
Етична проблема діагностики в антенатальному періоді[ред. | ред. код]
СГЛВС може бути діагностований з великою долею вірогідності у віці плода на 13-14 тижні вагітності. Антенатальна діагностика дає інформацію батькам про тяжкість серцевої вади у майбутньої дитини та час для розуміння щодо подальших кроків. Адже в разі збереження вагітності, батьки повинні знати про високий ризик втрати дитини, навіть при спеціалізованій кардіохірургічній допомозі.
Клінічні ознаки[ред. | ред. код]
При народженні малюки з СГЛВС можуть зовнішньо виглядати здоровими, поки функціонує відкрита артеріальна протока. Але вже протягом кількох годин або днів стан швидко погіршується внаслідок закриття відкритої артеріальної протоки та низької системної перфузії. У новонароджених з’являється тахіпное, тахікардія,
ціаноз помірної вираженості, кардіомегалія, пульс на периферичних судинах може не визначатися. Ціаноз іноді приймає тяжку форму, колір шкіри в цьому випадку може бути сірого кольору (як результат низької сатурації кисню в крові та низького показника серцевого викиду).
Діагностика[ред. | ред. код]
На початковому етапі обстеження пацієнта проводять пульсоксиметрію та аналіз газів артеріальної крові.
Оглядова рентгенографія органів грудної порожнини[ред. | ред. код]
Рентгенографія не виявляє специфічних ознак для СГЛВС. Кардіомегалія (збільшення розмірів серця) та враження легенів. Набряк легень може бути виявлений у пацієнтів з обструкцією легеневого венозного повернення.
Електрокардіографія[ред. | ред. код]
Гіпертрофія та збільшення об’єму правого передсердя; гіпертрофія правого шлуночка. Також виявляється синусова тахікардія. Стандартна електрокардіографія у 12 відведеннях може дати додаткову інформацію про наявність ішемії шлуночків, що відбулася внаслідок періоду зі зниженою перфузією; або ішемію внаслідок недостатнього коронарного кровотоку, що може свідчити про обструкцію дуги аорти в ділянці, що знаходиться біля відкритої артеріальної протоки.
Ехокардіографія[ред. | ред. код]
Ехокардіографія дозволяє точно встановити діагноз СГЛВС та швидко виявити такі характеристики вади:
- Місце та причину обструкції
- Морфологію аортального клапана (стеноз чи атрезія)
- Оцінку ступеня важкості обструкції
- Розмір лівого шлуночка
- Товщину лівого шлуночка
- Наявність ендокардіального фіброеластозу
- Функцію ВАП, кровотік через неї
- Скид крові з лівого до правого передсердя через Відкрите овальне вікно
- Наявність супутніх серцевих вад
Лікування[ред. | ред. код]
Без лікування СГЛВС призводить до смерті пацієнта, але при наявності високоспеціалізованої кардіохірургічної допомоги можливий шанс до подальшого життя[11].
Якщо перинатально за допомогою ехокардіографії встановлено діагноз аортального стенозу — це, як правило, призводить до СГЛВС. У цьому випадку треба готуватися до одного з нижчеприведених хірургічних втручань у новонародженого:
- Паліативне кардіохірургічне втручання зі створенням єдиного шлуночку — проводиться у 3 етапи, застосовується найчастіше.
- Трансплантація серця — застосовується дуже рідко в зв’язку з відсутністю донорського серця.
Після народження дитини, як правило, в кардіохірургічних центрах вже чекають пацієнта. Госпіталізація відбувається негайно в палату інтенсивної терапії. Слід зауважити, що деякі пацієнти з рестриктивним міжпередсердним сполученням потребують створення сполучення між правим та лівим передсердям. Якщо це можливо, проводять Процедуру Рашкінда. Вона виконується відразу ж після народження дитини для забезпечення кровотоку з лівого до правого передсердя, але носить дуже великий ризик у цьому випадку.
Інтенсивна терапія та передопераційне забезпечення[ред. | ред. код]
Існують два основних моменти, що мають бути реалізовані для успішного передопераційного ведення цих критично тяжких пацієнтів. Перший — Відкрита артеріальна протока повинна бути відкритою (відомо, що вона може закритися протягом 24—48 годин після народження дитини) для забезпечення системного кровотоку. Другий — забезпечення балансу між Системним судинним опором та Легеневим судинним опором для оптимізації кровотоку в обидва кола кровообігу.
[12] Для цього забезпечується постійна внутрішньовенна інфузія Простагландину Е1 (англ. Prostaglandin Е1 — PGE1).
Окрім Простагландину Е1, медикаментозну терапію при СГЛВС проводять такими лікарськими засобами: Допамін (Dopamine), Фуросемід (Lasix), Каптопріл (Capoten). Застосування оксигенотерапії в цьому випадку обмежене, тому що кисень виступає потужним вазодилататором, який збільшує легеневий кровотік, а це в свою чергу може зменшити системний кровотік. Нормальне насичення кисню в крові таких пацієнтів сягає 75-80%.
Хірургічне лікування[ред. | ред. код]
Хірургічне лікування СГЛВС включає в себе 3 етапи:
- Перший етап — Операція Норвуда (англ. Norwood operation).
Виконується, як правило, у віці до 14 днів. При цьому забезпечується:
• Конструкція безперешкодного кровотоку від системного шлуночку.
• Адекватна та безперешкодна коронарна циркуляція.
• Конструкція системно-легеневого артеріального шунта для забезпечення паралельної легеневої циркуляції та безперешкодного міжпередсердного з’єднання для безперешкодного легеневого венозного повернення.
Можливе виконання Модифікованої операції Норвуда, вперше запропонованої японським кардіохірургом Шунжі Сано (Shunji Sano).[13][14]
Деякі пацієнти після першого етапу хірургічного лікування можуть потребувати тимчасової підтримки функції серця за допомогою Екстракорпоральної мембранної оксигенації або Шлуночкового допоміжного пристрою.
- Другий етап — Двонаправлений кавопульмональний анастомоз (англ. Bidirectional cavopulmonary anastomosis) або Процедура гемі-Фонтен (англ. Hemi-Fontan procedure).
Виконується у віці від 2,5 до 4 місяців
- Третій (завершальний) етап — Тотальний кавопульмонарний анастомоз (англ. Total cavopulmonary connection).
Виконується у віці від 2 до 3 років (при масі пацієнта 12-15 кг).
Прогноз[ред. | ред. код]
Останнім часом у світі дискутуються та проводяться дослідження з хірургічного втручання на серці плода в утробі матері. Новий метод лікування дістав назву — Фетальна аортальна балонна вальвулопластика. В світовій медицині вже у 2000 році з’явилися перші повідомлення про використання нового методу лікування у 12 вагітних жінок. Лише 1 новонароджений залишився в живих.[15] В США вперше цей метод був застосований в 2002–2003 роках у Дитячому Шпиталі м. Бостона.[9] Так, група дослідників Гарвардського Університету та Бостонського дитячого шпиталю у 2004 році сповістила про результати Фетальної Балонної Вальвулопластики у ще ненароджених 24 дітей. 20 плодам в утробі матері на 21-29 тижні вагітності була виконана ця процедура; з них технічно вона була успішною лише в 14 випадках. В подальшому, після народження дітей, з’ясувалося, що це втручання допомогло лише 2 новонародженим із 14.[16] Отже, проблема остається відкритою.[17]
У зв’язку з високою смертністю немовлят із цією вродженою вадою серця, батькам ще ненародженої дитини в деяких країнах пропонують Переривання вагітності.
Кардіохірургічні центри в Україні, що надають високоспеціалізовану допомогу пацієнтам із СГЛВС[ред. | ред. код]
- Національний інститут серцево-судинної хірургії ім. М. М. Амосова АМН України
Дівіться також[ред. | ред. код]
Пренатальна діагностика
Фетальна аортальна балонна вальвулопластика
Транспозиція магістральних артерій
Примітки[ред. | ред. код]
- ↑ Julien I. E. Hoffman, Samuel Kaplan, Richard R. Liberthson Prevalence of congenital heart disease American Heart Journal 2004 Mar;147(3):425-39. PMID 14999190
- ↑ Lev M. Pathologic anatomy and interrelationship of hypoplasia of the aortic tract complexes. Lab Invest. 1952;1:61–70 PMID 14939725
- ↑ Noonan JA, Nadas AS. The hypoplastic left heart syndrome. An analysis of 101 cases. Pediatr Clin North Am 1958; 5: 1029–56. PMID 13600906
- ↑ Norwood WI, Lang P, Hansen DD Physiologic repair of aortic atresia-hypoplastic left heart syndrome. N Engl J Med 1983;308: 23–26. PMID 6847920
- ↑ D. Maxwell, L. Allan and M.J. Tynan, Balloon dilatation of the aortic valve in the fetus: a report of two cases. Br Heart J 65 (1991), pp. 256–258. PMID 6847920
- ↑ Архівована копія. Архів оригіналу за 6 березень 2016. Процитовано 3 жовтень 2010.
- ↑ Morris CD, Outcalt J, Menashe VD. Hypoplastic left heart syndrome: natural history in a geographically defined population. Pediatrics 1990;85:977-983 PMID 2339046
- ↑ Abbot, ME. Atlas of Congenital Cardiac Diseases. New York , American Heart Association; 1936.
- ↑ а б Richard A. Jonas , James DiNardo, Peter C. Laussen, Robert Howe, Robert LaPierre, Gregory Matte, Rebekah Dodson Comprehensive Surgical Management of Congenital Heart Disease «Hodder Arnold Publication» 2004 ISBN 0-340-80807-1
- ↑ Robert H. Anderson, Marco Pozzi, Suzie Hutchinson Hypoplastic Left Heart Syndrome Springer; 1 edition (November 12, 2004) ISBN 1-85233-765-6
- ↑ Василий Лазоришинец: «Детей, давшихся дорогой ценой, у нас много» «Здоров’я України» https://health-ua.org/article/health/425.html Архівовано 4 серпень 2009 у Wayback Machine.
- ↑ Hensley, Frederick A; Martin, Donald E; Gravlee, Glenn P Practical Approach to Cardiac Anesthesia Lippincott Williams & Wilkins 2003. ISBN 0-7817-3444-4
- ↑ Sano S, Ishino K, Kawada M, Arai S, Kasahara S, Asai T, et al. Right ventricle-to-pulmonary artery shunt in first-stage palliation of hypoplastic left heart syndrome. J Thorac Cardiovasc Surg 2003;126:504-10 PMID 12928651
- ↑ Shunji Sano New Era in Management of Hypoplastic Left Heart Syndrome Asian Cardiovasc Thorac Ann 2007;15:83-85 PMID 17387186
- ↑ Kohl T, Sharland G, Allan LD, Gembruch U, Chaoui R, Lopes LM, Zielinsky P, Huhta J, Silverman NH. World experience of percutaneous ultrasound-guided balloon valvuloplasty in human fetuses with severe aortic valve obstruction. Am J Cardiol. 2000 May 15;85(10):1230-3. Review. PMID 10802006
- ↑ Wayne Tworetzky, MD; Louise Wilkins-Haug, MD, PhD; Russell W. Jennings, MD; Mary E. van der Velde, MD; Audrey C. Marshall, MD; Gerald R. Marx, MD; Steven D. Colan, MD; Carol B. Benson, MD; James E. Lock, MD; Stanton B. Perry, MD Balloon Dilation of Severe Aortic Stenosis in the Fetus Circulation 2004 Oct 12;110(15):2125-31. Epub 2004 Oct 4.PMID 15466631
- ↑ Mizrahi-Arnaud A, Wilkins Haug L, Marshall A, Silva V. Maternal mirror syndrome after in utero aortic valve dilation. A case report. Fetal Diagn Ther. 2006;21(5):439-43. Review. PMID 16912494
Посилання[ред. | ред. код]
- Відділ хірургічного лікування вроджених вад серця Національного інституту серцево-судинної хірургії ім. М. М. Амосова www.serdechko.org.ua
англійською мовою
Синдром гіпоплазії лівих відділів серця. Відеоматеріали діагностичних процедур, операцій. Мультимедійна Бібліотека Children’s Hospital Boston, США
Синдром гіпоплазії лівих відділів серця Інформація від Mayo Clinic, США
Синдром гіпоплазії лівих відділів серця. Операція Норвуда. Інформація від Cincinnati Children’s Hospital Medical Center, США
Синдром гіпоплазії лівих відділів серця Інформація від University of Michigan Health System Cardiovascular Center, США
Інформаційна сторінка про Синдром гіпоплазії лівих відділів серця Сторінка створена батьками дітей, що народилися з діагнозом Синдром гіпоплазії лівих відділів серця
Синдром гіпоплазії лівих відділів серця Інформація від Children’s Hospital and Regional Medical Center Seattle, США
HLHS Echo Ехокардіографічне дослідження при гіпоплазії лівих відділів серця
Источник
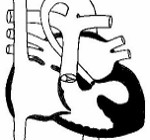
Синдром гипоплазии левых отделов сердца – группа морфологически близких дефектов сердца, включающих недоразвитие его левых отделов, атрезию или стеноз аортального и/или митрального клапанного отверстия, резкую гипоплазию восходящей аорты или комбинацию этих дефектов. Проявления синдрома развиваются по мере закрытия артериального протока, в первые сутки жизни новорожденного и характеризуются признаками кардиогенного шока: тахипноэ, одышкой, слабым пульсом, бледностью и цианозом, гипотермией. Диагноз синдрома гипоплазии левых отделов сердца можно предположить на основании двухмерной эхокардиографии, катетеризации сердца, рентгенографии, ЭКГ. Ведение больных с синдромом гипоплазии левых отделов сердца предполагает инфузию простагландина Е1; проведение ИВЛ, коррекцию метаболического ацидоза; поэтапную хирургическую коррекцию порока (операция Норвуда — операция Гленна или Геми-Фонтена – операция Фонтена).
Общие сведения
Синдром гипоплазии левых отделов сердца (СГЛОС) – термин, используемый для обозначения критического врожденного порока сердца, характеризующегося резким недоразвитием его левых камер и восходящей части аорты, а также митральным или аортальным стенозом. Синдром входит в пятерку наиболее часто встречающихся в кардиологии ВПС, наряду с дефектом межжелудочковой перегородки, транспозицией магистральных сосудов, тетрадой Фалло и коарктацией аорты. СГЛОС составляет 2-4% от всех встречающихся врожденных аномалий сердца, являясь ведущей причиной гибели новорожденных в первые дни и недели жизни. Мальчики страдают данным сочетанным пороком сердца в 2 раза чаще, чем девочки.

Синдром гипоплазии левых отделов сердца
Причины СГЛОС
Причины гипоплазии левых отделов сердца достоверно неясны. Предполагается возможность аутосомно-рецессивного, аутосомно-доминантного и полигенного типов наследования. Наиболее вероятной является теория мультифакториальной этиологии порока.
Различают два морфологических варианта СГЛОС. Первый (наиболее тяжелый) вариант включает гипоплазию левого желудочка и атрезию устья аорты, которые могут сочетаться с атрезией либо стенозом митрального отверстия; при этом полость левого желудочка щелевидна, ее объем составляет не более 1 мл. При втором (наиболее распространенном) варианте порока имеет место гипоплазия левого желудочка, стеноз устья аорты и гипоплазия ее восходящего отдела в сочетании с митральным стенозом; объем полости левого желудочка равен 1-4,5 мл.
Оба варианта гипоплазия левых отделов сердца сопровождаются наличием широкого открытого артериального протока и открытого овального окна, расширением правых отделов сердца и ствола легочной артерии, гипертрофией миокарда правого желудочка; нередко — фиброэластозом эндокарда.
Особенности гемодинамики
Тяжелые расстройства кровообращения при гипоплазии левых отделов сердца развиваются вскоре после рождения и характеризуются в литературе как «гемодинамическая катастрофа». Сущность нарушения гемодинамики определяется тем фактом, что кровь из левого предсердия не может поступить в гипоплазированный левый желудочек, а вместо этого попадает через открытое овальное окно в правые отделы сердца, где происходит ее смешение с венозной кровью. Эта особенность приводит к объемной перегрузке правых отделов сердца и их дилатации, которые наблюдаются с момента рождения.
В дальнейшем основной объем смешанной крови из правого желудочка поступает в легочную артерию, остальная же часть недонасыщенной кислородом крови через открытый артериальный проток устремляется в аорту и большой круг кровообращения. Ретроградным путем небольшое количество крови поступает в гипоплазированную часть восходящей аорты и венечные сосуды.
Фактически правый желудочек берет на себя двойную функцию, перекачивая кровь в легочный и системный круг кровообращения. Попадание крови в большой круг кровообращения возможно только по артериальному протоку, в связи с чем гипоплазия левых отделов сердца рассматривается как порок с дуктус-зависимым кровообращением. Прогноз для жизни ребенка зависит от сохранения артериального протока открытым.
Тяжелейшие расстройства гемодинамики приводят к выраженной легочной гипертензии вследствие высокого давления в системе сосудов малого круга; артериальной гипотонии, обусловленной неадекватным наполнением большого круга; артериальной гипоксемии, связанной со смешением крови в правом желудочке.
Симптомы СГЛОС
Клинические признаки, указывающие на гипоплазию левых отделов сердца, проявляются в первые часы или сутки после рождения. По своим проявлениям они схожи с респираторным дистресс-синдромом или кардиогенным шоком.
Как правило, дети с СГЛОС рождаются доношенными. У новорожденных наблюдается адинамия, сероватый цвет кожных покровов, тахипноэ, тахикардия, гипотермия. При рождении цианоз выражен незначительно, однако вскоре нарастает и становится диффузным либо дифференцированным, только на нижней половине туловища. Конечности наощупь холодные, периферическая пульсация на них ослаблена.
С первых дней жизни нарастает сердечная недостаточность с застойными хрипами в легких, увеличением печени, периферическими отеками. Характерно развитие метаболического ацидоза, олигурии и анурии. Нарушение системной циркуляции сопровождается неадекватной церебральной и коронарной перфузией, что приводит к развитию ишемии головного мозга и миокарда. В случае закрытия артериального протока ребенок быстро погибает.
Диагностика
Во многих случаях диагноз синдрома гипоплазии левых отделов сердца ставится еще до рождения ребенка при проведении ЭхоКГ плода. При объективном обследовании новорожденного ребенка определяется слабый пульс на руках и ногах, одышка в покое, усиленный сердечный толчок и видимая эпигастральная пульсация; выслушивается систолический шум изгнания, ритм галопа и одинарный II тон.
На ЭКГ отмечается отклонение ЭОС вправо, признаки резкой гипертрофии правых отделов сердца и левого предсердия. Фонокардиография фиксирует наличие низко- или среднеамплитудного систолического шума. Рентгенография грудной клетки при синдроме гипоплазии левых отделов сердца выявляет высокую степень кардиомегалии, шарообразные контуры сердечной тени, усиление легочного рисунка.
Эхокардиография обнаруживает следующие характерные признаки гипоплазии сердца: стеноз устья аорты и ее восходящего отдела, уменьшение размеров левого желудочка и увеличение правого желудочка, грубые изменения митрального клапана.
Зондирование полостей сердца обнаруживает пониженное насыщение крови кислородом в периферических артериях, лево-правый сброс крови на уровне предсердий, повышенное давление в правом желудочке и легочной артерии. Ангиокардиография позволяет визуализировать открытый артериальный проток, гипоплазированную восходящую аорту, резко дилатированный правый желудочек, расширенный легочный ствол и легочные артерии.
Дифференциальный диагноз при синдроме гипоплазии левых отделов сердца необходим с гипоплазией правого желудочка, единственным желудочком сердца, аномальным дренажем легочных вен, транспозицией магистральных сосудов, изолированным аортальным стенозом. Из внесердечных аномалий необходимо исключить острую дыхательную недостаточность, травму черепа, кровоизлияние в мозг.
Лечение СГЛОС
Наблюдение за новорожденными осуществляется в отделении реанимации. Для предупреждения закрытия или попытки открытия артериального протока осуществляется инфузия простагландина Е1. Необходимо проведение ИВЛ, коррекция метаболического ацидоза, введение диуретиков и инотропных препаратов.
Хирургическая коррекция гипоплазии левых отделов сердца проводится поэтапно и последовательно. Первый этап лечения – паллиативный; проводится в первые 2 недели жизни и заключается в выполнении операции Норвуда для уменьшения нагрузки на легочную артерию, и в то же время, для обеспечения кровоснабжения аорты. На втором этапе, в возрасте 3-6 месяцев ребенку выполняется операция Геми-Фонтена (или операция Гленна по наложению двухстороннего двунаправленного кава-пульмонального анастомоза). Окончательная гемодинамическая коррекция порока проводится примерно через год путем выполнения операции Фонтена (наложения тотального кавопульмонального анастомоза), позволяющей полностью разобщить круги кровообращения.
Прогноз
Порок является крайне неблагоприятным в отношении прогноза. В первый месяц жизни погибает около 90% детей с гипоплазией левых отделов сердца. Выживаемость после 1-го корригирующего этапа составляет 75 %, после 2-го — 95 %, после 3-го — 90 %. В целом через 5 лет после полной коррекции порока в живых остаются 70% детей.
Если гипоплазия левых отделов сердца выявляется у ребенка внутриутробно, ведение беременности и родоразрешение проводится в условиях специализированного перинатального медицинского центра. С первых дней жизни ребенок должен находиться под наблюдением неонатолога, детского кардиолога и кардиохирурга для проведения как можно более ранней коррекции порока.
Источник
