Синдром фрагильной хромосомы х и
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 29 декабря 2019;
проверки требуют 3 правки.
Синдро́м Ма́ртина — Белл (синдром ломкой X-хромосомы, fragile X syndrome, FraX (от англ. fragile — хрупкий, ломкий)) — наследственное заболевание.
Развитие синдрома связано с экспансией единичных тринуклеотидов (ЦГГ) в Х-хромосоме и приводит к недостаточной экспрессии белка FMR1, который необходим для нормального развития нервной системы. Существует четыре основных состояния хромосомного участка, подверженного нарушениям при синдроме ломкой Х-хромосомы, которые относятся к удлинению повторяющихся последовательностей ЦГГ. Нормальное количество повторов (отсутствие синдрома) — от 29 до 31. Премутация — от 55 до 200 повторов (синдром не развивается). Полная мутация — более 200 повторов (обычно от 230 до 4000), при которой проявляется синдром. Промежуточное состояние, или аллели серой зоны, — от 40 до 60 повторов[2].
История[править | править код]
В начале ХХ века учёные заметили преобладание умственной отсталости у лиц мужского пола. В 1943 году Джеймсом Мартином (James Purdon Martin) и Джулией Белл впервые была описана семья, где умственная отсталость наследовалась сцепленно с полом[3]. В этой английской семье 11 умственно отсталых детей мужского пола с психическим возрастом 2—4 года родились у интеллектуально нормальных матерей[3]. В двух случаях относительно небольшой интеллектуальный дефицит был у женщин этого семейства[3]. В 1969 году Hebert Lubs, проводя цитогенетическое обследование, выявил у больного синдромом Мартина-Белл вторичную перетяжку на длинном плече Х-хромосомы в локусе Xq27-28.
Частота распространения — 1:1000—1:2000 новорожденных мальчиков.
Этиология[править | править код]
Положение гена «FMR1» на Х-хромосоме.
Синдром ломкой Х-хромосомы развивается в результате мутации гена FMR1 в Х-хромосоме. Мутация в этом гене встречается приблизительно у одного из 2000 мужчин и у одной из 259 женщин. Распространённость непосредственно заболевания — приблизительно 1 из 4000 мужчин и 6000 женщин[4].
Экспансия повторяющихся кодонов ЦГГ приводит к гиперметилированию ДНК в промоторе гена FMR1 и, как следствие, фактическому прекращению его экспрессии.
Как предполагают, аномальное метилирование промотора гена FMR1 в локусе Хq27.3 является причиной формирования сайта ломкости Х-хромосомы. По этому цитогенетическому признаку синдром Мартина — Белл получил своё второе название — синдром ломкой Х-хромосомы.
Мутация гена FMR1 приводит к подавлению транскрипции белка FMR1. У здоровых индивидов FMR1, как считают, регулирует значительную популяцию мРНК: FMR1 играет важную роль в обучении и запоминании, а также принимает участие в развитии аксонов, формировании синапсов, появлении и развитии нервных связей[5].
Наследование[править | править код]
Синдром ломкой Х-хромосомы — сцепленное с полом доминантное заболевание с редуцированной пенетрантностью[6].
Мужчины имеют одну Х-хромосому, соответственно, если она содержит мутантный аллель, у носителя развивается заболевание. Женщины несут две Х-хромосомы, таким образом, их шанс получить нормальный аллель удваивается. Женщина с мутантным геном FMR1 может иметь симптомы болезни или быть здоровой. Несмотря на то, что вторая Х-хромосома может служить резервной копией, только одна Х-хромосома активна в каждой отдельной клетке, вследствие инактивации второй.
Мужчина с ломкой Х-хромосомой не может передать её ни одному из сыновей, только всем дочерям. Женщина с одной мутантной хромосомой имеет одинаковые шансы передать её как дочерям, так и сыновьям с вероятностью 50 %. Наследование синдрома ломкой Х-хромосомы обычно увеличивается с каждым новым поколением, это явление получило название парадокса Шермана.
Патогенез[править | править код]
В начале 1990-х годов было осуществлено секвенирование гена синдрома Мартина — Белл. Полученные результаты показали, что в основе клинических проявлений и цитогенетически выявляемой ломкости X-хромосомы при этом заболевании лежит многократное увеличение числа тринуклеотидных повторов ЦГГ. Оказалось, что у здоровых индивидов число этих повторов в X-хромосоме колеблется от 6 до 54, а увеличение этого числа свыше 200 повторов приводит к феномену ломкой X-хромосомы и клиническому проявлению заболевания. Предмутационное состояние — когда повторов ЦГГ от 55 до 200: заболевание у таких людей в типичной форме не проявляется, но высока вероятность того, что оно проявится у их потомков.
Экспансия тринуклеотидных повторов происходит во время гаметогенеза. Переход от состояния предмутации к полной мутации возможен только при передаче гена от матери, то есть «утяжеление» аллеля происходит во время овогенеза.
Клиническая картина[править | править код]
Мальчик с синдромом Мартина — Белл
Мальчики рождаются с большой массой тела — от 3,5 до 4 кг. Первым признаком, который заставляет заподозрить заболевание, является макроорхизм (увеличение размеров яичек) при отсутствии эндокринной патологии. Также есть определённые фенотипические признаки: большая голова с высоким и широким лбом, длинное лицо с увеличенным подбородком, несколько уплощённая средняя часть лица, тупой, слегка клювовидно загнутый кончик носа. Уши большие, иногда оттопыренные, низко расположенные. Кисти и стопы широкие, дистальные фаланги пальцев также широкие, суставы имеют повышенную подвижность. Кожа нередко гиперэластична. Часто встречаются светлоокрашенные радужные оболочки, светлые волосы. Не обязательно встречаются все признаки — могут быть один или несколько.
Неврологическая симптоматика неспецифична, определяется как и у всех детей с умственной отсталостью. Наблюдается некоторая мышечная гипотония, дискоординация движений. Также могут быть глазодвигательные, пирамидные и экстрапирамидные нарушения.
Главным симптомом синдрома является интеллектуальное недоразвитие и своеобразная речь. Такие больные говорят быстро, сбивчиво, имеются выраженные эхолалии и персеверации (бормочущая речь). Степень умственной отсталости при синдроме Мартина — Белл колеблется между средней и легкой умственной отсталостью[7].
Также могут быть нарушения поведения в виде агрессивности, двигательной расторможенности. В качестве одной из частых психопатологических особенностей отмечена симптоматика, напоминающая аутистическую: стереотипии, эхолалия, мутизм, самоповреждения, трудно устанавливаемый зрительный контакт и непереносимость прикосновений[7]. Однако в отличие от аутистов, эти дети стремятся к общению[7]. Встречаются также подпрыгивания, похлопывания руками, повороты вокруг своей оси, встряхивание кистями, «манежный» бег, разнообразные гримасы, монотонное хныканье.
Кроме вышеописанного у таких детей могут быть признаки раннего детского аутизма.
Диагностика[править | править код]
Характерными особенностями синдрома являются удлинённое лицо, большие или выступающие уши и низкий мышечный тонус.
Синдром хрупкой Х-хромосомы диагностируется путём определения количества ЦГГ-повторов и их статуса метилирования с помощью эндонуклеазной рестрикции и саузерн-блоттинга.
Это заболевание относится к болезням экспансии (экспансия — резкое увеличение числа копий повторяющихся участков молекулы ДНК (повторы) у индивидов в последующих поколениях родословной). Феномен экспансии числа тринуклеотидных повторов (ЦГГ) был впервые обнаружен как раз при молекулярно-генетическом исследовании этого синдрома.
Ранее диагноз синдрома Мартина-Белл основывался на данных клинико-генеалогического анализа и результатах цитогенетического исследования клеток больного, выращенных на специальной среде с дефицитом фолиевой кислоты. В случае обнаружения поломок X-хромосомы в локусе Xq27.3 диагноз синдрома не вызывает сомнений.
Лечение[править | править код]
Лечения для синдрома ломкой Х-хромосомы не существует, однако есть надежда, что дальнейшие исследования причин заболевания предоставят новые возможности терапии. В настоящее время симптомы можно облегчить с помощью когнитивно-поведенческой терапии, специфического обучения, медикаментов и, при необходимости, лечения физических аномалий. Лица, имеющие случаи синдрома ломкой Х-хромосомы в семье, должны получить генетическое консультирование при планировании беременности[8].
Поскольку в эксперименте обнаружение ломкости удалось обнаружить в среде, бедной фолатами, было предложено лечить таких детей фолиевой кислотой.
Эффект от лечения у детей выражен больше, чем у взрослых: пропадает агрессия, повышается внимание, улучшается моторика и речь.
Также пробуют лечить таких больных психостимуляторами.
Примечания[править | править код]
- ↑ Disease Ontology release 2019-05-13 — 2019-05-13 — 2019.
- ↑ Sherman, S. Epidemiology // Fragile X Syndrome, Diagnosis Treatment and Research (англ.) / Hagerman, R. J.; Hagerman, P. J.. — 3rd. — Baltimore: Johns Hopkins University Press (англ.)русск., 2002. — ISBN 0801868432.
- ↑ 1 2 3 J. Purdon Martin, Julia Bell. A pedigree of mental defect showing sex-linkage (англ.) // Journal of Neurology, Neurosurgery, and Psychiatry (англ.)русск. : journal. — 1943. — Vol. 6, no. 3—4. — P. 154—157. — doi:10.1136/jnnp.6.3-4.154. — PMID 21611430.
- ↑ Nolin S.L., Brown W.T., Glicksman A., et al. Expansion of the fragile X CGG repeat in females with premutation or intermediate alleles (англ.) // Am. J. Hum. Genet. (англ.)русск. : journal. — 2003. — Vol. 72, no. 2. — P. 454—464. — doi:10.1086/367713. — PMID 12529854.
- ↑ Bassell G.J., Warren S.T. Fragile X syndrome: loss of local mRNA regulation alters synaptic development and function (англ.) // Neuron (англ.)русск. : journal. — Cell Press (англ.)русск., 2008. — Vol. 60, no. 2. — P. 201—214. — doi:10.1016/j.neuron.2008.10.004. — PMID 18957214.
- ↑ Garber K.B., Visootsak J., Warren S.T. Fragile X syndrome (англ.) // Eur J Hum Genet (англ.)русск. : journal. — 2008. — Vol. 16, no. 6. — P. 666. — doi:10.1038/ejhg.2008.61. — PMID 18398441.
- ↑ 1 2 3 Н. Н. Иванец, Ю. Г. Тюльпин, В. В. Чирко, М. А. Кинкулькина. Психиатрия и наркология: учебник. — М.: ГЭОТАР-Медиа, 2006. — С. 596. — 832 с. — ISBN 5-9704-0197-8.
- ↑ Hagerman R.J., Berry-Kravis E., Kaufmann WE et al. Advances in the treatment of fragile X syndrome (англ.) // Pediatrics (англ.)русск.. — American Academy of Pediatrics (англ.)русск., 2009. — Vol. 123, no. 1. — P. 378—390. — doi:10.1542/peds.2008-0317. — PMID 19117905.
Ссылки[править | править код]
- Американские ученые вылечили умственную отсталость у мышей. Medportal.ru
- Синдром ломкой X-хромосомы. Пер. с англ. Н. Д. Фирсовой (2018)
Источник
Синдром фрагильной Х-хромосомы (ломкой Х-хромосомы, ФХС, FRAX-А, синдром Мартина-Белла) — клиника, диагностикаСиндром фрагильной Х-хромосомы (синдром ломкой Х-хромосомы) (ФХС, иногда упоминается в литературе как «FRAX-А» и синдром Мартина-Белла) представляет собой сочетание соматических и поведенческих характеристик, связанных с фрагильным участком (и локусом гена) длинного плеча Х-хромосомы в области Xq27.3, который обнаруживается только в культуре с умеренным дефицитом фолата. Данное заболевание является второй после синдрома Дауна причиной задержки умственного развития с коэффициентом IQ менее 50 и наиболее частой причиной семейных случаев умственной отсталости и предпосылкой для развития различных поведенческих проблем, включая аутизм и синдром гиперактивности (Percy et al., 1990; Reiss и Freund, 1990; Hagerman и Hagerman, 2002). У многих пациентов отмечаются специфические нарушения речи, языковых навыков, поведения и социальных навыков. «Беспорядочная» речь является характерным признаком (Hanson et al., 1986). Типичны гиперактивность и дефицит внимания, а аутизм выявляется в 23% случаев (Bregman et al., 1987; Thake et al., 1987; Vieregge и Froster-Iskenius, 1989). Тем не менее, поведенческий фенотип отличается от проявлений аутизма, вызванного другими причинами, а гиперактивность может быть особенно ярко выражена (Baumgardner et al., 1995; Hagerman et al., 2005). Женщины, являющиеся носителями полной мутации одной из Х-хромосом, обычно имеют нормальный фенотип. Приблизительно в 35% случаев отмечается задержка умственного развития, обычно легкая, а у 15% пациенток отмечается пограничный уровень интеллекта, сложности в обучении или и то и другое (Kemper et al., 1986). Таким образом, ФХС является важной причиной легкой задержки умственного развития у женщин. Кроме того, приблизительно у 10% женщин с нормальным интеллектом, являющихся носительницами патологической хромосомы, могут отмечаться психиатрические заболевания, в особенности аффективное или шизоидное расстройство (Reiss и Freund, 1990). а) Патогенез. Синдром вызван увеличением «нормального» количества дупликаций тринуклеотида ЦГГ на участке Xq27.3 гена FMR1, кодирующего белок FMRR Имеются сообщения о развитии премутации при наличии более 55 повторов (51-54 повтора—пограничное число), а полная мутация отмечается, когда количество повторов превышает 200. Передача синдрома от мужчин без симптомов заболевания предполагает наличие премутаций, связанных с повтором 55-200 копий. Премутация имеет тенденцию к стабильности в процессе сперматогенеза, но часто превращается в полную мутацию в процессе овогенеза; таким образом, дочери мужчин-носителей всегда являются носительницами только премутации, в то время как у детей женщин-носительниц часто развивается клинически выраженная форма заболевания. У мужчин с полной мутацией практически всегда отмечается задержка умственного развития, в то время как у женщин это осложнение встречается лишь в 30-50% случаев и по сравнению с мужчинами менее выражено (Staley et al., 1993). Выявление фрагильного участка возможно только в 30-50% случаев. Присутствие полной мутации препятствует трансляции гена в белок (в результате метилирования) (Knight et al., 1993). Отсутствие гена FMRP в редких случаях регистрируется у пациентов без увеличения количества тринуклеотидов, а с множественными делециями или точечными мутациями гена FMR1 (Hirst et al., 1995). Зарегистрированы редкие случаи, когда у мужчин с полной мутацией сохранялись нормальные когнитивные способности (Smeets et al., 1995). Ген FMRP экспрессирован во многих тканях, с особым изобилием в нейронах. Его содержание у лиц с премутациями остается нормальным (Devys et al., 1993). Функции гена FMRP до сих пор до конца не изучены. Полная мутация гена может стать причиной аутизма, неспособности к обучению, тревожных расстройств и задержки умственного развития. Имеются данные о том, что аутизм также встречается у молодых мужчин, являющихся носителями премутантных аллелей. В ходе одного из недавних исследований было продемонстрировано, что приблизительно у 30% пациентов с ФХС отмечается аутизм; среди пациентов с аутизмом (по сравнению с пациентами только с ФХС) выявляются более низкие когнитивные способности, более выраженные проблемы с речью и отклонения поведения. Другие отклонения, связанные с премутантными формами гена, включают «синдром тремора-атаксии» (ФХТАС) среди пожилых мужчин и в редких случаях у женщин и преждевременную недостаточность яичников (Hagerman et al., 2005). У пациентов с синдромом фрагильной Х-хромосомы (ФХС) отмечается нарушение регуляции путей, связанных с метаботрофным рецептором глутамата-5; считается, что данное нарушение метаболизма обусловливает характерный фенотип.
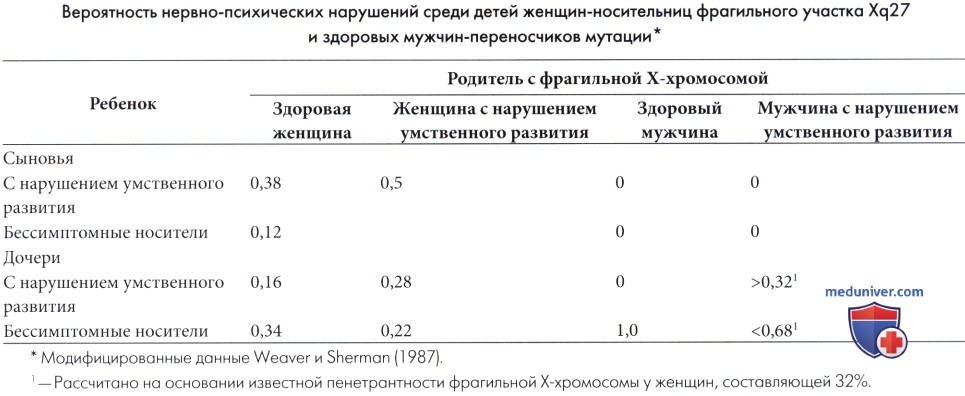
б) Распространенность. Синдром фрагильной Х-хромосомы (ФХС) (полная мутация ДНК) встречается с частотой приблизительно 1:4000 (среди мужчин) и 1:8000 (среди женщин), но учитывая, что исследования ДНК населения в целом не проводились, невозможно сделать вывод о достоверности данных сведений (Hagerman и Hagerman, 2002). Носительство премутаций отмечается с частотой 1:750-1000 мужчин и 1:250-350 женщин. С учетом того, что не у всех носителей фрагильной Х-хромосомы уровень IQ ниже 70, и они (не всегда) могут иметь лишь незначительные проблемы с учебой без гендерных различий, истинная распространенность ФХС (полной мутации и премутации с клинически значимыми отклонениями), вероятно, выше. У большинства мужчин с полной мутацией отмечаются отклонения от умеренной до тяжелой степени выраженности, в то время как у женщин проявления заболевания имеют менее выраженный характер, тем не менее, около трети пациенток имеют коэффициент IQ менее 70. Распространенность ФХС среди детей с трудностями в обучении от умеренной до тяжелой степени выраженности и без специфических дисморфических проявлений варьирует от 2% до 10% (Slaney et al., 1995). в) Диагностика. Диагноз синдрома фрагильной Х-хромосомы (ФХС) можно предположить на основании фенотипа; диагноз легко установить в постпубертатном периоде у мальчиков и затруднительно в препубертатном периоде у мальчиков и у девочек-носительниц, без типичных соматических изменений. Крупные уши и макроорхизм, напротив, часто не связаны с фрагильной Х-хромосомой (Hagerman, 1987). Семейный анамнез задержки умственного развития показателен, но обнаруживается только в трети случаев (Simko et al., 1989). Исследования ДНК в настоящее время надежны и оправдывают затраты (Rousseau et al., 1991, 1994; Oostra et al., 1993; Wang et al., 1993; Hagerman и Hagerman, 2002a). Экспресс-метод реакции антител, позволяющий выявить ген FMRP в лимфоцитах, был предложен в качестве скрининга для выявления полной мутации (Willemsen et al., 1995). Пренатальная диагностика синдрома фрагильной Х-хромосомы (ФХС) возможна с использованием культуры амниотических клеток или клеток ворсин хориона и методом анализа ДНК. Тем не менее, возникают этические проблемы, так как только у некоторых носителей мутации (особенно среди женщин) в дальнейшем разовьется заболевание. В настоящее время рассчитана (Weaver и Sherman, 1987) вероятность задержки умственного развития у детей больных родителей, но точные рекомендации остаются затруднительными.
г) Клинические проявления. Заболевание легче выявить у подростков, чем у детей в препубертатном возрасте. Наиболее важными проявлениями являются отсутствие замедленного физического развития, типично связанного с многими причинами умственной отсталости и, в особенности, нормальная или увеличенная окружность головы, вытянутое лицо с выступающей челюстью и макроорхизм (Но et al„ 1989). Классические проявления в виде вытянутого узкого лица и выступающих ушей часто незаметны в препубертатном периоде, хотя иногда бывают ярко выражены у молодых мужчин с ФХС. У взрослых женщин с полной мутацией часто отмечаются такие же изменения лица, но многие из них выглядят более «нормально», по сравнению с мужчинами. Макроорхизм отмечается приблизительно у трети мальчиков с ФХС и более чем у 90% взрослых мужчин. Другие частые изменения включают повышенную подвижность суставов пальцев, два сустава на первом пальце руки, плоские стопы, мягкую кожу, мышечную гипотонию, шум или дополнительный тон сердца (часто связанный с пролапсом митрального клапана или расширением корня аорты), косоглазие и высокое небо различной степени выраженности. В детском возрасте чрезвычайно часто встречается рецидивирующий средний отит, особенно по сравнению со здоровыми сибсами и детьми в общей популяции. В препубертатном возрасте у детей выявляются только следующие признаки: большая голова, большие уши и высокое небо. Помочь в установлении диагноза может также обнаружение повышенной гибкости суставов и мягкие уши. Несмотря на отсутствие макроорхизма у пациентов раннего возраста, в 15-50% случаев отмечается некоторое увеличение яичек (Simko et al., 1989). Типичные соматические проявления синдрома фрагильной Х-хромосомы (ФХС) представлены в таблице ниже. Задержка умственного развития при синдроме фрагильной Х-хромосомы (ФХС) обычно выражена слабо или умеренно, но с тенденцией к утяжелению в подростковом и взрослом возрасте (Borghgraef et al., 1987; Hagerman, 1987,1989; Wisniewski et al., 1989). У большинства мужчин по результатам стандартных тестов уровень IQ составляет менее 70 (чаще всего 35-40), но часть пациентов обладает нормальным или низко нормальным коэффициентом IQ. Вербальные навыки обычно превосходят способность к выполнению заданий и зрительно-пространственные навыки. Эпилепсия является достаточно частым проявлением и встречается в 15-25% случаев (Hagerman и Hagerman, 2002). Приступы часто имеют сложный парциальный характер, относительно доброкачественны и склонны к разрешению в подростковом возрасте, тем не менее, изредка отмечаются тяжелые и сложные случаи эпилепсии. Существует гипотеза о возможной связи припадков с аномалиями червя мозжечка, выявляемыми при ФХС. В подавляющем большинстве случаев у мужчин отмечаются явные признаки социальной дисфункции. Практически у всех мужчин присутствуют проявления аутизма, но лишь у немногих развивается полный синдром аутизма в сочетании с задержкой умственного развития или без нее. Фрагильная Х-хромосома наиболее распространена среди известных причин аутизма. Часто (приблизительно у половины мальчиков с полной мутацией) встречается гиперкинетический синдром в сочетании с аутизмом или без него, обычно с аутистическими проявлениями (Sullivan et al., 2006). Показатели когнитивных функций при ФХС отличаются от встречающихся при низкофункциональном аутизме, но достаточно часто соответствуют таковым при высокофункциональном аутизме и синдроме Аспергера. Некоторые авторы описывают сочетание синдрома Аспергера и синдрома фрагильной хромосомы (Hagerman, 1989). Некоторые варианты поведения, наиболее часто встречающиеся у пациентов мужского пола, включают избегание зрительного контакта, оборонительное поведение при прикосновении и социальную самоизоляцию (в возрасте от 0 до 2 лет); избегание зрительного контакта и приветственного поведения (отворачивание головы и тела при приветствии других людей), застенчивость, двигательные стереотипии различных видов и гиперактивность (в возрасте 3-4 лет); эхолалия, беспорядочная речь, «нервная непоседливость», хлопанье в ладоши, стереотипное махание вещами, кусание запястья или суставов пальцев, избегание зрительного контакта и приветственного поведения вместо стремления к социальной близости и заинтересованности в других людях (в возрасте 5-8 лет); сохраняющаяся застенчивость, избегание зрительного контакта и «нервозность», часто также привязанность к определенным вещам или людям на фоне общей картины умеренной задержки умственного развития с быстрой, беспорядочной речью с эхолалиями (очень часто отмечается разговор полушепотом, «нервный» смех) (в возрасте 9-12 лет); сохраняющиеся отклонения, часто усиливающиеся различными проблемами, связанными с началом пубертатного периода, включая трансвестизм, гипервозбудимость, самодеструктивное поведение и проблемы с одеждой (в связи с большим размером гениталий) (в возрасте 13-20 лет). В пубертатном периоде часто отмечается остановка когнитивного развития или даже ухудшение когнитивных функций. Сходная клиническая картина изредка отмечается у больных женщин, но в основном отклонения менее выраженные. У небольшого количества пациентов выявляется резко выраженный аутизм, а застенчивость и избегание зрительного контакта являются достаточно частыми проявлениями даже среди относительного большого числа больных без существенных отклонений. От трети до половины женщин с ФХС имеют различные варианты проблем обучения, которые варьируют от дислексии до легкой/умеренной задержки умственного развития. Имеются единичные сообщения о развитии шизоаффективного психоза у некоторых молодых женщин с фрагильной Х-хромосомой (Hagerman, 1989). У некоторых из этих женщин до развития психоза отмечались относительно небольшие проблемы в обучении, но с другой стороны, у них, по крайней мере, внешне, не выявлялось каких-либо проблем. Фенотип фрагильной Х-хромосомы также сочетается с синдромом тремора и атаксии (ФХТАС), который представлен тремором, атаксией, периферической поли-нейропатией и когнитивным дефицитом. Обычно отмечается значимая атрофия головного мозга и поражение белого вещества. ФХТАС развивается после подросткового возраста у мужчин (в отдельных случаях у женщин), имеющих премутации. Считается, что данный синдром связан с увеличением уровня аномальной информационной РНК гена FMR1. Имеющаяся в настоящее время информация в сочетании с недавно полученными сведениями о связи выраженности нейропатии (количества внутриядерных включений) и размера премутационного аллеля, подтверждает, что нейродегенеративный фенотип при ФХТАС является следствием распространенности повторов тринуклеотида ЦГГ (Cohen et al., 2006). Получены убедительные доказательства взаимосвязи премутации гена FMR1 и нарушения функции яичников с потерей фертильности (Wittenberger et al., 2007). Токсическое действие информационной РНК гена FMR1, кодирующей патологический белок, может являться причиной повреждения функции яичников. У женщин с преждевременной недостаточностью яичников отмечается повышенный риск наличия премутации гена FMR1; их информируют о возможности обследования на наличие фрагильной X-хромосомы. Специалисты по репродуктивной медицине могут обеспечить адекватные условия для разъяснения роли обследования на премутацию гена FMR1, создать условия для проведения и своевременно направлять пациенток на генетическую консультацию.
д) Лечение. В настоящее время специфического лечения синдрома фрагильной Х-хромосомы не существует (Hagerman, 1989). Некоторыми врачами использовалась фолиевая кислота (0,5-1,5 мг/кг, дважды в сутки), но эффективность сомнительна. В некоторых отчетах предполагается положительное воздействие фолиевой кислоты на симптомы аутизма, как минимум при назначении в дошкольном возрасте, но после пубертатного периода данный препарат оказывает незначительное отрицательное воздействие или не действует. Многие авторы использовали стимуляторы для подавления гиперактивности (в дозах, рекомендованных детям с синдромом дефицита внимания с гиперактивностью независимо от этиологии) и отмечали благоприятные или хорошие результаты (Hagerman и Hagerman, 2002). Ингибиторы обратного захвата серотонина могут быть эффективны в отношении тревожности, депрессивного настроения и раздражительности, но при применении необходим строгий контроль из-за возможности усиления импульсивности и агрессивного поведения. е) Другие, связанные с Х-хромосомой синдромы, с задержкой умственного развития. ФХС объясняется только 50% случаев преобладания задержки умственного развития среди мальчиков. Описано множество других более или менее идентифицированных синдромов связанной с Х-хромосомой задержки умственного развития (Opitz et al., 1986). Некоторые пациенты с анэуплоидией половых хромосом имеют трудности в обучении и другие нервно-психические отклонения. Данные заболевания описаны ниже. 1. FRAX-E. В некоторых случаях выявляется второй тип синдрома фрагильной Х-хромосомы (FRAX-E), вызванный распространением повторов тринуклеотида ГЦЦ в области Xq28, 600 тысяч нуклеотидов после гена FMR1 (Flynn et al., 1993). Задержка умственного развития обычно имеет слабо выраженный характер, а во многих случаях полностью отсутствует. 2. FRAX-F. Зарегистрирован третий вариант фрагильной Х-хромосомы (FRAX-F), который также связан с распространением повторов тринуклеотидов и может сочетаться с задержкой умственного развития и припадками (Hirst et al., 1993). 3. Синдром Ренпеннинга. Синдром Ренпеннинга, изначально считавшийся одним из клинических вариантов ФХС, характеризуется задержкой умственного развития от умеренной до тяжелой степени выраженности, легкой микроцефалией, низкорослостью и нормальным строением хромосом (Archidiacono et al, 1987). 4. Синдром Юберга-Марсиди. Данный редкий синдром включает такие проявления как задержка роста, глухота и микрогенитализм (Juberg и Marsidi, 1980). ж) Другие варианты рецессивных сцепленных с Х-хромосомой синдромов с задержкой умственного развития. Рецессивные сцепленные с Х-хромосомой синдромы с задержкой умственного развития были зарегистрированы также в сочетании с избыточным ростом тела (Golabi и Rusen, 1984), грубыми чертами лица, низкорослостью, макроорхизмом (Atkin et al., 1985) и прогрессирующими сложными неврологическими нарушениями (Schimke et al., 1984; Pfeiffer и Steffann, 1985). У родственников (мужского пола) пациентов со сцепленным с Х-хромосомой стенозом водопровода может отмечаться задержка умственного развития от умеренной до тяжелой степени выраженности, не сочетающаяся с гидроцефалией (Willems et al., 1987), иногда сопровождающаяся параплегией, приведенными первыми пальцами кистей и нарушениями речи (синдром задержки умственного развития-афазии-шаркающей походки-приведенных первых пальцев кистей). Сцепленная с Х-хромосомой глухота вследствие поражения слухового нерва, атрофия зрительного нерва и деменция могут быть проявлениями специфического рецессивного сцепленного с Х-хромосомой синдрома (Jensen 1981). — Также рекомендуем «Синдром Гольденхара — клиника, диагностика» Редактор: Искандер Милевски. Дата публикации: 4.12.2018 Оглавление темы «Наследственные синдромы в неврологии.»:
|
Источник

