Синдром диабетической стопы медицинский журнал

 Для цитирования. Кисляков В.А., Оболенский В.Н., Юсупов И.А. Синдром диабетической стопы: комплексный подход к лечению // РМЖ. 2015. No 12. С. 768–770.
Для цитирования. Кисляков В.А., Оболенский В.Н., Юсупов И.А. Синдром диабетической стопы: комплексный подход к лечению // РМЖ. 2015. No 12. С. 768–770.
Распространенность и экономические аспекты
В XXI в. сахарный диабет (СД) стал ведущим неинфекционным заболеванием. Каждые 10 с в мире становится на 2 больных СД больше – это 7 млн в год. По мнению экспертов Всемирной организации здравоохранения, СД занимает 1-е место среди заболеваний, приводящих к инвалидности, и 3-е – по смертности [1–4].
Согласно исследованиям Эндокринологического научного центра (ЭНЦ), в России распространенность СД достигает 10–12 млн человек (7–8% населения страны). Наиболее высокая распространенность СД среди взрослого населения крупных городов. При этом соотношение мужчин и женщин – 1:3. В половине случаев СД 2-го типа выявляется на 5–7-м году от начала заболевания, и у 20–30% выявляются специфические осложнения: катаракта, ретинопатия, нефропатия, нейропатия, синдром диабетической стопы (СДС), ишемическая болезнь сердца, артериальная гипертония и др. [5–8].
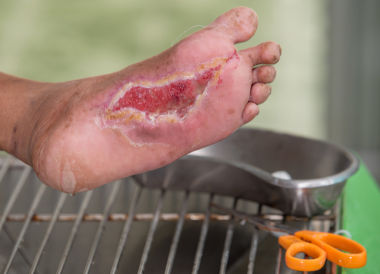
СДС приводит к гнойно-некротическим поражениям стоп с последующей потерей нижних конечностей – к самой высокой инвалидизации. Окончательные цифры распространенности СДС в настоящее время неизвестны. Тем не менее установлено, что у 15% больных СД развиваются патологические изменения в стопах или голеностопном суставе [9–13].
В последние годы широко обсуждаются не только клинические, но и экономические, социальные аспекты профилактики и лечения СДС, методы клинико-экономического анализа и, прежде всего, учет всех затрат, связанных с лечением СДС [1, 14].
На 18-м конгрессе Международной федерации диабета (МФД) были представлены, в частности, данные о распространенности язвенных дефектов при СДС в странах Балканского региона – 7,5%. Диагноз СД впервые ставится во время хирургического вмешательства у 15–19% больных, подвергающихся ампутации. Специалисты МФД считают, что вероятная частота ампутаций при СД составляет 5–24 на 100 000 населения в год, или 6–8 на 1000 больных в год, а в эпидемиологически неблагоприятных регионах достигает 24 на 1000 больных в год. В России, согласно данным государственного регистра, эти показатели колеблются от 0,76 до 18,2 и в среднем составляют 6,4 случая на 1000 больных [3, 4, 11, 15].
Расходы на лечение СДС в развитых странах составляют около 12–15% от всех затрат на лечение СД, в развивающихся странах они могут составлять до 40% от общего объема финансовых ресурсов, выделяемых на СД. Подсчитано, что на проведение одной ампутации в зарубежных странах тратится более 10 000 долл. Общие затраты на лечение СДС в среднем составляют 13 179 долл. и меняются в зависимости от степени тяжести по классификации Wagner в пределах от 1892 долл. при I степени до 27 721 долл. при IV–V степени тяжести. Лечение СДС на фоне хронической артериальной недостаточности нижних конечностей обходится в 4,5 раза дороже, чем при сохранном периферическом кровотоке. Ежегодная стоимость лечения язвенных поражений стоп при СДС в США составляет 5 млрд долл. прямых медицинских затрат и 400 млн долл. косвенных медицинских затрат. Кроме того, в США зафиксировали, что 77% людей старше 75 лет после ампутации не способны вернуться в собственный дом и им нужна дополнительная помощь и поддержка социальных групп [8, 16–18].
Анализ работы отделения диабетической стопы ЭНЦ показал, что при своевременно начатой адекватной терапии СДС понижается риск хирургических вмешательств и тяжелых осложнений: у 98% больных с нейропатической инфицированной формой СДС можно избежать хирургического вмешательства; у 60% с нейроишемической формой – проведения ампутаций на уровне голени и бедра; у 25% с критической ишемией – предотвратить высокие ампутации на уровне бедра; на 50% уменьшить частоту образования язв стоп в группе высокого риска [4, 5, 13].
Летальность среди больных СД, перенесших высокую ампутацию конечности по поводу гангрены, в течение последующих 5 лет достигает 68%, в ближайшие 3 нед. – 22%, в течение года – 11–41%, через 3 года – 20–50%, через 5 лет – от 39–68%. Частота ипсилатеральных ампутаций через год после первой ампутации – до 24%, через 2 года – 30%, через 5 лет – 49% и контралатеральных ампутаций через год после первой ампутации – до 12%, через 2 года – 23%, через 5 лет – 28-51%. Рецидивы язв на стопах через 1, 3, 5 лет составили 44, 61, 70% соответственно. Рецидивирующие деструктивные поражения ухудшают проблемы лечения, реабилитации, социальной помощи, увеличивая экономические затраты [19–23].
Если распространенность СД, а соответственно и СДС будет увеличиваться с той же скоростью, что и сейчас, то к 2025 г. экономический ущерб составит от 213 до 396 млрд долл. в год. 75% прироста заболевания придутся на развивающиеся страны. По данным немецких исследователей, общая стоимость лечения больных СД в Германии составляет приблизительно 5 млрд. евро, а средняя стоимость лечения 1 пациента – 5000 евро в год. Ежегодные общие затраты в России на лечение нейроишемической формы СДС составляют 56,2 млн долл., при этом затраты на ампутации достигают 14,4 млн долл. [2, 5, 17].
По оценке главного экономиста Morgan Stanley Эльги Бартш, сочетание двух факторов – СД и ожирения – снизит среднегодовые темпы роста валового внутреннего продукта (ВВП) в странах Организации экономического сотрудничества и развития (ОЭСР) в 2015–2035 гг. с 2,3 до 1,8%, в странах БРИКС (Бразилия, Россия, Индия, Китай, Южно-Африканская Республика) – с 4,5 до 4,2%. Согласно прогнозам ОЭСР, среднегодовые темпы роста ВВП России составят 2,8%. При сохранении нынешнего уровня потребления сахара гражданами страны этот показатель снизится до 2%. Согласно результатам исследования, проведенного фармацевтической компанией «Ново Нордиск», «Инвестиции в лечение сахарного диабета в России», ежегодные прямые затраты, связанные с СД в России, составляют 12,5 млрд долл. США. При этом 42% объема этих средств расходуется на лечение осложнений, которые выявляются у 40–50% людей в момент постановки диагноза. Соответственно диагностика заболевания на ранних стадиях позволит российскому обществу сэкономить более 1,5 млрд долл. США из средств, выделяемых на здравоохранение [13].
Принципы терапии
По мнению большинства авторов, в лечении пациентов с синдромом диабетической стопы должны участвовать квалифицированные эндокринолог, гнойный хирург, сосудистый хирург, ортопед, специально обученный средний медицинский персонал, а комплексное лечение должно включать общие и местные методы (рис. 1) [24–26].
Тактика комплексного лечения зависит от формы заболевания [14, 15, 18, 19, 21, 27]. Мы, как и ряд специалистов, выделяем следующие клинические формы СДС.
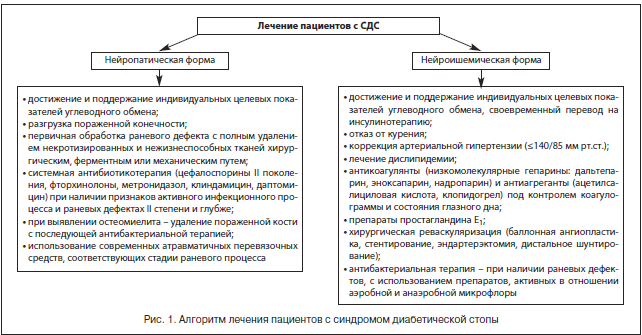
1. Нейропатическая форма:
– без остеоартропатии;
– с остеоартропатией – «сустав Шарко».
2. Нейроишемическая форма с учетом других характеристик.
К общим принципам терапии пациентов с СДС относятся коррекция факторов риска, компенсация углеводного обмена и поддержание целевых показателей углеводного обмена, компенсация сопутствующих заболеваний, системная антибактериальная, антитромботическая, вазопротекторная терапия в сочетании с адекватным обезболиванием.
К местным принципам лечения относятся: обеспечение полной разгрузки пораженной области с помощью разгрузочного полубашмака, индивидуальной разгрузочной повязки, костыля, сложной ортопедической обуви, кресла-каталки; контроль раневой инфекции, заключающийся в первичной обработке раны и местном лечении раны с правильным выбором повязки в зависимости от фазы течения раневого процесса; хирургическое лечение гнойно-некротического очага стопы с закрытием ран и/или формированием культи пораженной стопы при помощи реконструктивных и пластических операций; восстановление магистрального артериального кровотока в сосудах нижних конечностей.
Перспективным является применение L-лизина эсцината в комплексном лечении язвенных и гнойно-некротических поражений при СДС. Эффективность препарата объясняется его противоотечным действием, связанным со снижением проницаемости сосудистой стенки и улучшением венозного оттока. L-лизина эсцинат обладает стабилизирующим действием на мембраны клеток, снижает активность лизосомальных ферментов, принимающих непосредственное участие в воспалительном процессе. Кроме того, препарат блокирует эффекты фосфолипазы А2, которая является ключевым веществом в развитии воспалительной реакции, связанной с повреждением мембран клеток различными факторами при ишемии, инфекции и травме. Стабилизация фосфолипазы А2 способствует снижению активности простагландинов, что также приводит к уменьшению воспалительного ответа. Доказано также влияние L-лизина эсцината на такие медиаторы воспаления, как гистамин, серотонин, которые выделяются из тромбоцитов, тучных клеток и создают основу для классической воспалительной реакции. Комплексный эффект препарата L-лизина эсцината апробирован в нейрохирургической, неврологической, травматологической практике, ангиологии и флебологии [26–31].
Мы регулярно применяем L-лизина эсцинат по 10 мл в разведении на 50 мл физиологического (0,9%) раствора внутривенно капельно в течение 10 дней у пациентов с нейропатической формой СДС в послеоперационном периоде, с трофическими язвами на фоне нейропатических отеков и у больных с язвами на фоне венозной недостаточности (СЕАР 2-3). Отмечаем благоприятное течение послеоперационного периода, более раннее уменьшение отеков, снижение болевого синдрома, нейропатических болей, заживление язв. Рекомендуем применение L-лизина эсцината для лечения язвенных и гнойно-некротических поражений при СДС в амбулаторной и стационарной практике.
Заключение
СД является серьезным заболеванием, способным привести к тяжелым социально-экономическим и демографическим последствиям. Вопрос о влиянии СДС на качество жизни остается малоизученным. Неизвестны долговременные затраты, связанные с лечением рецидивов язв, проведением повторных ампутаций и увеличением расходов на социальное обслуживание. Кроме того, неучтенными остаются непрямые затраты вследствие утраты человеком из-за болезни профессиональных и социальных функций, что наносит обществу материальный и духовный ущерб.
Опыт других стран, например США, показал, что мультидисциплинарный подход, ранняя диагностика и обучение больных позволяют снизить количество язв стопы и ампутаций на 49–85% и существенно уменьшить расходы государства. Использование программ по профилактике осложнений и обучению больных СД приводит к уменьшению количества ампутаций почти в 2 раза, а экономический эффект от внедрения программ обучения составил 10 млн долл. [2, 5, 9, 11, 13, 21].
Учитывая вышеизложенное, 20 апреля 2015 г. в Кремле Президент РФ Владимир Путин подписал Закон о ратификации соглашения о сотрудничестве стран СНГ в борьбе с ростом заболеваемости сахарным диабетом [18], что в сочетании с грамотным ведением пациентов с СДС может улучшить прогноз как для этих пациентов, так и для больных СД в целом.
Источник
Синдром диабетической стопы: патогенез и принципы дифференциальной диагностики
Синдром диабетической стопы (СДС) – это инфекция, язва или деструкция глубоких тканей, связанная с нарушением нервной системы и/или снижением магистрального кровотока в артериях нижних конечностей различной степени тяжести. Язвенные дефекты являются наиболее частым проявлением СДС и их вероятность возникновения у пациентов с СД в течение жизни достигает 25%. Риск ампутации нижней конечности при наличии язвы существует в 12-24% случаев.
В зависимости от преобладания того или иного патогенетического фактора выделяют следующие формы СДС: нейропатическую (около 60-70 % случаев), нейроишемическую (20-30% пациентов) и ишемическую (в 5-10% случаев).
Патогенез развития СДС
Говоря о причинах и механизмах развития язв при СДС, необходимо особо подчеркнуть, что основное значение имеют не заболевания артерий нижних конечностей, а диабетическая нейропатия (рис.1). Гипергликемия и относительный или абсолютный недостаток инсулина запускают каскад патологических процессов, приводящих к дегенерации периферических нервов. Сенсорная дистальная нейропатия приводит к постепенной утрате основных видов чувствительности, лишая пациента возможности адекватно оценивать опасность повреждающего фактора (инородного предмета, высокой температуры, тесной обуви и др.), что часто приводит к незамеченным травмам, ожогам, потертостям. Моторная дистальная нейропатия способствует атрофии межкостных мышц, нарушению баланса между флексорами и экстензорами. В результате появляется характерная деформация стопы и пальцев, с формированием «патологических» участков избыточного давления – зон, где в норме повышенного давления при ходьбе не должно быть (верхушки пальцев, тыльная поверхность межфаланговых суставов, проекции головок плюсневых костей на подошвенной поверхности). Ограниченная подвижность суставов, обусловленная гликозилированием околосуставных тканей (сухожилий, капсулы сустава, кожи), также приводит к деформации стопы с изменением ее биомеханики и повышению локального избыточного давления на подошвенной поверхности. В ответ на постоянное избыточное давление образуются гиперкератозы (мозоли), которые сами по себе являются «инородными телами» для нижележащих слоев кожи и могут приводить к образованию гематом, аутолизу и инфицированию. Нарушение автономной (вегетативной) иннервации ведет к уменьшению потоотделения и, как следствие, к сухости кожи, появлению трещин, которые легко инфицируются и превращаются в язвенные дефекты.
Рисунок 1. Патогенез развития СДС

Атеросклероз периферических артерий (макроангиопатия) диагностируется примерно у половины пациентов с СДС. Однако макроангиопатия не является непосредственной причиной образования язв, но достоверно известно, что кожные покровы у пациента с нарушениями кровотока на нижних конечностях более восприимчивы к повышенному биомеханическому стрессу, при этом замедляется заживление, повышается риск инфицирования язвенных дефектов. Утолщение базальной мембраны капилляров (микроангиопатия) не ведет к критическому стенозу этих сосудов, однако любое экстравазальное воздействие (постравматический отек и/или инфекционное поражение в области язвы) может привести к окклюзии пораженных капилляров и гангрене пальцев.
Инфекция редко является причиной образования язвы. Однако после того как язва инфицируется, риск ампутации значительно возрастает, особенно при наличии ишемической и нейроишемической форм СДС.
В недавних исследованиях отмечена роль психосоциальных факторов в развитии СДС. Качество ухода за ногами у людей с СД может зависеть от их представлений о состоянии собственного здоровья, рисках СДС и их убеждений в эффективности профилактики СДС путем самообслуживания.
Методы дифференциальной диагностики различных форм СДС
Основными задачи диагностических мероприятий являются определение причины возникновения язвы, клинической формы СДС, оценка выраженности нарушений кровообращения, глубины поражения тканей стопы и выявление инфекции. В ходе дифференциальной диагностики необходимо помнить, что язвы на стопах могут возникать при васкулитах, хронической венозной недостаточности, тромбофлебите, плоскоклеточном раке кожи и раке кости.
Во-первых, при обращении пациента с СД и язвенным дефектом стопы, необходимо тщательно собрать жалобы и анамнез. В большинстве случаев образование язвы при СДС происходит под действием внешних факторов. Если у пациента нейропатическая форма СДС раневой дефект из-за отсутствия чувствительности длительно остается незамеченным, иногда могут беспокоить боли в ногах в ночное время, ноющего, жгучего характера, парестезии, судороги в икроножных мышцах, чувство онемения, однако перечисленные жалобы, как правило, при ходьбе уменьшаются или полностью купируются. При нейроишемической – боли в области травмы также могут отсутствовать, но появляться в икроножных мышцах во время ходьбы и иметь различную интенсивность. В случае, когда у пациента выраженная боль в конечностях в положении лежа с некоторым уменьшением ее интенсивности при спускании ног можно предположить наличие ишемической формы СДС. В ходе сбора анамнеза необходимо обратить внимание на длительность СД, вид сахароснижающей терапии и ее эффективность, наличие язв стопы и ампутаций ранее, других поздних осложнений СД, что имеет важное значение при выборе тактики лечения СДС и отчасти определяет прогноз заболевания. Большое значение имеет уровень информированности пациента о своем заболевании, принципах лечения СД, уходе за ногами.
Второй этап включает в себя осмотр обеих конечностей пациента, оценку состояния язвы, неврологического статуса и кровообращения на нижних конечностях (табл.1).
Таблица 1. Дифференциальная диагностика форм СДС в ходе осмотра нижних конечностей
При осмотре | Форма СДС | |
| Нейропатическая | Нейроишемическая и ишемическая | |
Внешний вид язвы | ||
| Кожа | Сухая, с участками гиперкератоза в зонах избыточного давления, теплая, розовая | Бледная или цианотичная, тонкая, прохладная |
| Деформации | Выраженные специфичные | Может существовать, но не носит специфичный характер |
| Пульсация | Сохранена с обеих сторон | Снижена или отсутствует |
| Расположение язв | В областях избыточного давления | Акральные некрозы (апикальная поверхность пальцев, пяточная область) |
Описание состояния язвы стопы — неотъемлемая часть комплексной оценки случая СДС. Протокол описания язвы исходно включает в себя пункты: время, прошедшее с момента образования язвы, локализация, размер, глубина язвы, состояние краев, стенок и дна раны, наличие и вид некротических тканей, количество и качество экссудата, болезненность, отек и гиперемия периульцинарных тканей. Классическими системными признаками инфекции в ране являются: лихорадка (может отсутствовать), лейкоцитоз, угнетение функции ЦНС, нарастание почечной недостаточности, декомпенсация углеводного обмена, кетоацидоз. Местными признаками – гнойное отделяемое, боль, отек, гиперемия, гипертермия, запах.
Инструментальная диагностика диабетической нейропатии необходима для определения формы СДС и степени риска возникновения рецидивов язв на стопах в будущем и проводится путем оценки основных видов чувствительности: вибрационной с помощью градуированного камертона 128 Гц по Рюдель-Сейферу или биотезиометра, температурной с использованием инструмента «тип-терм», тактильной монофиламентом и болевой неврологической иглой, в дополнение проводится исследование сухожильных рефлексов. Для первоначальной оценки состояния кровообращения на нижних конечностях следует провести классическую пальпацию периферических артерий (тыла стопы, задней большеберцовой, подколенной) или воспользоваться мини-допплером, а в дальнейшем всем пациентам с язвами стоп проводят ультразвуковое дуплексное сканирование (УЗДС). УЗДС позволяет визулизировать артерии в режиме реального времени, определить состояние стенки сосуда и периваскулярных тканей, выявить внутрипросветные образования, оценить степень, протяженность и локализацию стенозирующих просвет поражений. Сопутствующим УЗДС исследованием является определение лодыжечно — плечевого индекса (ЛПИ). Значения ЛПИ ниже 0,6 свидетельствуют о критической ишемии конечности, однако необходимо помнить, что в связи с наличием у многих больных СД медиакальциноза Менкеберга, артерии дистальных отделов русла имеют ригидную стенку, вследствие этого артериальное давление завышается, что приводит к ложно высоким показателям ЛПИ. При наличии язвы, заживление которой напрямую зависит от восстановления кровообращения в нижней конечности, проводят мультиспиральную компьютерную томография (МКСТ) артерий с контрастированием. Магнитно — резонансная томография (МРТ) также может применяться в диагностике поражений артерий нижних конечностей и имеет ряд преимуществ: присутствие кальция в стенках сосудов не влияет на качество изображения, в ходе процедуры не происходит рентгеновского облучения, не требуется йодсодержащего контраста, что наиболее актуально у пациентов с хронической почечной недостаточностью. МСКТ и МРТ позволяют решить вопрос о типе и объеме последующей реконструктивной сосудистой операций. Определение транскутанного напряжения кислорода (tcpO2) на пораженной конечности в отличие от визуализирующих методов, оценивающих патологию анатомии артериального русла, позволяет оценить его функциональную способность и резервные возможности, при этом уровень tcpO2 ниже 30 мм рт. ст. свидетельствует о критической ишемии.
Рутинным методом оценки состояния костных структур нижних конечностей до сегодняшнего дня остается рентгенография, которая позволяет выявить остеомиелит. К сожалению, рентгенография не всегда информативна, особенно при одновременном возникновении язвы и перелома стопы. В связи с этим используется МРТ, которая имеет уникальную способность визуализировать мягкую ткань, таким образом, позволяет диагностировать перелом уже на этапе образования отека костного мозга, внутрикостные кисты и микропереломы, а также проводить дифференциальную диагностику между остеомиелитом и диабетической остеартропатией. МСКТ в отличие от МРТ не показывает состояние костного мозга, но белее четко, чем рентгенография, выявляет переломы на этапе реакции надкостницы, а трехмерная реконструкция КТ-изображений позволяет наблюдать за процессом заживления и точно определить степень смещения костей друг относительно друга.
Бактериологическое исследование биоптата тканей язвы или визуализирующейся кости с анализом чувствительности микроорганизмов к антибактериальной терапии (АБТ) имеет первостепенное значение при решении вопроса о необходимости и виде АБТ. При оценке микробной контаминации критическим уровнем, требующим начала АБТ, принято считать значение ≥105 микробных тел на 1 грамм ткани.
Качественная диагностика формы СДС, проведенная в максимально короткие сроки, обеспечивает преемственность на всех этапах оказания медицинской помощи, снижает риск гнойно-некротических осложнений в ходе ведения пациента и снижает риск ампутаций, в том числе необоснованных.
Список литературы:
- International Consensus on the Diabetic Foot and Practical Guidelines on the Management and the Prevention of the Diabetic Foot// International Working Group on the Diabetic Foot, 2007, iwgdf.org;
- Удовиченко О.В., Грекова Н.М. Диабетическая стопа. – М.: Практическая медицина, 2010. – 272 с.;
- Токмакова А. Ю. Современная концепция диагностики и лечения хронических ран у больных с синдромом диабетической стопы // Сахарный диабет. 2009. №1. С.14-17;
- Анциферов М.Б., Комелягина Е.Ю. Синдром диабетической стопы. Диагностика, лечение и профилактика. – М.: Медицинское информационное агентство, 2013. – 304 с.
Источник:
Максимова Н.В. Синдром диабетической стопы: патогенез и принципы дифференциальной диагностики.// IDOCTOR, 2014, №5, с.58-62.
Источник
