Синдром диабетической стопы качество жизни

Diabetic ulcers of the foot are a menacing complication of diabetes mellitus commonly leading to amputations. To reduce the governmental expenses connected with the management of the diabetes foot, rehabilitation and social aid to them, it is necessary to implement special programmes to prevent the development of foot ulcers in patients with diabetes mellitus.
И.В. Гурьева – к.м.н., доцент кафедры эндокринологии и диабетологии Российской Медицинской Академии последипломного образования МЗ РФ
I.V. Gourieva, cand. of Med. Sci., assogiate professor, Dept. of Endocrinology and Diabetology, Russian Medical Academy for Advanced Medical Studies, Ministry of Health of the Russian Federation
Последнее десятилетие XХ века ознаменовано бурным развитием диабетологии. Для России особенно значимым является внедрение системы обучения управлению хроническим заболеванием, неразрывно связанной с ранней диагностикой и превентивным лечением осложнений сахарного диабета (СД).
Наряду с диабетическим поражением глаз и почек важное значение имеет проблема диабетической стопы. Общепризнано, что при диабете отсутствует “окклюзивное заболевание мелких сосудов”, кроме того, отрицается ведущая роль микроангиопатии в провоцировании развития диабетических язв стопы [1]. Ключевыми факторами, приводящими к поражению стоп при СД, являются периферическая нейропатия и атеросклеротическое поражение магистральных артерий нижних конечностей.
Стопа является основным участком человеческого тела, осуществляющим функцию опоры и участвующим в локомоторном акте, поэтому при сочетании патологии нервов и сосудов, вызванных СД, стопа особенно подвержена различным поражениям.
Более 50% поражений стоп провоцирует травма обувью. Это еще раз подтверждает важность внедрения превентивных программ обучения и использования специальной ортопедической обуви и вкладных элементов для профилактики поражений стоп и их рецидивов.
Механический фактор играет важную роль в этиологии большинства диабетических язв стопы (см. рисунок). Механизм повреждения типичен: деформация стопы (так называемые молоткообразные пальцы и выступание головок метатарзальных костей) в сочетании с сенсомоторной нейропатией приводит к повторяющемуся повышению плантарного давления и возникновению так называемого разделяющего механического воздействия (“shear stress”) в определенных точках стопы при ходьбе. Это давление вызывает поражение тканей, которое может начаться с предъязвы (геморрагия в области гиперкератоза, мозоль, незначительные повреждения кожи). При продолжении воздействия травматического фактора и отсутствии защитной чувствительности может развиться язва, проникающая на всю глубину кожи и легко инфицирующаяся.
Сопутствующее поражение магистральных сосудов нижних конечностей, проявляясь различной степенью ишемии тканей стопы, способствует прогрессирующему микротромбозу мягких тканей в местах сдавления обувью (акральных зонах стопы) или области язвы, быстрому инфицированию и развитию парциальной или тотальной гангрены стопы ( классификация Wagner).
Классификация диабетических язв стоп по Wagner
Стадия 0 Кожные покровы интактны, могут быть костные деформации
Степень 1 Поверхностная язва
Степень 2 Глубокая язва, проникающая в сухожилия, кость или сустав
Степень 3 Остеомиелит или глубокий абсцесс
Степень 4 Локализованная гангрена
Стадия 5 Распространенная гангрена, требующая большой ампутации
Эпидемиология и социально-экономические аспекты
К сожалению, частота диабетических поражений стоп растет и это связано со следующими причинами:
* рост заболеваемости СД;
* увеличение длительности течения СД в результате увеличения продолжительности жизни больных;
* общее старение населения;
* табакокурение;
* сочетание факторов риска, таких как гипертензия, гиперхолестеринемия, ожирение.
Несмотря на определенные успехи в профилактике и лечении диабетической стопы, по-прежнему 40-60% всех ампутаций нижних конечностей производятся у больных СД. В некоторых регионах частота ампутации достигает 70-70%. В 70% случаев ампутации предшествует язва стопы, [1].
Частота ампутаций у больных диабетом увеличивается с возрастом и в целом выше у мужчин, чем у женщин [2].
В большинстве исследований сообщается о значительном различии в частоте ампутаций нижних конечностей, составляющей от 7 до 206 на 100 000 населения в год [1]. Наиболее высок этот показатель в индейских резервациях США, наиболее низок в Дании и Великобритании.
Значительные колебания данных объясняются отсутствием адекватно проводимых эпидемиологических исследований на популяционной основе как в развитых, так и в развивающихся странах. Различия в частоте ампутаций могут быть обусловлены особенностями планирования исследования, демографическими факторами, различиями систем регистрации, неодинакововой распространенностью СД. Диагноз СД впервые ставится во время хирургического вмешательства у 15-19% больных, подвергающихся ампутации. Кроме того, у больных СД чаще производятся ампутации ниже уровня голеностопного сустава, чем у остальных пациентов, и это остается неучтенным [2].
Принимая во внимание вышеназванные факторы, полагают, что наиболее вероятная частота ампутаций при СД составляет 5-24 на 100 000 населения в год или 6-8 на 1000 больных в год, а в эпидемиологически неблагоприятных регионах может достигать 24 на 1000 больных в год [2].
Расходы, связанные с язвами и нетравматическими ампутациями нижних конечностей
Исследование | Страна | Стоимость, $ |
| Первичное заживление | ||
| Boulter и соавт., 1988 | Нидерланды | 10 000 |
| Apelgvist и соавт., 1994 | Швеция | 7 000 |
| Заживление с ампутацией | ||
| Connor, 1987 | Великобритания * | 14 000 |
| Boulter и соавт., 1988 | Нидерланды * | 15 000 |
| Bild и соавт., 1989 | США* | 8 000 — 12 000 |
| Reiber 1992 | США** | 20 000 — 25 000 |
| Apelgvist и соавт., 1994 | Швеция*** | 43 000**** — 65 000***** |
| Solomon и соавт., 1994 | Новая Зеландия* | 11 000 |
| Van Houtum и соавт., (1995) | Нидерланды* | 14 500 |
| Долговременная стоимость: 3 летний период | ||
| Apelgvist и соавт., 1995: | Швеция*** | |
| первичное заживление | 16 100****** — 26 700******* | |
| заживление с ампутацией | 43 100**** — 63 100***** | |
| * Стоимость госпитального лечения** Включена стоимость реабилитации*** Общая прямая стоимость до заживления**** Малая ампутация***** Большая ампутация****** Без ишемии******* С ишемией | ||
В ряде аналитических и экспериментальных исследований проведена идентификация факторов риска ампутаций.
Наиболее важным фактором риска ампутаций независимо от наличия СД признано поражение артерий нижних конечностей. Наиболее прогностически важным показателем заживления при этом являются параметры перфузии кожи [3,4]. Тем не менее очевидно, что адекватная кожная перфузия зависит не только от уровня артериального кровотока.
На кожную оксигенацию влияют также свойства кожи, повторяющееся механическое давление и тканевой отек, в том числе связанный с инфекцией и нейропатией [5].
В связи с вышесказанным наибольшую прогностическую ценность для заживления имеет показатель тканевой перфузии ТсрО2, измеряемый в коже на уровне тыла стопы.
При значениях ТсрО2 менее 20 мм рт.ст. относительный риск ампутации составил 161, тогда как при ТсрО2 от 20 до 30 мм рт.ст. – 7,5 [6] (относительный риск считается положительным, если он превышает 1,0). ТсрО2 более 40 мм рт.ст. в целом считается благоприятным для заживления послеоперационной раны или язвы. Факторами риска ампутаций также являются нейропатия, нарушенный гликемический контроль, предшествующие язвы и ампутации, наличие ретинопатии [6,7].
Пациенты, подвергшиеся ампутации конечности, составляют группу риска как в отношении потери второй (контралатеральной) конечности, так и в отношении смертности после ампутации. Данный феномен связан с системным поражением организма в результате поздних осложнений СД, трудностями реабилитации и протезирования больных и, несомненно, мощным стрессовым воздействием самой ампутации.
Эпидемиологические исследования показали, что примерно 6-30% больных СД после первой ампутации подвергаются ампутации второй конечности в течение 1-3 лет. Частота контралатеральной ампутации увеличивается с 12% через 1 год до 28-51% через 5 лет после первой ампутации.
Показатели смертности в течение 1 года после ампутации составляют 11-41%, в течение 3 лет — 20-50%, а в течение 5 лет — 39-68% [8,9,10]. Чаще всего смертельный исход после ампутаций обусловлен сопутствующими кардиальными или почечными осложнениями [7].
Более чем в 70% случаев у больных СД ампутации нижних конечностей предшествует язва стопы. В целом диабетические язвы стоп развиваются у 15% больных в течение жизни и наблюдаются у 6-20% госпитализированных больных [11 – 13].
Наибольшая частота язв стоп отмечена в возрасте 45-64 лет. Продолжительность пребывания у больных с диабетическими язвами в стационаре превышает таковую больных диабетом без язв на 59% [12].
Распространенность диабетических язв стоп в развитых странах среди больных СД составляет примерно 4-10%, а заболеваемость — 2,2-5,9% [1].
В популяционном исследовании с участием больных СД в возрасте 15-50 лет (Швеция) распространенность диабетических язв стоп среди больных инсулинзависимым, инсулиннезависимым СД и не страдающих этим заболеванием составила соответственно10, 9 и 0% [14]. В Великобритании диабетические язвы зарегистрированы у 5,3-7,4% больных [15].
В проспективном исследовании, проведенном в Сиэттле, распространенность различных поражений стоп составила 28%, ежегодная заболеваемость диабетическими язвами – 5,6% и распространенность ампутаций нижних конечностей – 7% [16].
Значительное количество язв не учитывается; так в Швеции врачам неизвестно о существовании 47% диабетических язв (из устного сообщения Y.Apelqust).
С развитием диабетических язв стоп ассоциируются патофизиологические, поведенческие и связанные с недостатком обучения факторы риска.
Факторы риска диабетических язв стоп [1]:
* нейропатия;
* поражение периферических сосудов;
* деформация стоп;
* предшествующие язвы;
* ограничение подвижности суставов;
* мужской пол;
* большая длительность диабета;
* курение;
* высокий уровень HbA1c;
* этнические особенности;
* недостаток обучения;
* низкий социально-экономический статус;
* нарушение остроты зрения;
* неадекватная обувь;
* пожилой возраст;
* нефропатия.
Основным фактором риска диабетических язв стоп признана нейропатия, которая проявляется, как правило, комбинированным поражением сенсорных, моторных и автономных нервных волокон, хотя выраженность каждого компонента может варьировать.
Признаки нейропатии наблюдаются у 25% больных СД с длительностью заболевания 10 лет и у 50% больных после 20 лет заболевания [17].
Отсутствие защитных чувствительных функций, прежде всего болевой, а также тактильной и температурной чувствительности, проприоцепции сочетается с высоким риском образования язв стоп. Риск возникновения язв значительно увеличивается при сочетании нейропатии и деформаций стоп.
Среди всех диабетических язв стопы преобладают нейропатические (с выраженной нейропатией) и нейроишемические (нейропатия в той или иной степени присутствует в сочетании с ишемией).
Прогноз заживления относительно благоприятен при нейропатических язвах и составляет 70% по сводным данным IDF Bulletin(1993г.) и колеблется от 50 до 70% в случае разрешения нейроишемических поражений, требующих по показаниям проведения сосудистых хирургических вмешательств (шунтирования или ангиопластики).
Тем не менее эти показатели достаточно высоки и заживление зависит от распространенности инфекции, тяжести ишемии, своевременности и квалификации междисциплинарной помощи. По данным специализированных центров, даже в срочных случаях, сопровождающихся распространенной инфекцией или выраженной ишемией, можно достигнуть 70% уровня заживления язв. В случаях же развившегося сепсиса при срочной госпитализации удается добиться заживления 86% поражений [19].
Наряду с социальной значимостью проблемы диабетической стопы общепризнан высочайший экономический ущерб.
Большинство диабетических язв стоп лечится амбулаторно и средние сроки заживления составляют 6-14 нед. Осложненные случаи требуют госпитализации продолжительностью от 30-40 дней до 2 мес в случаях лечения с последующей ампутацией (2). Согласно данным, полученным в Великобритании (1988-1989гг.), на долю больных СД с заболеваниями периферических сосудов и нейропатией пришлось 20,8% всех “диабетических” койко-дней [20].
Особенно высоки затраты бюджета в случае проведения ампутаций, по сводным данным они составляют от 10 000 до 60 000 долларов США [1] (см. таблицу).
Неизвестны долговременные затраты, связанные с лечением рецидивов язв, проведением повторных ампутаций и увеличением расходов на социальное обслуживание. 77% больных, подвергшихся ампутации в возрасте старше 75 лет, не способны вернуться домой или вести обычный образ жизни [1], что приводит к дополнительным расходом на социальное обслуживание наряду с увеличением срока госпитализации и расходов на реабилитацию.
В проспективном исследовании подтвержден высокий уровень рецидивов диабетических язв, который через 1, 3 и 5 лет составил соответственно 44, 61 и 70% [21]. При проведении рандомизированного исследования среди населения Швеции установлено повышение уровня смертности в 2 раза в группе больных с первичным заживлением язв и в 4 раза в группе больных, подвергшихся ампутации [1]. Высокая смертность больных с диабетическими язвами стоп связана с сопутствующим и распространенным мультифокальным атеросклерозом, проявляющимся церебрососудистой и сердечно-сосудистой патологией, а также нефропатией.
Кроме того, неучтенными остаются непрямые затраты вследствие потери человеком из-за болезни профессиональных и социальных функций, что наносит обществу материальный и духовный ущерб.
Для СД непрямые затраты высоки и могут составлять около 50% прямых расходов на его лечение [22].
Итак, не вызывает сомнения высочайшая социальная и экономическая значимость проблемы диабетической стопы. Именно поэтому она привлекает большое внимание различных государственных и общественных служб как в нашей стране, так и за рубежом, тем более что в ряде стран уже доказана на практике возможность предотвращения 50% ампутаций. В многочисленных исследованиях показано, что междисциплинарный подход, ранняя диагностика и обучение больных позволяют снизить количество язв стопы и ампутаций на 49-85% [1], и тем самым существенно уменьшить расходы государства.
Группа международных экспертов по диабетической стопе, собравшихся в 1998 г., в целях экономии бюджета предложила следующее.
* Оценить распространенность проблем диабета в регионах и фокусировать внимание на предотвращении ампутаций в регионах с их высоким уровнем.
* Поддерживать инфраструктуры, осуществляющие реализацию программы “Диабетическая стопа”, предполагающей идентификацию и концентрацию больных группы высокого риска и обеспечение их защитной обувью и стельками для предотвращения язвы стопы.
* Координировать действия специалистов различных дисциплин, оказывающих помощь больным СД, осуществляющих вторичную и третичную профилактику. При организации такой мультипрофессиональной помощи могут возникать финансовые и профессиональные проблемы.
* Внедрять результаты научных исследований в диабетические программы.
* Воодушевлять больных и специалистов по диабету совместно устанавливать реальные цели лечения достижение хорошего метаболического контроля, предотвращение осложнений и повышение качества жизни. Для этого необходимо обучение больных навыкам самопомощи и принципам модификации образа жизни.
В заключение следует подчеркнуть, что повышение уровня знаний врачей и больных, а также целенаправленные действия политиков позволят улучшить качество помощи больным СД, более эффективно использовать ресурсы в целях достижения по крайней мере 50% снижения частоты ампутаций среди больных СД.
Литература:
1. International Consensus and Guidelines on the Diabetic Foot, December 15, 1997.
2. Reiber G.E. The Epidemiology of the Diabetic Foot Problems. Diabetic Medicine Supple 1 1996;13 (1):6-11.
3. Cina C. Katsamouris A., Megerman I, Brewster DC., Utility of transcutaneons oxygen tension measurements in peripheral arterial occlusive disease. J Vasc Surg1984;1:362-71.
4. Oishi CS., Fronen A., Colbrauson FL. The role of noninvasive vascular studies in determining levels of amputation. J Bone Joint Surg 1988;70-A;1520-30.
5. Pecoraro RE. The healing diabetic ulcera major cause for limb loss. In: Barbul A. Caldwell M.D., Eaglstein W.H.eds. Clinical and Epidermal Repair: Normal and Chronic Wounds New York: Wiley-Liss, Inc.,1991;27-43.
6. Reiber GE., Pecoraro RE., Koepsell TD. Risk factors for amputation in patients with diabetes mellitus: a case-control study. Ann Int Med 1992;117:97-105.
7. Leb IS., Les M., Lee VS. et al. Lower extremity amputation. Incidence, risk factors and mortality in the Oklahoma Indian Diabetes Study. Diabetes 1993;42:876-82.
8. Ebskov B., Josephson P. Incidence of reamputation and death after gangrene of the lower extremity. Prosthetics and Orthotics International 1980;4:77-80.
9. Bradley R.M., Fulford Y.C. Atrial of conservative amputation for lesions of the foot in diabetes mellitus. Br J Surs 1965;52:38-43.
10. Sibbert S. Amputation of the lower extremity in diabetes mellitus. Diabetes 1952;1:297-9.
11. Palumbo PY., Melton LY. Peripheral vascular disease and diabetes. In: Harris M.I. Hamman R.F. eds: Diabetes in America. NIH Pub. No 85-1468, Washington, 1985: XV 1-21.
12. Preston SD., Reiber GE., Koepsell TD. Lower extremity amputation and inpatient mortality in Hospitalized persons with diabetes: national population risk factors and associations. University of Washington Thesis, 1993.
13. Bouter KP., Storm AY., de Groot RRM, et al. The diabetic foot in Dutch hospitals: epidemiological figures and clinical endcome. Eur J Med 1993; 2:215-18.
14. Borssen B., Bergenheim T., Lithner F. The epidemiology of foot lesions in diabetic patients aged 15-50 years Diabetic Med 1991;7:438-44.
15. Boulton AYM. et al. High prevalence of risk factors for ulceration in type 2 diabetic patients: a population based study. Diabetologia 1992;35 (S):AL S8.
16. Reiber GE. Who is at risk of limb loss and what to do about it? Journal of Rehabilitation Research and Development 1994;31:357-62.
17. Sims DS., Cavanagh PR., Ulbrecht Y.S. Risk Factors in the Diabetic Foot Recognition and Management. The J Amer Physical Therapy Assn 1988;68:(12) 1887-1901.
18. Mayes,W. An all too common complication. IDF Bulletin 1993;38 (1):4.
19. Edmonds M, Foster A. Management. IDF Bulletin 1993;38 (1):14-17.
20. Laining W., Williams DRR. Diabetes: A model for health Care Management. № 92 London, 1989.
21. Walsh CH. A healed ulcer: what now? Diab. Med Supple 1 1996;13:58-60.
22. Songer T.. The economics of diabetes care. In: Alberti KGMM. De Fronzo RA. Keen H., Zimmet P. (eds) International textbook of Diabetes Mellitus. Wiley, Chichester, 1992;1643-54.
Источник: www.rmj.ru/articles_2202.htm
Источник
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Суздальцев И.В.
1
Печёнкин Е.В.
1
Полапин И.А.
1
1 ГБОУ ВПО «Ставропольский государственный медицинский университет Министерства здравоохранения России»
В основе работы лежит анализ результатов комплексного лечения 224 больных с язвенно-некротическими осложнениями синдрома диабетической стопы. Основную группу из них составили 104 (46,4 %) больных, которые лечились с применением традиционного комплексного лечения и экзогенного монооксида азота, полученного при помощи аппарата «Плазон». В контрольную группу были включены 120(53,6 %) больных, получавших стандартное лечение. В исследование были включены только больные с синдромом диабетической стопы, имеющие поражения 1–4 степени по классификации Wagner F.W. Изучение отдаленных результатов лечения осуществлялось при помощи разработанной анкеты. Разработанный комплекс лечебных мероприятий с применением экзогенного монооксида азота позволил улучшить качество жизни и отдаленные результаты лечения больных с осложнёнными формами синдрома диабетической стопы.
cиндром диабетической стопы
no-терапия
отдалённые результаты лечения.
1. Анциферов М.Б., Комелягина Е.Ю. Синдром диабетической стопы. Диагностика, лечение и профилактика. – М.: Медицинское информационное агентство, 2013. – С 304
2. Дедов И.И., Шестакова М.В., Галстян Г.Р. и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом / Под редакцией Дедова И.И., Шестаковой М.В. (7-й выпуск) // Сахарный диабет. – 2015. – Т. 18. – № 1S. – С 112.
3. Дедов И.И., Шестакова М.В., Викулова О.К. Государственный регистр сахарного диабета в Российской Федерации: статус 2015 г. и перспективы развития // Сахарный диабет. – 2015. – Т 18. – № 3. – С. 5-22.
4. Суздальцев И.В., Полапин И.А. Влияние экзогенного монооксида азота на концентрацию интерлейкина – 6 и интерлейкина – 10 в сыворотке крови при комплексном лечении язвенно-некротических осложнений синдрома диабетической стопы // Медицинский вестник Северного Кавказа. – 2013. – Т. 8. – № 3. – С. 85-86.
5. Суздальцев И.В., Полапин И.А. Клинико-лабораторная оценка применения воздушно-плазменного потока монооксида азота в лечении язвенно-некротических осложнений синдрома диабетической стопы // Фундаментальные исследования. – 2013. – № 5 (часть 2). – С. 409–411.
6. Суздальцев И.В., Полапин И.А. Применение экзогенного монооксида азота в комплексном лечении язвенно-некротических поражений у больных с синдромом диабетической стопы // Медицинский вестник Северного Кавказа. – 2013. – Т. 8. – № 1. – С. 111–116.
7. Удовиченко О.В., Грекова Н.М. Диабетическая стопа. – М.: Практическая медицина, 2010. – С. 272.
8. Шикина И.Б., Печенкин Е.В., Душин Р.В. Лавасепт в комплексном лечении гнойно-некротической формы синдрома диабетической стопы // Consiliummedicum. Хирургия. – 2006. – № 2. – С. 37-39.
9. American Diabetes Association. Standards of medical care in diabetes – 2015. Diabetes Care 2015; 38; Suppl 1:S1-93.
Актуальность. Увеличение числа больных сахарным диабетом влечет за собой увеличение количества больных с инфицированной формой синдрома диабетической стопы (СДС) [1,2,3,9]. Большинство больных с указанной патологией составляют пациенты пожилого и старческого возраста [3,7]. Своевременное лечение трофических язв, гнойно-некротических ран у больных сахарным диабетом позволяет избежать распространения инфекции, приводящей к ампутации конечности [1,4,5,7,8]. Одним из перспективных методов лечения хирургической инфекции при синдроме диабетической стопы является терапия экзогенным монооксидом азота (NO-терапия), полученным плазмо-химическим путем на аппарате «Плазон» [6]. При нереконструируемом поражении дистального артериального русла конечности с наличием трофических нарушений эффективным методом спасения конечности является комплексное хирургическое лечение с применением экзогенного монооксида азота. В результате лечебного воздействия экзогенный монооксид азота улучшает микроциркуляцию, оказывает антибактериальное, антисептическое действие, активизирует антиоксидантную защиту, стимулирует регенерацию тканей [4,5,6].
Цель исследования. Изучить результаты и качество жизни у пациентов с язвенно-некротическими поражениями при синдроме диабетической стопы после проведенного комплексного лечения с применением экзогенного монооксида азота.
Материалы и методы. В основе работы лежит анализ результатов комплексного лечения 224 больных с язвенно-некротическими осложнениями СДС. Женщин было 116 (51,8 %), мужчин – 108 (48,2 %). Анализ анамнестических данных показал, что у 29 больных (12,8 %) продолжительность заболевания была до 5 лет, у 78 больных (34,9 %) – до 10 лет, у 117 больных (52,3 %) – свыше 10 лет.
Все пациенты были разбиты на две группы. Основную группу составили 104 (46,4 %) больных, которые лечились с применением традиционного комплексного лечения в сочетании с применением экзогенного монооксида азота, полученного с помощью аппарата «Плазон».
После первичной обработки ран стопы и некрэктомии использовался для работы Скальпель – Коагулятор – Стимулятор воздушно-плазменный СКСВП/NO–01 «ПЛАЗОН», являющийся новой полифункциональной лечебной технологией на основе использования воздушной плазмы и экзогенного монооксида азота (хирургия+NO-терапия). Аппарат использовался для коагуляции и стерилизации раневых поверхностей, деструкции и испарения нежизнеспособных тканей и патологических образований, рассечения (ограниченно) биологических тканей плазменным потоком с температурой до 4000 °С, а также для стимуляции репаративных процессов при лечении трофических язв газовым потоком с температурой до 40 °С, содержащим монооксид азота. Для получения хирургического эффекта использовалось воздействие на ткани человеческого организма потока воздушной плазмы. Для получения терапевтического эффекта использовалось воздействие на биологические ткани потока газа, образованного путем охлаждения воздушной плазмы и содержащего молекулы монооксида азота. Местно на раневую поверхность проводилась терапия воздушно-плазменным потоком монооксида азота в терапевтическом режиме с применением манипулятора с диаметром выходного канала 2 мм, позволяющим получить низкотемпературные (25–40 0С) газовые потоки с высоким содержанием молекул NO (до 2000–3000 ppm), с экспозицией 30 секунд на 1 см2 с расстояния 5 см ежедневно до 10–15 сеансов. При наличии некротически измененных тканей выполнялось их удаление в режиме коагуляции. Лечение проводили в сочетании с традиционными антисептическими повязками.
Хирургическое лечение проводилось с решением двух задач – устранением гнойно-некротического очага с максимально возможным сохранением местных тканей и адекватного раскрытия раны с созданием условий для выполнения ранних восстановительных операций. Применяли следующие способы закрытия ран: лоскутная кожная пластика, метод натяжения местных тканей. При неэффективности комплексного лечения и отсутствия достаточного кровоснабжения стопы проводилась низкая или высокая ампутация нижней конечности.
В контрольную группу были включены 120 (53,6 %) больных с СДС, получавших традиционное лечение. В исследование были включены только больные с СДС, имеющие поражения 1–4 степени по классификации Wagner F.W.
Количество пациентов от 30 до 60 лет составило в основной группе – 54 (51.9 %), в контрольной группе – 63 (52,6 %)). Больные пожилого и старческого возраста составили в основной группе – 50 (48.1 %), в контрольной группе – 57 (47.4 %).
Как в основной (40,4 %), так и в контрольной группе (43,3 %) большинство больных имели нейроостеоартропатическую форму синдрома диабетической стопы, нейропатическая и нейроишемическая совместно составили 59,6 % в основной и 56,7 % в контрольной группах.
Изучение отдаленных результатов лечения осуществлялось с помощью разработанной нами анкеты в сроки от 6 месяцев до 1 года с момента выписки больного из стационара.
Для оценки отдаленных результатов лечения мы использовали 3-х балльную систему («хорошо», «удовлетворительно», «плохо»). К «хорошим» результатам были отнесены все те случаи, когда пролеченные пациенты чувствовали себя практически здоровыми в момент обследования, не предъявляли жалоб, связанных с последствиями стационарного лечения, наблюдалось полное заживление язвенного дефекта и отсутствие явных проявлений нейроишемии, у лиц трудоспособного возраста – сохранение трудоспособности. К «удовлетворительным» были отнесены результаты тех пациентов, у которых наблюдалось полное заживление язвенного дефекта, но отмечались явные проявления нейроишемии и боли в области послеоперационного рубца, не требующее стационарного лечения, снижение или частичная утрата трудоспособности. Сюда же вошли больные, которые в течение некоторого времени после операции (не более 6 месяцев) испытывали характерные жалобы, а впоследствии их не предъявляли. Результаты лечения считались «плохими» при неполном заживлении язвенно-некротического дефекта, наличии явных признаков нейроишемии, требующих повторного пребывания в стационаре, и утрате трудоспособности.
Невыраженные проявления нейроишемии, периодические декомпенсации показателей сахара крови, появления язвенно-некротических дефектов другой локализации, длительное заживление раны рассматривались как неизбежные осложнения сахарного диабета.
С целью оценки качества жизни использовалась русская версия опросника SF-36. Анализ качества жизни проводился через 6 месяцев после стационарного лечения у 50 пациентов основной группы и 50 пациентов контрольной группы.
Биометрический анализ был проведен с использованием статистических компьютерных программ STATISTICA 6 RU, «Biostat» и MicrosoftOfficeExcel. Средние выборочные значения количественных признаков приведены нами в виде М±m, где М – это среднее выборочное, m – это ошибка среднего выборочного.
Полученные результаты. Отдаленные результаты в основной группе изучены у 96 (92,32 %) пациентов, а в контрольной у 87 (72,5 %). Всего отдаленные результаты проанализированы у 183 (81,7 %) из 224 пациентов основной и контрольной групп.
Хорошие отдалённые результаты получены у 118 (64,48 %) пациентов, удовлетворительные результаты получены у 57 (31,14 %), плохие результаты – у 8 (4,38 %) пациентов. В основной группе статистически достоверно можно проследить доминирование хороших результатов проведенного лечения (72,9 % наблюдений основной группы в сравнении с 55,2 % в группе контроля (p=0,019)). Удовлетворительные результаты преимущественно наблюдались в группе контроля (p=0,041). Статистически достоверные различия в плохих результатах не были получены (Таблица 1).
Таблица 1
Отдаленные результаты лечения пациентов с язвенно-некротическими поражениями при синдроме диабетической стопы
Результат | Основная группа (n=96) | Контрольная группа (n=87) | P* | |||
n | % | n | % | |||
Хороший | 118 | 70 | 72,9% | 48 | 55,2% | 0,019 |
Удовлетворительный | 57 | 23 | 24% | 34 | 39,1% | 0,041 |
Плохой | 8 | 3 | 3,1% | 5 | 5,7% | 0,614 |
Всего | 183 | 96 | 100% | 87 | 100% | |
Примечание: * – по критерию χ2.
По данным анкетирования было выяснено, что плохие отдалённые результаты как в основной, так и в контрольной группах наблюдались из-за плохого амбулаторного наблюдения за раной, несвоевременного обращения к специалистам и у пациентов, которые не выполняли рекомендации лечащего врача, данные при выписке из стационара.
Анкета используемого опросника качества жизни SF-36 включала в себя 8 шкал, самое большое значение каждой из которых составляло 100 баллов, где за 0 принято отсутствие здоровья, а за 100 – полное здоровье. Шкалы были составлены на два показателя – «физический компонент здоровья» и «психологический компонент здоровья» (Таблица 2), (Таблица 3).
Таблица 2
«Физический компонент здоровья» у пролеченных пациентов с
язвенно-некротическими поражениями при синдроме диабетической стопы
Показатели шкал SF-36 | Основная группа (n=50) | Контрольная группа (n=50) | P* |
PF(Физическое функционирование) | 80,37±2,17 | 76,21±2,21 | 0,103 |
RP (Ролевое функционирование) | 51,16±1,83 | 45,66±1,37 | 0,035 |
BP(Интенсивность боли) | 61,03±3,12 | 68,39±2,56 | 0,046 |
GH(Общее состояние здоровья) | 60,04±1,34 | 49,52±2,36 | 0,142 |
Примечание: * – по критерию χ2.
Таблица 3
«Психологические компоненты здоровья» у пролеченных пациентов с язвенно-некротическими поражениями при синдроме диабетической стопы
Показатели шкал SF-36 | Основная группа (n=50) | Контрольная группа (n=50) | P* |
MH (Психическое здоровье) | 60,05±3,28 | 38,86±3,58 | 0,046 |
RE (Ролевое функционирование) | 67,59±3,46 | 51,86±3,58 | 0,024 |
SF (Социальное функционирование) | 75,08±1,78 | 59,19±1,62 | 0,041 |
VT (Жизненная активность) | 60,17±2,76 | 52,34±1,80 | 0,009 |
Примечание: * – по критерию χ2.
По полученным результатам выявлено, что применение NO-терапии приводит к улучшению качества жизни данной категории больных. Уровень качества жизни пациентов основной группы статистически достоверно выше по всем шкалам «психического компонента» и двум шкалам «физического компонента» (ролевое функционирование, обусловленное физическим состоянием и интенсивность боли).
Сравнение и проведенный анализ свидетельствуют о присутствии статистически значимых различий качества жизни в основной и контрольной группах пациентов. В большей степени статистически достоверными являются показатели «психологического компонента». Различия в шкалах «физического компонента» подтверждается для BP (интенсивность боли) и RP (ролевое функционирование, обусловленное физическим состоянием) (рисунок).
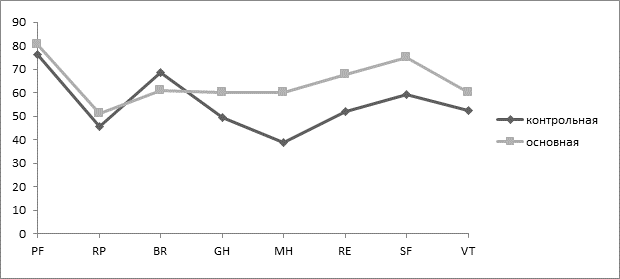
Средние показатели, отражающие качество жизни пациентов основной и контрольной групп по шкалам опросника SF-36
На основании полученных результатов исследований можно говорить о том, что применение экзогенного монооксида азота в комплексном лечении осложнённых форм СДС способствует снижению лейкоцитоза, снижению показателей абсолютной микробной обсемененности язвенно-некротических поражений стоп. Быстрее купируется отек, болевой синдром, уменьшается количество раневого отделяемого, быстрее начинают появляться грануляционные ткани, что ведет к уменьшению площади язвенно-некротического дефекта. Отмечен выраженный антибактериальный, противовоспалительный, иммуномодулирующий и стимулирующий репаративные процессы, эффекты применения экзогенного монооксида азота, что также подтверждается сокращением количества повторных операций в 3,8 раза у больных основной группы. К преимуществам применения экзогенного монооксида азота в комплексном лечении язвенно-некротических поражений СДС можно отнести улучшение отдаленных результатов – увеличение числа хороших результатов с 55,2 % до 72,9 % и снижение количества удовлетворительных в 1,6 раза.
Выводы
1. Применение экзогенного монооксида азота в комплексной терапии оказывает выраженный лечебный эффект и способствует уменьшению количества повторных операций в 3,8 раза по сравнению с традиционными методами у больных с язвенно-некротическими поражениями при синдроме диабетической стопы.
2. Разработанный комплекс лечебных мероприятий с использованием экзогенного монооксида азота позволил улучшить отдаленные результаты лечения больных с синдромом диабетической стопы, осложненной язвенно-некротическими поражениями: увеличить число хороших результатов с 55,2 % до 72,9 % и снизить количество удовлетворительных результатов в 1,6 раза.
3. Введение экзогенного монооксида азота в комплекс лечения язвенно-некротических поражений у больных с синдромом диабетической стопы позволяет улучшить дальнейшее качество их жизни: уровень качества жизни пациентов основной группы статистически достоверно выше по всем шкалам «психического компонента» и двум шкалам «физического компонента» (ролевое функционирование, обусловленное физическим состоянием и интенсивность боли).
Библиографическая ссылка
Суздальцев И.В., Печёнкин Е.В., Полапин И.А. РЕЗУЛЬТАТЫ И КАЧЕСТВО ЖИЗНИ ПАЦИЕНТОВ С ОСЛОЖНЁННЫМИ ФОРМАМИ СИНДРОМА ДИАБЕТИЧЕСКОЙ СТОПЫ ПОСЛЕ ПРОВЕДЁННОГО КОМПЛЕКСНОГО ЛЕЧЕНИЯ С ПРИМЕНЕНИЕМ ЭКЗОГЕННОГО МОНООКСИДА АЗОТА // Современные проблемы науки и образования. – 2016. – № 2.;
URL: https://science-education.ru/ru/article/view?id=24415 (дата обращения: 03.05.2020).

Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
