Синдром диабетической стопы галстян токмакова
 Для цитирования. Кисляков В.А., Оболенский В.Н., Юсупов И.А. Синдром диабетической стопы: комплексный подход к лечению // РМЖ. 2015. No 12. С. 768–770.
Для цитирования. Кисляков В.А., Оболенский В.Н., Юсупов И.А. Синдром диабетической стопы: комплексный подход к лечению // РМЖ. 2015. No 12. С. 768–770.
Распространенность и экономические аспекты
В XXI в. сахарный диабет (СД) стал ведущим неинфекционным заболеванием. Каждые 10 с в мире становится на 2 больных СД больше – это 7 млн в год. По мнению экспертов Всемирной организации здравоохранения, СД занимает 1-е место среди заболеваний, приводящих к инвалидности, и 3-е – по смертности [1–4].
Согласно исследованиям Эндокринологического научного центра (ЭНЦ), в России распространенность СД достигает 10–12 млн человек (7–8% населения страны). Наиболее высокая распространенность СД среди взрослого населения крупных городов. При этом соотношение мужчин и женщин – 1:3. В половине случаев СД 2-го типа выявляется на 5–7-м году от начала заболевания, и у 20–30% выявляются специфические осложнения: катаракта, ретинопатия, нефропатия, нейропатия, синдром диабетической стопы (СДС), ишемическая болезнь сердца, артериальная гипертония и др. [5–8].
СДС приводит к гнойно-некротическим поражениям стоп с последующей потерей нижних конечностей – к самой высокой инвалидизации. Окончательные цифры распространенности СДС в настоящее время неизвестны. Тем не менее установлено, что у 15% больных СД развиваются патологические изменения в стопах или голеностопном суставе [9–13].
В последние годы широко обсуждаются не только клинические, но и экономические, социальные аспекты профилактики и лечения СДС, методы клинико-экономического анализа и, прежде всего, учет всех затрат, связанных с лечением СДС [1, 14].
На 18-м конгрессе Международной федерации диабета (МФД) были представлены, в частности, данные о распространенности язвенных дефектов при СДС в странах Балканского региона – 7,5%. Диагноз СД впервые ставится во время хирургического вмешательства у 15–19% больных, подвергающихся ампутации. Специалисты МФД считают, что вероятная частота ампутаций при СД составляет 5–24 на 100 000 населения в год, или 6–8 на 1000 больных в год, а в эпидемиологически неблагоприятных регионах достигает 24 на 1000 больных в год. В России, согласно данным государственного регистра, эти показатели колеблются от 0,76 до 18,2 и в среднем составляют 6,4 случая на 1000 больных [3, 4, 11, 15].
Расходы на лечение СДС в развитых странах составляют около 12–15% от всех затрат на лечение СД, в развивающихся странах они могут составлять до 40% от общего объема финансовых ресурсов, выделяемых на СД. Подсчитано, что на проведение одной ампутации в зарубежных странах тратится более 10 000 долл. Общие затраты на лечение СДС в среднем составляют 13 179 долл. и меняются в зависимости от степени тяжести по классификации Wagner в пределах от 1892 долл. при I степени до 27 721 долл. при IV–V степени тяжести. Лечение СДС на фоне хронической артериальной недостаточности нижних конечностей обходится в 4,5 раза дороже, чем при сохранном периферическом кровотоке. Ежегодная стоимость лечения язвенных поражений стоп при СДС в США составляет 5 млрд долл. прямых медицинских затрат и 400 млн долл. косвенных медицинских затрат. Кроме того, в США зафиксировали, что 77% людей старше 75 лет после ампутации не способны вернуться в собственный дом и им нужна дополнительная помощь и поддержка социальных групп [8, 16–18].
Анализ работы отделения диабетической стопы ЭНЦ показал, что при своевременно начатой адекватной терапии СДС понижается риск хирургических вмешательств и тяжелых осложнений: у 98% больных с нейропатической инфицированной формой СДС можно избежать хирургического вмешательства; у 60% с нейроишемической формой – проведения ампутаций на уровне голени и бедра; у 25% с критической ишемией – предотвратить высокие ампутации на уровне бедра; на 50% уменьшить частоту образования язв стоп в группе высокого риска [4, 5, 13].
Летальность среди больных СД, перенесших высокую ампутацию конечности по поводу гангрены, в течение последующих 5 лет достигает 68%, в ближайшие 3 нед. – 22%, в течение года – 11–41%, через 3 года – 20–50%, через 5 лет – от 39–68%. Частота ипсилатеральных ампутаций через год после первой ампутации – до 24%, через 2 года – 30%, через 5 лет – 49% и контралатеральных ампутаций через год после первой ампутации – до 12%, через 2 года – 23%, через 5 лет – 28-51%. Рецидивы язв на стопах через 1, 3, 5 лет составили 44, 61, 70% соответственно. Рецидивирующие деструктивные поражения ухудшают проблемы лечения, реабилитации, социальной помощи, увеличивая экономические затраты [19–23].
Если распространенность СД, а соответственно и СДС будет увеличиваться с той же скоростью, что и сейчас, то к 2025 г. экономический ущерб составит от 213 до 396 млрд долл. в год. 75% прироста заболевания придутся на развивающиеся страны. По данным немецких исследователей, общая стоимость лечения больных СД в Германии составляет приблизительно 5 млрд. евро, а средняя стоимость лечения 1 пациента – 5000 евро в год. Ежегодные общие затраты в России на лечение нейроишемической формы СДС составляют 56,2 млн долл., при этом затраты на ампутации достигают 14,4 млн долл. [2, 5, 17].
По оценке главного экономиста Morgan Stanley Эльги Бартш, сочетание двух факторов – СД и ожирения – снизит среднегодовые темпы роста валового внутреннего продукта (ВВП) в странах Организации экономического сотрудничества и развития (ОЭСР) в 2015–2035 гг. с 2,3 до 1,8%, в странах БРИКС (Бразилия, Россия, Индия, Китай, Южно-Африканская Республика) – с 4,5 до 4,2%. Согласно прогнозам ОЭСР, среднегодовые темпы роста ВВП России составят 2,8%. При сохранении нынешнего уровня потребления сахара гражданами страны этот показатель снизится до 2%. Согласно результатам исследования, проведенного фармацевтической компанией «Ново Нордиск», «Инвестиции в лечение сахарного диабета в России», ежегодные прямые затраты, связанные с СД в России, составляют 12,5 млрд долл. США. При этом 42% объема этих средств расходуется на лечение осложнений, которые выявляются у 40–50% людей в момент постановки диагноза. Соответственно диагностика заболевания на ранних стадиях позволит российскому обществу сэкономить более 1,5 млрд долл. США из средств, выделяемых на здравоохранение [13].
Принципы терапии
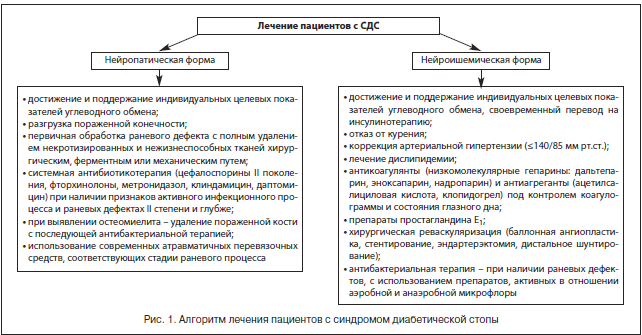
По мнению большинства авторов, в лечении пациентов с синдромом диабетической стопы должны участвовать квалифицированные эндокринолог, гнойный хирург, сосудистый хирург, ортопед, специально обученный средний медицинский персонал, а комплексное лечение должно включать общие и местные методы (рис. 1) [24–26].
Тактика комплексного лечения зависит от формы заболевания [14, 15, 18, 19, 21, 27]. Мы, как и ряд специалистов, выделяем следующие клинические формы СДС.

1. Нейропатическая форма:
– без остеоартропатии;
– с остеоартропатией – «сустав Шарко».
2. Нейроишемическая форма с учетом других характеристик.
К общим принципам терапии пациентов с СДС относятся коррекция факторов риска, компенсация углеводного обмена и поддержание целевых показателей углеводного обмена, компенсация сопутствующих заболеваний, системная антибактериальная, антитромботическая, вазопротекторная терапия в сочетании с адекватным обезболиванием.
К местным принципам лечения относятся: обеспечение полной разгрузки пораженной области с помощью разгрузочного полубашмака, индивидуальной разгрузочной повязки, костыля, сложной ортопедической обуви, кресла-каталки; контроль раневой инфекции, заключающийся в первичной обработке раны и местном лечении раны с правильным выбором повязки в зависимости от фазы течения раневого процесса; хирургическое лечение гнойно-некротического очага стопы с закрытием ран и/или формированием культи пораженной стопы при помощи реконструктивных и пластических операций; восстановление магистрального артериального кровотока в сосудах нижних конечностей.
Перспективным является применение L-лизина эсцината в комплексном лечении язвенных и гнойно-некротических поражений при СДС. Эффективность препарата объясняется его противоотечным действием, связанным со снижением проницаемости сосудистой стенки и улучшением венозного оттока. L-лизина эсцинат обладает стабилизирующим действием на мембраны клеток, снижает активность лизосомальных ферментов, принимающих непосредственное участие в воспалительном процессе. Кроме того, препарат блокирует эффекты фосфолипазы А2, которая является ключевым веществом в развитии воспалительной реакции, связанной с повреждением мембран клеток различными факторами при ишемии, инфекции и травме. Стабилизация фосфолипазы А2 способствует снижению активности простагландинов, что также приводит к уменьшению воспалительного ответа. Доказано также влияние L-лизина эсцината на такие медиаторы воспаления, как гистамин, серотонин, которые выделяются из тромбоцитов, тучных клеток и создают основу для классической воспалительной реакции. Комплексный эффект препарата L-лизина эсцината апробирован в нейрохирургической, неврологической, травматологической практике, ангиологии и флебологии [26–31].
Мы регулярно применяем L-лизина эсцинат по 10 мл в разведении на 50 мл физиологического (0,9%) раствора внутривенно капельно в течение 10 дней у пациентов с нейропатической формой СДС в послеоперационном периоде, с трофическими язвами на фоне нейропатических отеков и у больных с язвами на фоне венозной недостаточности (СЕАР 2-3). Отмечаем благоприятное течение послеоперационного периода, более раннее уменьшение отеков, снижение болевого синдрома, нейропатических болей, заживление язв. Рекомендуем применение L-лизина эсцината для лечения язвенных и гнойно-некротических поражений при СДС в амбулаторной и стационарной практике.
Заключение
СД является серьезным заболеванием, способным привести к тяжелым социально-экономическим и демографическим последствиям. Вопрос о влиянии СДС на качество жизни остается малоизученным. Неизвестны долговременные затраты, связанные с лечением рецидивов язв, проведением повторных ампутаций и увеличением расходов на социальное обслуживание. Кроме того, неучтенными остаются непрямые затраты вследствие утраты человеком из-за болезни профессиональных и социальных функций, что наносит обществу материальный и духовный ущерб.
Опыт других стран, например США, показал, что мультидисциплинарный подход, ранняя диагностика и обучение больных позволяют снизить количество язв стопы и ампутаций на 49–85% и существенно уменьшить расходы государства. Использование программ по профилактике осложнений и обучению больных СД приводит к уменьшению количества ампутаций почти в 2 раза, а экономический эффект от внедрения программ обучения составил 10 млн долл. [2, 5, 9, 11, 13, 21].
Учитывая вышеизложенное, 20 апреля 2015 г. в Кремле Президент РФ Владимир Путин подписал Закон о ратификации соглашения о сотрудничестве стран СНГ в борьбе с ростом заболеваемости сахарным диабетом [18], что в сочетании с грамотным ведением пациентов с СДС может улучшить прогноз как для этих пациентов, так и для больных СД в целом.
Источник
