Синдром дауна и дефект межжелудочковой перегородки
Хорошо известно, что врожденные аномалии сердца встречаются почти у половины детей с синдромом Дауна и оказывают большое влияние на младенческую выживаемость. С середины прошлого столетия проводилось множество исследований по выявлению частоты, специфичности и характера пороков сердца у этих детей. Так, в период 1970–1980-х гг. отмечалось повышение распространенности врожденных аномалий сердечнососудистой системы у пациентов с синдромом Дауна. Связано это было в основном с улучшением диагностики открытого артериального протока и дефекта межпредсердной перегородки (M. J. Khoury, J. D. Erickson, 1992). По данным зарубежных авторов, при синдроме Дауна наиболее часто встречаются дефект межжелудочковой перегородки, дефект межпредсердной перегородки, общий открытый атриовентрикулярный канал, тетрада Фалло и другие пороки, составляющие менее 1 %.
За годы научных наблюдений стало очевидным, что для выявления врожденного порока сердца у новорожденного с синдромом Дауна физическое обследование, включающее осмотр и аускультацию, является обязательным, но недостаточным. Так, McElhinney и др. установили, что информативность физического обследования для выявления сердечных аномалий у детей с синдромом Дауна не превышает 80 %. Оказалось, что 15 из 114 исследуемых детей при осмотре не имели признаков врожденных пороков сердца, но при ультразвуковом исследовании у них были диагностированы сердечные аномалии, а девяти из них в дальнейшем потребовалось оперативное лечение.
Материалы и методы
Нами проведено исследование частоты встречаемости и особенностей клинической картины врожденных пороков сердца и персистирующих фетальных коммуникаций у 522 детей с синдромом Дауна в возрасте от 0 до 8 лет, воспитывающихся в домашних условиях. Дети получали медико-психолого-педагогическую помощь в Центре ранней помощи Благотворительного фонда «Даунсайд Ап», где наблюдались с момента обращения (возраст при первом посещении варьировал от 0 до 7 лет) до 8 лет. При первичном обращении проводился сбор анамнеза, клиническое обследование, анализ медицинской документации. Все дети, даже в случае отсутствия клинически выраженных симптомов порока сердца, направлялись на электрокардиографическое и эхокардиографическое обследования и, при необходимости, на лечение в соответствующие профильные кардиологические стационары и диспансеры.
Результаты
У всех пациентов синдром Дауна был подтвержден хромосомным исследованием. Регулярная трисомия 21-й хромосомы была выявлена у 499 детей (499/522), что составило 90,4 %, транслокационная форма – у 24 (4,3 %), мозаицизм – у 28 (5,1 %), у одного ребенка трисомии 21-й и Х хромосом (кариотип 48,ХХХ,+21) – 0,2 %.
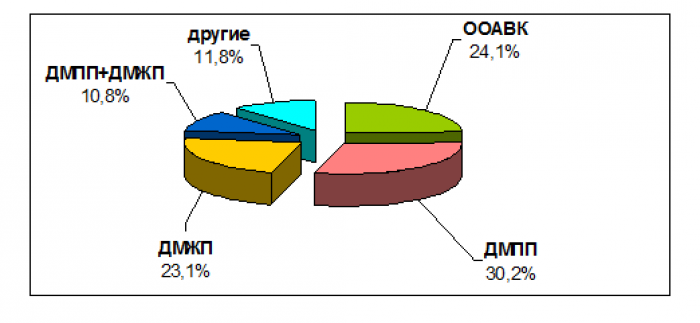
Получены результаты эхокардиографического исследования 428 детей (см. рис.). Врожденные пороки сердца диагностированы у 195 (195/428), что составило 45,6 %. В структуре этих аномалий у детей с синдромом Дауна чаще отмечался дефект межпредсердной перегородки (ДМПП), а именно в 30,2 % (59/195) случаев. Общий атриовентрикулярный канал (ОАВК) составил 24,1 % (47/195), дефект межжелудочковой перегородки (ДМЖП) – 23,1 % (45/195), сочетание дефектов межпредсердной и межжелудочковой перегородок (ДМПП+ДМЖП) – 10,8 %. Другие пороки, такие как тетрада Фалло, стеноз легочной артерии и др., в сумме составили 11,8 % (23/195). Персистенция гемодинамически значимого открытого артериального протока (ОАП), потребовавшего оперативного вмешательства, была выявлена в 2,8 % (12/428).
 Структура сердечных аномалий у детей с синдромом Дауна
Структура сердечных аномалий у детей с синдромом Дауна
Почти все исследуемые нами дети родились доношенными. Срок родов составил 38,2 ± 1,3 недель. Однако при оценке антропометрических данных новорожденных с синдромом Дауна и врожденными пороками сердца оказалось, что их физическое развитие страдает еще внутриутробно. Задержка физического развития (ЗВУР) – масса тела при рождении ниже 10 перцентилей в соответствии со сроком гестации в сравнении с показателями физического развития Г. М. Дементьевой, Е. В. Короткой – отмечалась у 18,7% детей. У всех новорожденных с сердечными аномалиями наблюдалась асимметричная форма ЗВУР (Pounderal Index, PI>25). Вероятно, задержка физического развития формировалась под влиянием, в основном, не генетического фактора.
Известно, что у новорожденных с синдромом Дауна нередко отмечается морфофункциональная незрелость (по нашим данным, она встречается в 17,9 % случаев). У детей с морфофункциональной незрелостью часто недооцениваются размеры дефекта межпредсердной перегородки, который рассматривают как открытое овальное окно даже при гемодинамической его значимости, и артериального протока, в то время как имеет место недостаточность кровообращения. Застойная легочная гипертензия приводит к развитию пневмонии. Возникновение и затяжное течение пневмонии у детей с синдромом Дауна объясняется характерными для них иммунологическими нарушениями.
Хорошо известно, что манифестация сердечной недостаточности у детей раннего возраста, в отличие от детей старшего возраста, может протекать под маской других состояний. Помимо классических симптомов, таких как тахикардия (учащение сердцебиения), тахипноэ (увеличение частоты дыхания), цианоз кожи и слизистых, типичны вялое сосание, снижение темпов физического и психомоторного развития. В подобных случаях у педиатров возникают определенные затруднения в проведении дифференциальной диагностики при наличии у ребенка синдрома Дауна. У таких детей клинические симптомы недостаточности кровообращения могут расцениваться как проявления особенностей психомоторного развития, типичных для синдрома Дауна. Так, если возникают трудности вскармливания: ребенок вялый, неохотно берет грудь или соску, вяло сосет, не может высосать необходимый объем питания, вплоть до полного отказа от кормлений, такие проблемы часто объясняются мышечной гипотонией, общей вялостью, характерной для детей с синдромом Дауна, с последующим назначением общеукрепляющего массажа, что ухудшает состояние ребенка. В дальнейшем отмечается плохая прибавка в весе. Она направляет клиницистов на выявление патологии со стороны желудочно-кишечного тракта, гипогалактии у матери, исследования качества молока, его инфицированности. В борьбе с прогрессирующей гипотрофией младенца нередко переводят на искусственные смеси. Важно отметить, что гипотрофия может стать причиной отсрочки оперативного лечения порока сердца и/или неблагоприятно повлиять на его исход.
Таким образом, слабая нацеленность педиатров на выявление симптомов недостаточности кровообращения у ребенка с синдромом Дауна затрудняет ее своевременную диагностику, а следовательно, и адекватное лечение врожденного порока сердца.
Наглядным примером будет анализ истории болезни.
Андрей Б., от первой, физиологично протекавшей беременности. Роды в срок. Вес мальчика при рождении – 3000 г., рост – 51см, оценка по шкале АПГАР 88б. Состояние ребенка после рождения удовлетворительное. Отмечались признаки морфофункциональной незрелости, фенотипические признаки синдрома Дауна. С целью подтверждения хромосомной патологии была взята кровь для определения кариотипа. Выявлена регулярная трисомия 21-й хромосомы. С первых суток жизни отмечался систолический шум при аускультации грудной клетки. Для исключения аномалий развития сердца проведено ЭХОКГ и обнаружено открытое овальное окно размером 4 мм. Ребенок был выписан домой под наблюдение участкового педиатра и кардиолога по месту жительства. В дальнейшем мальчик стал вялым, неохотно брал грудь, отмечались частые срыгивания, редкий стул. За месяц ребенок прибавил в весе 210 г. При осмотре обращали на себя внимание признаки недостаточности кровообращения: одышка в покое, умеренная тахикардия. Мальчик был направлен в НЦССХ им. Бакулева, где диагностирован порок развития сердца – дефект межпредсердной перегородки размером 6 мм со значительным нарушением сердечной гемодинамики. Рентгенограмма грудной клетки показала расширение корней легких, КТИ = 57 %. По данным ЭКГ: отклонение электрической оси сердца вправо. В возрасте 4 месяцев проведено оперативное лечение дефекта межпредсердной перегородки.
Успехи в области кардиохирургии за последние десятилетия позволили повысить выживаемость младенцев с синдромом Дауна и патологией сердечнососудистой системы с 78 % в 1985 г до 90 % к 2004 г. (Claire Irving и др., 2008).
Hijii Т. и др. (1997) сообщили, что до 24-летнего возраста доживают 87,8 % пациентов с синдромом Дауна, перенесших оперативное лечение врожденного порока сердца.
При сравнении течения и исходов оперативного лечения полной формы атривентрикулярного канала у младенцев с синдромом Дауна и без синдрома, в работе, проведенной на базе НЦССХ им. Бакулева, Т. И. Задко отмечает, что у детей с синдромом Дауна быстрее развивается легочная гипертензия, важным механизмом в развитии которой, очевидно, является окислительный стресс. Генетически обусловленные особенности антиоксидантной системы, в том числе изначально низкий уровень глутатиона и более высокая антиоксидантная активность сыворотки у детей с синдромом Дауна (Н. П. Котлукова, О. И. Артеменко и др., 2008), свидетельствуют о более высоком окислительном стрессе при развитии легочной гипертензии при пороках сердца с легочной гиперволемией.
Из ранних осложнений хирургической коррекции атриовентрикулярного канала у детей с синдромом Дауна чаще встречаются инфекционно-септические осложнения, тогда как у детей без синдрома – острая сердечная недостаточность (Т. И. Задко, 2005). Это обстоятельство объясняется анатомическими особенностями порока и имеющимися иммунологическими нарушениями у младенцев с трисомией 21-й хромосомы.
Выводы
Полученные нами данные частоты сердечных аномалий не противоречат уже известным в литературе. Около половины детей с синдромом Дауна имеют патологию сердечнососудистой системы: 45,5 % – врожденные пороки сердца, 2,8 % – гемодинамически значимый открытый артериальный проток.
Анализ данных проведенных исследований, а также собственные полученные результаты делают очевидной необходимость раннего кардиологического обследования всех новорожденных с синдромом Дауна, включающего помимо осмотра и аускультации проведение эхокардиологического и электрокардиологического исследований. Внимательный подход и оценка клинических симптомов, а также знание генетически обусловленных особенностей детей с синдромом Дауна помогут своевременно диагностировать недостаточность кровообращения и начать адекватную терапию. Все дети с выявленными пороками сердца должны быть консультированы кардиохирургом для определения необходимости и сроков оперативного лечения.
Литература
- Задко Т. И. Синдром Дауна в сочетании с полной формой атриовентрикулярной коммуникации: актуальность, диагностика, сопутствующая патология, анатомия, особенности естественного течения, результаты хирургического лечения // Детские болезни сердца и сосудов. – 2005. – № 6. – С. 10–18.
- Роль окислительного стресса и антиоксидантной системы в патогенезе врожденных пороков сердца / Н. П. Котлукова, О. И. Артеменко, М. П. Давыдова, О. Н. Ильина, Л. А. Курбатова // Педиатрия. – 2009. – Т. 87, № 1. – С. 24–28.
- Cassidy S. B., Allanson J. E. Management of Genetic Syndromes. 2-nd ed. – P. 191–210. URL: https://www.wiley.com/en-us/Management+of+Genetic+Syndromes%2C+3rd+Edition-p-9780470191415
- Correlation between abnormal cardiac physical examination and echocardiographic findings in neonates with Down syndrome / D. B. McElhinney, M. Straka, E. Goldmuntz, E. H. Zackai // American Journal of Medical Genetics. – 2002. – Part A. – P. 238–241.
- Khory M. J., Erickson J. D. Improved ascertainment of cardiovascular malformation in infants with Down syndrome, Atlanta, 1968 through 1989 // Epidemiology. – 1992. – Vol. 136. – P. 1457–1464.
- Life expectancy and social adaptation in individuals with Down syndrome and without surgery for congenital heart disease / T. Hijii, J. Fukushige, H. Igarashi et al. // Clinical Pediatrics. – 1997. –Vol. 36. – P. 327–332.
- Twenty-year trends in prevalence and survival of Down syndrome / C. Irving, A. Basu, S. Richmond et al. // European Journal of Human Genetics. – 2008. – Vol. 16. – P. 1336–1340.
Источник
Дефект межжелудочковой перегородки — наиболее частый из врожденных пороков сердца. Дефекты межжелудочковой перегородки встречаются с одинаковой частотой у лиц обоего пола. В большинстве случаев их диагностируют в грудном возрасте из-за грубого шума в сердце. У 25—40% происходит спонтанное закрытие дефекта межжелудочковой перегородки, из них у 90% — в возрасте до 8 лет. Степень функциональных нарушений зависит от величины сброса и легочного сосудистого сопротивления. Если имеется сброс слева направо, но отношение легочного кровотока к системному (QP/QS) < 1,5:1, то легочный кровоток возрастает незначительно и повышения легочного сосудистого сопротивления не происходит. При больших дефектах межжелудочковой перегородки (QP/QS > 2:1) значительно увеличивается легочный кровоток и легочное сосудистое сопротивление; давления в правом и левом желудочках выравниваются. По мере увеличения легочного сосудистого сопротивления возможно изменение направления сброса (справа налево), что проявляется цианозом, симптомом барабанных палочек; увеличивается риск парадоксальных эмболий. В отсутствие лечения развиваются правожелудочковая и левожелудочковая недостаточность и необратимые изменения легочных сосудов (синдром Эйзенменгера).
А. Типы
1. Мембранозные (75%): располагаются в верхней части межжелудочковой перегородки сразу под аортальным клапаном и септальной створкой трехстворчатого клапана. Часто закрываются самопроизвольно.
2. Мышечные (10%): располагаются в мышечной части перегородки, на значительном расстоянии от клапанов и проводящей системы. Мышечные дефекты межжелудочковой перегородки бывают множественными, фенестрированными и часто закрываются самопроизвольно.
3. Надгребневые (дефекты межжелудочковой перегородки выносящего тракта правого желудочка, 5%): располагаются выше наджелудочкового гребня (мышечный пучок, отделяющий полость правого желудочка от его выносящего тракта). Часто сопровождаются аортальной недостаточностью. Самопроизвольно не закрываются.
4. АВ-канал (дефект АВ-перегородки, дефект межжелудочковой перегородки приносящего тракта правого желудочка, 10%): обнаруживается в задней части межжелудочковой перегородки вблизи места прикрепления колец митрального и трехстворчатого клапанов. Часто встречается при синдроме Дауна. Дефект межжелудочковой перегородки сочетается с дефектом межпредсердной перегородки типа ostium primum и пороками развития створок и хорд митрального и трехстворчатого клапанов. Самопроизвольно не закрывается.
Б. Клиническая картина. Первым проявлением обычно служит грубый шум в сердце. Небольшие дефекты межжелудочковой перегородки часто протекают бессимптомно и могут остаться нераспознанными. При больших дефектах межжелудочковой перегородки нередко наблюдаются отставание в физическом развитии и частые респираторные инфекции. В тех редких случаях, когда больной с большим дефектом межжелудочковой перегородки доживает до подросткового и зрелого возраста, имеются симптомы право- и левожелудочковой недостаточности (одышка, отеки ног, ортопноэ). Синдром Эйзенменгера (необратимая легочная гипертензия вследствие сброса слева направо) может проявляться головокружением, обмороками, кровохарканьем, абсцессами головного мозга и болью в груди.
В. Течение и прогноз в отсутствие лечения
1. Небольшие дефекты межжелудочковой перегородки: продолжительность жизни существенно не меняется, но увеличивается риск инфекционного эндокардита.
2. Дефекты межжелудочковой перегородки средних размеров: сердечная недостаточность обычно развивается в детском возрасте; при самопроизвольном закрытии или уменьшении размеров наступает улучшение. Тяжелая легочная гипертензия встречается редко.
3. Большие дефекты межжелудочковой перегородки (без градиента давления между желудочками, или нерестриктивные): в большинстве случаев диагностируются в раннем возрасте, у 10% приводят к синдрому Эйзенменгера; большинство больных умирает в детском или подростковом возрасте. Материнская смертность во время беременности и родов при синдроме Эйзенменгера превышает 50%; в 3,3% случаев у прямых родственников больных с дефектами межжелудочковой перегородки также обнаруживается этот порок.
Г. Физикальное исследование
1. Внешний вид. При сердечной недостаточности наблюдается слабость, кахексия; часто обнаруживают вдавления в нижней части передней грудной стенки, так называемые борозды Харрисона (смещение участков грудной клетки в результате хронической одышки). При сбросе справа налево — цианоз и симптом барабанных палочек.
2. Пульс. При небольших дефектах межжелудочковой перегородки пульс на периферических артериях нормальный, пульсация яремных вен также не изменена. При легочной гипертензии наблюдается набухание шейных вен, высокоамплитудные волны A (сокращение предсердия при ригидном правом желудочке) и, иногда, волна V (трикуспидальная регургитация) на югулярной флебограмме.
3. Пальпация. Усиленный верхушечный толчок. Дрожание у левого нижнего края грудины.
4. Аускультация. Грубый пансистолический шум у левого нижнего края грудины. Патологическое расщепление II тона в результате удлинения периода изгнания правого желудочка. При надгребневых дефектах межжелудочковой перегородки бывает диастолический шум аортальной недостаточности.
Д. Неинвазивные исследования
1. ЭКГ. При большом сбросе слева направо: перегрузка левого предсердия и левого желудочка, отклонение электрической оси влево. При легочной гипертензии: перегрузка правого желудочка, отклонение электрической оси вправо.
2. Рентгенография грудной клетки. При небольших дефектах межжелудочковой перегородки: норма. При большом сбросе слева направо: увеличение левого желудочка, усиление легочного сосудистого рисунка вследствие увеличения легочного кровотока. При легочной гипертензии: выраженное увеличение ствола и проксимальных отделов легочной артерии с резким сужением дистальных ветвей, обеднение легочного сосудистого рисунка.
3. ЭхоКГ. Двумерную ЭхоКГ проводят с целью непосредственной визуализации дефекта межжелудочковой перегородки, выявления патологии митрального и аортального клапанов, увеличения камер сердца, сопутствующих врожденных пороков. С помощью допплеровского исследования (в том числе цветного) оценивают величину и направление сброса, рассчитывают давление в легочной артерии.
Е. Инвазивные исследования. Катетеризацию сердца и коронарную ангиографию проводят для подтверждения диагноза, измерения давления в легочной артерии и исключения ИБС (при соответствующих симптомах и перед операцией). Величину сброса можно оценить качественно с помощью левой вентрикулографии и количественно по насыщению крови кислородом в правом желудочке (в отличие от дефектов межпредсердной перегородки вместо насыщения кислородом смешанной венозной крови используют значение среднего насыщения в правом предсердии).
Ж. Лечение
1. Медикаментозное. При бессимптомном течении и нормальном давлении в легочной артерии (даже при больших дефектах межжелудочковой перегородки) возможно консервативное лечение. Если к 3—5 годам жизни самопроизвольного закрытия не происходит, показана хирургическая коррекция. При застое в легких применяют гидралазин (или нитропруссид натрия для неотложной терапии), который снижает ОПСС в большей степени, чем легочное сосудистое сопротивление, что приводит к уменьшению сброса слева направо и улучшению состояния. При правожелудочковой недостаточности назначают диуретики. До и в течение 6 мес после неосложненной хирургической коррекции дефекта межжелудочковой перегородки показана профилактика инфекционного эндокардита.
2. Хирургическое. Осложнения: при хирургическом закрытии дефекта (обычно — заплатой) периоперационная летальность — 3%, полная АВ-блокада возникает менее чем у 2% оперированных. Результаты: в большинстве случаев состояние улучшается, ЭКГ-признаки перегрузки правого желудочка часто исчезают, однако легочная гипертензия обычно сохраняется. Показания:
а. При бессимптомном течении — если к 3—5 годам жизни не происходит самопроизвольного закрытия дефекта.
б. Сердечная недостаточность и легочная гипертензия у детей младшего возраста.
в. У взрослых — QP/QS > 1,5:1. Хирургическое лечение неэффективно при тяжелой легочной гипертензии, когда отношение легочного сосудистого сопротивления к ОПСС і 0,9.
Источник: М.Фрид, С.Грайнс «Кардиология» (пер. с англ.), Москва, «Практика», 1996
опубликовано 31/08/2011 20:44
обновлено 31/08/2011
— Врожденные пороки сердца у взрослых
Источник
