Синдром чарга стросса что это
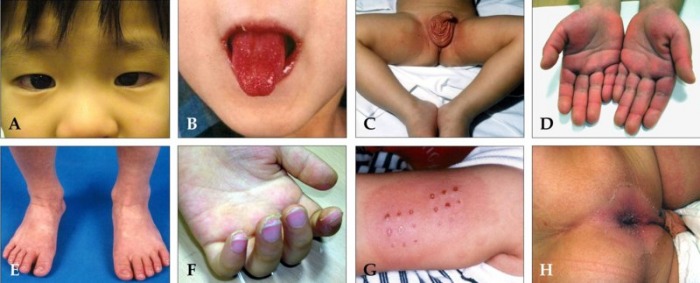
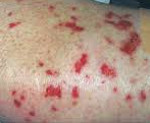
Синдром Черджа-Стросс – воспалительно-аллергическое поражение мелких и средних сосудов (капилляров, венул, артериол), протекающее с образованием некротизирующих эозинофильных гранулем. Для синдрома Черджа-Стросс характерны гиперэозинофилия, поражение бронхо-легочной системы, сердца, ЖКТ, центральной и периферической нервной системы, кожи и суставов. Диагноз синдрома Черджа-Стросс основан на данных анамнеза, клинической картины, лабораторных исследований, рентгенографии органов грудной клетки, биопсии легких. В качестве основной терапии синдрома Черджа-Стросс показано назначение системных глюкокортикостероидов и цитостатиков.
Общие сведения
Синдром Черджа-Стросс – разновидность системного васкулита с гранулематозным воспалением сосудов среднего и мелкого калибра и преимущественным поражением респираторного тракта. Синдром Черджа-Стросс относится к полисистемным нарушениям, чаще всего затрагивающим органы с богатым кровоснабжением — кожу, легкие, сердце, нервную систему, ЖКТ, почки. Синдром Черджа-Стросс во многом напоминает узелковый периартериит, но в отличие от него поражает не только мелкие и средние артерии, но и капилляры, вены и венулы; характеризуется эозинофилией и гранулематозным воспалением, преимущественным поражением легких. В ревматологии синдром Черджа-Стросс встречается редко, ежегодная заболеваемость составляет 0,42 случая на 100 тыс. населения. Синдромом Черджа-Стросс страдают люди от 15 до 70 лет, средний возраст пациентов составляет 40-50 лет; у женщин заболевание выявляется несколько чаще, чем у мужчин.
Синдром Черджа-Стросс
Причины
Причины синдрома Черджа-Стросс неизвестны. Патогенез связан с иммунным воспалением, пролиферативно-деструктивными изменениями и повышением проницаемости сосудистой стенки, тромбообразованием, кровоизлияниями и ишемией в зоне повреждения сосудов. Важную роль в развитии синдрома Черджа-Стросс играет повышенный титр антинейтрофильных цитоплазматических антител (ANCA), антигенными мишенями которых являются ферменты нейтрофилов (главным образом, протеиназа-3 и миелопероксидаза). ANCA вызывают преждевременную дегрануляцию и нарушение трансэндотелиальной миграции активированных гранулоцитов. Сосудистые изменения приводят к появлению многочисленных эозинофильных инфильтратов в тканях и органах с образованием некротизирующих воспалительных гранулем.
На первый план при синдроме Черджа-Стросс выходит поражение легких. При гистологическом исследовании выявляются интерстициальные и периваскулярные эозинофильные инфильтраты в стенках легочных капилляров, бронхов, бронхиол и альвеол, перивазальных и перилимфатических тканях. Инфильтраты имеют разнообразную форму, обычно локализуются в нескольких сегментах легкого, но могут распространяться на всю легочную долю. Кроме острофазных воспалительных реакций, отмечаются рубцовые склеротические изменения в сосудах и легочной ткани.
Спровоцировать развитие синдрома Черджа-Стросс могут вирусная или бактериальная инфекция (например, гепатит В, стафилококковое поражение носоглотки), вакцинация, сенсибилизация организма (аллергические заболевания, лекарственная непереносимость), стрессы, охлаждение, инсоляция, беременность и роды.
Симптомы
В своем развитии синдром Черджа-Стросс проходит три стадии.
Продромальная стадия может длиться несколько лет. При типичном течении синдром Черджа-Стросс начинается с поражения респираторного тракта. Появляются аллергический ринит, симптомы носовой обструкции, полипозные разрастания слизистой носа, рецидивирующие синуситы, затяжные бронхиты с астматическим компонентом, бронхиальная астма.
Вторая стадия синдрома Черджа-Стросс характеризуется повышением уровня эозинофилов в периферической крови и тканях; проявляется тяжелыми формами бронхиальной астмы с сильными приступами кашля и экспираторного удушья, кровохарканьем. Приступы бронхоспазма сопровождаются выраженной слабостью, длительной лихорадкой, миалгией, похуданием. Хроническая эозинофильная инфильтрация легких может привести к развитию бронхоэктатической болезни, эозинофильной пневмонии, эозинофильного плеврита. При появлении плеврального выпота отмечаются боли в грудной клетке при дыхании, усиление одышки.
Третья стадия синдрома Черджа-Стросс характеризуется развитием и доминированием признаков системного васкулита с полиорганным поражением. При генерализации синдрома Черджа-Стросс степень тяжести бронхиальной астмы уменьшается. Период между появлением симптомов бронхиальной астмы и васкулита составляет в среднем 2-3 года (чем короче промежуток, тем неблагоприятнее прогноз заболевания). Отмечается высокая эозинофилия (35-85%). Со стороны сердечно-сосудистой системы возможно развитие миокардита, коронарита, констриктивного перикардита, недостаточности митрального и трехстворчатого клапанов, инфаркта миокарда, пристеночного фибропластического эндокардита Леффлера. Поражение коронарных сосудов может стать причиной внезапной смерти больных синдромом Черджа-Стросс.
Для поражения нервной системы характерны периферическая нейропатия (мононейропатия, дистальная полинейропатия «по типу перчаток или чулок»; радикулопатии, нейропатия зрительного нерва), патология ЦНС (геморрагический инсульт, эпилептические приступы, эмоциональные расстройства). Со стороны ЖКТ отмечается развитие эозинофильного гастроэнтерита (абдоминальные боли, тошнота, рвота, диарея), реже — кровотечения, перфорация желудка или кишечника, перитонит, кишечная непроходимость.
При синдроме Черджа-Стросс возникает полиморфное поражение кожи в виде болезненной геморрагической пурпуры на нижних конечностях, подкожных узелков, эритемы, крапивницы и некротических пузырьков. Часто наблюдаются полиартралгии и непрогрессирующий мигрирующий артрит. Поражение почек встречается редко, носит невыраженный характер, протекает в форме сегментарного гломерулонефрита и не сопровождается ХПН.
Диагностика
Больные синдромом Черджа-Строcс за первичной помощью обычно обращаются к различным специалистам — отоларингологу, пульмонологу, аллергологу, неврологу, кардиологу, гастроэнтерологу и поздно попадают к ревматологу. Диагностика синдрома Черджа-Стросс основана на клинико-лабораторных данных и результатах инструментальных исследований. Диагностическими критериями синдрома Черджа-Стросс считаются: гиперэозинофилия (>10% от общего числа лейкоцитов), бронхиальная астма, моно- или полинейропатия, синусит, эозинофильные инфильтраты в легких, экстраваскулярные некротизирующие гранулемы. Наличие не менее 4-х критериев подтверждает диагноз в 85% случаев.
При синдроме Черджа-Стросс также выявляется анемия, лейкоцитоз, повышение СОЭ и уровня общего IgE. Для более половины случаев синдрома Черджа-Стросс характерно обнаружение перинуклеарных антител с антимиелопероксидазной активностью (рANCA).
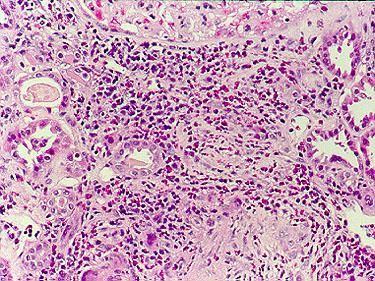
Рентгенография органов грудной клетки при синдроме Черджа-Стросс позволяет обнаружить быстро исчезающие, ограниченные затемнения и очаговые тени в легких, наличие плеврального выпота. При биопсии легкого определяется гранулематозное воспаление мелких сосудов, инфильтраты в околососудистом пространстве, содержащие эозинофилы. Дифференциальную диагностику синдрома Черджа-Стросс следует проводить с узелковым полиартериитом, гранулематозом Вегенера, хронической эозинофильной пневмонией, идиопатическим гиперэозинофильным синдромом, микроскопическим полиангиитом.
Лечение синдрома Черджа-Стросс
Лечение предполагает длительное назначение высоких доз системных глюкокортикостероидов. По мере улучшения состояния дозу препаратов снижают. При наличии поражений сердечно-сосудистой системы, легких, множественного мононеврита возможно применение пульс-терапии метилпреднизолоном. При неэффективности глюкокортикостероидов используются цитостатики (циклофосфамид, азатиоприн, хлорбутин), которые способствуют более быстрой ремиссии и снижению риска рецидивов, но создают высокий риск инфекционных осложнений. Перед началом терапии отменяются все лекарственные препараты, к которым у больного выявлена сенсибилизация.
Прогноз
Без лечения прогноз синдрома Черджа-Стросс неблагоприятный. При полиорганном поражении происходит быстрое прогрессирование синдрома Черджа-Стросс с высоким риском смертельного исхода от сердечно-легочных нарушений. При адекватном лечении 5-летняя выживаемость составляет 60-80%.
Источник
Эозинофильный гранулематоз с полиангиитом, также известный как синдром Чарга — Стросс (Churg-Strauss Syndrome), является редким системным некротизирующим васкулитом, поражающий мелкие и средние сосуды и связанный с тяжелой бронхиальной астмой и эозинофилией.
Впервые клинические и патологические признаки этого заболевания описали Jacob Churg и Lotte Strauss в 1951 году у 13 пациентов с бронхиальной астмой, эозинофилией, гранулематозным воспалением, некротизирующим системным васкулитом и некротизирующим гломерулонефритом. В 1990 году Американская коллегия ревматологов (ACR) предложили ввести следующие шесть критериев для диагностики синдрома Чарга — Стросс:
- Манифестация бронхиальной астмы;
- Увеличение более чем на 10% количества эозинофилов в периферической крови;
- Параназальный синусит;
- Легочные инфильтраты (могут быть переходными);
- Гистологические признаки васкулита с внесосудистыми скоплениями эозинофилов;
- Моно- или полинейропатия.
Диагноз считается установленным при наличии четырех признаков из шести. Консенсусная конференция 1994 года в Chappel Hill (Северная Каролина, США) по классификации системных васкулитов не изменила критерии ACR.
Этиология
Причины развития СЧС неизвестны. Возможно, это аллергическая или аутоиммунная реакция организма на факторы окружающей среды или лекарственные средства. Известны несколько случаев развития синдрома индуцированного лекарствами. Описан случай месалазин-индуцированного СЧС у пациента с болезнью Крона и склерозирующим холангитом. В публикациях рассматривается связь между пропилтиоурацилом, метиломазолом и васкулитами, в т.ч. и СЧС. Также есть предположение, что прием антагонистов лейкотриеновых рецепторов и уменьшение дозы или отмена системных глюкокортикоидов ведет к ухудшению течения бронхиальной астмы и приводит к развитию СЧС.
Эпидемиология и патофизиология
В мире частота встречаемости синдрома Чарга-Стросс составляет 2,5 случаев на 100000 людей и несколько чаще встречается у мужчин. СЧС встречается как у детей, так и взрослых. Заболеванием страдают люди от 15 до 70 лет, средний возраст — 38 лет.
Патофизиология синдрома до конца не изучена. Особенностью заболевания является значительная эозинофилия в крови и тканях, ассоциирующаяся с активностью заболевания. Установлено, что у пациентов с СЧС в активной фазе заболевания эозинофилы экспрессируют поверхностные маркеры активации и секретируют биологически активные белки, приводящих к тканевому повреждению. Несомненно, в патогенезе СЧС участвуют цитокины. Показано, что увеличение содержания ИЛ-6 в сыворотке крови предшествует росту ревматоидных факторов в сыворотке крови и определяется в начале обострения СЧС. Таким образом, ИЛ-6 может быть важным пусковым фактором. Установлено, что у пациентов с СЧС отмечается существенный рост уровня интерферона-α и ИЛ-2, а также умеренное повышение ФНО-α и ИЛ-1β, подобно наблюдаемому при узелковом периартериите.
Предполагается, что эозинофилия поддерживается высоким уровнем ИЛ-5 в крови, который продуцируется главным образом активированными лимфоцитами типа Th2. Показано, что при рефрактерном течении СЧС введение меполизумаба — антител к интерлейкину-5 -приводило к улучшению.
Результаты биопсии пораженных периферических нервных волокон свидетельствуют о том, что при эпиневральном некротизирующем васкулите начинают численно преобладать активированные цитотоксические Т-лимфоциты (CD8+ цитотоксические Т-клетки и CD4+ Т-хелперы) над эозинофилами, включая и воспалительный экссудат. Иногда в воспалительном экссудате обнаруживаются CD20+ (В-лимфоциты), возможно, также определение иммуноглобулина Е (IgE) и антител к C3d.
Предполагается, что АНЦА к миелопероксидазе играют важную роль в патогенезе повреждения сосудистой стенки посредством активации нейтрофилов, адгезии полиморфноядерных клеток к эндотелиальным клеткам сосудов, с последующим литическим повреждением эндотелия.

Клиническая картина
За исключением неспецифических симптомов, которые также наблюдаются при узелковом периартериите (слабость, повышение температуры тела, снижение аппетита и массы тела), на первый план при синдроме Чарга-Стросс выходит поражение органов дыхания.
У большинства больных одним из первых проявлений является бронхиальная астма, особенностью течения которой является появление легочных инфильтратов (у 2/3 больных). Описаны также случаи кровохарканья и альвеолярного кровотечения.
Более чем у 70% больных с СЧС клиническая картина болезни начинается с проявлений аллергического ринита, который часто дает осложнения в виде полипозных разрастаний слизистой носа, рецидивирующих после удаления, и присоединением синуситов.
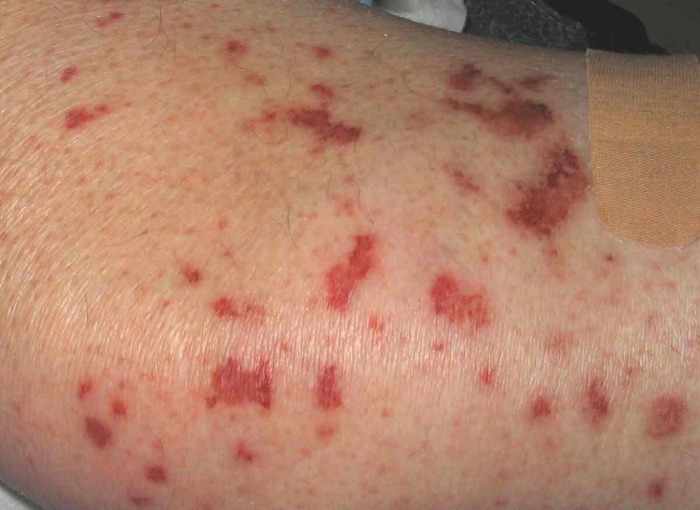
Изменения кожи, наблюдаемые у 60 % пациентов с СЧС, включают в себя:
- Лейкоцитокластический васкулит с пальпируемой пурпурой, расположенных преимущественно на разгибательной поверхности верхних и нижних конечностях;
- Ливедо, некроз кожи и гангрена, подкожные узелки (у одной трети больных это начальное проявление поражения кожи).
- Поражение сердечно-сосудистой системы могут включать:
- Миокардит и признаки сердечной недостаточности;
- Инфаркт миокарда, как следствие коронарного васкулита;
- Поражения почек (не являются частым клиническим проявлением):
- Почечная гипертензия;
- Признаки уремии и быстропрогрессирующей почечной недостаточности;
- Некротизирующий гломерулонефрит.
Вовлечение в процесс органов ЖКТ — относительно частая клиническая проблема при СЧС. Васкулит и эозинофильный инфильтрат могут привести к ишемии, а в последующем явиться причиной перфорации стенки желудка или кишечника. У пациентов с СЧС выявляются эозинофильный гастроэнтерит, желудочно-кишечное кровотечение, васкулит кишечника.
Поражение нервной системы включает в себя множественный мононеврит или симметричную сенсорно-моторную периферическую полинейропатию. Часто фиксируют изменения со стороны черепно-мозговых нервов, в частности ишемию зрительного нерва. Поражение ЦНС включает развитие гиперкинетического состояния, энцефалопатии, инсультов и психических расстройств.
Лабораторная диагностика
Лабораторным маркером синдрома Чарга-Стросс является эозинофилия (5000-9000 эозинофилов/ мкл), которая наблюдается у 90 % больных. Имеет место нормоцитарная нормохромная анемия, ускорение СОЭ, повышение С-реактивного белка. Антинейтрофильные цитоплазматические антитела выявляются приблизительно у 40 % пациентов с СЧС.У большинства АНЦА-положительных пациентов с CЧС (от 70 до 75%) определяются антитела к миелопероксидазе с перинуклеарным окрашиванием (так называемый MPO-АНЦА или пAНЦA). Показано, что у лиц с СЧС титры пАНЦА коррелируют с тяжестью заболевания; снижение титров этих антител отражало эффективность проводимой иммуносупрессивной терапии и, наоборот, рост титров пАНЦА рассматривался как признак обострения заболевания. Также маркером СЧС является определение эотаксина-3 в сыворотке крови. Отмечено повышение этого показателя при активности процесса у пациентов с СЧС.
Другие методы исследования
Рентгенография органов грудной клетки позволяет обнаружить затемнения или узелки в легких (в 75% случаев),узловатые и билатерально расположенные инфильтраты, которые крайне редко осложняются формированием асептической полости, затемнения симметрично расположены по периферии, признаки плеврального выпота.
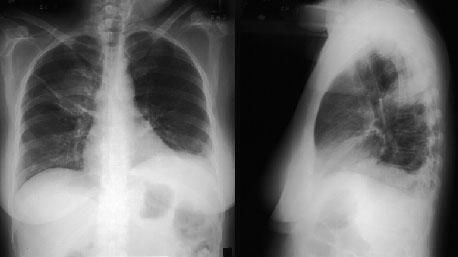
Компьютерная томография высокого разрешения проводится с диагностической целью при необъяснимой одышке, выявлении рентгенологических изменений и снижении сатурации кислорода. С помощью этого метода можно визуализировать:
- паренхиматозные инфильтраты, часто схожие с феноменом «матового стекла», расположенные преимущественно по периферии;
- утолщение стенок бронхов; в отдельных местах дилатацию вплоть до образования бронхоэктазов;
- возможно выявление узлов в легочной ткани
Результаты иммунологического исследования могут показать повышенный уровень IgE в сыворотке крови, гипергаммаглобулинемию, обнаружение ревматоидного фактора в низких титрах, повышенный уровень эозинофильного катионного белка (ECP), растворимого рецептора интерлейкина-2 (sIL-2R) и тромбомодулина (sTM). которые являются маркерами повреждения эндотелия; Повышенный уровень эозинофильного катионного белка и растворимого рецептора интерлейкина указывают на иммунорегуляторный дефект, связанный с васкулитом и эозинофилией.
На бронхоальвеолярном лаваже эозинофилия проявляется в 33 % случаев.
При постановке диагноза нужно исключить другие возможные заболевания, прежде всего узелковый полиартериит, гранулематоз Вегенера, хроническую эозинофильную пневмонию, идиопатический гиперэозинофильный синдром и микроскопический полиангиит. Окончательный диагноз устанавливается по результатам биопсии пораженной ткани.
Лечение
Лечение СЧС проводят комбинацией глюкокортикоидов и метотрексата или микофенолат мофетила. При наличии поражений сердечно-сосудистой, дыхательной и нервной систем возможно применение пульс-терапии метилпреднизолоном.В качестве поддерживающей терапии рекомендуется прием комбинации низких доз глюкокортикоидов и азатиоприна, ритуксимаба, метотрексата или микофенолат мофетила. Необходимо помнить об индивидуальной чувствительности к применяемой терапии, при наличии которой стоит задуматься об отмене препаратов. Пациентам с уровнем сывороточного креатинина ≥500 ммоль/л (5,7 мг/дл) в связи с быстро прогрессирующим гломерулонефритом при установлении нового или рецидивирующего заболевания и для лечения тяжелых форм диффузного альвеолярного кровотечения назначается плазмаферез.
Прогноз без лечения неблагоприятен; Основным причинами смерти являются миокардит и инфаркт миокарда. При адекватном лечении однолетняя выживаемость составляет 90%, а пятилетняя — 62 %.
Источники
- https://emedicine.medscape.com/article/333492-overview
- Buzio1 C., Oliva E. Diagnosis of Churg–Strauss syndrome: eotaxin-3 makes it easier // Rheumatology.- 2011.- doi: 10.1093/rheumatology/ker007
- Семенкова Е.Н., Моисеев С.В., Наместникова О.Г. Клинические аспекты синдрома гиперэозинофилии // Клин. мед.- 2004.-N 2.-C. 28–31
Источник
