Причина гиперхолестеринемии при нефротическом синдроме
Этим термином обозначается симптомокомплекс, характеризующийся массивной протеинурией(более 3 г белка/сутки), гипо- и диспротеинемией, гиперлипидемией, гиперхолестеринемией, распространенными отеками и водянкой серозных полостей.
По этиологииразличают первичный и вторичный нефротический синдром. Причиной развития первичного нефротического синдромаявляются первично возникающие заболевания почек, такие, как гломерулопатия с минимальными изменениями в виде слияния малых ножек подоцитов (липоидный нефроз), мембранозный гломерулонефрит, фокально-сегментарный гломерулосклероз, мембранозно-пролиферативный гломерулонефрит.
Вторичный нефротический синдромвозникает при многих заболеваниях, в основном системного характера, при которых почки поражаются вторично. К числу таких заболеваний относятся сахарный диабет (диабетическая нефропатия), амилоидоз, злокачественные опухоли, коллагенозы (системная красная волчанка, склеродермия, ревматизм, узелковый периартериит), хронические инфекционные процессы в организме, паразитарные заболевания
(токсоплазмоз, шистоматоз и др.), аллергические заболевания (сывороточная болезнь и др.). Кроме этого вторичный нефротический синдром возникает при интоксикациях (золото, ртуть, висмут, пенициламин, нестероидные противовоспалительные средства, яды насекомых и змей), нефропатии беременных, тромбозе почечных сосудов и др.
Этиология нефротического синдрома в значительной степени зависит от возраста. Наиболее частой причиной развития этого синдрома у детей является нефропатия с минимальными изменениями; у взрослых среди причин развития нефротического синдрома на первом месте стоит мембранозный гломерулонефрит; у людей старше 60 лет, наряду с мембранозным гломерулонефритом, развитие нефротического синдрома во многих случаях связано с диабетической нефропатией и другими системными заболеваниями, вторично нарушающими функцию почек.
Патогенез.Во всех случаях нефротического синдрома имеет место повышенная проницаемость базальной мембраны капилляров клубочков для белка. Протеинурияможет иметь как селективный, так и неселективный характер. При нефротическом синдроме с минимальными изменениями повышение клубочковой проницаемости связано с уменьшением постоянного электрического заряда стенки капиллярных петель, что обусловлено исчезновением из нее сиалопротеида, в норме тонким слоем покрывающего эндотелий и отростки подоцитов, лежащих на базальной мембране. При мембранозном гломерулонефрите главную роль играет потеря функции барьера, зависящего от размера пор в базальной мембране, которые в норме ограничивают прохождение плазменных белков с молекулярной массой более 150 кД.
Повышение проницаемости фильтрующих мембран клубочков связывают с повреждающим действием откладывающихся на них иммунных комплексов, а также лизосомальных ферментов и активных форм кислорода, выделяемых нейтрофилами и моноцитами. Кроме того, в плазме крови больных с нефротическим синдромом обнаружен фактор, предположительно образуемый лимфоцитами, который повышает проницаемость клубочкового барьера. При любом механизме повреждения происходит повышенное поступление белков плазмы крови, преимущественно альбуминов, в клубочковый фильтрат, и развивается резко выраженная протеинурия (более 3 г белка/сутки, в отдельных случаях — до 50 г белка/сутки). Следствием этого является гипопротеинемия(менее 60 г белка/л),
главным образом за счет снижения содержания альбуминов. Вызываемое гипопротеинемией падение коллоидно-осмотического давления сопровождается усиленным выходом жидкости из сосудов в межклеточное пространство и серозные полости тела и развитием гиповолемии, что, в свою очередь, вызывает повышение активности РААС и усиление продукции альдостерона; последний снижает экскрецию натрия с мочой и увеличивает его концентрацию в крови. При проведении ряда клинических и экспериментальных исследований было установлено, что, кроме описанного механизма, развитию гипернатриемии при нефротическом синдроме способствует снижение реакции почек на действие предсердного натрийдиуретического пептида, стимулирующего выведение натрия с мочой. Установлено, что пониженная реакция нефротической почки на предсердный натрийуретический пептид обусловлена пострецепторным дефектом в механизме действия этого фактора на уровне канальцевого эпителия. Возникающее при этом повышение осмотического давления стимулирует секрецию АДГ, который усиливает задержку в организме воды, что ведет к развитию отеков (рис. 19-2).
Стимуляция секреции АДГ под действием гипернатриемии сопровождается увеличением объема плазмы крови, но происходит ее разжижение, гипопротеинемия и гипоонкия возрастают. Вследствие этого избыточная вода не задерживается в кровеносном русле, а перемещается в ткани, что способствует дальнейшему нарастанию отеков, т.е. возникает «порочный круг».
Развитию гипопротеинемии при нефротическом синдроме, кроме протеинурии, способствуют повышенный выход белка в ткани в составе транссудата и потеря его через отечную слизистую кишечника. Гипопротеинемия сочетается с диспротеинемией,так как наряду с альбуминами нередко снижается содержание в крови γ-глобулинов, которые также могут поступать в мочу. Вместе с тем развивается гиперлипидемияза счет повышения содержания липопротеинов низкой и очень низкой плотности (ЛПОНП) при нормальном или пониженном уровне липопротеинов высокой плотности. В плазме крови повышается содержание холестерина и триацилглицеролов. За развитие гиперлипидемии ответственны два механизма: повышение продукции липопротеинов в печени и нарушение катаболизма хиломикронов и ЛПОНП. Предполагается, что пониженный катаболизм липопротеинов может быть обусловлен потерей с мочой некоторых субстанций (например, ли-
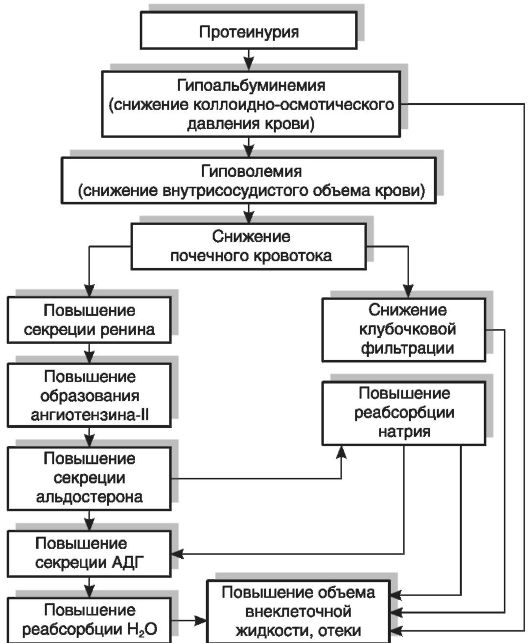 Рис. 19-2.Механизм развития отеков при нефротическом синдроме. АДГ — антидиуретический гормон
Рис. 19-2.Механизм развития отеков при нефротическом синдроме. АДГ — антидиуретический гормон
попротеиновой липазы). Однако ни один из компонентов, выделенных из мочи этих больных, полностью не устраняет нарушения обмена липопротеинов. Гиперхолестеринемия и гиперлипидемия повышают риск развития у таких пациентов сердечно-сосудистых нарушений.
При нефротическом синдроме многие транспортные белки, связывающие эндогенные и экзогенные субстанции, теряются с мочой. В связи с этим в плазме крови у больных с нефротическим синдромом понижен уровень ряда микроэлементов (Fe, Cu
и Zn), метаболитов витамина D, тареоидньгх и стероидных гормонов. Многие лекарства в плазме крови связаны с альбуминами, поэтому при гипоальбуминемии повышается количество свободно циркулирующих форм, что может повысить их токсичность.
Развитие обширных отеков(вплоть до отека легких и мозга) и накопление транссудата в серозных полостях могут сопровождаться тяжелыми нарушениями функции жизненно важных органов и стать причиной летального исхода. Наряду с этим при нефротическом синдроме возникает ряд осложнений, являющихся факторами риска для таких больных.
Главную опасность при нефротическом синдроме составляют тромбоэмболические осложнения.У больных мембранозным гломерулонефритом часто возникает тромбоз почечной вены (у 20-30% взрослых пациентов); нередко происходит тромбоз глубоких вен голени. Другим опасным осложнением является эмболия легочной артерии. Артериальные тромбозы менее часты, но они могут привести к нарушению коронарного кровообращения, что повышает риск развития инфаркта миокарда. Главными факторами, ответственными за состояние гиперкоагуляции при нефротическом синдроме, являются повышение содержания прокоагулянтов — фибриногена и плазменных факторов V и VIII, снижение содержания антикоагулянта антитромбина III, ослабление активности фибринолитической системы вследствие снижения содержания плазминогена и повышение активности а2-антиплазмина; кроме того, происходит увеличение количества тромбоцитов и повышается их способность к адгезии и агрегации, что способствует нарушению микроциркуляции в различных органах и тканях.
Другую опасность для больных с нефротическим синдромом представляют инфекционные осложнения. Ранее дети с этим синдромом умирали от бактериальной инфекции, в частности от пневмококкового перитонита. Повышенная чувствительность к бактериальной инфекции обусловлена снижением уровня иммуноглобулинов А и G вследствие потери их с мочой.
Нередко происходит развитие гипокалыщемии,что обусловлено потерей с мочой связанного с белком кальция и метаболитов витамина D и снижением продукции этого витамина в проксимальных канальцах нефронов. Следствием гипокальциемии является развитие гиперпаратиреоза и остеопороза.Из других осложнений следует указать на возможность развития острой почечной недостаточности в связи с резко выраженной гиповолемией.
Ренальные показатели при нефротическом синдроме в значительной степени зависят от заболевания, на фоне которого он развился. В наиболее чистом виде они выражены при нефропатии с минимальными изменениями. При этом состоянии развивается олигурия,относительная плотность мочи повышена (1030-1050); кроме массивной протеинурии, регистрируется липидурия;в осадке мочи обнаруживаются гиалиновые, восковидные и эпителиальные цилиндры с жировыми включениями. При других вариантах нефротического синдрома в осадке мочи могут присутствовать эритроциты и лейкоциты. Массивная протеинурия повреждает эпителий канальцев, и это может сопровождаться развитием глюкозурии, гипераминоацидурии, фосфатурии, почечного канальцевого ацидоза; возникает состояние, подобное синдрому де Тони- Дебре-Фанкони.
Считается, что прогноз нефротического синдрома благоприятен при нефропатии с минимальными изменениями (при условии своевременно начатого лечения). При нефротическом синдроме другой этиологии исход зависит от вида заболевания, возникших осложнений, возраста пациента, своевременности и правильности лечения.
Источник

Гиперхолестеринемия – это увеличение концентрации общего холестерина в плазме крови выше 5 ммоль/л. Причины данного лабораторного отклонения могут быть разнообразными – от погрешности в питании и ожирения до эндокринных расстройств и генетических заболеваний. Чаще всего клинически протекает бессимптомно. В некоторых случаях наблюдаются ксантомы (узловые образования на коже в области суставов), ксантелазмы (бляшки желтоватого цвета в области век), липоидная дуга на роговице. Уровень холестерина исследуется в венозной крови до приема пищи. Коррекция осуществляется с помощью диеты и назначения статинов.
Классификация
Наиболее часто в клинической практике используется классификация гиперхолестеринемии по Фридериксону, в основе которой лежит разделение по преобладанию той или иной фракции холестерина:
- Тип I – увеличение концентрации хиломикронов (ХМ).
- Тип IIa – повышение уровня липопротеидов низкой плотности (ЛПНП).
- Тип IIb – высокое содержание липопротеидов низкой и очень низкой плотности (ЛПОНП и ЛПНП).
- Тип III – увеличение уровня липопротеидов промежуточной плотности (ЛППП).
- Тип IV – повышение значений ЛПОНП.
- Тип V – высокий уровень ЛПОНП и ХМ.
По происхождению гиперхолестеринемию подразделяют на:
1. Первичную. Данная форма в свою очередь делится на:
- Полигенную. Наиболее частая разновидность. Вызвана сочетанием генетической предрасположенности и воздействия экзогенных факторов (питание, курение и т.д.).
- Семейную. Обусловлена различными наследственными нарушениями липидного обмена из-за генетических мутаций.
2. Вторичную. Высокое содержание в крови холестерина, развивающееся на фоне некоторых заболеваний, эндокринных расстройств или приема лекарственных препаратов.
По степени увеличения в крови уровня холестерина выделяют:
- Легкую гиперхолестеринемию – от 5,0 до 6,4 ммоль/л.
- Умеренную гиперхолестеринемию – от 6,5 до 7,8 ммоль/л.
- Высокую гиперхолестеринемию – 7,9 ммоль/л и выше.
Причины гиперхолестеринемии
Физиологические
Значения холестерина могут превышать норму и у здоровых людей. Например, изменения в балансе женских половых гормонов во время беременности вызывает увеличение уровня холестерина. После родов показатели возвращаются к норме. В случае неправильной подготовки перед сдачей биохимического анализа крови (прием жирной пищи накануне сдачи крови) холестерин оказывается выше нормы.
Наследственные нарушения обмена липидов
Данная группа заболеваний носит название «наследственные (семейные) гиперхолестеринемии». Они обусловлены мутациями генов, кодирующих экспрессию рецепторов липопротеидов (LDLR, АпоВ-100, PCSK9) или фермента липопротеинлипазы. Это приводит к нарушению катаболизма и поглощения липопротеидов клетками, в результате чего концентрация холестерина в крови начинает значительно возрастать.
Отличительной особенностью семейных форм гиперхолестеринемии является обнаружение очень высоких показателей холестерина (у гомозиготных больных он может достигать 20 ммоль/л) уже с раннего детства (5-7 лет). Все это ассоциировано с быстрым прогрессированием атеросклероза и развитием серьезных сердечно-сосудистых осложнений уже в 20-25-летнем возрасте. Для нормализации уровня холестерина требуется агрессивная липидснижающая терапия.

Ксантелазмы на веках — признак гиперхолестеринемии
Ожирение
Избыточный вес занимает первое место среди этиологических факторов гиперхолестеринемии и составляет более 90% всех ее случаев. Патогенез влияния избыточного веса на уровень холестерина выглядит следующим образом. Адипоциты выделяют большое количество биологически активных веществ, снижающих чувствительность клеток к инсулину, формируется инсулинорезистентность.
В результате активируется липолиз и высвобождение свободных жирных кислот (СЖК). Из поступающего в печень избытка СЖК синтезируется большое количество ЛПОНП – одной из фракций холестерина. Гиперхолестеринемия нарастает медленно и прямо пропорциональна степени ожирения, может постепенно вернуться к норме при снижении веса, однако при длительном течении становится необратимой.
Болезни почек
Причиной гиперхолестеринемии могут быть заболевания почек, сопровождающиеся нефротическим синдромом: начальная стадия гломерулонефритов, диабетическая или гипертоническая нефропатия, нефропатия при множественной миеломе. Возрастание показателей ХС связано с потерей с мочой белков-переносчиков и ферментов, участвующих в катаболизме липидов (лецитин-холестерин-ацетилтрансферазы, липопротеинлипазы).
Тяжесть гиперхолестеринемии коррелирует со степенью протеинурии. После специфической терапии основного заболевания и купирования нефротического синдрома уровень ХС обычно нормализуется, однако в части случаев остается повышенным длительное время, что может потребовать дополнительных лечебных мер для предупреждения прогрессирования атеросклероза.
Эндокринные расстройства
Особое место в структуре причин гиперхолестеринемии занимают болезни эндокринной системы. Недостаточность или избыточная продукция того или иного гормона вызывает значительные сдвиги на разных этапах липидного метаболизма.
- Сахарный диабет 2 типа. Наиболее распространенная причина среди эндокринных заболеваний. Механизм развития гиперхолестеринемии такой же, как при ожирении (относительный дефицит инсулина, усиленный синтез ЛПОНП). Степень повышения ХС соответствует тяжести диабета. Для нормализации показателей необходима как противодиабетическая, так и липидснижающая терапия.
- Гипотиреоз. Тироксин и трийодтиронин стимулируют образование рецепторов ЛПОНП, регулируют активность холестерин-7-альфа-гидроксилазы – основного фермента синтеза желчных кислот. Снижение концентрации гормонов щитовидной железы при гипотиреозе приводит к замедлению катаболизма ЛПОНП и превращения холестерина в желчные кислоты. Гиперхолестеринемия умеренная, полностью обратимая. Исчезает вместе с остальными симптомами заболевания после заместительной гормонотерапии.
- Болезнь/синдром Иценко-Кушинга. Первичный и вторичный гиперкортицизм увеличивают содержание холестерина как прямо (гормоны коры надпочечников глюкокортикостероиды снижают количество ЛПОНП-рецепторов) так и опосредованно (через развитие стероидного сахарного диабета). Гиперхолестеринемия сильнее выражена и более стойкая, чем при гипотиреозе.
Холестаз
Повышение уровня холестерина в сыворотке может наблюдаться при болезнях печени и желчевыводящих путей, сопровождающихся внутри- или внепеченочным холестазом (застоем желчи). Гиперхолестеринемия вызвана нарушением утилизации ХС для выработки желчных кислот. Ее степень коррелирует с тяжестью холестаза.
Наиболее высокие показатели наблюдаются при первичном склерозирующем холангите, первичном и вторичном билиарном циррозе, менее выраженные – при паренхиматозных болезнях печени (алкогольном, вирусных гепатитах, жировой дистрофии печени). Устранение холестаза приводит к достаточно быстрой нормализации ХС.
Другие причины
- Аутоиммунные заболевания: системная красная волчанка, гипергаммаглобулинемия.
- Метаболические расстройства: подагра, болезни накопления (болезнь Гоше, Нимана-Пика).
- Психические заболевания: нервная анорексия.
- Прием лекарственных препаратов: оральных контрацептивов, бета-адреноблокаторов, тиазидных диуретиков.
Диагностика
Лабораторно гиперхолестеринемия выявляется при исследовании венозной крови. Помимо концентрации общего ХС большую информативность несет определение его фракций и триглицеридов. Для дифференциальной диагностики важное значение имеет возраст пациента и другие анамнестические данные – прием медикаментов, наличие близких родственников с подтвержденной семейной формой гиперхолестеринемии. Для уточнения этиологического фактора проводится следующее обследование:
- Рутинные лабораторные анализы. Измеряется содержание печеночных трансаминаз (АЛТ, АСТ), маркеров холестаза (щелочной фосфатазы, гамма-глутамилтранспептидазы), глюкозы. При подозрении на нефротический синдром проводится общий анализ мочи, анализ на микроальбуминурию, суточную протеинурию.
- Гормональные исследования. Определяется концентрация ТТГ, тиреоидных гормонов (свободные Т4 и Т3). Для подтверждения гиперкортицизма проверяется уровень кортизола в крови после выполнения малой и большой дексаметазоновых проб.
- Иммунологические тесты. Проводятся анализы на маркеры вирусных гепатитов (HBsAg, HCV), антимитохондриальные (АМА), антинейтрофильные (ANCA) антитела.
- УЗИ. На УЗИ органов брюшной полости могут обнаруживаться камни желчного пузыря, утолщение стенок, признаки жировой инфильтрации в печени.
- Генетические исследования. В случае подозрения на наследственную гиперхолестеринемию методом полимеразной цепной реакции выявляются мутации генов рецепторов LDLR, PSCK-9, АпоB-100.

Для медикаментозной коррекции гиперхолестеринемии назначают разные группы препаратов
Коррекция
Консервативная терапия
При обнаружении гиперхолестеринемии необходимо обязательно обратиться к врачу для выяснения причины этого лабораторного феномена и подбора грамотного лечения. Большое внимание уделяется борьбе с основным заболеванием (иммуносупрессивной терапии при нефротическом синдроме, гормонозаместительной при гипотиреозе, желчегонной при холестазе), так как его устранение может привезти к нормализации уровня ХС без дополнительного вмешательства.
Немедикаментозные методы коррекции гиперхолестеринемии включают полный отказ от курения, ограничение употребления алкоголя. Также пациентам, страдающим ожирением, для снижения массы тела необходимо соблюдать диету с уменьшением в рационе доли животных жиров (сливочное масло, жареное мясо, колбасы) и увеличением растительных жиров (овощи, морепродукты), фруктов и цельнозерновых продуктов, регулярно выполнять различные физические упражнения.
Для медикаментозной коррекции гиперхолестеринемии применяются следующие лекарственные препараты:
- Статины (аторвастатин, розувастатин). Наиболее эффективные и часто назначаемые средства для снижения уровня ХС. Механизм действия основан на подавлении синтеза ХС в печени.
- Фибраты (клофибрат). Данные ЛС стимулируют активность фермента ЛПЛ, тем самым ускоряют деградацию ЛП. Снижают не только ХС, но и триглицериды, поэтому нередко становятся препаратами выбора у больных, страдающих сахарным диабетом.
- Эзетимиб. Ингибирует всасывание ХС в кишечнике. Используется в комбинации со статинами.
- Ингибиторы PCSK9 (алирокумаб). Это моноклональные антитела, которые связываются с рецепторами ЛПНП в печени, что стимулирует распад липопротеидов. Назначаются при неэффективности статинов.
- Секвестранты желчных кислот (холестирамин, колестипол). Представляют собой ионообменные смолы, подавляющие абсорбцию желчных кислот в кишечнике. Истощение запасов ЖК активирует их синтез из холестерина в печени. Применяются у пациентов с холестазом.
- Никотиновая кислота. Данный препарат уменьшает поступление жирных кислот в печень, из-за чего подавляется синтез ЛП. Обладает слабым гипохолестеринемическим эффектом, поэтому используется как дополнение к другим препаратам.
- Омега-3-жирные кислоты. Эйкозапентаеновая и докозагексаеновая кислоты являются компонентами рыбьего жира. Данные вещества связываются с ядерными рецепторами PPAR клеток печени, что приводит к снижению сывороточного уровня липидов.
Хирургическое лечение
Одно из обязательных условий в эффективном лечении гиперхолестеринемии – нормализация массы тела. Пациентам с морбидным ожирением (индекс массы тела выше 40), особенно в сочетании с сахарным диабетом 2 типа, при безуспешности консервативных методов показаны бариатрические операции – бандажирование желудка, желудочное шунтирование или резекция.
Если гиперхолестеринемия вызвана холестазом вследствие желчнокаменной болезни, выполняется хирургическое удаление желчного пузыря (холецистэктомия). Пациентам с болезнью Иценко-Кушинга проводится эндоскопическая трансназальная аденомэктомия (удаление аденомы гипофиза). При синдроме Иценко-Кушинга прибегают к двусторонней адреналэктомии.
Прогноз
Гиперхолестеринемия приводит к отложению ХС на стенках артериальных сосудов, формированию атеросклеротических бляшек, сужению просвета и ухудшению кровоснабжения органов и тканей. Основное клиническое значение это имеет для коронарных и мозговых артерий. Поэтому длительное повышение концентрации холестерина является неблагоприятным прогностическим фактором в отношении сердечно-сосудистых заболеваний и ассоциировано с такими грозными осложнениями как острый инфаркт миокарда и острое нарушение мозгового кровообращения.
Источник
