Пересадка костного мозга при миелодиспластическом синдроме
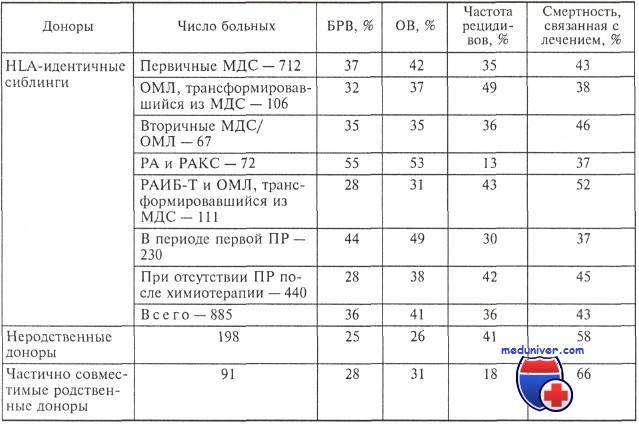
Трансплантация гемопоэтических стволовых клеток (ГСК) при миелодиспластическом синдроме (МДС) — эффективностьНаибольшее распространение в лечении миелодиспластического синдрома получила аллогенная трансплантация гемопоэтических стволовых клеток, которая на сегодняшний день является единственным радикальным методом лечения миелодиспластического синдрома. Однако применение аллогенной трансплантации при миелодиспластическом синдроме в значительной степени ограничивается пожилым возрастом большинства больных (только 25 % больных моложе 60 лет). Так, например, по данным Европейского регистра (ЕВМТ) за 2001 и 2002 гг., аллогенная трансплантация ГСК была проведена 3613 больным ОМЛ, в то время как при МДС этот показатель составил 1121 больных. Впервые аллогенная трансплантация костного мозга при МДС была проведена в 1984 г.. При анализе результатов аллогенной трансплантации костного мозга первым 250 больным МДС от полностью совместимых или частично совместимых родственных и неродственных доноров установлено, что 5-летняя безрецидивная выживаемость, по данным расчетов за разные временные интервалы, составила от 32,4 до 39,1 %, вероятность развития рецидивов в течение 5 лет — от 14,1 до 24 %, вероятность летальных исходов, не связанных с рецидивами в течение 5 лет, — от 38,7 до 47 %. Как показал целый ряд исследований, наилучшие результаты трансплантации достигаются в тех случаях, когда донором является полностью HLA-совместимый (HLA-идентичный) сиблинг (родные сестра или брат). Результаты применения аллогенной трансплантации гемопоэтических стволовых клеток (данные ЕВМТ) приведены в таблице. В другом крупном исследовании проведение трансплантации костного мозга от HLA-идентичных сиблингов 452 больным миелодиспластическими синдромами продемонстрировало, что 1- и 3-летняя БРВ в общей группе составили 53 и 40 %. При РА и РАКС этот показатель составил 45 %, при РАИБ и РАИБ-Т — 33 %. У больных РАИБ и РАИБ-Т с числом бласт-ных клеток менее 5 % к моменту трансплантации (после достижения ремиссии в результате предшествующего лечения) 3-летняя БРВ была достоверно выше по сравнению с группой с числом бластных клеток 5 % и более (55 и 26 %, р = 0,0007). БРВ, ОВ, смертность, связанная с трансплантацией, и частота рецидивов к 1 и 3 годам наблюдения составили 53 и 40 %, 54 и 42 %, 32 и 37 %, 17 и 23 % соответственно. Результаты аллогенной трансплантации гемопоэтических стволовых клеток больным МДС и ОМЛ, трансформировавшимся из МДС к 3 годам наблюдения
Аллогенная трансплантации гемопоэтических стволовых клеток также позволяет получить наилучшие результаты по сравнению с другими методами лечения при вторичных МДС и ОМЛ. По данным R. P. Witherspoon и соавт., 6-летняя ОВ составила 13 %. В зависимости от варианта заболевания ОВ составила при РА+РАКС (12 больных) 33 %, при РАИБ (18 больных) — 20 %, при РА-ИБ-Т+ОМЛ (15 и 52 больных) — 8 %. Как видно из изложенных данных, аллогенная трансплантация гемопоэтических стволовых клеток сопровождается высокой частотой летальных исходов, не связанных с рецидивами МДС, что может быть обусловлено высокой токсичностью стандартных миелоаблативных режимов кондиционирования. Для ее уменьшения наряду с некоторыми модификациями миелоаблативных режимов используются немиелоаблативные режимы (так называемая мини-трансплантация). Последние также позволяют осуществить аллогенную трансплантацию больным более старшего возраста. Сравнение результатов применения миелоаблативного (26 больных) и немиелоаблативного (20 больных) режимов кондиционирования показало меньшую частоту смертей в раннем посттрансплантационном периоде (в течение 100 дней после трансплантации) — 23 и 5 % соответственно. Трехлетняя общая выживаемость составила 54 и 49 %. A. Y. Но и соавт. использовали в качестве режима кондиционирования флударабин, бусульфан и кэмпас-1Н (Campath-1H). Аллогенная трансплантация гемопоэтических стволовых клеток проводилась от совместимых сиблингов и неродственных доноров 62 больным МДС в возрасте от 40 до 71 года (средний возраст 56 лет). Смертность, не связанная с рецидивами, к 100, 200 и 360 дням составила 0, 5 и 5 % соответственно при трансплантации гемопоэтических стволовых клеток от сиблингов и 11, 17 и 21 % — от неродственных доноров. ОВ и БРВ к 1 году наблюдения при трансплантации ГСК от сиблингов составила 73 и 61 %, от неродственных доноров — 71 и 59 %. Негативные факторы прогноза при проведении аллогенной трансплантации гемопоэтических стволовых клеток больным миелодиспластическими синдромами (МДС)
Обобщая результаты аллогенной трансплантации гемопоэтических стволовых клеток больным миелодиспластическими синдромами, D. Milojkovic и G. J. Mufti указывают на факторы, отрицательно влияющие на ее результаты. Применение аутологичной трансплантация костного мозга и периферических стволовых клеток (ПСК) у больных в полной ремиссии после интенсивной химиотерапии менее распространено и проводится в рамках клинических исследований. Аутологичная трансплантация ГСК рассматривается в качестве альтернативного метода лечения при невозможности проведения аллогенной трансплантации. Одной из основных проблем, связанных с аутологичной трансплантацией, является высокий риск рецидивов вследствие контаминации реинфузируемых гемопоэтических стволовых клеток опухолевыми клетками, а также с сохраняющейся у пациента остаточной болезнью. По данным Т. De Witte и соавт., при проведении аутологичной трансплантации гемопоэтических стволовых клеток 126 больным МДС и ОМЛ, трансформировавшимся из МДС, во время первой полной ремиссии 3-летняя БРВ, ОВ, смертность, связанная с лечением, и частота рецидивов составили 33, 38, 25 и 55 % соответственно. Достоверно худшие результаты были получены при проведении аутологичной трансплантации во время второй и последующей ремиссий. Указанные выше показатели составили 18, 14, 51 и 64 %. Как показало многоцентровое исследование EORTC по сравнению результатов аутологичной трансплантации ГСК и аллогенной от HLA-идентичного сиблинга, проведенной на постконсолидационном этапе лечения, достоверных различий по актуриальной 4-летней выживаемости и бессобытийной выживаемости не было. Эти показатели составили 33,3 и 23,1 % при проведении аллогенной трансплантации и 39 и 21,5 % — при аутологичной трансплантации. Показания к трансплантации гемопоэтических стволовых клеток
Полученные данные указывают, во-первых, на преимущества «интенсивной» консолидационной терапии, во-вторых, на преимущества аллогенной трансплантации и, в-третьих, на более удовлетворительные отдаленные результаты терапии при проведении аутологичной трансплантации по сравнению с использованием курсовой химиотерапии. При этом следует иметь в виду, что неоправданное использование интенсивной, равно как и стандартной химиотерапии может не только ухудшить качество жизни больного, но и привести к тяжелым, угрожающим жизни осложнениям. Гематологами из Англии предложены рекомендации по лечению больных миелодиспластическими синдромами <65 лет, в которых излагаются показания к разным видам трансплантации гемопоэтических стволовых клеток. По мнению авторов, трансплантация гемопоэтических стволовых клеток не показана больным с благоприятным и промежуточным-1 прогнозом по шкале IPSS со стабильным течением заболевания и отсутствием родственного донора [294], однако и это положение не является общепринятым. Так, например, гематологи из Германии считают целесообразным проведение аллогенной трансплантации всем больным миелодиспластическими синдромами симости от группы прогноза и характера течения заболевания. Необходимость проведения аллогенной трансплантации гемопоэтических стволовых клеток больным с благоприятным прогнозом, особенно в старших возрастных группах при удовлетворительном качестве жизни остается нерешенной проблемой. Еще одну проблему представляет этап лечения больных, на котором следует проводить аллогенную трансплантацию гемопоэтических стволовых клеток. Несмотря на убедительные данные, указанные выше, о целесообразности проведения трансплантации в периоде первой полной ремиссии, имеются сообщения об отсутствии достоверных преимуществ этой лечебной тактики. В исследовании Т. J. Nevill и соавт. больные миелодиспластическими синдромами (МДС) острыми миелоидныными лейкозами, трансформировавшимся из миелодиспластических синдромов, были разделены на 2 группы: получавшие и не получавшие химиотерапию перед аллогенной трансплантацией ГСК. Пятилетняя бессобытийная выживаемость, частота рецидивов и смертельных исходов, не связанных с рецидивами, в первой группе составили 36, 39 и 41 %. Эти показатели были выше во второй группе (24, 45, 56 %), однако достоверные различия отсутствовали. Рекомендации ЕВМТ по проведению трансплантации у больных МДС
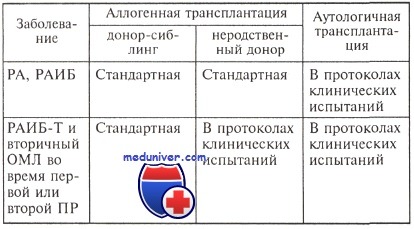
У больных, которым перед трансплантацией проводилась химиотерапия и была получена ПР, бессобытийная выживаемость составила 72 %, у больных, резистентных к химиотерапии или во время первого рецидива, — 12 % (р = 0,001). Результаты лечения миелодиспластических синдромов у детей (на небольшой группе больных) также не продемонстрировали преимущества проведения химиотерапии перед аллогенной трансплантацией. Пятилетняя бессобытийная выживаемость у больных, получавших и не получавших химиотерапию, составила 43 и 59 % соответственно. Таким образом, с одной стороны, проведение химиотерапии может увеличить время на поиск донора и при достижении ПР получить достаточно удовлетворительные результаты трансплантации гемопоэтических стволовых клеток, с другой — при резистентном течении миелодиспластического синдрома результаты трансплантации значительно ухудшаются. Кроме того, при использовании химиотерапии вероятность получения ПР в большинстве случаев не превышает 60 % и сопровождается достаточно высокой токсичностью, что может повлиять на более поздние сроки проведения трансплантации и увеличить риск развития рецидива. При всем разнообразии мнений по проблеме трансплантации гемопоэтических стволовых клеток аллогенная трансплантация, согласно рекомендациям Европейской группы исследователей — ЕВМТ (2002), рассматривается как оптимальный метод лечения МДС у взрослых (старше 16 лет), если она осуществляется при ранних вариантах заболевания или во время ПР, полученной после химиотерапии. Вопрос о роли аутологичной трансплантации во время ПР продолжает обсуждаться. К общим положениям (касающимся не только миелодиспластических синдромов (МДС)) относятся: максимальный возраст больных, который не должен превышать 65 лет при аутологичной трансплантации, 60 — при аллогенной от HLA-идентичного сиблинга и 50 — при аллогенной трансплантации от неродственного донора. В случае использования немиелоаблативных режимов кондиционирования возрастные границы увеличиваются до 70 лет. Группа ЕВМТ рекомендует проведение немиелоаблативной аллогенной трансплантации в рамках клинических исследований. В связи с недостаточными данными о преимуществах и недостатках трансплантации гемопоэтических стволовых клеток выделены 4 категории этого вида лечения: стандартная, в протоколах клинических испытаний, на стадии разработки и нерекомендуемая. Предложения ЕВМТ указаны в таблице. — Также рекомендуем «Программы дифференцированной терапии миелодиспластического синдрома (МДС) — эффективность» Оглавление темы «Химиотерапия миелодиспластических синдромов (МДС)»:
|
Источник
Миелодиспластический синдром – группа гематологических заболеваний, при которых наблюдаются цитопения, диспластические изменения костного мозга и высокий риск возникновения острого лейкоза. Характерные симптомы отсутствуют, выявляются признаки анемии, нейтропении и тромбоцитопении. Диагноз устанавливается с учетом данных лабораторных анализов: полного анализа периферической крови, гистологического и цитологического исследования биоптата и аспирата костного мозга и т. д. Дифференциальный диагноз может представлять значительные затруднения. Лечение – переливание компонентов крови, химиотерапия, иммуносупрессивная терапия, пересадка костного мозга.
Миелодиспластический синдром
Миелодиспластический синдром – группа заболеваний и состояний с нарушениями миелоидного кроветворения и высоким риском развития острого лейкоза. Вероятность развития увеличивается с возрастом, в 80% случаев данный синдром диагностируется у людей старше 60 лет. Мужчины страдают несколько чаще женщин. У детей миелодиспластический синдром практически не встречается. В последние десятилетия гематологи отмечают увеличение заболеваемости среди лиц трудоспособного возраста. Предполагается, что причиной «омоложения» болезни могло стать существенное ухудшение экологической обстановки.
До недавнего времени лечение миелодиспластического синдрома было только симптоматическим. Сегодня специалисты разрабатывают новые методы терапии, однако эффективное лечение этой группы болезней все еще остается одной из самых сложных проблем современной гематологии. Пока прогноз при миелодиспластическом синдроме, в основном, зависит от особенностей течения болезни, наличия или отсутствия осложнений. Лечение осуществляют специалисты в сфере онкологии и гематологии.
Причины и классификация миелодиспластического синдрома
С учетом причин развития различают два типа миелодиспластического синдрома: первичный (идиопатический) и вторичный. Идиопатический вариант выявляется в 80-90% случаев, диагностируется преимущественно у пациентов старше 60 лет. Причины возникновения установить не удается. В числе факторов риска первичного миелодиспластического синдрома – курение, повышенный уровень радиации при выполнении профессиональных обязанностей или проживании в неблагоприятной экологической зоне, частый контакт с бензином, пестицидами и органическими растворителям, некоторые наследственные и врожденные заболевания (нейрофиброматоз, анемия Фанкони, синдром Дауна).
Вторичный вариант миелодиспластического синдрома наблюдается в 10-20% случаев, может возникать в любом возрасте. Причиной развития становится химиотерапия или радиотерапия по поводу какого-то онкологического заболевания. В число лекарственных средств с доказанной способностью вызывать миелодиспластический синдром включают циклофосфан, подофиллотоксины, антрациклины (доксорубицин) и ингибиторы топоизомеразы (иринотекан, топотекан). Вторичный вариант отличается более высокой резистентностью к лечению, более высоким риском развития острого лейкоза и более неблагоприятным прогнозом.
В современной редакции классификации ВОЗ различают следующие типы миелодиспластического синдрома:
- Рефрактерная анемия. Сохраняется более полугода. В анализе крови бласты отсутствуют либо единичные. В костном мозге дисплазия эритроидного ростка.
- Рефрактерная анемия с кольцевыми сидеробластами. Сохраняется более полугода. В анализе крови бласты отсутствуют. В костном мозге дисплазия эритроидного ростка.
- Рефрактерная цитопения с многолинейной дисплазией. В анализе крови тельца Ауэра отсутствуют, бласты отсутствуют либо единичные, выявляются панцитопения и увеличение количества моноцитов. В костном мозге диспластические изменения менее 10% клеток в 1 миелоидной клеточной линии, бластов менее 5%, телец Ауэра нет.
- Рефрактерная анемия с избытком бластов-1. В анализе крови тельца Ауэра отсутствуют, бластов более 5%, цитопения и увеличение количества моноцитов. В костном мозге дисплазия одной либо нескольких клеточных линий, бластов 5-9%, телец Ауэра нет.
- Рефрактерная анемия с избытком бластов-2. В анализе крови увеличение количества моноцитов, цитопения, бластов 5-19%, могут выявляться тельца Ауэра. В костном мозге дисплазия одной либо нескольких клеточных линий, бластов 10-19%, обнаруживаются тельца Ауэра.
- Неклассифицируемый миелодиспластический синдром. В анализе крови цитопения, бласты отсутствуют либо единичные, тельца Ауэра отсутствуют. В костном мозге дисплазия одного мегакариоцитарного либо гранулоцитарного ростка, бластов более 5%, тельца Ауэра отсутствуют.
- Миелодиспластический синдром, ассоциированный с изолированной делецией 5q. В анализе крови анемия, бластов более 5%, возможен тромбоцитоз. В костном мозге более 5% бластов, тельца Ауэра отсутствуют, изолированная делеция 5q.
Симптомы миелодиспластического синдрома
Клиническая симптоматика определяется степенью нарушений миелопоэза. При мягко протекающих расстройствах возможно длительное бессимптомное или стертое течение. Из-за слабой выраженности клинических проявлений некоторые больные не обращаются к врачам, и миелодиспластический синдром обнаруживается во время проведения очередного медицинского осмотра. При преобладании анемии наблюдаются слабость, одышка, плохая переносимость физических нагрузок, бледность кожных покровов, головокружения и обморочные состояния.
При миелодиспластическом синдроме с тромбоцитопенией возникает повышенная кровоточивость, отмечаются десневые и носовые кровотечения, на коже появляются петехии. Возможны подкожные кровоизлияния и меноррагии. Миелодиспластический синдром с выраженными нейтропенией и агранулоцитозом проявляется частыми простудами, стоматитом, синуситом или стрептодермией. В тяжелых случаях возможно развитие пневмонии или сепсиса. Инфекционные заболевания нередко вызываются грибками, вирусами или условно-патогенными микробами. У каждого пятого пациента с миелодиспластическим синдромом выявляется увеличение лимфоузлов, селезенки и печени.
Диагностика миелодиспластического синдрома
Диагноз выставляется с учетом данных лабораторных исследований: анализа периферической крови, биопсии костного мозга с последующим цитологическим исследованием, цитохимических и цитогенетических тестов. В анализе периферической крови больных миелодиспластическим синдромом обычно обнаруживается панцитопения, реже выявляется дву- или одноростковая цитопения. У 90% пациентов наблюдается нормоцитарная либо макроцитарная анемия, у 60% — нейтропения и лейкопения. У большинства больных миелодиспластическим синдромом отмечается тромбоцитопения.
При исследовании костного мозга количество клеток обычно нормальное либо повышенное. Уже на ранних стадиях обнаруживаются признаки дизэритропоэза. Количество бластов зависит от формы миелодиспластического синдрома, может быть нормальным либо увеличенным. В последующем наблюдаются дисгранулоцитопоэз и дисмегакариоцитопоэз. У некоторых больных признаки дисплазии костного мозга выражены очень слабо. В процессе цитогенетического исследования у ¾ больных выявляются хромосомные нарушения. Дифференциальный диагноз миелодиспластического синдрома проводят с В12-дефицитной анемией, фолиево-дефицитной анемией, апластической анемией, острым миелолейкозом и другими острыми лейкозами.
Лечение и прогноз при миелодиспластическом синдроме
Тактика лечения определяется выраженностью клинической симптоматики и лабораторных изменений. При отсутствии явных признаков анемии, геморрагического синдрома и инфекционных осложнений осуществляется наблюдение. При миелодиспластическом синдроме с выраженной анемией, тромбоцитопенией и нейтропенией, а также при высоком риске возникновения острого лейкоза назначают сопроводительную терапию, химиотерапию и иммуносупрессивную терапию. При необходимости осуществляют пересадку костного мозга.
Сопроводительная терапия является самым распространенным методом лечения миелодиспластического синдрома. Предусматривает внутривенные инфузии компонентов крови. При длительном применении может провоцировать повышение уровня железа, влекущее за собой нарушения деятельности жизненно важных органов, поэтому переливания гемокомпонентов производят при одновременном приеме хелаторов (лекарственных средств, связывающих железо и способствующих его выведению).
Иммуносупрессоры эффективны при лечении миелодиспластического синдрома с отсутствием хромосомных аномалий, наличием гена HLA-DR15 и гипоклеточном костном мозге. Химиотерапию применяют при невозможности трансплантации костного мозга. Высокие дозы препаратов используют при трансформации миелодиспластического синдрома в острый лейкоз, а также при рефрактерных анемиях с избытком бластов при нормоклеточном и гиперклеточном костном мозге, низкие – при невозможности пересадки костного мозга. Наряду с перечисленными средствами пациентам назначают гипометилирующие средства (азацитидин). Наиболее надежным способом достижения полноценной длительной ремиссии является трансплантация костного мозга.
Прогноз зависит от типа миелодиспластического синдрома, количества хромосомных аномалий, необходимости в регулярных переливаниях компонентов крови, выраженности клинических проявлений и наличия осложнений. Различают 5 групп риска. Средняя выживаемость больных миелодиспластическим синдромом, входящих в группу с самым низким уровнем риска, составляет более 11 лет; с самым высоким – около 8 месяцев. Вероятность отторжения костного мозга после трансплантации – около 10%.
Источник