Патогенез двс синдрома по стадиям
Синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) представляет собой приобретенное расстройство гемостаза, при котором одновременно или последовательно наблюдается массивное микротромбообразование, избыточное потребление факторов свертывания, активация фибринолиза и кровоточивость. ДВС-синдром — неспецифический синдром, развивающийся как осложнение основного заболевания-индуктора, если по каким-то причинам активируется система коагуляции.
Причинами первоначального тромбообразования является чрезмерная активация свертывающей системы на фоне повреждения эндотелия или массивного выброса тромбопластина в следующих ситуациях:
- инфекции (сепсис, септический шок, вызванный грам-отрицательными возбудителями, тяжелые вирусные инфекции, СПИД);
- шок (анафилактический, септический, травматический, кардиогенный и др.) или аноксия;
- острый внутрисосудистый гемолиз (отравления гемолитическими ядами, трансфузия несовместимой крови);
- онкологические процессы — лейкозы, парапротеинемии, диссеминированные формы рака, аденома простаты;
- хирургическое вмешательство — травматичные операции, трансплантации органов, использование искусственного кровообращения;
- акушерская патология — эмболия околоплодными водами, преждевременная отслойка плаценты, атонические маточные кровотечения, антенатальная гибель плода, септический аборт, тяжелые формы гестоза;
- иммунные патологии — системная красная волчанка, ревматоидный артрит, геморрагические васкулиты, диффузный гломерулонефрит;
- ожоги.
Под действием тромбина происходит образование не только фибрина из фибриногена, но и растворимых комплексов мономеров фибрина. Гиперкоагуляция ведет к чрезмерному потреблению прокоагулянтов (тромбоциты, фибриноген, факторы свертывания) и местной или системной активации фибринолиза. При взаимодействии плазмина с фибрином и фибриногеном образуются продукты деградации фибрина, D-димеры. Избыточный фибринолиз приводит к разрушению не только фибриновых тромбов, но и к инактивации факторов свертывания.
Общая схема взаимодействия свертывающей и фибринолитической систем в условиях ДВС-синдрома представлена на рисунке 1.
Рис. 1. Схема образования фибриногена и продуктов паракоагуляции при ДВС-синдроме
М. С. Мачабели (1970, 1981) предложена следующая патогенетическая классификация стадий тромбогеморрагического синдрома.
I. Стадия гиперкоагуляции и тромбообразования (характеризующаяся поступлением в кровоток тромбопластина);
II. Стадия нарастающей коагулопатии потребления с усилением фибринолитической активности;
III. Дефибринационно-фибринолитическая стадия (характеризующаяся глубокой гипокоагуляцией, вплоть до полной несвертываемости крови и выраженной тромбоцитопении);
IV. Восстановительная стадия или стадия остаточных тромбозов и блокад (характеризуется восстановлением фибриногена и других факторов свертывания крови).
Этиологически выделяют:
- Тромбогеморрагические синдромы с преобладанием активации гемостаза по внешней схеме (попадание тканевого тромбопластина в кровоток извне: патология отслойки плаценты, эмболия околоплодными водами и другая акушерская патология);
- Тромбогеморрагические синдромы с активацией по внутренней схеме (фосфолипидная активация — гестозы/антифосфолипидный синдром, иммунноконфликтная беременность);
- Тромбогеморрагические синдромы, связанные с развитием острого или хронического васкулита (связанные с бактериемией — хорионамнионит, эндометрит; аллергические реакции).
Наиболее удобна, на наш взгляд, клиническая классификация, предложенная В. Г. Лычевым (1998). Выделяются следующие стадии ДВС-синдрома:
I. Гиперкоагуляции;
II. Нормокоагуляции;
III. Гипокоагуляции;
IV. Исхода.
По клиническому течению различают 2 варианта развития ДВС-синдрома — острый, с преобладанием геморрагических проявлений и подострый (хронический) без выраженных клинических проявлений, диагностируемый в основном по лабораторным тестам, выявляющим повышенное потребление факторов свертывания и тенденцию к тромбообразованию.
ДВС-синдром является неспецифичным и универсальным синдромом, однако острота и выраженность синдрома зависят от тяжести исходной патологии. Так, острое течение с тяжелыми геморрагическими проявлениями характерно для септического шока, эмболии околоплодными водами, выброса плацентарного тромбопластина в родах или при кесаревом сечении, гемотрансфузионных осложнений; подострое течение наблюдается при ряде гнойно-септических осложнений, иммуннокомплексной патологии; хронический ДВС-синдром типичен для компенсированного течения гестозов.
Клиническая картина ДВС-синдрома складывается, с одной стороны, из проявлений геморрагического и тромботического характера в зависимости от течения и стадии синдрома, с другой, включает проявления полиорганной недостаточности, развившейся на фоне нарушений свертывания и микроциркуляции.
В некоторых источниках проводится параллель между ДВС-синдромом, синдромом системного воспалительного ответа и синдромом полиорганной дисфункции (А. А. Рагимов, Л. А. Алексеева, 1999).
Все же, учитывая разнообразие клинических проявлений этой патологии, основную роль в диагностике ДВС-синдрома играют лабораторные методы. Кроме того, начало лечения на доклинической стадии, не дожидаясь развернутой манифестации этого грозного состояния, оставляет значительно больше шансов на благополучный исход.
Лысенков С.П., Мясникова В.В., Пономарев В.В.
Неотложные состояния и анестезия в акушерстве. Клиническая патофизиология и фармакотерапия
Опубликовал Константин Моканов
Источник
Сюжет Пандемия коронавируса нового типа, распространившегося из Китая
Коронавирусная инфекция COVID-19 может вызывать осложнение в виде синдрома диссеминированного внутрисосудистого свертывания (ДВС-синдром). В связи с этим Комитет Госдумы по охране здоровья планирует направить в Минздрав предложение о корректировке клинических рекомендаций по лечению пациентов с коронавирусной инфекцией.
Что такое ДВС-синдром?
Синдром диссеминированного внутрисосудистого свертывания — это универсальное неспецифическое нарушение системы гемостаза (функциональная система организма, позволяющая поддерживать жидкое состояние крови, а также предупреждающая и тормозящая кровотечения; она обеспечивает устойчивость основных физиологических функций). Нарушение характеризуется внутрисосудистым свертыванием крови и образованием в ней множества микросгустков фибрина и скоплений клеток крови: тромбоцитов и эритроцитов. Эти клетки оседают в капиллярах органов, в результате чего в них возникают глубокие микроциркуляторные и дистрофические нарушения.
Согласно Справочнику фельдшера, во время ДВС-синдрома активируются свертывающая и фибринолитическая системы (растворяет тромбы и сгустки крови), после чего наступает их истощение. В тяжелых случаях это приводит к полной несвертываемости крови.
В медицинских источниках этот патологический процесс также называют коагулопатией потребления, тромбогеморрагическим синдромом (ТГС), синдромом рассеянного внутрисосудистого свертывания (РВС), гиперкоагуляционным синдромом.

Из-за чего возникает ДВС-синдром?
Медикам известно огромное количество причин, способных вызвать у больного развитие ДВС-синдрома. По данным Справочника фельдшера, его развитие неизбежно или высоковероятно при акушерской патологии (предлежание плаценты, преждевременная отслойка плаценты, закупорка сосудов матки околоплодными водами, внутриутробная смерть плода), сепсисе, деструктивных процессах в печени, почках, при панкреатите.
ДВС-синдром возникает во время шока любого происхождения (геморрагический, травматический, ожоговый, анафилактический и т. д.). При этом степень тяжести синдрома прямо пропорциональна выраженности и продолжительности шокового состояния. Этот синдром также развивается при остром внутрисосудистом гемолизе (разрушение клеток внутри кровеносных сосудов), в том числе при несовместимых переливаниях крови, которые не подходят больному по групповой принадлежности.
Согласно Медицинскому справочнику, ДВС-синдром также могут вызывать оперативные вмешательства, ставшие особо травматичными для больного. Например, операции при злокачественных новообразованиях, на паренхиматозных органах (почки, печень, легкие, селезенка, поджелудочная железа, щитовидная железа), с использованием аппарата искусственного кровообращения (АИК) а также внутрисосудистые вмешательства.
Его вызывают опухоли, особенно гемобластозы, лейкозы, рак легкого, печени, поджелудочной, предстательной железы, почки. ДВС-синдром возникает при иммунных и иммунокомплексных болезнях (в том числе при системной красной волчанке, ревматизме, ревматоидном артрите с висцеральными поражениями и пр.).
ДВС-синдром учащают кровотечения, коллапс, переливания большого объема крови. Этот патологический процесс может возникать на фоне аллергических реакций, отравления змеиными ядами, лечения определенными препаратами.

Как протекает ДВС-синдром и какие у него симптомы?
ДВС-синдром может протекать как в острой форме — при всех видах шока и терминальных состояниях, так и иметь затяжное, волнообразное течение. Его клиническая картина включает симптомы основного заболевания, послужившего его причиной, признаки развившегося шока (при острых формах), глубокие нарушения системы гемостаза, возникновение тромбозов и кровотечений, анемию (снижение в крови красных телец), нарушения функций в органах, нарушения метаболизма.
ДВС-синдром имеет четыре стадии (или фазы) протекания. На первой агрегантные свойства тромбоцитов повышаются, что приводит к распространенному свертыванию крови и образованию множественных тромбов в сосудах различных органов. Из-за образования тромбов в большом количестве расходуются факторы свертывания и наступает переходная стадия, во время которой нарастает коагулопатия (нарушение свертываемости крови) и тромбоцитопения — количество тромбоцитов в периферической крови сильно снижается, в результате чего повышается кровоточивость и замедляется процесс остановки кровотечений из мелких сосудов. Также во время переходной фазы могут происходить сдвиги в свертываемости крови как в сторону гипер-, так и в сторону гипокоагуляции.
Первая фаза — гиперкоагуляции и микротромбозов — может быть кратковременной при остром ДВС-синдроме или протекать скрыто, из-за чего патология может сразу проявиться в виде кровотечений.
На третьей стадии возникает глубокая гипокоагуляция, способность крови к свертыванию может полностью утрачиваться. Последняя стадия — восстановительная. В случае неблагоприятного течения синдрома на последней стадии возникают различные осложнения, которые в большинстве случаев приводят к летальному исходу.

Как лечат ДВС-синдром?
Больные с синдромом диссеминированного внутрисосудистого свертывания проходят лечение в отделениях реанимации либо в палатах интенсивной терапии. Они нуждаются в интенсивном наблюдении и лечении, во время которого специалисты следят за эффективностью дыхания и кровообращения, проводят частые повторные лабораторные исследования.
Терапия ДВС-синдрома комплексная. Во-первых, врачи проводят лечение, направленное на устранение причины синдрома. Например, при сепсисе назначается антибактериальная терапия, при акушерской и гинекологической патологии применяются радикальные меры (экстирпация матки, кесарево сечение и т. д.).
Пациенту назначают противошоковую терапию, а также лечение, направленное на поддержание необходимого объема циркулирующей крови. Для этого показано переливание свежезамороженной плазмы с гепарином, которая содержит все факторы свертывания. Параллельно с медикаментозным лечением, направленным на восстановление системы гемостаза, врачи ведут борьбу с полиорганной недостаточностью. Пациенту может потребоваться поддержка функций легких, почек, желудочно-кишечного тракта, надпочечников и других органов.
Оставить
комментарий (0)
Источник
Диссеминированное внутрисосудистое свертывание (ДВС) ㅡ клинико-патологический синдром, осложняющий течение различных заболеваний. ДВС характеризуется системной активацией патологических путей, приводящей к нарушению регуляции коагуляции; проявляется образованием фибриновых сгустков с последующей органной дисфункцией и сопутствующим потреблением тромбоцитов и факторов свертывания, клинически проявляющимся кровотечениями.
Смертность от ДВС за последние годы значительно снизилась. По данным министерства здравоохранения Японии, смертность от ДВС упала с 65 % в 1998 году до 46 % в 2010 и 2012 годах, такая же тенденция наблюдается и в США (с 76 до 51 % между 2006 и 2010 годами). Данное снижение смертности обусловлено более глубоким пониманием патогенеза заболевания, улучшением ранней диагностики и применением новых протоколов лечения ДВС.
Этиология
ДВС часто развивается на фоне сепсиса либо инфекции (30–51 %), травмы (черепно-мозговая травма, ожоги, жировая эмболия) или больших оперативных вмешательств (45 %). Другими причинами ДВС могут быть деструкция органов (тяжелый панкреатит), злокачественный процесс, тяжелые акушерские патологии (эмболия амниотической жидкостью, отслойка плаценты, тяжелая преэклампсия, послеродовое кровотечение), фульминантная печеночная недостаточность, цирроз печени, тяжелые токсические или иммунологические реакции (отравление ядами змей, переливание несовместимой крови, отторжение трансплантата), сосудистые заболевания (гемангиомы, аневризмы аорты, синдром Казабаха-Мерритта).
Патофизиология ДВС
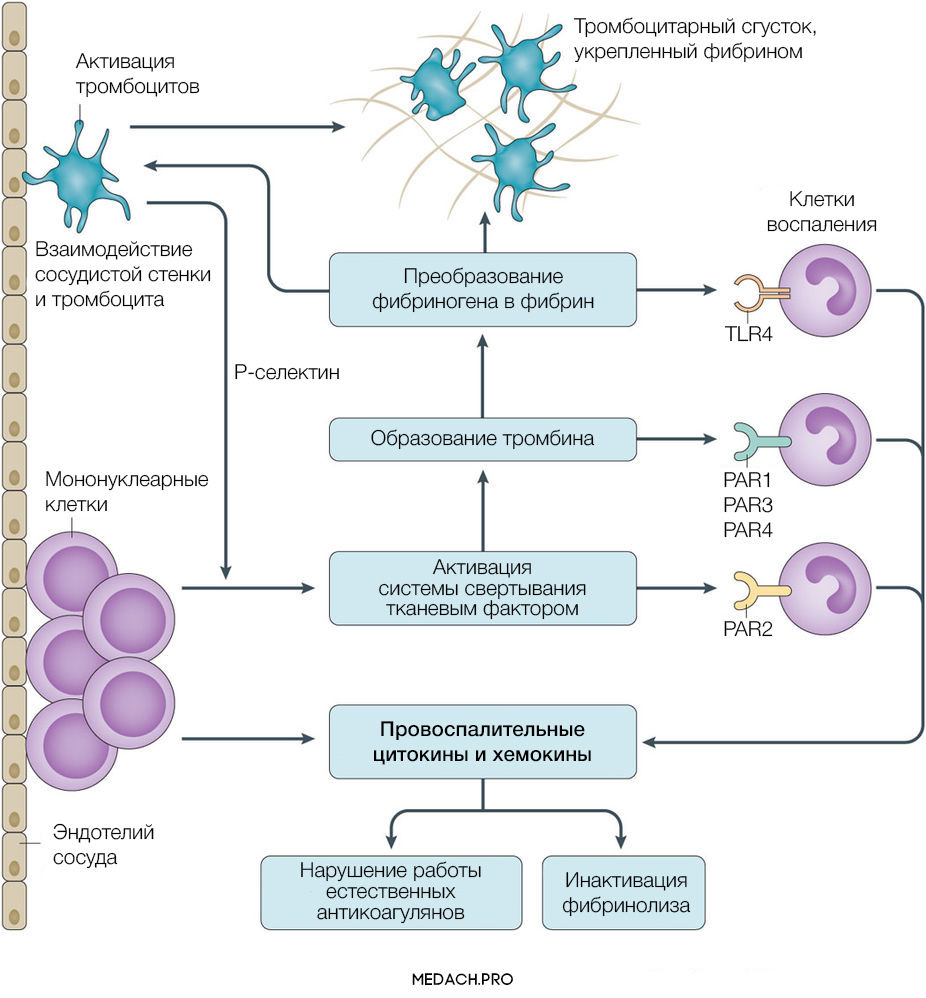
К развитию ДВС приводит нарушение регуляции противосвертывающей и свертывающей систем крови. Формирование фибринового сгустка является продуктом целого каскада реакций, в которых задействованы как факторы свертывания, так и клеточные элементы. Выделяют внутренний и внешний пути активации коагуляции. Инициация процесса свертывания при ДВС зачастую начинается с попадания в кровоток тканевого фактора ― фактора VII (внешний путь) (рис. 1).
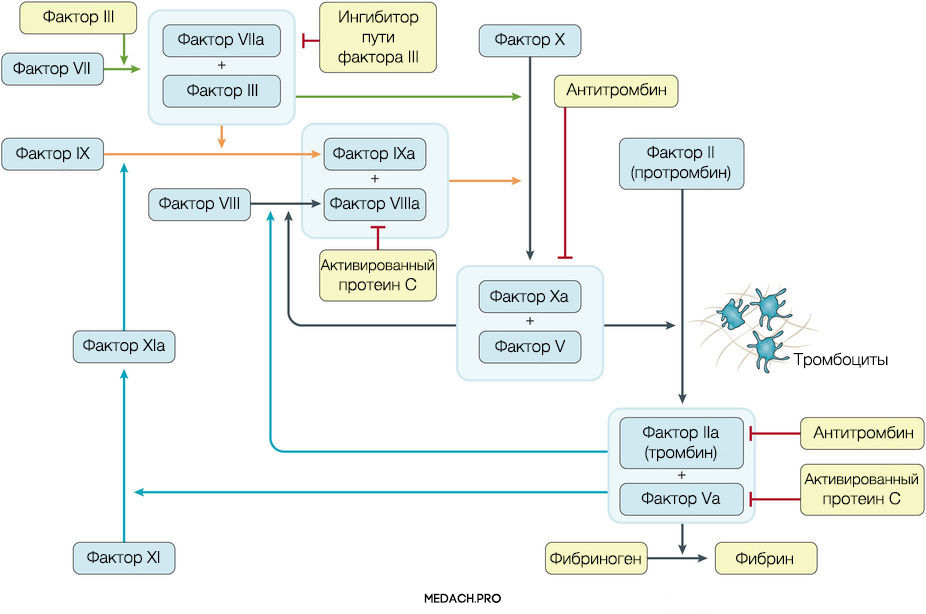
Рисунок 1 | Инициация процесса свертывания при ДВС зачастую начинается с попадания в кровоток тканевого фактора ― фактора VII (внешний путь)
Тканевой фактор (ТФ) представляет собой мембрано-ассоциированный гликопротеин, находящийся в субэндотелиальном слое сосудов, в физиологических условиях не контактирующий с кровью. Выброс тканевого фактора могут спровоцировать различные процессы, такие как прямое повреждение сосудов, воспалительные и иммунологические реакции. При сепсисе ТФ непосредственно продуцируется моноцитами, а также выделяется в результате взаимодействия тромбоцитов со стенкой сосудов, что приводит к значительному усилению коагуляции. Выброс провоспалительных цитокинов и хемокинов провоцируется взаимодействием ТФ, тромбина и других факторов коагуляции с воспалительными клетками через специфические протеаза-активируемые рецепторы (PARs) 1–4 типа, а также дополнительно тромбином через Toll-like рецепторы 4 типа (TLR4). Развитие ДВС на фоне онкологических процессов имеет свои особенности, так как некоторые опухоли могут производить прокоагулянтные факторы (тканевой фактор и цистеиновая протеаза фактора X) (рис. 2).

Рисунок 2 | Активация прокоагулянтных факторов в патогенезе ДВС-синдрома
Важное место в процессе свертывания занимает тромбин: он не только участвует в преобразовании фибриногена в фибрин, но также активирует другие факторы и ко-факторы свертывания (факторы VII, IX и XI). Тромбин инициирует скрепление частиц фибриногена в мономеры, а затем и в полимеры. Последующая стабилизация тромба происходит с помощью тромбин-активируемых факторов XIII (фактора XIIIа).
Реакции коагуляции контролируются противосвертывающей системой крови, включающей в себя: антитромбин (блокирует фактор Xa и тромбин), протеин С (протеолитически разрушает Va и VIIIa факторы), ингибитор пути тканевого фактора (ингибирует комплекс тканевой фактор-VIIa фактор).
При сепсис-индуцированном ДВС нарушаются все три компонента противосвертывающей системы. Во-первых, снижается уровень антитромбина в результате нарушения его синтеза в печени, увеличения его клиренса из-за образования протеаза-антитромбинового комплекса, экстраваскулярных потерь из-за повышения проницаемости клеточной стенки и разрушения эстеразой нейтрофилов. В дополнение к этому, в стенке сосудов нарушается синтез протеогликанов, способствующих связи антитромбина с гепарин-сульфатом. Во-вторых, при сепсисе снижается активность протеина С и его кофактора — протеина S, который обладает как антикоагулянтным, так и в некоторой степени противовоспалительным эффектами. В-третьих, нарушается работа системы ингибитора пути активации тканевого фактора (ИПТФ). В норме ИПТФ присутствует на поверхности эндотелия сосудов или циркулирует в крови в связанном с липопротеинами виде. Его роль в развитии ДВС пока плохо изучена.
Повреждение тромбоцитов играет центральную роль в нарушении коагуляции при ДВС. Тромбоциты могут активироваться как напрямую, через провоспалительные медиаторы (фактор активации тромбоцитов), так и опосредованно через тканевой фактор и тромбин. Впоследствии на мембране активированных тромбоцитов происходит фиксация фибрина. Тромбин стимулирует экспрессию на мембране тромбоцитов Т-селектина, который регулирует адгезию тромбоцитов к лейкоцитам и эндотелию сосудистой стенки, а также ускоряет секрецию ТФ мононуклеарами. В дополнение ко всему повреждение эндотелия и взаимодействие тромбоцит-сосудистая стенка вызывает выброс в кровь ультра-больших мономеров фактора фон Виллебранда (vWF). Фактор фон Виллебранда является важным медиатором адгезии тромбоцитов и коагуляции крови, его деградация осуществляется с помощью металлопротеиназы ADAMTS-13. Доказано, что недостаток металлопротеиназы и, вследствие этого, снижение деградации vWF способствует развитию ДВС-синдрома и более тяжелому его течению.
Фенотип ДВС синдрома
Повышенное образование тромбина при ДВС-синдроме приводит к манифестации различных фенотипов, которые не обязательно характеризуются повышенным тромбообразованием. Например, ранняя гиперфибринолитическая (геморрагическая) фаза, вызывающая всплеск продукции тромбина в ранней фазе тяжелой травмы. Через 24–48 часов она сменяется прокоагулянтной (тромботической) фазой, характерной чертой которой является гиперпродукция плазмин-ингибирующего комплекса, приводящая к супрессии активности протеина С. Фенотип ДВС частично зависит от этиологического фактора, но в большей степени обусловлен преобладающим нарушением в регуляции гемостаза организма [2, 3]. Часто наблюдается активация системы свертывания (повышение тромбин-антитромбинового комплекса), однако степень фибринолитической активности (ингибитора активатора плазминогена) варьирует в зависимости от причины (рис. 3).
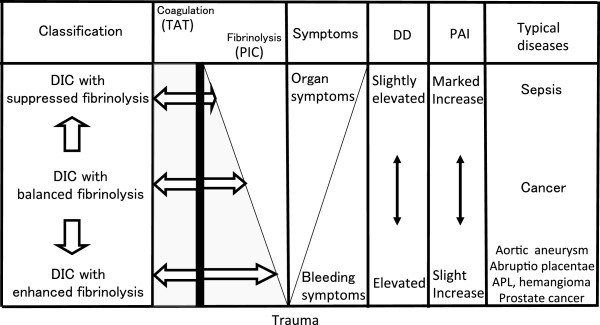
Рисунок 3 | Фенотипы ДВС-синдрома. TAT — комплекс тромбин-антитромбин; PIC — комплекс плазмин-альфа-2-антиплазмин; DD — Д-димер; PAI — ингибитор активатора плазминогена
В столбце «Symptoms» обозначен переход от кровотечений к органному поражению (развитие микро- и макротромбозов). На данном рисунке не обозначены продукты деградации фибрина (ПДФ), тем не менее при гиперфибринолитическом фенотипе ДВС имеется тенденция к преобладанию ПДФ над количеством Д-димеров. При терапии препаратами транс-ретиноевой кислоты при остром промиелоцитарном лейкозе ингибируется экспрессия опухолевыми клетками аннексина II, в результате чего меняется и фенотип ДВС (теряет характеристики гиперфибринолитического, приобретая характеристики прокоагулянтного фенотипа).
Диагностика
Критерии для выявления ДВС-синдрома по шкале ISTH (International Society of Thrombosis and Haemostasis Scoring System):

Рисунок 4 | ISTH (International Society of Thrombosis and Haemostasis Scoring System)
Критерии Japanese Association for Acute Medicine (JAAM):

Рисунок 5 | Japanese Association for Acute Medicine (JAAM)
Данные шкалы отличаются различной чувствительностью в отношении прогнозирования смертности: считается, что шкала JAAM имеет бо́льшую чувствительность к неявному ДВС-синдрому, в результате чего смертность при ДВС-синдроме, выявленном по данной шкале, почти в два раза ниже (около 22%).
Критерии ДВС Japanese Ministry of Health, Labor and Welfare (JMHLW):

Рисунок 6 | Japanese Ministry of Health, Labor and Welfare (JMHLW)
Данные критерии не адаптированы для пациентов с заболеваниями печени или нефротическим синдромом.
На основании представленных выше шкал выставляется диагноз ДВС. Наиболее подходящая шкала выбирается в зависимости от возможности проведения определенных лабораторных тестов и клинической ситуации. При возможности пациенту рекомендуется проводить контроль лабораторных показателей коагуляции каждые 8 часов.
Лечение
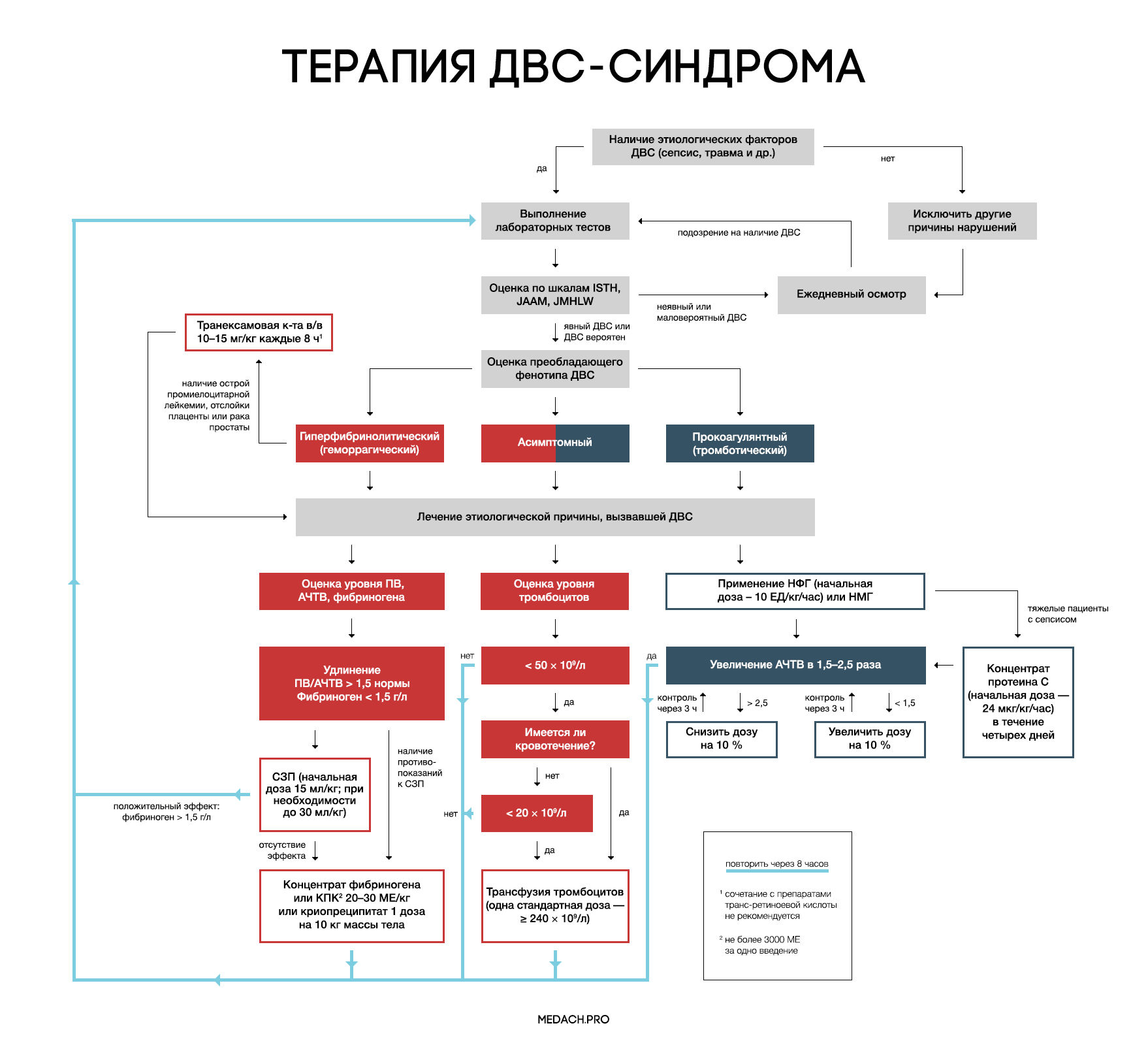
Рисунок 7 | Алгоритм тактики ведения пациентов с ДВС-синдромом (авторская работа Medach)
Терапия этиологического фактора
Главным в терапии ДВС-синдрома является лечение состояния, вызвавшего его развитие. Выделяют два варианта течения ДВС-синдрома:
— Контролируемый ДВС-синдром: характеризуется временным нарушением регуляции коагуляционных механизмов и быстрым восстановлением после ликвидации провоцирующего состояния (трансфузионная реакция, отслойка плаценты). В ряде случаев может разрешаться самостоятельно.
— Неконтролируемый ДВС-синдром (вызван сепсисом или травмой): в этом случае помимо ликвидации основной этиологической причины требуется незамедлительное начало терапии.
Важно отметить, что раннее начало применения препаратов, влияющих на систему свертывания крови (до развития ДВС-синдрома), может в значительной степени нарушить регуляцию гемостаза и, вследствие этого, ухудшить состояние пациента.
Заместительная терапия
Рекомендации по заместительной терапии ДВС сделаны на основании объединения данных гайдлайнов различных сообществ (British Committee for Standards in Haematology (BCSH), Japanese Society of Thrombosis and Hemostasis (JSTH), Italian Society for Thrombosis and Hemostasis (SISET)), занимающихся интенсивной терапией ДВС. При сочетании активного кровотечения или риска его развития и определенных уровней лабораторных показателей рекомендуется применение тромбоцитарной массы, свежезамороженной плазмы (СЗП), криопреципитата или концентрата фибриногена, концентрата протромбинового комплекса (КПК). Все нижеперечисленные рекомендации касаются категории пациентов с активным кровотечением.
Рекомендуется трансфузия тромбоцитов при наличии признаков активного кровотечениями и уровне тромбоцитов < 50 × 10^9 /л либо при отсутствии кровотечения, но наличии высокого риска его развития и уровне тромбоцитов < 20 × 10^9 /л. Трансфузия тромбоцитарной массы начинается с одной стандартной взрослой дозы (более 240 × 10^9/л). Переливание СЗП может применяться при удлинении ПВ/АЧТВ (больше 1,5 от нормы) или снижении уровня фибриногена менее 1,5 г/дл. Начальная доза СЗП составляет 15 мл/кг, при необходимости более жесткой коррекции уровня факторов свертывания допустимо использование дозы 30 мл/кг, однако следует помнить, что такие высокие дозы СЗП могут вызвать перегрузку объемом. КПК или концентрат фибриногена применяются при наличии подтвержденной тяжелой гипофибриногенемии (< 1,5 г/дл), несмотря на использование СЗП либо при наличии противопоказаний к ее применению. При применении 3 грамм концентрата фибриногена уровень фибриногена плазмы крови повышается примерно на 1 г/л. Такой же эффект достигается при переливании 4 единиц СЗП или 2 доз криопреципитата (10 донорских единиц). При планировании у пациентов инвазивных процедур необходимо контролировать уровень лабораторных показателей свертывания крови, и при необходимости превентивно провести трансфузию тромбоцитов или СЗП. Эффективность и безопасность применения рекомбинантного фактора VIIа у пациентов с ДВС требует дальнейшего исследования.
Антикоагулянтная терапия
Применение антикоагулянтов противопоказано при развитии ДВС-синдрома в результате травмы, или при травматическом шоке в сочетании с активным кровотечением. Для использования при ДВС-синдроме с преобладанием тромбозов рекомендуется нефракционированный гепарин (НФГ) или низкомолекулярные гепарины (НМГ). НФГ применяется в начальной дозе 10 ЕД/кг/час под контролем АЧТВ с поддержанием его увеличения в 1,5–2,5 раза от нормы. Необходимо помнить о профилактике тромбоэмболии НФГ или НМГ у тяжелых пациентов без признаков кровотечений. Уровень антитромбина III может частично использоваться для оценки дальнейшей эффективности применения гепарина, но зачастую имеются сложности (высокая стоимость, отсутствие реагентов) при измерении активности антитромбина III. На данный момент крупные исследования о применении НМГ у пациентов с ДВС-синдромом отсутствуют, и возможность профилактики НМГ строится на данных их использования у пациентов хирургического профиля.
Синтетические ингибиторы протеаз (габексата мезилат, нафамостата мезилат) разрешены к использованию в Японии, однако крупные РКИ, показывающие их эффективность при ДВС-синдроме, отсутствуют.
Концентраты антикоагулянтных факторов
Исследования в данном направлении ведутся на протяжении уже многих лет; так, с 1980 года проводятся испытания концентрата антитромбина, однако его эффективность при ДВС-синдроме до сих пор не доказана. На основании предположения, что при ДВС происходит угнетение выработки протеина С, зародилась идея применения активированного протеина С. После проведения больших исследований данный препарат показал эффективность в группах с тяжелой сопутствующей патологией (сепсис). Крупных исследований, сравнивающих эффективность рекомбинантного активированного человеческого протеина С и полученного из плазмы концентрата протеина С, не проводилось. Концентрат протеина С применяется в виде продолжительной инфузии со скоростью 24 мкг/кг/час в течении четырех дней. При необходимости проведения инвазивных процедур введение протеина С прерывается до их выполнения (период полувыведения около 20 минут), а затем возобновляется через несколько часов. При применении протеина С необходимо учитывать повышение рисков кровотечения (2–3,5 %) и внутричерепного кровоизлияния (0,1–0,3 %), а также то, что в исследованиях препарата не участвовали пациенты с тромбоцитопенией ( < 30 x 10^9/л). Для контроля терапии используется АЧТВ. Исследования по применению тифакогина (рекомбинантного ингибитора пути тканевого фактора) не увенчались успехом.
На данный момент имеется ряд исследований по безопасности и эффективности рекомбинантного растворимого человеческого тромбомодулина (rhTM), однако их результаты гетерогенны. Проведенный метаанализ данных исследований показал, что препараты rhTM оказывают положительный эффект на выживаемость в группе тяжелого сепсиса и пациентов с количеством баллов по шкале APACHE II более 24 или по шкале SOFA более 11. На данный момент исследования препаратов rhTM перешли в третью фазу.
Антифибринолитики
При ДВС-синдроме фибринолиз заблокирован повышением уровня ингибитора активатора плазминогена (PAI-1). Следовательно, при кровотечениях, вызванных ДВС-синдромом, применение антифибринолитиков не рекомендуется, за исключением случаев развития гиперфибринолитического фенотипа ДВС, возникшего на фоне острой промиелоцитарной лейкемии, отслойки плаценты или карциномы простаты.
Отличительными лабораторными особенностями гиперфибринолитического фенотипа является наличие повышенного уровня тромбин-антитромбинового комплекса (≥ 20 мкг/л) и плазмин-ингибирующего комплекса (≥ 10 мкг/л), а также снижение активности альфа-2-ингибитора плазмина более чем на 50 %.
При таком фенотипе показано использование транексамовой кислоты в дозе по 1 грамму (10–15 мг/кг) через каждые 8 часов. У пациентов с лейкемией часто проводится лечение препаратами транс-ретиноевой кислоты, но, по данным исследований, ее сочетание с транексамовой кислотой повышает риск развития тромбозов. Данную комбинацию необходимо применять в крайнем случае, при наличии признаков жизнеугрожающего кровотечения.
Источники
Levi M. et al. Guidelines for the diagnosis and management of disseminated intravascular coagulation //British journal of haematology. – 2009. – Т. 145. – №. 1. – С. 24-33.
Gando S., Levi M., Toh C. H. Disseminated intravascular coagulation //Nature Reviews Disease Primers. – 2016. – Т. 2. – С. 16037.
Gando S., Wada H., Thachil J. Differentiating disseminated intravascular coagulation (DIC) with the fibrinolytic phenotype from coagulopathy of trauma and acute coagulopathy of trauma‐shock (COT/ACOTS) //Journal of Thrombosis and Haemostasis. – 2013. – Т. 11. – №. 5. – С. 826-835.
ISTH, International Society on Thrombosis and Haemostasis. Adapted with permission from from Taylor Jr. FB, Toh CH, Hoots WK, et al. Towards Definition, Clinical and Laboratory Criteria, and a Scoring System for Disseminated Intravascular Coagulation. Thromb Haemost 2001; 86: 1327–30.
Gando S, Iba T, Eguchi Y, Ohtomo Y, Okamoto K, Koseki K, Mayumi T, Murata A, Ikeda T, Ishikura H, Ueyama M, Ogura H, Kushimoto S, Saitoh D, Endo S, Shimazaki S, Japanese Association for Acute Medicine Disseminated Intravascular
Coagulation (JAAM DIC) Study Group: A multicenter, prospective validation of disseminated intravascular coagulation diagnostic criteria for critically ill patients: comparing current criteria. Crit Care Med 2006, 34: 625-631.
Kobayashi N. et al. Criteria for diagnosis of DIC based on the analysis of clinical and laboratory findings in 345 DIC patients collected by the Research Committee on DIC in Japan //Disseminated intravascular coagulation. – Karger Publishers, 1983. – Т. 49. – С. 265-275.
Wada H. et al. Guidance for diagnosis and treatment of disseminated intravascular coagulation from harmonization of the recommendations from three guidelines //Journal of thrombosis and haemostasis. – 2013. – Т. 11. – №. 4. – С. 761-767.
Afshari, A., Wetterslev, J., Brok, J. & Moller, A. M. Antithrombin III for critically ill patients. Cochrane Database Syst. Rev. 3, CD005370 (2008).
Abraham, E. et al. Efficacy and safety of tifacogin (recombinant tissue factor pathway inhibitor) in severe sepsis: a randomized controlled trial. JAMA 290, 238–247 (2003).
Asakura H. Classifying types of disseminated intravascular coagulation: clinical and animal models //Journal of intensive care. – 2014. – Т. 2. – №. 1. – С. 20.
Источник
