О синдроме раздраженного кишечника статьи для врачей

В статье представлены результаты исследования, посвященного определению доли пациентов с абдоминальным болевым синдромом и нарушением стула как проявлениями синдрома раздраженного кишечника в общем потоке пациентов, обратившихся за экстренной помощью в дежурный хирургический стационар.

Введение
Согласно определению Всемирной гастроэнтерологической организации, синдром раздраженного кишечника (СРК) — это функциональное рецидивирующее кишечное расстройство, при котором абдоминальный болевой синдром или дискомфорт связаны с актом дефекации, изменениями частоты и характера стула, а также с другими нарушениями опорожнения кишечника [1].
Первое упоминание о СРК относится к 1892 г., когда английский клиницист W. Osler определил основные проявления данного заболевания и обратил внимание на то, что у пациентов с данной патологией чаще всего имеется склонность к истерии и депрессии. W. Osler объединил проявления данной болезни термином «слизистый колит» [2]. В 1930-х гг. в литературе появляется термин «раздраженный кишечник». Также в мировой литературе встречаются следующие термины, описывающие симптомокомплекс, характерный для СРК: кишечная колика, невроз кишечника, спастический колит, синдром раздраженной толстой кишки, невроз кишечника, функциональная колопатия, дискинезия толстой кишки, нервная диарея [3].
В настоящее время СРК выделяют как отдельную нозологическую форму в МКБ-10 (K 58). В данном разделе также отдельно выделяют СРК с диареей (К 58.0), СРК без диареи (К 58.9).
Активно изучаются и обсуждаются на многочисленных гастроэнтерологических форумах патогенетические механизмы формирования СРК. Основная роль отводится висцеральной чувствительности ЖКТ (висцеральная гипералгезия) и нарушению моторики [4]. Также важная роль в формировании данного синдрома принадлежит регуляции со стороны ЦНС — многократно повторяющиеся стрессы сопровождаются нарушением моторики ЖКТ [5]. Многие специалисты рассматривают перенесенные инфекционные заболевания кишечника как возможную причину формирования сенсомоторной дисфункции кишечника и как этиологическую причину развития СРК [6]. Одну из важнейших ролей в формировании СРК отводят психосоциальным факторам: хронический стресс и тревожные расстройства, эмоциональное и физическое насилие [7]. У пациентов с СРК чаще всего выявляется склонность к тревоге, депрессии, истерии, преувеличению собственных симптомов, канцерофобии и т. д. [8].
В настоящее время СРК рассматривается как результат взаимодействия психосоциальных и биологических факторов [9]. Висцеральная гипералгезия, вегетативные и гормональные нарушения, перенесенные инфекции ЖКТ, психологические факторы, нарушения моторики и нервной регуляции ЖКТ в разной степени формируют патогенетическую основу СРК [10].
СРК исключает само понятие «воспаление» — основной морфологический признак колита любой этиологии (язвенного, псевдомембранозного, инфекционного, постлучевого). При СРК отсутствуют какие-либо макроскопические изменения в стенке кишечника. Для колита любой этиологии характерно наличие эрозий и язв в слизистой оболочке кишечника [11]. При гистологическом исследовании выявляются множественные лейкоцитарные инфильтраты, крипт-абсцессы, наложения фибрина. Именно эти различия позволяют на данный момент дифференцировать воспалительные и функциональные раздражения кишечника [12].
Согласно Римским критериям IV пересмотра СРК определяется как функциональное расстройство кишечника, протекающее с повторяющимися болями в животе, которые возникают с периодичностью 1 раз и более в неделю и связаны с 2 из 3 признаков:
с дефекацией;
с изменением частоты дефекации;
с изменением формы стула.
Эти признаки должны проявляться у пациента по меньшей мере последние 3 мес. с общей продолжительностью не менее 6 мес. Для оценки формы стула используется Бристольская шкала стула (Bristol stool scale). Вариант течения СРК устанавливается с учетом частоты актов дефекации (>25%) с измененной консистенцией стула, где 1-й и 2-й типы консистенции соответствуют СРК с преобладанием запоров, а 6-й и 7-й типы — СРК с преобладанием диареи (табл. 1). При последнем пересмотре Римских критериев по СРК отмечена важность отказа от приема препаратов, влияющих на стул, на время дифференциальной диагностики СРК [13].

Диагноз СРК является диагнозом-исключением [14]. Актуальность проблемы диагностики и лечения СРК обусловлена не только отсутствием четко отработанной схемы лечения, но и сложностью дифференциальной диагностики на этапе первичного обращения в стационар между СРК, воспалительными заболеваниями кишечника, а также острой хирургической патологией. С проявлениями СРК нередко приходится сталкиваться врачам-хирургам.
Цель исследования — определить долю пациентов с абдоминальным болевым синдромом и нарушением стула как проявлениями СРК в общем потоке пациентов, обратившихся за экстренной помощью в дежурный хирургический стационар.
Материал и методы
Нами был проведен ретроспективный анализ историй болезни 240 пациентов (110 мужчин и 130 женщин) в возрасте от 18 до 40 лет, обращавшихся за медицинской помощью с жалобами на боли в животе и нарушение стула в экстренный хирургический стационар клиник СамГМУ с января 2017 г. по октябрь 2018 г.
От каждого пациента было получено информированное согласие на участие в исследовании, которое проводилось в соответствии с утвержденным протоколом, этическими принципами Хельсинкской декларации Всемирной медицинской ассоциации (Сеул, 2008), трехсторонним Соглашением по надлежащей клинической практике (ICH GCP) и действующим законодательством РФ.
Критериями исключения были: воспалительные заболевания кишечника (неспецифический язвенный колит [НЯК], болезнь Крона) по данным фиброколоноскопии, непреднамеренная потеря массы тела, ночные симптомы, семейный анамнез (онкологические заболевания толстого кишечника, целиакия), анемия, ректальное кровотечение в анамнезе, недавнее применение антибиотиков, образования в брюшной полости / прямой кишке, УЗ-признаки гепатомегалии, спленомегалии, лимфаденопатии, повышение уровня воспалительных маркеров, лихорадка выше 37,5 °С.
Средний возраст пациентов составил 29,3±11,7 года. На догоспитальном этапе у данных пациентов после осмотра врачом-инфекционистом была исключена острая инфекционная патология. Женщины при локализации болей в нижнем отделе живота осмотрены гинекологом для исключения гинекологической патологии. Все пациенты были осмотрены врачом-хирургом.
В целях дифференциальной диагностики был проведен стандартный комплекс обследований, включающий в себя: общий анализ крови, биохимический анализ крови, общий анализ мочи, комплексное УЗИ брюшной полости. При наличии показаний проводилась ФГДС, фиброколоноскопия.
У пациентов выявлялась частота и интенсивность основных клинических проявлений, условия возникновения и купирования симптомов. Для оценки интенсивности боли применялась 100-мм визуально-аналоговая шкала (ВАШ) боли, на которой оценка 0 мм соответствовала отсутствию боли, 10–30 мм — слабой боли, 40–60 мм — умеренной боли, 70–90 мм — сильной боли, 100 мм — нестерпимой боли, или «сильнейшей боли, которую только можно представить» (рис. 1).

Пациенты были разделены на 3 группы. В I группу (n=115) вошли пациенты с подтвердившейся хирургической патологией, которые требовали консервативного либо оперативного лечения, из них 60 мужчин и 55 женщин. Средний возраст составил 30,2±8,1 года. В данную группу были включены пациенты с установленными диагнозами: острый аппендицит, острый холецистит, острый панкреатит, дивертикулярная болезнь ободочной кишки, кишечная непроходимость, перфоративная язва желудка и двенадцатиперстной кишки. Во II (n=32) группу были включены пациенты с подтвердившимися впоследствии воспалительными заболеваниями кишечника — НЯК или болезнью Крона. Средний возраст составил 28,3±4,6 года. В данной группе преобладали мужчины (21 мужчины, 11 женщин). В III группу (n=93) вошли пациенты, у которых по результатам дообследования был установлен диагноз СРК. Данную группу составили 60 мужчин и 33 женщины, средний возраст — 24,2±4,2 года.
Результаты и обсуждение
Статистически значимых различий между группами пациентов по полу (χ2 = 0,001; p = 0,05) не выявлено.
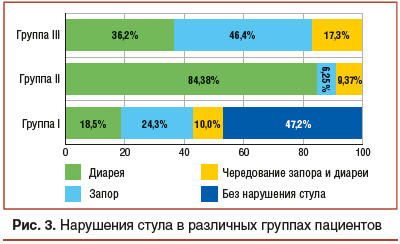
В I группе боли в животе разной интенсивности присутствовали у всех пациентов. Нестерпимые боли встречались в 6,09% случаев, сильная и умеренная боль — в 39,13% и 48,7% соответственно. Слабая боль была у 6,08% пациентов (рис. 2). Локализация болей у данной категории больных была различной. У 35,6% пациентов боль локализовалась в правой подвздошной области, у 40,87% — в верхнем отделе живота, у 6,96% — в нижнем отделе живота, у 5,24% — в левой подвздошной области, у 7,85% — по всему животу и у 3,48% — в околопупочной области. В I группе пациенты с диареей составили 18,5%, с запорами — 24,3%, без нарушений стула — 47,2%, с чередованием диареи и запора — 10% (рис. 3). Наибольшее количество пациентов (48,7%) в качестве провоцирующего фактора выделили прием пищи. У 32,1% пациентов симптомы возникли без какой-либо явной причины. Физическую нагрузку как провоцирующий фактор отметили 8,7% заболевших, эмоциональную нагрузку — 10,4% пациентов. Достичь аналгезии путем введения спазмолитических препаратов удалось у 45,2% заболевших. У 54,8% пациентов купирование болей спазмолитиками не проводилось, т. к. пациентам было выполнено экстренное оперативное вмешательство.
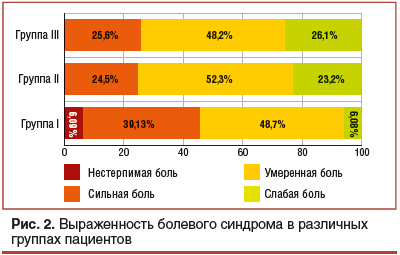
В группе пациентов с воспалительными заболеваниями кишечника сильные абдоминальные боли наблюдались у 24,5%, умеренные боли — у 52,3%, слабая боль — у 23,2% заболевших. Пациентов с нестерпимой болью в данной группе не было (рис. 2). Наиболее часто у пациентов данной группы боль локализовалась в нижних отделах живота (36,2%) и в левой подвздошной области (24,4%). В правой подвздошной области боли наблюдались у 11%
заболевших. Редко боли отмечались в околопупочной области (9,1%), в верхнем отделе живота (9,2%) и по всему животу (10,1%).
Основным нарушением стула в данной группе была диарея — 84,38%, у 9,37% пациентов отмечалось чередование запора и диареи. Запор без диареи встретился только у 6,25% заболевших (рис. 3). Основными провоцирующими факторами пациенты считали прием пищи — 38,5%, эмоциональную нагрузку — 33,2%. Чрезмерную физическую нагрузку перед заболеванием отмечали 8,2% пациентов. При этом 20,1% пациентов не смогли указать на возможный провоцирующий фактор. Купирования болевого синдрома спазмолитическими препаратами удалось добиться у 84,5% пациентов. У 15,5% пациентов болевой синдром купировался только на фоне комбинированной спазмолитической, антибактериальной и гормональной терапии.
У пациентов III группы нестерпимых болей также не отмечалось, но у 25,6% заболевших боли были сильными. Большинство пациентов (48,2%) отмечали умеренную интенсивность болей. Слабая боль наблюдалась у 26,1% больных (см. рис. 2). Локализовалась боль чаще в околопупочной области (41,6%) и правой подвздошной области (32,5%). Реже отмечалась боль в левой подвздошной области (19,3%). В верхнем отделе живота боль отмечалась в 2% случаев, в нижнем отделе — в 4,5%. Запоры у больных в данной группе отмечались в 46,4% случаев, диарея — в 36,2%. Чередование запоров и диареи наблюдали у 17,3% пациентов (см. рис. 3). Стресс как провоцирующий фактор назвали 69,4% исследуемых. Нарушение диеты перед приступом заболевания отмечали 22,4% пациентов. Физическую нагрузку как провоцирующий фактор отметили 4,2% заболевших. Затруднились указать условия возникновения болей 3,9% пациентов. При этом во всех случаях удалось купировать болевой синдром при помощи спазмолитиков.
Распределение пациентов, экстренно поступивших с абдоминальным болевым синдромом в хирургический стационар, в соответствии с диагнозом отражено на рисунке 4.

Выводы
СРК — это полиэтиологическое заболевание, характеризующееся многообразной клинической картиной.В практике врача-хирурга значительную долю пациентов, обратившихся в экстренный хирургический стационар, составляют пациенты с СРК. Данный синдром может симулировать как острую хирургическую патологию, так и воспалительные заболевания кишечника. Наличие большого количества неспецифических симптомов затрудняет дифференциальную диагностику у данных пациентов. Однако отличительной особенностью, позволяющей заподозрить СРК у пациента, является цикличность течения. Прогноз у пациентов с СРК благоприятный в отличие от воспалительных заболеваний кишечника и в большинстве случаев поддается комплексной терапии. Отсутствие жизнеугрожающих осложнений у СРК (кровотечение, перфорация кишечника, стриктуры кишечника, кишечная непроходимость и т. д.), свойственных воспалительным заболеваниям кишечника, позволяет пациентам с данной патологией проходить лечение у гастроэнтеролога.
Источник
Введение
Синдром раздраженного кишечника (СРК) – функциональное кишечное расстройство, проявляющееся абдоминальным болевым синдромом и/или нарушениями дефекации и/или метеоризмом. СРК – одно из очень частых заболеваний в гастроэнтерологической практике: 40–70% обращающихся к гастроэнтерологу пациентов имеют СРК. Он может проявляться в любом возрасте и в т.ч. у детей. Соотношение девушек и юношей – 2–4:1.
Синдром раздраженного кишечника (СРК) – функциональное кишечное расстройство, проявляющееся абдоминальным болевым синдромом и/или нарушениями дефекации и/или метеоризмом. СРК – одно из очень частых заболеваний в гастроэнтерологической практике: 40–70% обращающихся к гастроэнтерологу пациентов имеют СРК. Он может проявляться в любом возрасте и в т.ч. у детей. Соотношение девушек и юношей – 2–4:1.
В 1988 г. в Риме прошло совещание Международной группы по изучению функциональной патологии желудочно–кишечного тракта. На этом совещании, получившем в дальнейшем название «Римские критерии СРК», впервые официально был утвержден термин «синдром раздраженного кишечника», дано его определение и разработаны критерии постановки диагноза. В 1999 г. критерии были дополнены и приняты «Римские критерии СРК II».
Ниже приводятся симптомы, на основе которых можно диагностировать СРК (Рим, 1999):
• Частота стула менее чем 3 раза в неделю.
• Частота стула более чем 3 раза в день.
• Твердый или бобовидный кал.
• Разжиженный или водянистый кал.
• Натуживание на протяжении акта дефекации.
• Императивные позывы на акт дефекации (невозможность задержать опорожнение кишечника).
• Ощущение неполного опорожнения кишечника.
• Выделение слизи во время акта дефекации.
• Чувство переполнения, вздутия или переливания в животе.
Все изменения дефекации при СРК происходят на фоне болевого синдрома, что является основным диагностическим отличием от функционального запора и функциональной диареи, которые протекают без болей в животе.
Болевой синдром характеризуется многообразием проявлений: от диффузных тупых болей до острых спазматических; от постоянных до пароксизмов болей в животе. Длительность болевых эпизодов – от нескольких минут до нескольких часов. Помимо основных «диагностических» критериев, у больного могут наблюдаться следующие симптомы: учащение мочеиспускания, дизурия, никтурия, дисменорея, утомляемость, головная боль, боль в спине. Изменения психической сферы в виде тревожных и депрессивных расстройств встречаются у 40–70% больных с синдромом раздраженного кишечника.
В настоящее время диагностическими критериями СРК считается наличие абдоминального дискомфорта или болей в течение 12 не обязательно последовательных недель за последние 12 месяцев, в сочетании с двумя из следующих трех признаков:
– купирующиеся после акта дефекации;
и/или
– ассоциирующиеся с изменением частоты стула; и/или
– ассоциирующиеся с изменением формы кала.
СРК – диагноз исключения. Для постановки диагноза необходимо провести тщательный сбор жалоб, анамнеза, общеклинические лабораторные исследования, биохимические исследования крови, инструментальные исследования, исключающие органическую патологию кишечника (ультразвуковое исследование, ректороманоскопию, колоноскопию, иригографию, паразитологическое исследование и т.д.).
Так как большинство методов инвазивны, очень важно провести тщательный сбор анамнеза у больного и родителей, выявить симптомы и после этого провести необходимые исследования.
Особое внимание следует обратить на наличие у пациентов «симптомов тревоги» (alarm symptoms) или так называемых «красных флагов» (red flags), к которым относятся лихорадка, немотивированное похудание, дисфагия, рвота с кровью (гематемезис) или черный дегтеобразный стул (мелена), появление алой крови в кале (гематохезия), анемия, лейкоцитоз, увеличение СОЭ. Обнаружение любого из этих симптомов делает диагноз СРК маловероятным и требует тщательного диагностического поиска с целью исключения серьезного органического заболевания.
Несмотря на то, что число больных с СРК растет, до сих пор не разработаны единые патогенетические стандарты терапии данной патологии. Используемая в настоящее время терапия направлена на отдельные известные звенья патогенеза. Нами предпринята очередная попытка сравнить несколько схем патогенетической терапии больных синдромом раздраженного кишечника.
Материалы и методы
Нами обследовано 145 больных (41 мальчик и 104 девочки) средний возраст 17,3 лет. При поступлении больные предъявляли следующие жалобы.
Боли в животе наблюдались у 100% больных. Боль локализовалась внизу живота у 48% (из них 77% в левой подвздошной области, 12,5% в правой подвздошной области, 10,5% «весь низ»), по ходу кишечника у 28% больных, без четкой локализации – 24%. Иррадиация болей не отмечалась ни в одном случае. Характер болей различался: от тупых, ноющих (54%) до схваткообразных колик (33%). 19 больных отмечали чередование острых и тупых болей. Связь с приемом пищи отмечали 22% больных (после еды), остальные четкой связи не отмечали. У 78% больных боль усиливалась перед дефекацией и у 81% проходила после дефекации.
Повышенное газообразование с чувством распирания отмечалось у 78% больных.
Запоры отмечались у 54% больных (частота стула менее 3 раз в неделю). У 25% больных отмечался диарейный синдром (стул более трех раз в день). У остальных пациентов (21%) отмечалось чередование поносов, запоров, регулярного стула.
У большинства больных имелось изменение консистенции стула. «Овечий» кал был у 48 больных, у 13 больных стул был очень плотный, широкой «колбаской». У 11 пациентов стул был кашицеобразный, а у 8 водянистый. Обычной консистенции стул отмечался у 23% больных.
Примесь слизи в кале отмечали 83% больных. Других патологический примесей в кале не было.
Шестьдесят один больной отмечал чувство неполного опорожнения кишечника. У 54 больных время натуживания при дефекации составляло более 1/3 всего акта дефекации.
Для всех обследованных было характерно отсутствие клинических проявлений СРК в ночное время.
Таким образом, согласно классификации СРК (МКБ–10, Римские критерии II) под нашим наблюдением находились 36 больных с синдромом раздраженного кишечника с преобладанием диареи, 78 больных с синдромом раздраженного кишечника с преобладанием запоров и 31 пациент с преобладанием болей в животе и метеоризмом.
Согласно поставленным задачам исследования все больные были разделены на шесть групп. Так как одним из ведущих патогененетических механизмов у больных с СРК является спазм мышечного слоя толстой кишки, в базисную терапию нашим больным был включен миотропный спазмолитик мебеверина гидрохлорид (Дюспаталин) в дозе 200 мг 2 раза в день за 20 минут до еды в течение 30 дней.
Механизм действия мебеверина сводится к блокаде быстрых натриевых каналов клеточной мембраны миоцита, что нарушает поступление натрия в клетку, замедляет процессы деполяризации и блокирует вход кальция в клетку через медленные каналы. В результате прекращается фосфорилирование миозина и отсутствует сокращение мышечного волокна. Известно также, что выход ионов кальция из внутриклеточных депо в результате активации a1–адренорецепторов приводит к открытию калиевых каналов, выходу ионов калия из клетки, гиперполяризации и отсутствию мышечного сокращения, что может становиться в течение длительного времени причиной мышечной гипотонии. В отличие от других миотропных спазмолитиков мебеверин препятствует пополнению внутриклеточных кальциевых депо, что в конечном итоге приводит лишь к кратковременному выходу ионов калия из клетки и ее гипополяризации. Последняя предупреждает развитие постоянного расслабления или гипотонии мышечной клетки. Следовательно, назначение мебеверина (Дюспаталина) приводит только к снятию спазма без развития гипотонии гладкой мускулатуры, т.е. не нарушает моторики желудочно–кишечного тракта. К числу достоинств Дюспаталина относятся также селективное действие препарата на желудочно–кишечный тракт, отсутствие побочных эффектов, современная лекарственная форма в виде капсул, содержащих микросферы с постепенным высвобождением действующего вещества.
Две группы пациентов (в первую вошли пациенты с СРК с запором, во вторую – СРК с диареей) получали в качестве базисной терапии только Дюспаталин.
Длительное время всю клиническую картину СРК объясняли нарушением микробиоценоза кишечника. Бактерии, присутствующие в толстой кишке, переводят углеводы, не переваренные в тонком кишечнике, в короткоцепочечные жирные кислоты. Короткоцепочечные жирные кислоты затем выбрасываются в просвет кишки. Эти вещества частично поглощаются слизистой оболочкой кишечника, а также служат субстратом для микрофлоры кишечника, увеличивая ее биомассу. В дополнение к этому короткоцепочечные жирные кислоты снижают рН и увеличивают осмотическое давление.
Были предложены и другие гипотезы относительно гастроинтестинального транзита и кишечной микрофлоры, предполагающие вовлечение множественных механизмов, но до сих пор они не были убедительно подтверждены. Заслуживают внимания и другие гипотезы [2,3,4] влияния кишечной микрофлоры на кишечный транзит:
• выделение газа, который ускоряет транзит;
• увеличение содержания некоторых веществ (КЦЖК) может стимулировать мышечную стенку;
• стимуляция образования холецистокинина;
• уменьшение порога ответа гладкой мускулатуры слепой кишки на химическую стимуляцию;
• микробный метаболизм желчных кислот, поступающих в толстую кишку, приводит к стимуляции кишечного транзита;
• увеличение веса каловых масс, как результат роста бактериальной биомассы, также стимулирует транзит.
В связи с этим третью группу составили пациенты с СРК с диарей, которые получали Дюспаталин плюс пробиотик пробифор по 1 порошку 2 раза в день курсом 14 дней. В четвертой группе были пациенты с СРК с запорами, которые также получали Дюспаталин с пробифором.
По мере развития современных методик изучения двигательной активности желудочно–кишечного тракта, стало очевидно, что патологическая, или повышенная, сократимость кишки далеко не всегда являлись причиной отмечаемых пациентами болей или других симптомов. И наоборот, когда регистрировались какие–либо отклонения двигательной активности желудочно–кишечного тракта, пациенты часто не предъявляли никаких жалоб.
Исследование моторной функции выявило повышение висцеральной чувствительности и пониженный порог на растяжение кишки. При этом выявлено 2 вида висцеральной гипералгезии: 1) снижение порога восприятия боли и 2) более интенсивное ощущение боли при нормальном пороге ее восприятия. Выраженность синдрома висцеральной гипералгезии хорошо коррелирует с симптомами СРК [6,7].
Таким образом, пациенты пятой группы (СРК с диареей) в качестве терапии получали Дюспаталин и препарат смекта (1 пакет 3 раза в день через 1 час после еды в течение 21 дня).
Шестую группу составили пациенты с запорами, получавшие Дюспаталин с препаратом лактулозы (Дюфалак). Доза Дюфалака подбиралась индивидуально в зависимости от выраженности запоров. Лактулоза – это синтетический дисахарид, не встречающийся в природе, в котором каждая молекула галактозы связана b–1,4–связью с молекулой фруктозы. Лактулоза попадает в толстый кишечник в неизмененном виде (лишь около 0,25–2,0% всасывается в неизмененном виде в тонкой кишке) и служит питательным субстратом для сахаролитических бактерий. В процессе бактериального разложения лактупозы на короткоцепочечные жирные кислоты (молочную, уксусную, пропионовую, масляную) снижается рН содержимого толстой кишки. За счет этого же повышается осмотическое давление, ведущее к задержке жидкости в просвете кишки и усилению ее перистальтики. Использование Дюфалака как источника углеводов и энергии приводит к увеличению бактериальной массы и сопровождается активной утилизацией аммиака и азота аминокислот. Эти изменения в конечном итоге ответственны за профилактический и терапевтический эффекты лактулозы при запорах.
Курс лечения продолжался 30 дней. Контроль терапии проводился через 1 неделю, 1, 3, и 6 месяцев от начала лечения.
Результаты исследования
В течение первой недели терапии улучшение состояния отмечали пациенты всех групп (28–60%). Хороший ответ на медикаментозную терапию характерен для больных с функциональными нарушениями ЖКТ и в том числе с синдромом раздраженного кишечника.
При контрольном обследовании через 1 месяц мы получили следующие результаты. Болевой синдром купировался у 84% больных первой группы, 89% – второй, у 86% пациентов четвертой группы. В третьей, пятой и шестой группах болевой синдром купировался у всех пациентов. Несмотря на такой положительный эффект, в первой группе у 40% больных сохранялись запоры. В остальных группах регулярный стул отмечался у 78, 83, 79, 80 и 92% соответственно. В группах, где больные получали в качестве терапии пробиотический препарат и лактулозу, более чем у половины пациентов сохранялись жалобы на метеоризм. По–видимому, это связано с активной жизнедеятельностью микроорганизмов в толстой кишке на фоне приема про– и пребиотического препарата.
Самочувствие как хорошее через 1 месяц от начала терапии расценивали 68% в первой группе, 83% во второй, 94% в третьей и шестой группах, 78% в четвертой и 100% пациентов пятой группы.
Однако длительность такого положительно эффекта после окончания терапии была различной в группах. Так, через 3 месяца только 40% в первой группе расценивали свое самочувствие как хорошее. Во второй и четвертой группах половина больных была удовлетворена своим состоянием здоровья. А в пятой и шестой группах 90% больных отмечали хорошее самочувствие. Такая же динамика наблюдается в жалобах больных на боль в животе. У 30% пациентов первой и второй групп вновь появились боли в животе. В третьей и четвертой группах болевой синдром наблюдался у 22 и 28% соответственно. В пятой группе только один больной пожаловался на боли в животе через 3 месяца от начала терапии, в шестой группе таких жалоб не предъявлял ни один пациент.
Регулярный стул отмечался у 94 и 85% пациентов шестой и пятой групп соответственно, 29 и 66% в четвертой и третьей группах и 32 и 61% в первой и второй группах.
Через 6 месяцев от начала терапии в первой, второй, третьей и четвертой группах болевой синдром отмечался у 40% пациентов, регулярный стул у четверти пациентов с запорами и у половины – с диарей. Самочувствие как хорошее оценивали 32 – 61% больных. В пятой группе (СРК с диарей на фоне терапии Дюспаталин + смекта) через 6 месяцев от начала терапии 2 ребенка пожаловались на боль, регулярный стул наблюдался у 70% пациентов, метеоризм у 4 детей. Хорошее самочувствие отмечали 75% больных этой группы.
Такой же положительный эффект наблюдался в шестой группе (СРК с запором терапия Дюспаталин + Дюфалак). Так, болевой синдром через шесть месяцев отмечался у 19% пациентов, метеоризм у 28%, регулярный стул у 72%, хорошее самочувствие у 75% больных.
Заключение
1. Дюспаталин является базовым средством терапии СРК у детей независимо от преобладающей клинической симптоматики.
2. Монотерапия Дюспаталином в стандартной дозе 200 мг х 2 раза в сутки у больных СРК дает положительный эффект более чем у половины пациентов.
3. Более выраженный положительный эффект отмечается на фоне комплексной терапии Дюспаталина с пре–, пробиотическими препаратами, а также обволакивающей, сорбционной терапией. Стойкий эффект (более 6 месяцев после окончания курса лечения) наблюдается при терапии больных с СРК с диарей Дюспаталином и смектой.
4. При СРК с преобладанием запоров оптимальным является сочетание Дюспаталина и препарата Дюфалак в индивидуально подобранной дозе. Стойкий и выраженный эффект более чем у 75% пациентов отмечается через 6 месяцев после лечения. Связано это, по–видимому, с действием терапии сразу на несколько звеньев патогенеза СРК.
Литература
1. Aube A.C. Short–chain fatty acids. Their role in intestinal pathophysiology and therapeutic potential in gastroenterology. GASTROENTEROL. INT. 1995, 8/4 (167–176)
2. Abrams GD, et al. PSEBM, 1967; 126: 301–304,
3. Cummings JH. Constipation, dietary fiber and the control of large bowel function. Post Med J, 1984, 60: 811–819
4. Husebye E, et al. Intestinal microflora simulates myoelectric activity of rat small intestine by promoting cyclic initiation and aboral propagation of migrating myoelectric complex. Dig Dis Su, 1994, 39 (5): 946–956,
5. Ручкина И.Н., Парфенов А.И., Петраков А.В., Осипов Г.А. Роль кишечных инфекций и дисбактериоза в формировании синдрома раздраженного кишечника. Экспериментальная и клиническая гастроэнтерология. №1 2004. С.106
6. Избранные лекции по гастроэнтерологии./ Под редакцией В.Т. Ивашкина, А.А. Шептулина. – м.: МЕДпресс, 2001 – 88С.
7. Ritchie J. Pain from distension of the pelvic colon by inflating a balloon in the irritable bowel syndrome. Gut 1973: 14: 125–32.
8. Логинов А.С., Потапова В.Б., Парфенов А.И. Ультраструктурные изменения слизистой оболочки толстой кишки при синдроме раздраженного кишечника. Рос. журн. гастроэнтерол., гепатол., колопроктол. 1996; VI (2): 78–81.
9. Парфенов А. П. Синдром раздраженного кишечника. Лечащий Врач, №06 2002 Абдоминальный болевой синдром: этиология, патогенез и вопросы терапии
10. Яковенко Э.П. Лечащий врач, 2001, № 05–06
11. Marteau P, et al. Bifidobacterium animalis, souche DN–173 010 shortens the colonic transit time in healthy women. A double blind randomised controlled study. Submitted,
12. Колесников Д.Б. Синдром раздраженной толстой кишки (психосоматические соотношени типология, терапия). Автореф. дис. канд. мед. Наук М. 2000
13. Borriello SP. Bacteria and gastrointestinal secretion motility. Scand J Gastroenterol Suppl, 1984, 93: 115–121,
Источник
