Некротический энтероколит код мкб
Содержание
- Описание
- Дополнительные факты
- Причины
- Симптомы
- Возможные осложнения
- Диагностика
- Дифференциальная диагностика
- Лечение
Названия
Название: Некротический энтероколит новорожденных.

Некротический энтероколит новорожденных
Описание
Некротический энтероколит новорожденных (НЭК). Это неспецифическое заболевание воспалительного характера, которое вызывается инфекционными агентами на фоне повреждения слизистой оболочки кишечника или ее функциональной незрелости. Симптомы включают соматические реакции и абдоминальные проявления. При длительном течении наблюдаются признаки перфорации кишечника и клиника перитонита. Диагностика НЭК сводится к физикальному обследованию, оценке симптомов по шкале Walsh и Kliegman и рентгенографии. Лечение зависит от стадии заболевания, может быть как консервативным, так и хирургическим.
Дополнительные факты
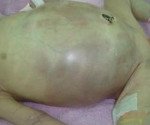
Некротический энтероколит новорожденных или «болезнь выживших недоношенных» – это гетерогенная патология, которая характеризуется развитием язв и некрозов стенки кишечника с дальнейшей перфорацией. Более 90% больных детей – недоношенные, с массой тела до 1500г. Общая заболеваемость составляет 0,5-3 на 1000 новорожденных. Прогноз, как правило, неясен, т. Для НЭК характерно резкое ухудшение состояния на фоне мнимого благополучия. Часто требуется хирургическое вмешательство. Летальность в зависимости от формы колеблется от 25 до 55%. Даже после успешного проведения операции показатель смертности составляет свыше 60%. При условии выживания ребенка наблюдается тяжелый период реабилитации, остается высокий риск послеоперационных осложнений.
Некротический энтероколит новорожденных
Причины
Некротический энтероколит новорожденных – полиэтиологическое заболевание. Основными патогенетическими факторами являются гипоксия и ишемия в перинатальном периоде, нерациональное питание новорожденного и заселение кишечника аномальными микроорганизмами. К способствующим факторам относятся преждевременные роды, эклампсия, травмы ЦНС при родах, иммунодефицитные состояния у ребенка, аномалии развития кишечника, отягощенный семейный анамнез.
Ишемия кишечника может быть обусловлена внутриутробной асфиксией плода, при которой наблюдается централизация кровообращения, постановкой катетера в пупочную артерию, влекущей за собой спазм артерий и их тромбоэмболию, явлением «сгущения крови» и артериальной гипотензией, при которых нарушается ток крови и поступление питательных веществ. К алиментарным причинам развития некротического энтероколита новорожденных относят питание ребенка искусственными смесями и их резкую смену, использование гипертонических растворов, повреждающих слизистую оболочку кишечника, врожденную непереносимость молока, непосредственную инвазию патогенных агентов через ЖКТ. Наиболее часто причиной НЭК становятся Kl pneumonia, E. Coli, клостридии, стафилококки, стрептококки и грибы рода Candida.
• Молниеносная. Перфорация стенки кишечника возникает на протяжении 36-48 часов после проявления первых симптомов – незначительного нарушения общего состояния ребенка. Характерна для доношенных детей с аномалиями развития ЖКТ (гастрошизис), гемолитической анемией, травмами ЦНС.
• Острая. Дебют характеризуется абдоминальными симптомами. Как правило, спустя 8-16 часов присоединяются соматические проявления, резко ухудшается общее состояние ребенка. Без соответствующего лечения НЭК быстро переходит в 3 стадию. Наблюдается у детей с массой тела при рождении свыше 1500 г.
• Подострая. Первичные абдоминальные проявления имеют перемежающийся характер, возникают поэтапно. Соматические расстройства развиваются медленно. Для этой формы характерно рецидивирующее течение. Обычно возникает у глубоко недоношенных детей с массой тела менее 1500 г.
В зависимости от массивности поражения различают следующие варианты НЭК:
• Локальный. Патологические изменения наблюдаются на ограниченном отрезке кишечника.
• Полисегментарный. Характерно поражение сразу нескольких участков.
• Паннекроз или тотальный. В патологический процесс втягивается весь кишечник.
Симптомы
Некротический энтероколит новорожденных может возникать в первые 24 часа после родов (ранняя форма) или после 1 месяца жизни (поздняя форма), средний возраст детей на момент появления симптомов – 1-2 недели. Все проявления данной патологии можно разделить на 3 группы: соматические, абдоминальные, генерализованные. Первыми, как правило, появляются абдоминальные симптомы, которые почти сразу дополняются соматическими. Генерализованные проявления НЭК отмечаются при прогрессировании заболевания и возникновении перфорации кишечника, что, в зависимости от формы, может происходить через 1-3 дня.
В группу соматических симптомов входят патологические реакции организма на развитие НЭК: приступы апноэ, респираторный дистресс, олигурия, ухудшение микроциркуляции (позитивный симптом «белого пятна»). К абдоминальным признакам НЭК относятся симптомы раздражения брюшной полости и дисфункция ЖКТ: потеря аппетита, метеоризм, рвота желчью и кровью, отсутствие перистальтических шумов, мелена, асцит, покраснение кожи, отечность подкожной жировой клетчатки и резкое напряжение мышц передней брюшной стенки. Нарушения в организме ребенка, возникшие в результате прогрессирования некротического энтероколита новорожденных, объединяют в группу генерализованных проявлений. Сюда входят гипертермия, переходящая в гипотермию, артериальная гипотония, бледность и диффузный цианоз, выраженная вялость и сонливость, ДВС-синдром, дыхательная и сердечно-сосудистая недостаточность.
Вялость. Гиперкалиемия. Гипонатриемия. Лейкоцитоз. Мелена. Метеоризм. Отсутствие аппетита. Понос (диарея). Рвота.
Возможные осложнения
Большинство осложнений некротического энтероколита новорожденных, как правило, развиваются после проведенного хирургического лечения. Наиболее часто после оперативного вмешательства возникает кишечный свищ, синдром «укороченной кишки», хроническая диарея, демпинг-синдром, обезвоживание, синдром мальабсорбции, стриктура толстого кишечника, абсцесс, задержка физического развития. Также при НЭК могут встречаться патологические состояния, вызванные полным парентеральным питанием: дефицит витамина D (рахит), поражение печени (гепатит) и костей (деминерализация).
Диагностика
Диагностика некротического энтероколита новорожденных включает в себя сбор анамнеза, клиническое, лабораторное и инструментальное обследование. Анамнестические данные могут помочь педиатру и детскому хирургу установить возможную этиологию, проследить за динамикой заболевания. При объективном осмотре выявляются присутствующие на данный момент клинические симптомы – абдоминальные, соматические и генерализованные проявления. Специфических лабораторных тестов для подтверждения НЭК не существует. Информативными являются следующие данные, полученные при проведении лабораторных исследований: лейкоцитоз со сдвигом формулы влево, лейкопения и тромбоцитопения в ОАК, ацидоз и гипоксемия при определении газового состава крови, гиперкалиемия и гипонатриемия в электролитном спектре, диспротеинемия и выявления С-реактивного протеина в белковом спектре, обнаружение крови в кале при пробе Грегерсена. С целью выявления инфекционного возбудителя проводится бактериальный посев, ИФА и ПЦР.
Ведущую роль в диагностике некротического энтероколита новорожденных играют инструментальные методы: рентгенография, УЗИ, КТ и МРТ. Они дают возможность визуализировать отек стенок кишечного тракта, плюс-ткань, наличие воздуха в брюшной полости, в просвете портальной или печеночной вен, а также отсутствие перистальтики на серии последовательных снимков. В педиатрии для подтверждения диагноза «некротический энтероколит новорожденных» и определения стадии заболевания применяется шкала Walsh и Kliegman При использовании данной шкалы учитываются присутствующие у ребенка соматические симптомы, проявления со стороны желудочно-кишечного тракта и рентгенологические признаки. В зависимости от количества и выраженности проявлений выделяют подозреваемый НЭК (1а и 2а ), явный НЭК (2а и 2б ), прогрессирующий НЭК (3а и 3б ). Это имеет существенное значение при выборе тактики лечения.
Дифференциальная диагностика
Дифференциальная диагностика некротического энтероколита новорожденных проводится с такими патологиями как неонатальный сепсис, пневмония, пневмоперитонеум, кишечная непроходимость различного генеза, аппендицит новорожденного, бактериальный перитонит и спонтанная перфорация кишечника.
Лечение
Тактика лечения некротического энтероколита новорожденных зависит от тяжести состояния ребенка и стадии заболевания. Детям с 1а, 1б и 2а стадиями показана консервативная терапия. С момента постановки диагноза отменяется энтеральное питание и проводится постановка назо- или орогастрального зонда с целью декомпрессии. Ребенок переводится на полное парентеральное питание (TPN) в соответствии с клиническими протоколами. Параллельно назначаются антибактериальные препараты из групп пенициллинов (ампициллин) и аминогликозидов II поколения (гентамицин) в комбинации с медикаментами, действующими на анаэробную микрофлору (метронидазол). При неэффективности выбранной антибиотикотерапии применяют цефалоспорины III-IV поколения (цефтриаксон) в сочетании с аминогликозидами III поколения (амикацин). Таким детям рекомендованы пробиотики и эубиотики для нормализации кишечной микрофлоры. Также проводят СВЧ-терапию, вводят иммуномодуляторы и гамма-глобулины.
Детям с 2б, 3а и 3б стадиями показано хирургическое вмешательство. Объем операции зависит от распространенности поражения кишечника. Как правило, проводится экономная резекция пораженного участка с формированием энтеростомы или колостомы. При локальных формах НЭК возможно наложение анастомоза по типу «конец в конец». После операции назначается инфузионная терапия и медикаментозное лечение, аналогичное более ранним стадиям.
Источник
Рубрика МКБ-10: P77
МКБ-10 / P00-P96 КЛАСС XVI Отдельные состояния, возникающие в перинатальном периоде / P75-P78 Расстройства системы пищеварения у плода и новорожденного
Определение и общие сведения[править]
Некротизирующий энтероколит (НЭК)
Эпидемиология
Заболеваемость НЭК составляет 2,4 на 1000 новорожденных (1-10 на 1000) или около 2,1% (от 1 до 7%) общего числа детей, поступающих в ОРИТН. Большую часть заболевших составляют недоношенные и малые по сроку гестации дети. Гестационный возраст менее 36 нед имеют 76% заболевших новорожденных, массу тела менее 2000 г — 81%. НЭК страдают около 10% (от 1 до 28%) недоношенных новорожденных, имеющих массу тела при рождении менее 1500 г. Некоторые авторы отмечают увеличение заболеваемости при достижении ребенком постконцептуального возраста 33-35 нед.
На долю доношенных новорожденных приходится 10-20% случаев заболевания НЭК. Считают, что для развития НЭК у доношенных детей должны быть дополнительные отягчающие факторы, такие как ВПС, гипотиреоидизм, синдром Дауна, атрезия тонкой кишки или гастрошизис, полицитемия, а также ситуации, снижающие оксигенацию тканей кишечника или кровоток в нем, факты переливания крови, перинатальный стресс, агрессивная тактика питания. Ряд авторов указывают на возможность развития НЭК у доношенных детей без указанных факторов риска. Более 50% детей, у которых развился НЭК, имеют перинатальный анамнез, отягощенный инфекцией.
Средние показатели летальности при НЭК составляют 10-45% и зависят, помимо степени зрелости, также от стадии и распространенности процесса. Образование перфорации кишки и развитие перитонита в 63% случаев приводит к летальному исходу, особенно при распространении воспалительного процесса на тощую кишку и проксимальнее (на двенадцатиперстную кишку и желудок).
Классификация
Существуют классификации НЭК, предложенные М. Беллом и соавт. (1978), Уолшем и Клейгманом (1986), а также отечественная классификация.
Этиология и патогенез[править]
В настоящее время НЭК рассматривают как полиэтиологическое заболевание. К факторам риска развития НЭК относят:
• недоношенность;
• гипоксию (асфиксию);
• бактериальную колонизацию кишечника патогенной микрофлорой;
• ЭП (энтеральное питание).
Недоношенность может быть благоприятным фоном для развития заболевания, что связано со следующими факторами:
• большая частота внутриутробной гипоксии и асфиксии в родах;
• особенности формирования биоценоза кишечника в условиях проведения интенсивной терапии;
• особенности взаимодействия клеток кишечника с иммунокомпетентными клетками у новорожденных и избыточной активностью воспалительного ответа;
• незрелость нервной системы кишечника и механизмов регуляции моторики кишечника;
• нарушение механизмов адаптации к ЭП у недоношенных детей в связи с незрелостью и отсутствием раннего ЕВ (естественного вскармливания);
• несовершенство местного иммунитета.
Патогенез
Патоморфологически НЭК характеризуется воспалением и обширным повреждением ткани. Специфичными гистопатологическими изменениями на начальных стадиях бывают отек и отслойка эпителия ворсин. Затем появляются признаки деструкции ворсин, отека подслизистой оболочки, после чего характерно появление в ней микрогеморрагий, микротромбозов, стаза крови в капиллярах. При тяжелом течении может произойти полное исчезновение структуры ворсинок, изъязвление слизистой оболочки; визуализируются пузырьки газа (пневматоз) в подслизистой оболочке (рис. 20-2, см. цв. вклейку) и под серозной оболочкой. Пневматоз кишечной стенки часто обнаруживают при НЭК у новорожденных, но это неспецифический симптом, так как наблюдается при других патологиях и в более старшем возрасте. Некоторые авторы расценивают пневматоз желудка как маркёр фульминантного течения НЭК. Серозная оболочка утолщается из-за отека.
У больных с НЭК выявлены типичные симптомы вторичной нейронной дисплазии. Обнаруживаются дегенеративные изменения подслизистого и межмышечного сплетения нервной системы кишки. Сплетения теряют глиальные клетки и нейроны, в ганглиях выявляются участки лизиса в центре, ганглии напоминают пустые корзины. Обнаруживаются повреждения, напоминающие фокальный аганглиоз. Снижается продукция ингибирующих мышечный тонус нейромедиаторов (вазоактивного интестинального пептида и оксида азота). Изменения в подслизистом сплетении доминируют, и они тем выраженнее, чем сильнее повреждение слизистой оболочки. Таким образом, при НЭК наблюдаются дегенеративные изменения нервных сплетений кишечника, возможно, вторичные по отношению к гипоксемии.
Одним из ведущих звеньев патогенеза НЭК, по мнению большинства авторов, выступает нарушение микроциркуляции в кишечнике. Гипоксия, особенно внутриутробная, может существенно изменять кровоснабжение ЖКТ. У детей, перенесших внутриутробную гипоксию, изменения кровотока в системе мезентериальных сосудов сохраняются и постнатально, причем в этой группе детей гораздо чаще выявляют симптомы дизадаптации ЖКТ к ЭП. Однако ишемия кишечной стенки бывает не единственным патогенетическим фактором при НЭК. Клинические и патоморфологические изменения при НЭК свидетельствуют о синергизме действия ишемии и бактериальных факторов агрессии в ходе развития заболевания.
Гипоксия как мощный стрессорный фактор активирует иммунную систему, что отражается в повышении синтеза цитокинов и других регуляторных веществ.
Ишемия с последующей реперфузией способствует поддержанию повышенной проницаемости кишечной стенки, характерной для недоношенных. Повышение проницаемости кишечной стенки у детей, оперированных по поводу НЭК, длится в течение 3 нед и более от начала заболевания. Повышенная проницаемость облегчает проникновение бактерий через стенку кишки в системный кровоток. Важно при этом, что массивное обсеменение полости кишечника бактериями может привести к транслокации даже при отсутствии изменения проницаемости и нарушений межклеточных контактов, например у ряда доношенных детей с НЭК.
84% детей с НЭК имеют все признаки не только локальной, но и системной воспалительной реакции, при развитии перфораций кишечника системную воспалительную реакцию наблюдают в 100% случаев. При НЭК происходит повышение концентрации цитокинов в системной циркуляции. Системная воспалительная реакция может быть не только следствием НЭК как первичного очага. По-видимому, если активация провоспалительного каскада произошла по другим причинам, возникновение местного очага воспаления в кишечнике облегчается. Так, присутствие повышенного количества ИЛ-6 в пуповинной крови повышает риск развития НЭК.
Клинические проявления[править]
М. Белл и соавт. (1978) предложили классификацию НЭК, согласно которой различают следующие стадии течения заболевания.
• I стадия:
— наличие крови в стуле;
— большой остаточный объем в желудке при зондовом питании;
— вздутие и напряжение живота, пальпация плотных петель кишечника;
— растяжение кишечных петель, пневматоз кишки (при рентгенологическом исследовании).
• II стадия:
— нарастание увеличения живота и напряжения передней брюшной стенки, ее покраснение или цианоз на фоне ухудшения состояния;
— нарастающие тромбоцитопения и ацидоз;
— наличие жидкости в брюшной полости (при рентгенологическом исследовании).
• III стадия:
— образование перфорации и развитие перитонита;
— развитие шока.
В последующем Уолш и Клейгман предложили классификацию (1986), учитывающую стадийные изменения общеклинических, гастроэнтерологических и рентгенологических симптомов.
В отечественной практике в клиническом течении НЭК принято выделять четыре стадии.
• Стадия продрома:
— вздутие живота;
— увеличение объема застойного содержимого в желудке;
— срыгивание;
— появление симптомов нарушения функции дыхательной системы (усиление работы дыхания, необходимость в более жестких параметрах ИВЛ, появление приступов апноэ).
• Стадия клинических проявлений:
— вялое сосание;
— частое срыгивание, в том числе с примесью желчи;
— снижение массы тела;
— урежение стула;
— кровь в кале (определяемая визуально или по реакции на скрытую кровь);
— жидкий стул, развитие эксикоза.
• Стадия предперфорации:
— рвота кишечным содержимым и желчью;
— рвота «кофейной гущей»;
— резкое вздутие живота;
— напряжение, болезненность передней брюшной стенки;
— отечность, синюшность передней брюшной стенки;
— вялая перистальтика или ее отсутствие;
— отсутствие стула или он скудный с алой кровью;
— анус сомкнут, легкая ранимость слизистой оболочки кишки.
• Стадия перфорации и перитонита:
— перитонеальный шок;
— признаки наличия воздуха в брюшной полости.
Принципиальное отличие этой клинической классификации
от классификации Белла — выделение стадии продрома, когда нет достоверных признаков НЭК. Выделение данной стадии снижает риск несвоевременной диагностики и позволяет вовремя изменить тактику ведения больного.
Детей с НЭК следует рассматривать как группу высокого риска по развитию сепсиса. При I стадии заболевания системная воспалительная реакция наблюдается у 38% детей, при II и III стадии ее частота достигает 75-95%, в том числе у 37-64% детей (в зависимости от стадии заболевания) имеет место ДВС-синдром. У 60% детей в период течения НЭК выявляют другие гнойновоспалительные заболевания.
Как минимум у 75% детей с НЭК наблюдается полиорганная недостаточность с вовлечением двух систем и более: недостаточность кровообращения — у 75-80% детей, дыхательная недостаточность — у 56-90%, почечная недостаточность — у 36-83%, нарушения функции печени — у 50% и более в зависимости от стадии заболевания. Для НЭК типичны нарушения кислотнощелочного равновесия (метаболический ацидоз).
Течение заболевания чаще циклическое, однако возможны рецидивы заболевания, в том числе после закрытия кишечных стом.
Некротизирующий энтероколит у плода и новорожденного: Диагностика[править]
Диагностика основана на оценке факторов риска, клинической картины, рентгенологическом исследовании. Также проводят УЗИ брюшной полости, в сомнительных случаях — лапароцентез.
Инструментальные исследования
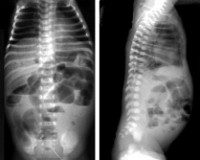
Для НЭК характерны следующие рентгенологические признаки.
• Расширение кишечных петель (55-100% случаев).
• Снижение газонаполнения и асимметричное расположение кишечных петель.
• Пневматоз кишечной стенки (19-98%).
• Газ в системе воротной вены (61% при тотальном поражении).
• Пневмоперитонеум (12-30%).
• Жидкость в брюшной полости (11%), косвенными признаками наличия которой выступают:
— сильное вздутие живота при отсутствии газонаполнения кишечных петель;
— переполненные газом петли кишечника в центре брюшной полости;
— разделение кишечных петель.
• Персистирующая дилатация кишечных петель.
• Наличие неподвижной (статичной) петли.
• Токсическая дилатация толстой кишки.
• Расширение желудка.
В стадии реконвалесценции и при подготовке к оперативному вмешательству по закрытию ранее наложенной кишечной стомы для оценки проходимости кишечника выполняют рентгеноконтрастное исследование с метризамидом.
При УЗИ брюшной полости также можно выявить газ или жидкость в брюшной полости, симптом мишени, утолщение стенок кишечных петель, пневматоз, газ в системе воротной вены.
Лабораторные исследования
Для комплексной диагностики и мониторинга состояния оценивают данные дополнительных методов исследования.
• В клиническом анализе крови — признаки воспалительной реакции (лейкоцитоз или лейкопения, нейтрофилез или нейтропения, сдвиг лейкоцитарной формулы влево, тромбоцитопения).
• По данным биохимического анализа крови — наличие воспалительного синдрома, гипонатриемии, признаков нарушения экскреторной функции почек, синдрома цитолиза, синдрома холестаза.
• По данным определения КОС (кислотно основное состояние) — признаки метаболического ацидоза.
• При исследовании кала — положительная реакция на скрытую кровь.
• По коагулограмме — признаки ДВС-синдрома.
• Положительные результаты посева крови.
Для подбора адекватной антибактериальной терапии показано проведение посевов из ануса, кишечной стомы (при ее наличии) с определением антибиотикочувствительности микрофлоры. Желательно определение метаболитов анаэробной микрофлоры и грибов в крови.
Перспективные методы диагностики
Концентрация IL-1ra >130 000 пкг/мл имеет чувствительность 100% и специфичность 92%. Более поздно повышающийся IL-10 через 8 ч от начала заболевания в концентрации >250 пкг/мл также имеет чувствительность 100% как тест, диагностирующий развитие III стадии НЭК у данного ребенка.
При определении экскреции D-лактата с мочой отмечают ее увеличение. Выявляют нарастание количества эндотоксина (липополисахарида грамотрицательных бактерий). В плазме определяют уровень кишечного протеина, связывающего жирные кислоты.
В период реконвалесценции после возобновления ЭП рекомендуют проведение ежедневного мониторинга объема стула, определение экскреции углеводов и липидных фракций с калом (копрологическое исследование или липидограмма кала) один раз в неделю для оценки усвоения нутриентов. После перевода на полное ЭП и отмены антибактериальной терапии показано исследование биоценоза кишечника.
Дифференциальный диагноз[править]
Некротизирующий энтероколит у плода и новорожденного: Лечение[править]
При подозрении на НЭК немедленно проводят следующие консервативные мероприятия:
• прекращают ЭП и отменяют прием препаратов внутрь;
• проводят декомпрессию желудка;
• проводят посиндромную терапию (респираторную поддержку, купирование нарушений гемодинамики, коррекцию КОС, электролитных нарушений, эксикоза, нарушений гемостаза, болевого синдрома);
• проводят полное ПП (особенности расчета описаны ниже);
• текущие антибиотики заменяют с учетом возможной роли анаэробной флоры в сочетании с госпитальными штаммами грамотрицательных и грамположительных бактерий с последующей сменой с учетом чувствительности.
Проведение очистительных клизм при энтероколите может спровоцировать перфорацию кишечника.
Хирургическое лечение
Показаниями к хирургическому лечению служат:
• опухолевидное образование брюшной полости;
• воспалительные изменения брюшной стенки; уплотнение, отек или фиброзное воспаление подкожной клетчатки брюшной стенки — грозные признаки, которые обычно появляются при наличии подлежащего абсцесса, перитонита или гангрены кишки;
• специфическая рентгенологическая картина (пневмоперитонеум, признаки асцита, симптом статичной петли);
• лабораторные данные (остро возникшая тромбоцитопения, коагуляционные нарушения, тяжелая гипонатриемия и стойкий ацидоз подтверждают наличие некроза кишечной стенки);
• абдоминальный парацентез (о некрозе кишечной стенки свидетельствуют мутная жидкость коричневого цвета, вы-
явление при окраске по Граму внеклеточных бактерий, большое число лейкоцитов, преобладание нейтрофилов более 80%).
Немедикаментозное лечение
Нутритивная поддержка новорожденных в период разгара и реконвалесценции НЭК имеет определенные особенности.
Отмена ЭП у новорожденного — общепринятая тактика при подозрении на развитие НЭК. В период разгара заболевания проводится полное ПП. Потребность новорожденного в энергии и нутриентах при НЭК отличается от потребностей здорового недоношенного или доношенного новорожденного. Несмотря на то что единственное исследование, посвященное энергетическому и белковому обмену у новорожденных со II-III стадией НЭК (по Беллу), не выявило существенных изменений обмена веществ, следует учесть высокий риск развития сепсиса, дыхательной и сердечной недостаточности при расчете количественных параметров нутритивной поддержки.
Перевод больных с НЭК на ЭП проводят постепенно. Назначение ЭП возможно в случае полного купирования болевого синдрома, отсутствия признаков раздражения брюшины, синдрома срыгивания, геморрагического синдрома, восстановления перистальтики. До 3 сут от начала манифестации заболевания назначать ЭП не рекомендуется, в то же время ранее принятая тактика (проведение полного ПП в течение 10-14 дней) также не бывает оптимальной в связи с риском развития атрофии слизистой оболочки кишечника и вторичного синдрома холестаза. До введения продукта для вскармливания новорожденному в течение 0,5-1 сут вводят изоосмолярную жидкость — изотонический раствор натрия хлорида или глюкозо-солевой раствор в объеме, соответствующем трофическому питанию — около 0,5 мл/(кгхч). При удовлетворительном усвоении жидкости (отсутствии застойного содержимого в желудке, срыгивания, нарастания вздутия живота, сохранении удовлетворительной перистальтаки, наличии самостоятельного стула без примеси крови) возможно назначение продуктов для ЭП. Появление перечисленных симптомов НЭК на любом из этапов проведения питания служит показанием к его отмене и возобновлении полного ПП.
В случае отсутствия необходимости оперативного лечения при подборе продукта для ЭП следует учитывать высокую (50%) вероятность развития вторичной лактазной недостаточности в период реконвалесценции, снижение функции переваривания и всасывания липидов. В качестве стартового продукта при наличии молока у матери показано назначение нативного грудного молока в сочетании с препаратами лактазы с последующей отменой последних под контролем экскреции углеводов с калом. При отсутствии грудного молока до полного купирования воспалительного процесса предпочтительно назначение смесей на основе полного гидролизата белка. После купирования воспалительного процесса и перевода на полное ЭП недоношенным детям назначают специальные смеси, из которых предпочтительны низколактозные или безлактозные, доношенным детям — стандартные адаптированные или безлактозные смеси в зависимости от наличия вторичной лактазной недостаточности. По показаниям назначают панкреатические ферменты, проводят коррекцию дисбиотических нарушений.
Профилактика[править]
Прочее[править]
Источники (ссылки)[править]
Неонатология. Национальное руководство. Краткое издание [Электронный ресурс] / Под ред. Н.Н. Володина — М. : ГЭОТАР-Медиа, 2013. — https://www.rosmedlib.ru/book/ISBN9785970424438.html
Дополнительная литература (рекомендуемая)[править]
Действующие вещества[править]
Источник
