Миелодиспластический синдром у детей что это такое


Миелодиспластический синдром (МДС) — тяжелое гематологическое заболевание, которое относится к группе онкопатологий и плохо поддается терапии. В основе недуга лежит нарушение процесса воспроизведения клеток крови: их развития и деления. В результате подобных аномалий образуются онкологические структуры, и формируются незрелые бласты. Постепенно количество нормально функционирующих, зрелых клеток в организме уменьшается. Данный синдром называют «дремлющим лейкозом» из-за скопления в крови бластных клеток.
Костный мозг — важный кроветворный орган, в котором происходят процессы образования, развития и созревания клеток крови, то есть осуществляется гемопоэз. Этот орган также принимает участие в иммунопоэзе — процессе созревания иммунокомпетентных клеток. У взрослого человека в костном мозге содержатся незрелые, недифференцированные и низкодифференцированные клетки – стволовые.

Большинство заболеваний костного мозга обусловлены мутацией стволовой клетки крови и нарушением ее дифференциации. МДС не является исключением. Расстройство кроветворения приводит к развитию острого лейкоза. Причина первичного МДС неизвестна. Мутагенные факторы оказывают негативное воздействие на стволовую клетку крови, что приводит к нарушению ДНК и выработке в костном мозге аномальных клеток, постепенно вытесняющих нормальные. Вторичный синдром развивается в результате длительного лечения цитостатиками, при частом контактировании с химическими веществами, в следствии облучения. Заболевание чаще развивается у пожилых лиц старше 60 лет, чаще у мужчин. Раньше среди детей синдром практически не встречался. В настоящее время недуг «помолодел». Все чаще случаи МДС наблюдаются у больных среднего возраста, что связано с экологическими проблемами крупных городов. Миелодиспластический синдром имеет код по МКБ-10 D46.
Цитопения — клиническое проявление патологий системы кроветворения. Симптоматика недуга определяется поражением определенной клеточной линии. У больных возникает слабость, утомляемость, бледность, головокружение, лихорадка, кровоточивость, кровоизлияния. Специфические признаки при этом отсутствуют. Диагностика патологии основывается на результатах гемограммы и гистологического исследования биоптата костного мозга. Лечение заключается в переливании основных компонентов крови, проведении химиотерапии, иммуносупрессивной терапии и пересадке костного мозга.

цитопения с нарушением созревания клеток крови по нескольким росткам
Эффективное лечение МДС – одна из самых сложных проблем современной медицины. Его проводят специалисты в области онкогематологии. Синдром в запущенных случаях приводит к онкологии. Но так происходит не всегда. Легкие формы недуга типа рефракционной анемии обычно не заканчиваются формированием рака. Недостаток клеток крови приводит к анемии, кровоточивости, сердечной дисфункции, увеличению риска развития инфекционных заболеваний. Прогноз МДС определяется особенностями течения патологического процесса, своевременностью диагностических и общетерапевтических мероприятий. Своевременная терапия – единственный реальный шанс сохранить и продлить жизнь больных.
Этиология и патогенез
Гемопоэз – процесс кроветворения, который заключается в образовании и созревании клеток крови. Он происходит непрерывно, что связано с коротким сроком жизни клеток: от нескольких дней до 3-4 месяцев. Ежедневно в живом организме синтезируется огромное количество новых кровяных телец из клеток-предшественников. В процессе миелопоэза образуются миелоидные клетки – эритроцитарные, лейкоцитарные и тромбоцитарные клеточные элементы. Под воздействием негативных экзогенных и эндогенных факторов в костном мозге происходят патологические изменения, возникает расстройство кроветворения.

Этиология и патогенез МДС в настоящее время полностью не изучены. Ученые установили факторы, провоцирующие развитие патологии:
- загрязнения окружающей среды,
- радиоактивное излучение,
- табакокурение,
- опасные и вредные производственные факторы,
- контакты с агрессивными веществами,
- длительное проведение иммуносупрессивной терапии,
- врожденные генетические заболевания.
Первичный или идиопатический синдром — недуг невыясненной этиологии, который развивается в 80% случаев у лиц в возрасте 60-65 лет.
Вторичный синдром обусловлен воздействием на организм химиотерапевтических препаратов или лучевой терапии. Эта форма обычно развивается у молодых людей, быстро прогрессирует, отличается высокой устойчивостью к лечению и максимальным риском развития острого лейкоза.
В костном мозге вырабатываются все клеточные элементы крови. Там они находятся в незрелом состоянии, то есть являются предшественниками зрелых форм. По мере необходимости каждая из них превращается в полноценные клетки и выполняет жизненно важные функции, от которых зависит процесс дыхания, гемостаз, иммунная защита. При МДС стволовые клетки погибают до выхода в кровяное русло и не достигают своей функциональной зрелости. Это приводит к дефициту нормальных клеточных форм в крови и нарушению их функций, связанному с клеточной дисплазией.
МДС часто называют тлеющей лейкемией или предлейкозом, обусловленном генной мутацией стволовых клеток. Клональная пролиферация эритроидных, миелоидных и мегакариоцитарных форм приводит к неэффективному гемопоэзу и панцитопении. В костном мозге и крови происходят характерные морфологические изменения, обусловленные аномальной клеточной продукцией. У больных увеличивается печень и селезенка. Нестабильность синдрома обусловлена тенденцией к переходу в острый миелобластный лейкоз.
Симптоматические проявления
МДС не имеет специфической симптоматики. Его клинические проявления определяются степенью тяжести и формой недуга.
-
 Анемический синдром — постоянный и обязательный признак патологии. Для него характерны гиперхромия и макроцитоз. Большой размер эритроцитов и их интенсивное окрашивание, зависящее от повышенного содержания гемоглобина, – признаки анемии при МДС и остром лейкозе. При анемии больные быстро утомляются, плохо переносят физические нагрузки, жалуются на головокружение, одышку, боль в груди, костях и суставах, невозможность сосредоточится. Их кожа становится бледной, ухудшается аппетит, снижается вес и работоспособность, возникает нервозность, цефалгия, дрожь в теле, шум в ушах, сонливость, тахикардия, обмороки. Плохо переносят анемию престарелые больные, а также лица с сердечно-легочной патологией. У них могут развиться тяжелые последствия – стенокардия, инфаркт миокарда, аритмии.
Анемический синдром — постоянный и обязательный признак патологии. Для него характерны гиперхромия и макроцитоз. Большой размер эритроцитов и их интенсивное окрашивание, зависящее от повышенного содержания гемоглобина, – признаки анемии при МДС и остром лейкозе. При анемии больные быстро утомляются, плохо переносят физические нагрузки, жалуются на головокружение, одышку, боль в груди, костях и суставах, невозможность сосредоточится. Их кожа становится бледной, ухудшается аппетит, снижается вес и работоспособность, возникает нервозность, цефалгия, дрожь в теле, шум в ушах, сонливость, тахикардия, обмороки. Плохо переносят анемию престарелые больные, а также лица с сердечно-легочной патологией. У них могут развиться тяжелые последствия – стенокардия, инфаркт миокарда, аритмии. - Нейтропения характеризуется лихорадкой, снижением сопротивляемости организма к патогенным биологическим агентам, частым развитием инфекционных заболеваний бактериальной и вирусной этиологии. У больных повышается температура тела, потливость, возникает слабость, увеличиваются лимфоузлы. Сепсис и пневмония у таких пациентов часто заканчиваются летальным исходом.
- При тромбоцитопении кровоточат десна, появляются гематомы и петехии, часто течет кровь из носа, возникают длительные кровотечения после мелких хирургических вмешательств и различных инвазивных манипуляций. Возможно развитие внутренних кровотечений, меноррагий, кровоизлияний в головной мозг. Массивная потеря крови часто становится причиной смерти пациентов.
- У больных возникает лимфаденит, гепатомегалия, спленомегалия, специфическое поражение кожи — лейкемиды.
МДС долгое время может протекать бессимптомно или иметь стертое течение. Больные часто не обращают внимание на слабовыраженные клинические проявления и не посещают своевременно врача. Обычно МДС обнаруживают случайно во время проведения очередного медосмотра.
Диагностика
Диагноз МДС ставят после проведения лабораторного исследования периферической крови и гистологического исследования биоптата костного мозга. Специалисты изучают образ жизни больного, его анамнез, наличие профессиональных вредностей.

наиболее достоверный диагностический метод – трепанбиопсия костного мозга
Диагностические методы при МДС:
- гемограмма — анемия, лейкопения, нейтропения, моноцитоз; панцитопения – абсолютное показание для цитологического исследования костного мозга;
- биохимия крови – определение уровня железа, фолиевой кислоты, эритропоэтина, ЛДГ и АСТ, АЛТ, щелочной фосфатазы, мочевины;
- иммунограмма – специальный комплексный анализ, позволяющий определить, в каком состоянии находится иммунная система;
- гистология костного мозга выявляет деструкцию ткани, очаги поражения, наличие аномальных клеток, дисбаланс кроветворной и жировой ткани, гиперплазию всех ростков кроветворения, признаки дисплазии клеток;

- цитохимическое исследование – нарушение обмена микроэлементов и витаминов: щелочной фосфатазы в лейкоцитах, миелопероксидазы, железа;
- цитогенетический анализ – выявление хромосомных аномалий;
- дополнительные инструментальные исследования, позволяющие оценить состояние внутренних органов — УЗИ, КТ и МРТ.
Только после полноценной диагностики и постановки правильного диагноза можно переходить к лечению недуга.
Лечение
Интенсивное лечение МДС заключается в применении целого комплекса мероприятий. В тяжелых случаях медикаментозную терапию проводят в условиях стационара. Больные с более легкими формами синдрома лечатся амбулаторно или на дневном стационаре. Основными среди общетерапевтических мероприятий являются химиотерапия и иммуносупрессивные методики. Трансплантация костного мозга проводится при тяжелом течении болезни и повышает шансы больных на выздоровление.

Лечение МДС проводится с целю нормализации показателей периферической крови, устранения симптомов патологии, предупреждения трансформации недуга в острый лейкоз, улучшения и продления жизни больных.
Симптоматическая терапия направлена на устранение клинических проявлений синдрома и сопутствующих заболеваний, осложняющих течение основного недуга.
- Внутривенное капельное введение кровяных ингредиентов – тромбоконцентрата или эритроцитарной массы. Тромбоцитарную массу переливают редко.
- Для профилактики гемосидероза – «Дисферал».
- Иммуносупрессоры – «Леналидомид», антитимоцитарный и антилимфоцитарный глобулин, «Циклоспорин А», комбинации глюкокортикоидов.
- Химиотерапевтические средства – «Цитарабин», «Дакоген», «Мельфалан».
- Препараты-стимуляторы эритропоэза — железосодержащие препараты: «Ферроплекс», «Фенюльс», «Сорбифер дурулес»; препараты витаминов: «Цианкобаламин», «Фолиевая кислота»; анаболики-стероиды: «Анаполон», «Нандролон»; препараты эритропоэтина: «Эральфон», «Эпокомб»
- Стимуляторы лейкопоэза – «Нейпоген», «Лейкоген», «Метилурацил», «Интерлейкин».
- Ингибирование апоптоза – естественной гибели клеток – «Сандиммун», «Весаноид».
- Ингибиторы развития кровеносных сосудов – «Талидамид», «Ревлимид».
- Гипометилирующие средства – «Азацитидин».
- При развитии инфекционных осложнений — антибиотики и антимикотики.
Схема лечения и дозировка препаратов зависят от возраста пациента, степени тяжести заболевания и общего состояния здоровья. Эффективность медикаментозной терапии достаточно низкая и непродолжительная. Единственный способ спасти больного — выполнить пересадку костного мозга. В тяжелых случаях также проводят трансплантацию стволовых клеток. Несмотря на свою эффективность, эти способы лечения имеют много недостатков: являются дорогостоящими, имеют высокую вероятность отторжения трансплантата, требуют дополнительной подготовки пациента к операции, вызывают трудности в поиске подходящего донора.
В настоящее время развитие генной инженерии и культивирование клеток крови достигли нового уровня. С их помощью процесс кроветворения можно регулировать. Специалисты определяют сколько клеток недовырабатывается индивидуально у каждого больного, а затем переходят непосредственно к лечению.
С помощью любого из вышеперечисленных методов можно добиться полной ремиссии синдрома.
Профилактика
Специфической профилактики синдрома не существует. Профилактические мероприятия, не допускающие ухудшения состояния больных и предупреждающие трансформацию синдрома в лейкоз:
- укрепление иммунитета,
- сбалансированное питание,
- поддержание гемоглобина на оптимальном уровне,
- частые прогулки на свежем воздухе,
- своевременное обращение к врачу при появлении первых признаков синдрома,
- периодическая сдача анализов и прохождение необходимых исследований,
- гигиена кожи,
- защита от контактов с химическими веществами,
- защита от радиации,
- ограничение активной физической нагрузки,
- своевременное лечение простудных и инфекционных заболеваний.
Прогноз
Прогноз МДС неоднозначный. Он зависит от тяжести патологии и своевременности лечения. Продолжительность жизни при легких формах синдрома составляет 15 лет, при наличии тяжелого течения недуга она не превышает 10 месяцев. При отсутствии или неэффективности лечения МДС трансформируется в острый лейкоз. Адекватная терапия обеспечивает максимальное продление жизни. Наблюдение за больными, имеющими стертую клиническую картину и относительно благоприятное течение недуга, осуществляют постоянно, даже в период стабильных показателей крови и костного мозга.
У пожилых людей синдром протекает особенно тяжело и плохо лечится. Это связано с наличием у них хронических заболеваний и подавлением иммунитета. Их организм не справляется, и процесс выздоровления затягивается.
Видео: базовая информация о миелодиспластическом синдроме
Источник
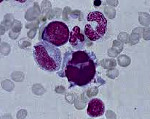
Миелодиспластический синдром – группа гематологических заболеваний, при которых наблюдаются цитопения, диспластические изменения костного мозга и высокий риск возникновения острого лейкоза. Характерные симптомы отсутствуют, выявляются признаки анемии, нейтропении и тромбоцитопении. Диагноз устанавливается с учетом данных лабораторных анализов: полного анализа периферической крови, гистологического и цитологического исследования биоптата и аспирата костного мозга и т. д. Дифференциальный диагноз может представлять значительные затруднения. Лечение – переливание компонентов крови, химиотерапия, иммуносупрессивная терапия, пересадка костного мозга.
Общие сведения
Миелодиспластический синдром – группа заболеваний и состояний с нарушениями миелоидного кроветворения и высоким риском развития острого лейкоза. Вероятность развития увеличивается с возрастом, в 80% случаев данный синдром диагностируется у людей старше 60 лет. Мужчины страдают несколько чаще женщин. У детей миелодиспластический синдром практически не встречается. В последние десятилетия гематологи отмечают увеличение заболеваемости среди лиц трудоспособного возраста. Предполагается, что причиной «омоложения» болезни могло стать существенное ухудшение экологической обстановки.
До недавнего времени лечение миелодиспластического синдрома было только симптоматическим. Сегодня специалисты разрабатывают новые методы терапии, однако эффективное лечение этой группы болезней все еще остается одной из самых сложных проблем современной гематологии. Пока прогноз при миелодиспластическом синдроме, в основном, зависит от особенностей течения болезни, наличия или отсутствия осложнений. Лечение осуществляют специалисты в сфере онкологии и гематологии.
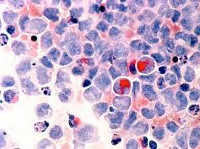
Миелодиспластический синдром
Причины и классификация миелодиспластического синдрома
С учетом причин развития различают два типа миелодиспластического синдрома: первичный (идиопатический) и вторичный. Идиопатический вариант выявляется в 80-90% случаев, диагностируется преимущественно у пациентов старше 60 лет. Причины возникновения установить не удается. В числе факторов риска первичного миелодиспластического синдрома – курение, повышенный уровень радиации при выполнении профессиональных обязанностей или проживании в неблагоприятной экологической зоне, частый контакт с бензином, пестицидами и органическими растворителям, некоторые наследственные и врожденные заболевания (нейрофиброматоз, анемия Фанкони, синдром Дауна).
Вторичный вариант миелодиспластического синдрома наблюдается в 10-20% случаев, может возникать в любом возрасте. Причиной развития становится химиотерапия или радиотерапия по поводу какого-то онкологического заболевания. В число лекарственных средств с доказанной способностью вызывать миелодиспластический синдром включают циклофосфан, подофиллотоксины, антрациклины (доксорубицин) и ингибиторы топоизомеразы (иринотекан, топотекан). Вторичный вариант отличается более высокой резистентностью к лечению, более высоким риском развития острого лейкоза и более неблагоприятным прогнозом.
В современной редакции классификации ВОЗ различают следующие типы миелодиспластического синдрома:
- Рефрактерная анемия. Сохраняется более полугода. В анализе крови бласты отсутствуют либо единичные. В костном мозге дисплазия эритроидного ростка.
- Рефрактерная анемия с кольцевыми сидеробластами. Сохраняется более полугода. В анализе крови бласты отсутствуют. В костном мозге дисплазия эритроидного ростка.
- Рефрактерная цитопения с многолинейной дисплазией. В анализе крови тельца Ауэра отсутствуют, бласты отсутствуют либо единичные, выявляются панцитопения и увеличение количества моноцитов. В костном мозге диспластические изменения менее 10% клеток в 1 миелоидной клеточной линии, бластов менее 5%, телец Ауэра нет.
- Рефрактерная анемия с избытком бластов-1. В анализе крови тельца Ауэра отсутствуют, бластов более 5%, цитопения и увеличение количества моноцитов. В костном мозге дисплазия одной либо нескольких клеточных линий, бластов 5-9%, телец Ауэра нет.
- Рефрактерная анемия с избытком бластов-2. В анализе крови увеличение количества моноцитов, цитопения, бластов 5-19%, могут выявляться тельца Ауэра. В костном мозге дисплазия одной либо нескольких клеточных линий, бластов 10-19%, обнаруживаются тельца Ауэра.
- Неклассифицируемый миелодиспластический синдром. В анализе крови цитопения, бласты отсутствуют либо единичные, тельца Ауэра отсутствуют. В костном мозге дисплазия одного мегакариоцитарного либо гранулоцитарного ростка, бластов более 5%, тельца Ауэра отсутствуют.
- Миелодиспластический синдром, ассоциированный с изолированной делецией 5q. В анализе крови анемия, бластов более 5%, возможен тромбоцитоз. В костном мозге более 5% бластов, тельца Ауэра отсутствуют, изолированная делеция 5q.
Симптомы миелодиспластического синдрома
Клиническая симптоматика определяется степенью нарушений миелопоэза. При мягко протекающих расстройствах возможно длительное бессимптомное или стертое течение. Из-за слабой выраженности клинических проявлений некоторые больные не обращаются к врачам, и миелодиспластический синдром обнаруживается во время проведения очередного медицинского осмотра. При преобладании анемии наблюдаются слабость, одышка, плохая переносимость физических нагрузок, бледность кожных покровов, головокружения и обморочные состояния.
При миелодиспластическом синдроме с тромбоцитопенией возникает повышенная кровоточивость, отмечаются десневые и носовые кровотечения, на коже появляются петехии. Возможны подкожные кровоизлияния и меноррагии. Миелодиспластический синдром с выраженными нейтропенией и агранулоцитозом проявляется частыми простудами, стоматитом, синуситом или стрептодермией. В тяжелых случаях возможно развитие пневмонии или сепсиса. Инфекционные заболевания нередко вызываются грибками, вирусами или условно-патогенными микробами. У каждого пятого пациента с миелодиспластическим синдромом выявляется увеличение лимфоузлов, селезенки и печени.
Диагностика миелодиспластического синдрома
Диагноз выставляется с учетом данных лабораторных исследований: анализа периферической крови, биопсии костного мозга с последующим цитологическим исследованием, цитохимических и цитогенетических тестов. В анализе периферической крови больных миелодиспластическим синдромом обычно обнаруживается панцитопения, реже выявляется дву- или одноростковая цитопения. У 90% пациентов наблюдается нормоцитарная либо макроцитарная анемия, у 60% — нейтропения и лейкопения. У большинства больных миелодиспластическим синдромом отмечается тромбоцитопения.
При исследовании костного мозга количество клеток обычно нормальное либо повышенное. Уже на ранних стадиях обнаруживаются признаки дизэритропоэза. Количество бластов зависит от формы миелодиспластического синдрома, может быть нормальным либо увеличенным. В последующем наблюдаются дисгранулоцитопоэз и дисмегакариоцитопоэз. У некоторых больных признаки дисплазии костного мозга выражены очень слабо. В процессе цитогенетического исследования у ¾ больных выявляются хромосомные нарушения. Дифференциальный диагноз миелодиспластического синдрома проводят с В12-дефицитной анемией, фолиево-дефицитной анемией, апластической анемией, острым миелолейкозом и другими острыми лейкозами.
Лечение и прогноз при миелодиспластическом синдроме
Тактика лечения определяется выраженностью клинической симптоматики и лабораторных изменений. При отсутствии явных признаков анемии, геморрагического синдрома и инфекционных осложнений осуществляется наблюдение. При миелодиспластическом синдроме с выраженной анемией, тромбоцитопенией и нейтропенией, а также при высоком риске возникновения острого лейкоза назначают сопроводительную терапию, химиотерапию и иммуносупрессивную терапию. При необходимости осуществляют пересадку костного мозга.
Сопроводительная терапия является самым распространенным методом лечения миелодиспластического синдрома. Предусматривает внутривенные инфузии компонентов крови. При длительном применении может провоцировать повышение уровня железа, влекущее за собой нарушения деятельности жизненно важных органов, поэтому переливания гемокомпонентов производят при одновременном приеме хелаторов (лекарственных средств, связывающих железо и способствующих его выведению).
Иммуносупрессоры эффективны при лечении миелодиспластического синдрома с отсутствием хромосомных аномалий, наличием гена HLA-DR15 и гипоклеточном костном мозге. Химиотерапию применяют при невозможности трансплантации костного мозга. Высокие дозы препаратов используют при трансформации миелодиспластического синдрома в острый лейкоз, а также при рефрактерных анемиях с избытком бластов при нормоклеточном и гиперклеточном костном мозге, низкие – при невозможности пересадки костного мозга. Наряду с перечисленными средствами пациентам назначают гипометилирующие средства (азацитидин). Наиболее надежным способом достижения полноценной длительной ремиссии является трансплантация костного мозга.
Прогноз зависит от типа миелодиспластического синдрома, количества хромосомных аномалий, необходимости в регулярных переливаниях компонентов крови, выраженности клинических проявлений и наличия осложнений. Различают 5 групп риска. Средняя выживаемость больных миелодиспластическим синдромом, входящих в группу с самым низким уровнем риска, составляет более 11 лет; с самым высоким – около 8 месяцев. Вероятность отторжения костного мозга после трансплантации – около 10%.
Источник
