Метаболический синдром и бронхиальная астма
Освещена проблема влияния метаболического синдрома на формирование и течение бронхиальной астмы
Метаболический синдром (МС) – «неинфекционная пандемия XXI века», одна из самых актуальных проблем современной медицины [1–3]. По данным экспертов Всемирной организации здравоохранения, около 17% женщин и 15% мужчин (треть населения земного шара) имеют избыточную массу тела или страдают ожирением [4]. Кроме того, в последнее время наметилась четкая тенденция к росту данной патологии, преимущественно среди лиц среднего и молодого возраста [5, 6].
Вместе с тем растет и количество патологических состояний, неразрывно связанных с МС [1, 6]. В 1989 г. N. Kaplan обозначил сочетание абдоминального ожирения, нарушенной толерантности к глюкозе, артериальной гипертензии (АГ) и гипертриглицеридемии как «смертельный квартет», а спустя пять лет G. Enzi заговорил о «смертельном секстете», добавив к вышеупомянутой четверке сахарный диабет (СД) 2-го типа, синдром апноэ во сне и подагру [7].
В настоящее время доказана и не подвергается сомнению связь МС с АГ, абдоминальным типом ожирения, неалкогольной жировой болезнью печени, атерогенной дислипидемией, инсулинорезистентностью и связанными с ней нарушениями углеводного обмена (вплоть до развития СД), гиперурикемией и/или подагрой [1]. Исследования последних лет позволяют также говорить об ассоциации МС с патологией билиарного тракта – холестерозом желчного пузыря и холестериновым холелитиазом [6, 8–11].
Необходимо отметить, что проблема ассоциированных с ожирением состояний привлекала внимание клиницистов еще тогда, когда понятия профилактики неинфекционных заболеваний практически не существовало. В работах отечественного ученого М.П. Кончаловского, датированных 1930 годом, можно встретить понятие «артритический диатез» (или «артритическая конституция»), которое объединяет избыточную массу тела, подагру, склонность к заболеваниям сердечно-сосудистой системы и бронхиальной астме (БА) [12, 13]. Именно эти данные стали первым предположением о взаимосвязи метаболических нарушений с БА.
БА так же, как и МС, является глобальной проблемой здравоохранения во всем мире. По приблизительным оценкам, общее количество больных в популяции составляет 334 млн, а распространенность заболевания в разных странах варьирует от 3 до 15%, при этом за последние несколько десятилетий число впервые диагностированных случаев БА возросло более чем в 3 раза [14]. В целях контроля возрастающей заболеваемости БА разработанные международным советом экспертов в 1993 г. Глобальные стратегии лечения и профилактики астмы (Global Initiative for asthma, GINA) ежегодно пересматриваются.
Патогенез
После того как было показано, что ключевым моментом, лежащим в основе и МС и БА, является хроническое персистирующее воспаление, вопрос о взаимосвязи этих двух патологических состояний стал весьма актуальным. Исследования последних лет обнаруживают высокую частоту развития БА у пациентов, имеющих индекс массы тела (ИМТ) 30 и более, что нашло свое отражение и в GINA, где был выделен отдельный вариант (фенотип) заболевания – «на фоне ожирения» [14–16]. Выделение фенотипов было предложено, прежде всего, с целью разработки пациентоориентированных подходов к лечению в случаях более тяжелого течения БА [17–19]. Кроме того, в этой же редакции рекомендаций среди прочих факторов, ухудшающих контроль симптомов и предопределяющих отсутствие положительного ответа на лечение, ожирение занимает одно из центральных мест. Несмотря на это, эксперты сходятся во мнении о необходимости дальнейшего изучения взаимосвязи между патологическими особенностями хронического воспаления дыхательных путей и определенными клиническими паттернами, в частности ожирением [14–19].
Известно, что именно с ожирения и развивающейся на его фоне инсулинорезистентности (ИР) начинается весь патогенетический каскад развития заболеваний, входящих в понятие МС [7, 20]. Инсулин является одним из центральных гормонов гомеостаза, биологическая роль которого выходит за пределы регуляции метаболизма только глюкозы и липидов [21]. Поскольку развитие ИР в ключевых метаболических органах (печень, мышцы, жировая ткань) сопровождается компенсаторной гиперинсулинемией, можно предположить, что в тканях, которые сохраняют свою чувствительность к инсулину, будет наблюдаться усиление его биологической активности [2, 5, 10]. В частности, этим объясняют развитие на фоне ИР «неметаболических» заболеваний, таких как БА, онкологические заболевания [1, 21].
Несмотря на то что экспрессия рецепторов к инсулину в легких была обнаружена еще в 1985 г. [22], их роль до сих пор остается не до конца изученной. Важно отметить, что взаимодействие этих рецепторов с инсулином обратимо [23]. Инсулиновые рецепторы играют важную роль в развитии эпителиальных клеток легких [15]. Miakotina O.L. et al. показали, что высокие уровни инсулина в крови у женщин с СД приводили к задержке процесса развития легких у плода путем ингибирования синтеза белка сурфактанта [24]. Отмечено, что инсулин через активацию фосфатидилинозитол-3-киназного пути способствует дегрануляции тучных клеток и усилению бронхоконстрикции [24, 25].
В основе БА лежит гиперреактивность дыхательных путей – чрезмерное сужение бронхов в ответ на нормальные стимулы. Такая гиперреактивность связана с дисфункцией эпителия бронхов и избыточной пролиферацией гладких мышц в пределах стенки бронха [26]. В настоящее время хорошо изучена способность инсулина индуцировать пролиферацию гладкомышечных клеток бронхов посредством активации расположенных на них рецепторов к инсулиноподобному фактору роста-1 [16, 27, 28].
Абдоминальную жировую ткань называют самостоятельным эндокринным органом, который синтезирует различные метаболически и иммунологически активные молекулы (фактор некроза опухоли α (ФНО-α), интерлейкины (ИЛ) -1, -6, -1β и др.), приводящие к запуску системной воспалительной реакции в организме [29–31]. Характерной особенностью этого воспаления является отсутствие специфической антигенной направленности и связи с синтезом специфических антител, поскольку не связано с проникновением чужеродного агента [12].
С-реактивный белок (СРБ), синтезируемый гепатоцитами, – один из наиболее чувствительных маркеров системного воспаления. Имеются данные о корреляции между уровнем СРБ и основными компонентами МС, а также степенью бронхиальной обструкции при БА [32].
ИЛ-6, продуцируемый активированными макрофагами жировой ткани, способен стимулировать реакции гуморального компонента иммунного ответа, которые контролируются Т-хелперами Тh-2 типа [33]. Если принять во внимание, что патогенез БА включает в себя как хроническое персистирующее воспаление в стенке бронхов, так и смещение регуляторного профиля Т-хелперов именно в направлении реакций гуморального типа, то связь БА и ожирения становится более очевидной [12].
В проведенных ранее исследованиях было установлено значительное увеличение сывороточной активности ФНО–α у больных, имеющих признаки МС, уже на самых ранних этапах его развития, при этом повышение уровня ФНО-α положительно коррелирует с количеством компонентов МС [3, 6]. Исходя из того, что ФНО-α также играет важную роль в патогенезе БА, усиливая воспалительные изменения в стенке бронхов, можно сделать предположение о взаимоотягощающем влиянии БА и ожирения [20, 31].
Еще одним моментом, предрасполагающим к более тяжелому течению БА у пациентов с МС, является снижение на фоне ожирения продукции противовоспалительных цитокинов, в частности ИЛ-10, подавляющего экспрессию воспалительных ИЛ-6 и ФНО-α [10, 31, 34].
В последние десятилетия в развитии МС и его компонентов большое внимание уделяется системе протеогормонов (адипокинов), продуцируемых жировой тканью, – лептину, адипонектину, резистину [7]. Адипонектин уменьшает продукцию свободных жирных кислот жировой тканью, повышает синтез противовоспалительных цитокинов (ИЛ-10, антагониста рецептора ИЛ-1), а через подавление ядерного фактора транскрипции NF-kB уменьшает процессы воспаления и апоптоза [35]. Лептин повышает β–окисление жирных кислот, стимулирует активацию макрофагов и моноцитов, которые продуцируют провоспалительные цитокины – ФНО-α, ИЛ-6, ИЛ-1 [20]. Показано, что у пациентов с ожирением отмечается достоверное снижение сывороточной концентрации адипонектина и повышение уровня лептина [11]. Рецепторы к лептину обнаруживаются в дыхательных путях, а уровень лептина в сыворотке крови напрямую коррелирует с содержанием лептина в бронхоальвеолярной жидкости [36]. Сам лептин служит медиатором дифференцировки липофибробластов в нормальные фибробласты и синтеза фосфолипидов легочного сурфактанта, тем самым определяет нормальное развитие легких. При наличии МС гиперлептинемия может усиливать аллергическое воспаление дыхательных путей, при этом лептинергический сигнальный путь сегодня рассматривают как один из центральных патогенетических механизмов при неатопической БА, возникшей у взрослых больных [37]. Участие лептина в развитии воспаления в бронхах было продемонстрировано на экспериментальных моделях и в клинических исследованиях [38]. В частности, у лептин-дефицитных мышей отмечается снижение синтеза макрофагами лейкотриенов – ключевых молекул, определяющих гиперреактивность бронхов, а введение экспериментальным особям экзогенного лептина увеличивает продукцию лейкотриенов [39]. Недавно было установлено, что лептин может уменьшать диаметр бронхов не за счет воспалительного отека слизистой, а посредством прямого ингибирования холинергического пути [38]. Кроме того, лептин оказывает стимулирующее действие на выработку ростковых факторов, запускающих пролиферацию клеток гладкой мускулатуры бронхов [37–39].
Рецепторы к адипонектину также выявляются на поверхности эпителия, выстилающего дыхательные пути, однако его уровни в сыворотке крови и бронхоальвеолярной жидкости не показали статистически значимой корреляционной связи [40]. Возможно, это объясняется тем, что молекула адипонектина имеет большую молекулярную массу и ей сложно проникнуть в дыхательные пути [34, 40].
Клиника и лечение
Безусловно, при ожирении снижается подвижность стенок грудной клетки и, как следствие, уменьшается ее экскурсия. Кроме того, для пациентов с абдоминальным типом ожирения характерно высокое стояние купола диафрагмы, которое приводит к уменьшению дыхательного объема легких и затруднению легочной вентиляции [41, 42].
Не исключается также определенная роль в ухудшении течения БА на фоне ожирения гастроэзофагеальной рефлюксной болезни (ГЭРБ) [12, 13]. Как известно, увеличение количества висцеральной жировой ткани неизбежно ведет к повышению внутрибрюшного давления, а это, в свою очередь, запускает механизм ретроградного заброса содержимого желудка и/или двенадцатиперстной кишки в пищевод [43]. По имеющимся в настоящее время данным, у 50% больных БА и ожирением диагностируется ГЭРБ, в то время как у больных БА с нормальным ИМТ ГЭРБ диагностируется в 30% случаев [5]. Кроме того, ряд исследований свидетельствуют, что аспирация гастродуоденального содержимого в респираторный отдел дыхательных путей – патогенетическое звено в инициации воспалительного процесса в бронхах [5, 12, 13].
На фоне проводимой терапии обострения БА, ассоциированной с МС, статистически значимо чаще не происходит полного восстановления показателей функции внешнего дыхания (по данным спирографии, пикфлоуметрии), отражающих рестриктивные нарушения, степень выраженности которых прямо пропорциональна степени абдоминального ожирения [18].
Сообщается также, что наличие МС у больных БА значительно ухудшает ее клиническое течение [17]. Так, например, показатели функции внешнего дыхания (жизненная емкость легких, форсированная жизненная емкость легких, объем форсированного выдоха за первую секунду, максимальная объемная скорость) при БА достоверно снижаются при абдоминальном характере ожирения, увеличении степени ожирения и степени АГ, повышении уровня гликемии натощак, выраженности атерогенных нарушений (возрастания концентрации триглицеридов и снижения уровня холестерина липопротеидов высокой плотности), а также при СД 2-го типа. Кроме того, ожирение абдоминального типа, АГ, СД 2-го типа достоверно ухудшают контроль над симптомами БА.
Именно меньшая эффективность базисной терапии с использованием ингаляционных глюкокортикостероидов (ИГКС) считается наиболее клинически значимой особенностью течения БА у больных с МС [19]. Исследования последних лет показали, что повышенный уровень ФНО-α у пациентов с БА и ожирением подавляет противовоспалительный эффект ИГКС на клеточном уровне, тем самым делая лечение менее успешным [44]. Показано также, что на фоне имеющегося ожирения у лиц с БА нередко наблюдается толерантность к бронходилататорам [44]. Все это в конечном итоге ведет к повышению суточной дозы применяемых лекарственных препаратов и, как следствие, к усилению нежелательных побочных эффектов, в первую очередь со стороны сердечно-сосудистой системы. В результате у больных с избыточной массой тела и ожирением частота обострений БА, требующих госпитализаций в специализированные пульмонологические отделения, увеличивается в 4 раза по сравнению с больными БА, имеющими нормальный ИМТ [12].
Заключение
Таким образом, данные современной литературы проливают свет на механизмы формирования и особенности клинического течения БА у пациентов с МС и ориентируют практических врачей и исследователей более пристально и серьезно оценивать поражение органов дыхания, которым на общем фоне проблем, ассоциированных с МС, не уделяется должного внимания.
Источник
Ермолова А.В., Будневский А.В.
Актуальность. Одно из хронических заболеваний, которое представляет глобальную медико-социальную проблему для всех возрастных групп – это бронхиальная астма (БА) [5].
За последнее время значительно выросла распространенность БА – около 300 миллионов человек: во взрослой популяции болезнь встречается в 6,0-7,5% случаев, в детской – в 12,5%, растет количество тяжелых форм, частота выхода на инвалидность по причине БА составляет 2,0%, растет уровень смертности – БА сокращает на 6,6 лет среднюю продолжительность жизни у мужчин и на 13,5 лет – у женщин.
С другой стороны неприемлемая ценовая политика в отношении лекарственных препаратов и, как следствие, неэффективная медикаментозная терапия, определяют низкий уровень качества жизни (КЖ) данной категории пациентов [2-5, 7].
Учитывая бурное развитие лечебно-профилактических мероприятий при БА, сформировавшиеся неблагоприятные тенденции могут быть объяснены отсутствием необходимого взаимодействия между медицинским персоналом и больными, невосприимчивостью пациентами рекомендаций врача и низким уровнем знаний больных о своем заболевании, неспособностью использовать полученную информацию в жизни. Также необходимо учитывать, что в большинстве случаев у пациентов отсутствует мотивация на адекватное лечение и профилактику, нет веры в выздоровление, что в итоге определяет прогноз БА [2,5,7].
В программе «Глобальная инициатива по бронхиальной астме» (Global Initiative for Asthma – GINA, пересмотр 2011), одним из первых пунктов ведения пациентов с БА обозначено обучение, направленное на борьбу с болезнью [2]. Физическим тренировкам (ФТ) также отведено одно из важных мест в лечебно-профилактическом процессе у больных БА, т.к. физические нагрузки с одной стороны могут выступать как провоцирующий фактор, способствующий обострению и усугубляющий течение заболевания, с другой стороны, ограничение физической активности непосредственно влияет на увеличение распространенности и степени тяжести БА [2].
Метаболический синдром (МС) – это комплекс нарушений гормонального, метаболического и клинического статуса, основой которого является инсулинорезистентность, компенсаторная гиперинсулинемия, абдоминальное ожирение, артериальная гипертензия, атерогенная дислипидемия. На I Международном конгрессе по преддиабету и МС последний определен как пандемия XXI века. Заболеванием страдает до 35,0-40,0% населения земного шара, чаще в возрасте старше 40 лет [6].
На современном этапе актуальность приобретает вопрос сочетанного течения широко распространенных и социально значимых заболеваний, таких как БА и МС. Ряд научных публикаций демонстрирует наличие между этими нозологическими формами многочисленных и сложных патогенетических связей, способствующих возникновению феномена взаимоотягощения, который ограничивает возможность контролируемого течения БА и снижает КЖ данной категории пациентов [1, 8].
Комплексный подход к организации лечебно-профилактических мероприятий с акцентом на обучение и дозированные ФТ у данной категории пациентов, позволит повысить эффективность проводимой противоастматической терапии, уровень контроля над БА, восстановить профессиональный и социальный статус, и как следствие, улучшить КЖ пациентов.
Цель работы – повысить эффективность лечебно-профилактических мероприятий у больных БА на фоне МС.
Материалы и методы. В исследование включили 60 человек с диагнозом БА смешанного генеза среднетяжелого течения, стадия ремиссии в сочетании с МС в возрасте от 18 до 60 лет (15 мужчин и 45 женщин, средний возраст составил 49,81±0,77 лет).
Диагноз БА был выставлен в соответствии с GINA (пересмотр, 2011) [2].
МС диагностировался в соответствии с критериями диагностики МС Международной диабетической Федерацией (2005) [6], рекомендациями экспертов Всероссийского научного общества кардиологов (2009) [4].
Критерии исключении из исследования: возраст моложе 18 и старше 60 лет, БА легкого и тяжелого течения, острый период заболевания, хроническая обструктивная болезнь легких, дыхательная недостаточность III ст., заболевания опорно-двигательного аппарата с функциональными нарушениями, тяжелые неконтролируемые и/или инкурабельные сопутствующие заболевания и их осложнения.
К моменту включения в исследование все пациенты получали стандартную медикаментозную терапию БА.
Методом случайных чисел было рандомизировано 2 группы: первая группа – 30 человек, которые наряду со стандартной медикаментозной терапией БА прошли курс обучения и ФТ, вторая группа – 30 человек, получали только традиционную терапию БА.
С учетом международного и отечественного опыта была разработана комплексная лечебно-профилактическая программа для больных БА с МС, с акцентом на образование пациентов и ФТ.
Обучение пациентов осуществлялось в группах по 4-5 человек. В течение одной недели проводили 5 семинаров длительностью 1 ч 30 мин. с перерывом на 10 мин. 4 семинара касались вопросов этиологии, патогенеза БА, особенностям клинической картины, лечения и профилактики БА, принципов самоконтроля и самоведения, 1 семинар — вопросов понятия «МС», этиологии, факторов риска, патогенеза, стадий развития МС. Пациенты были обеспечены печатными материалами – образовательные листовки и брошюры, посвященные основным вопросам БА и МС, возможностью связаться по телефону с исследователем с целью реализации индивидуального подхода к каждому пациенту и, при необходимости, коррекции лечебно-профилактических мероприятий.
ФТ включали комплекс лечебной гимнастики (ЛГ) для больных БА с учетом сопутствующего МС с методическими рекомендациями, курс ЛГ проводился ежедневно в течение 30 дней, после обучения.
Комплексное обследование больных включало оценку клинико-инструментальных показателей при включении в исследование и через 12 месяцев:
1. оценка тяжести течения БА по показателям «число обострений заболевания в течение последних 12 месяцев», «число вызовов бригад скорой медицинской помощи (СМП) в течение последних 12 месяцев», «число госпитализаций в течение последних 12 месяцев»;
2. оценка контроля над БА по результатам теста по контролю над астмой (Asthma Control Test™ – АСТ™);
3. оценка клинической симптоматики БА (одышка, чувство удушья, заложенности в груди, кашель с вязкой мокротой) с помощью 10-бальной визуальной аналоговой шкалы;
4. исследование функции внешнего дыхания (ФВД) по общепринятой методике с оценкой форсированной жизненной емкости легких – ФЖЕЛ, жизненной емкости легких – ЖЕЛ, объема форсированного выдоха за 1-ю сек. – ОФВ1, индекса Тиффно – ОФВ1/ЖЕЛ, пиковой объемной скорости – ПОС, максимальной объемной скорости — МОС, измеренной после выдоха первых 75%, 50%, 25% ФЖЕЛ – МОС 75,50,25, прироста ОФВ1 после проведения бронхолитической пробы;
5. оценка КЖ при помощи опросника The Short Form-36 (SF-36) с количественной оценкой 8 параметров: физическая активность – ФА, роль физических проблем в ограничении жизнедеятельности – РФ, боль – Б, общее восприятие здоровья – ОЗ, жизнеспособность – ЖС, социальная активность – СА, роль эмоциональных проблем в ограничении жизнедеятельности – РЭ, психическое здоровье – ПЗ.
Статистический анализ полученных данных выполнен на персональном компьютере с использованием программы Statgraphics Plus 5.1.
Результаты и обсуждение. В результате применения комплексной лечебно-профилактической программы у больных БА с МС через 12 месяцев получена статистически достоверная положительная динамика клинико-инструментальных показателей, тогда как у больных, которые получали только традиционную терапию БА, достоверной динамики исследуемых показателей получено не было.
В первой группе больных на фоне курса обучения и ФТ через 12 месяцев достоверно снизилось число обострений заболевания в течение последних 12 месяцев с 3,40±0,16 до 1,40±0,14 раз, т.е. в 2,4 раза (F=95,60; p=0,0000), число вызовов бригад СМП в течение последних 12 месяцев с 2,93±0,12 до 1,53±0,10 раз, т.е. в 1,9 раз (F=79,93; p=0,0000), число госпитализаций в течение последних 12 месяцев с 1,73±0,11 до 1,03±0,12 раза, т.е. в 1,7 раз, во второй группе динамика статистически значимой не была (табл. 1).
Таблица 1. Динамика числа обострений, вызовов бригад СМП и числа госпитализаций по поводу БА у больных в исследуемых группах

Примечание: здесь и далее n – число пациентов, количественные данные представлены в виде М±m, * – р < 0,05 – различия между группами являются достоверными
У больных первой группы через 12 месяцев достоверно улучшился контроль заболевания: полного контроля БА достигли 40,0% пациентов, частично контролируемое течение БА стало у 46,7%, неконтролируемое течение сохранилось у 13,3% пациентов (исходно все больные БА не контролировали заболевание) (χ2=48,38; р=0,0000).
По результатам АСТ™ в первой группе уровень контроля над заболеванием достоверно вырос с 13,50±0,44 до 21,87±0,63 баллов, т.е. на 8,37 баллов (F=116,90; p=0,0000), во второй группе динамика статистически значимой не была (табл. 2).
Таблица 2. Динамика показателей контроля над БА в исследуемых группах
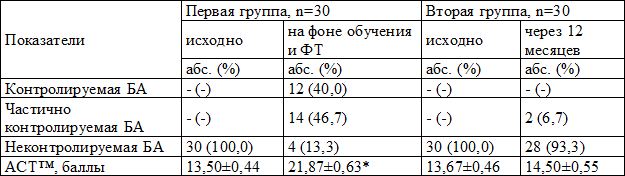
Примечание: здесь и далее абс. – число, % — процент случаев, прочерк «-» – отсутствие данных
Таблица 3. Динамика выраженности клинических симптомов БА в исследуемых группах
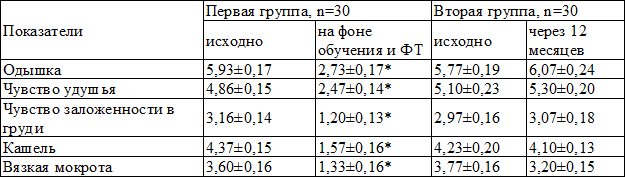
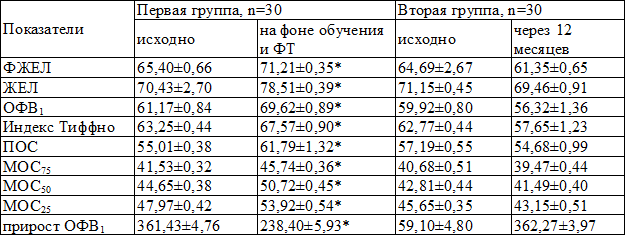
Таблица 4. Динамика спирометрических показателей в исследуемых группах

Через 12 месяцев у больных первой группы отмечено достоверное уменьшение выраженности клинических симптомов БА, во второй группе динамика статистически значимой не была (табл. 3).
Анализ ФВД у больных первой группы через 12 месяцев выявил достоверную положительную динамику – нормализация спирометрических показателей у 90,0% пациентов, во второй группе динамика статистически значимой не была (табл. 4).
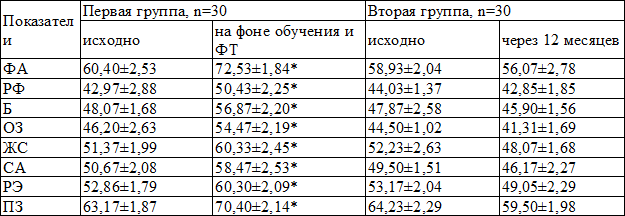
Через 12 месяцев у больных первой группы по результатам анкетирования с использованием опросника SF-36 получено достоверное положительное влияние курса обучения и ФТ как на физический, так и психологический компоненты КЖ за счет снижения числа обострения и госпитализаций, связанных с БА, уменьшения выраженности клинических симптомов заболевания, нормализации показателей спирограммы, во второй группе динамика статистически значимой не была (табл. 5).
Таблица 5. Динамика показателей КЖ больных БА в исследуемых группах
Выводы
1. Применение комплексной лечебно-профилактической программы с акцентом на обучение и ФТ, разработанной с учетом сопутствующего МС, приводит к достоверному уменьшению частоты обострений основного заболевания, снижению числа вызовов бригад СМП и количества госпитализаций.
2. Обучение и дозированные ФТ приводит к достоверному уменьшению выраженности дневных и ночных симптомов БА, нормализации показателям спирографии, достижению должного уровня контроля над заболеванием.
3. Лечебно-профилактическая программа с акцентом на обучение и ФТ оказывает достоверное положительное влияние на физический и психологический компоненты КЖ.
4. Необходимо включать в терапию больных БА образовательные программы и ФТ, разработанные с учетом сопутствующей соматической патологии с целью оптимизации лечебно-профилактических мероприятий, улучшения КЖ пациентов данной категории.
Источник
