Медицинская помощь больным синдромом диабетической стопы


Введение
Сахарный диабет (СД) — хроническое заболевание, сопровождающееся развитием сосудистых осложнений. По данным ВОЗ, в настоящее время в мире СД болеют 285 млн человек. Прогнозы показывают, что к 2025 г. количество больных СД достигнет 380 млн человек, а к 2035 г. — 600 млн. В настоящее время в России количество больных СД составляет 3 121 318 человек, из них 40–60% уже имеют поздние осложнения [1–3]. Известно, что СД является фактором риска для множества хронических заболеваний и одной из ведущих причин инфарктов, инсультов, почечной недостаточности, слепоты, долго не рубцующихся ран и ампутации нижних конечностей [4]. Если сегодня осложнения СД ежегодно являются причиной не менее 1,6 млн смертей в мире [5], то через 10 лет эта цифра удвоится. В России смертность от СД 1 типа составляет 2,1 на 100 тыс. населения, при СД 2 типа — 60,3 на 100 тыс. [1].
Лидирующее положение среди всех осложнений СД принадлежит синдрому диабетической стопы (СДС), встречающемуся у 20–80% больных в возрасте от 20 до 75 лет. Актуальность медико-социальной проблемы СД связана с высокой прогрессирующей распространенностью, инвалидизацией и возрастающей смертностью этих больных [1, 2, 6, 7].
В связи с актуальностью лечения хирургической инфекции больных СД СДС выделен в качестве самостоятельной нозологии (доклад исследовательской группы ВОЗ 1997 г. по теме «Сахарный диабет»). СДС — это патологическое состояние стоп больного СД, которое возникает на фоне поражения периферических нервов, сосудов, кожи и мягких тканей, костей, суставов и проявляется острыми и хроническими язвами, костно-суставными поражениями и гнойно-некротическими процессами.
Чаще всего осложнениям СДС предшествуют язвенные поражения. Наибольшая частота язв стоп зафиксирована в возрасте 45–64 лет, язвенно-некротические формы, нередко приводящие к ампутациям, развиваются в 15% случаев СДС [6].
Лидирующей причиной нетравматических ампутаций нижних конечностей является СДС, составляющий 50–70%. Гнойно-некротические процессы на стопе развиваются еще чаще, достигая 15% у больных СД [8, 9]. Длительно незаживающие язвы или раны становятся причиной развития гнойно-воспалительных осложнений, повторных госпитализаций и оперативного лечения [9–11]. В результате хирургического лечения у больных с СДС остаются различные раневые дефекты, которые переходят в длительно незаживающие язвы [12].
Факторы, влияющие на результат лечения язвенных и раневых дефектов стоп при СДС (ишемия, нейропатия, инфекция), имеют невысокое прогностическое значение [3, 13–16].
Лечение инфицированных ран ног составляет ¼ всех диабетических госпитализаций в США и Великобритании. Ориентировочная стоимость первичного лечения СДС в США составляет 4595 долл. и почти 28 тыс. долл. в течение 2 лет после постановки диагноза [17].
В результате консервативного лечения добиться первичного заживления язвенного дефекта удается в 63–81% случаев, необходимость ампутации при длительном лечении на различных уровнях конечности возникает у 14–24% пациентов, летальность достигает 5–13%. Эти цифры говорят об актуальности проблемы повышения эффективности лечения больных СД, имеющих хронические раны и язвы нижних конечностей [17, 18].
На заживление язвенных дефектов стоп у больных СД влияет множество факторов: периферическая нейропатия (сенсорная, моторная, автономная); факторы, предрасполагающие к нарушению макроциркуляции: метаболизм (нарушение липидного обмена, гипергликемия, повышение уровня свободных радикалов, гиперкоагуляция, гиперинсулинемия, протеинурия), зависимость от конституции (возраст, пол, ожирение, наследственность), курение, хроническая почечная недостаточность (гемодиализ), прием таких лекарственных препаратов, как β-блокаторы, тиазидные диуретики; нарушение микроциркуляции; инфекция; длительность течения СД; наличие длительно незаживающего язвенного дефекта; предшествующая ампутация [12, 14, 19]. Частота заживления в зависимости от типа дефектов варьирует от 57 до 94% [20].
Большинство авторов придерживаются консервативного подхода к лечению СДС, однако длительность такой терапии составляет долгие месяцы. По мнению многих авторов, стандартные схемы местной медикаментозной терапии раневых и язвенных дефектов малоэффективны. Требуется всесторонняя оценка эффективности использования современных перевязочных средств для местной терапии хронических ран и язв у больных с СДС [5, 6, 12, 17, 18].
Разнообразные клинические исследования показали высокую эффективность препаратов на основе ионизирующего серебра в лечении гнойно-некротических осложнений при СДС. Местная терапия в лечении хронических ран и язв сульфатиазолом серебра основана на высокой противомикробной активности в отношении грамположительных и грамотрицательных бактерий, различных резистентных к антибиотикам микроорганизмов, активизации регенераторных процессов в ране [18, 21, 22]. В России единственным препаратом с данным действующим веществом является Аргосульфан® [23].
Улучшение результатов комплексного консервативного лечения раневых и язвенных дефектов стопы при СД в настоящее время связывают с сохранением опорной функции пораженной конечности.
Цель работы — оценить эффективность местного лечения сульфатиазолом серебра раневых и язвенных дефектов у больных с СДС перед реконструктивными пластическими операциями.
Материал и методы
В исследование включили 120 пациентов, у которых воспалительный процесс на стопе в результате комплексного лечения имел благоприятное течение с формированием анатомических и функциональных дефектов, находящихся во второй и третьей стадиях раневого процесса.
Основную группу составили 58 (48,3%) пациентов, которым назначали сульфатиазол серебра в монотерапии. 62 (51,7%) пациента, которым назначали антибактериальные и дезинфицирующие мази на водорастворимой основе, составили контрольную группу. Сульфатиазол серебра наносили на поверхность раны или язвы тонким слоем 2–3 мм под окклюзионную повязку 1 р./сут.
В исследуемых группах СД 2 типа выявлен у 94 пациентов (78,3%), СД 1 типа — у 26 больных (21,7%). Средние сроки заболевания до момента диагностики СД составили 7,6+2,3 года. Возраст пациентов варьировал от 15 до 84 лет, основная часть больных (72,6%) — трудоспособного возраста (от 25 до 65 лет). Женщин было 63,3% (76 больных), мужчин — 36,7% (44 больных). Средний возраст — 55,6±3,8 года. В обеих группах большинство составили пациентыс нейроишемической формой СДС (НИФ СДС) — 87 человек (72,5%), нейропатическая форма СДС отмечена у 33 (27,5%) пациентов. Сопутствующая патология в виде ишемической болезни сердца, цереброваскулярной болезни, патологии опорно-двигательного аппарата, ожирения наблюдалась у 45% больных.
Со 2-й степенью поражения стопы по F.W. Wagner наблюдали 52 (43,3%) больных, с 3-й степенью — 68 больных (56,7%). Средняя площадь поражения составила 38,35+11,5 см2.
Комплексная консервативная терапия включала антибактериальные препараты, аналоги простагландина Е1, антикоагулянты или низкомолекулярные гепарины, разгрузку пораженной конечности и местное лечение. Всем пациентам, как оперированным по поводу осложнений СДС, так и получавшим консервативное лечение, назначали инсулинотерапию. Для лечения использовали инсулин короткой и средней продолжительности действия.
В клинической практике применялась классификация University Texas San Antonio (UTSA) (Frykberg R.G., Zvonis T., Armstrong D.G., 2006) (табл. 1), которая связывает глубину поражения с ишемией и инфекцией. UTSA-классификация используется во многих международных диабетических центрах, т. к. учитывает все важные элементы патогенеза диабетической язвы: инфекцию, ишемию и глубину гнойно-некротического процесса.

У всех больных при первичной хирургической обработке гнойного очага проводили посев отделяемого на микрофлору, определяли уровень микробной обсемененности и чувствительность микрофлоры к антибиотикам. Повторяли посевы из раны через каждые 3–5 сут, а также во время повторных хирургических обработок, перед выполнением кожно-пластической операции.
Одновременно с посевом при необходимости осуществляли микроскопическое исследование мазков-отпечатков из глубины раны, окрашенных по Граму.
Результаты исследования
Реконструктивным сосудистым операциям подверглись 52 (43,3%) пациента с НИФ СДС: из них 37 (30,8%) проведена реваскуляризация пораженной нижней конечности путем баллонной ангиопластики, 10 (8,3%) — стентирование пораженных артерий. Только медикаментозная коррекция критической ишемии проводилась у 5 (4,2%) пациентов.
При первичных бактериологических исследованиях получена полимикробная флора с преобладанием грамположительных бактерий (Staphylococcus aureus, Streptococcus spp.), бактерий семейства Enterobacteriaceae (E. coli, Klebsiella spp. и др.) и анаэробов, обсемененность ран составила 105–108 КОЕ/г у 87% больных. Моноинфекции, представленные грамположительными бактериями (Staphylococcus aureus, Streptococcus spp.), выявлены в 13% случаев.
После проведения курса противовоспалительной антибактериальной терапии совместно с местным лечением микробиологическая картина менялась в обеих группах исследуемых (табл. 2).

Мы изучили качественный и количественный состав микрофлоры после комплексного лечения, перед выполнением кожной пластики, опираясь на данные, полученные до и во время выполнения пластического закрытия раны. Количество Pseudomonas spp. до кожной пластики составило 10,7%, Proteus spp. — 2,4%, Acinetobacter spp. — 8,3%, Klebsiella spp. — 3,1%, анаэробы не определялись. Как видно, количество в посевах грамотрицательной флоры заметно преобладало. Так, Pseudomonas spp. высевалась у 14,1% оперированных из основной группы, Proteus spp. — у 3,7%, Acinetobacter spp. — у 10,4%, Klebsiella spp. — у 5,2%, анаэробы не определялись. Число посевов с отрицательным результатом увеличилось до 27,4%. Микробные ассоциации были выявлены только у 8% больных. Результаты бактериологического анализа у больных контрольной группы оценивали на момент полного разрешения гнойно-воспалительного процесса. После купирования воспалительного процесса уровень микробной обсемененности раневой поверхности в большинстве случаев не превышал 105 микробных тел в 1 г ткани и в среднем составлял lg 3,86+1,04.
В 1-е сут стационарного лечения у 80 больных (66,7%) преобладал воспалительный тип цитограммы. С начала использования в местной терапии сульфатиазола серебра очищение раневых и язвенных дефектов от некрозов и появление воспалительного типа цитограммы у больных основной группы отмечено на 4,8+0,8 сут (р<0,05). Сульфатиазол серебра поддерживал на поверхности раневых и язвенных дефектов умеренно влажную среду. У пациентов в основной группе появление грануляций отмечено к 9,6+0,9 сут (р<0,05) лечения. У пациентов группы сравнения сроки формирования грануляционной ткани были значительно дольше и составили 13,4+1,4 сут (р<0,01).
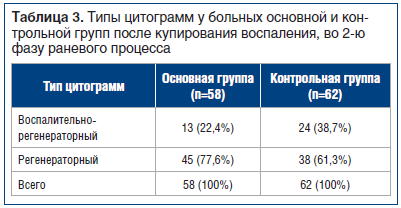
У пациентов группы сравнения, получавших стандартную местную терапию, воспалительный тип цитограммы зарегистрирован на 7,5+0,6 сут (р<0,05) стационарного лечения. По мере разрешения воспалительного и ишемического процесса, при комплексном консервативном лечении цитологическая картина менялась. На фоне лечения гнойно-воспалительного процесса сменялись фазы раневого процесса — из первой во вторую. К моменту проведения кожной пластики у 83 (69,2%) больных наблюдались регенераторные типы цитограмм, у 37 (30,8%) больных выявлен воспалительно-регенераторный тип (р<0,048) (табл. 3).
После купирования воспаления, очищения раневых и язвенных дефектов у 13,8% (n=8) больных в основной группе язвенные и раневые дефекты зажили самостоятельно в сроки 28,8+7,5 сут (р<0,05). В группе сравнения у 22,5% больных (n=14) сроки заживления ран и язв составили 54,8+4,7 сут (р<0,05). Средняя площадь раневых дефектов достигла 11,8+3,5 см2.
Остальным 81,7% (n=98) пациентов с раневыми и язвенными дефектами разной локализации на стопе были выполнены реконструктивно-восстановительные операции.
Пластика раны с помощью только местных тканей выполнена 39 (39,8%) больным. Пластика местными тканями с перемещением кожных лоскутов выполнена большинству пациентов — 27 (27,5%). Остальным 14 (14,3%) больным закрывали дефекты с помощью ротационных кожных лоскутов, дермотензии. Средняя площадь дефекта составила 30,25+9,6 см2. Оптимальными условиями для пластики местными тканями мы считали кровоток магистрального и измененного магистрального типа; показатели тканевой перфузии краев раны — более 1 пф. ед., ТсрО2 ≥ 30 мм рт. ст.
Пластика раневых и язвенных дефектов свободным кожным лоскутом выполнена 18 (18,4%) больным. Площадь раневого дефекта в среднем составила 14+8,4 см2.
При изолированной андрогензависимой дермопатии полное приживление свободного кожного лоскута отмечено у 15 (83,3%) из 18 больных. Лизис до 50% площади кожи выявлен у 2 (11,1%) пациентов, лизис больше 50% площади лоскута — у 1 (5,5%). Частичное отторжение кожного лоскута наблюдалось у 2 (11,1%) больных.
Несмотря на развитие осложнений в ближайшем послеоперационном периоде, хороший результат лечения был отмечен у 93 (77,5%) пациентов. В результате пластики местными тканями удалось сформировать плотный рубец, что позволило сохранить опорную функцию стопы у 32 (82,0%) из 39 больных, у которых применялся данный способ кожной пластики.
Вторичные дефекты сформировались у 14 (14,2%) больных. Нагноение раны выявлено у 5 (5,1%) больных, расхождение швов — у 4 (4,0%), ишемия лоскута с развитием краевого некроза — у 4 (4,0%), полный некроз лоскута — у 1 (1,0%) пациента. Частичное заживление ран, не требующее повторной кожной пластики, отмечено у 7 (7,1%) больных. Из них 5 (5,1%) пациентов выписаны с открытыми дефектами, которые самостоятельно зажили в сроки от 7 до 23 дней.
Количество осложнений, развившихся в раннем послеоперационном периоде, зависело от степени компенсации микрокровотока. При компенсированном кровотоке нам удалось получить малое количество осложнений, которые были отмечены у 3 (3,0%) больных, при субкомпенсированном кровотоке — большее количество осложнений, при котором отмечалось худшее заживление ран и приживление лоскутов, — у 16 (16,3%) больных.
В группе больных, получавших сульфатиазол серебра, отмечено сокращение сроков стационарного лечения перед кожно-пластическими операциями на 3,8+0,5 сут, уменьшение площади раневых и язвенных дефектов.
У 2 (1,6%) больных, получавших сульфатиазол серебра, отмечено появление аллергической реакции в виде крапивницы и зуда, что послужило поводом для отмены данного препарата у больных.
Заключение
Развитие осложнений после кожно-пластических операций связано с пролонгированной ишемией. Местное применение сульфатиазола серебра в комплексном лечении язвенных и раневых дефектов стопы, развившихся в результате тяжелых гнойно-некротических поражений на фоне СДС, ускорило регенераторно-репаративный процесс в ранах, сократило сроки госпитализации, позволило в ранние сроки подготовить раны и язвы к пластике, восстановить опорную функцию конечности. Это создает предпосылки для скорейшей физической и социальной реабилитации больного и значительно снижает затраты на лечение.
Благодарность
Компания «Валеант» поддерживала техническую редакцию статьи и обеспечивала взаимодействие между авторами настоящей публикации.
Источник
Синдром диабетической стопы относится к поздним осложнениям сахарного диабета. Является одним из самых распространенных осложнений, развивающихся при сахарном диабете.
Под синдромом диабетической стопы понимают целый комплекс нарушений в дистальных отделах ног, которые приводят к деструктивным поражениям костных тканей и язвенных поражений кожи.
Сидром диабетической стопы очень коварен, он трудно поддается лечению. По статистике почти 30-40% людей с сахарным диабетом страдают от этого синдрома. Чаще всего оно развивается у больных сахарным диабетом второго типа, так как часто люди не подозревают о том, что у них начался сахарный диабет. Диабет второго типа часто развивается незаметно, поэтому человек может долгое время не знать, что он болен. А за то время, пока он не следит за своим сахаром, начинают прогрессировать осложнения диабета, в том числе и синдром диабетической стопы.
Риск развития осложнений зависит от стажа диабета. Обычно у людей со стажем в 15-20 лет находят те или иные проявления синдрома диабетической стопы.
В настоящее время диагностика и лечение синдрома затруднено. Чаще всего, к лечению приступают на поздних сроках, когда вылечить последствия осложнения практически невозможно.
При повышении уровня гликолизированного (гликированного) гемоглобина на 1,5% от нормы увеличивает риск развития поражений нижних конечностей на 20%.
Из ста человек, страдающих от язв стопы, у 15-20 приходится проводить ампутацию ноги.
Симптомы диабетической стопы
Синдром диабетической стопы имеет множество проявлений, но все сводится к поражению стоп и, если во время не начать лечение, к гангрене и ампутации ноги.
Признаки, указывающие на развитие синдрома диабетической стопы:
- Поражается кожные покровы;
- Образуются язвы;
- Поражается костная ткань;
- Поражаются мягкие ткани стоп;
- Поражение периферических сосудов и нервов;
- Деформация стопы;
- Некротические процессы мягких тканей;
- Гангрена.
Причины развития поражений стопы
Основная причина развития синдрома диабетической стоп является декомпенсация сахарного диабета. Высокий сахар негативно влияет на состояние мелких сосудов, происходит нарушение иннервации ног и пальцев, что и приводит к образованию язв, к тому, что эти язвы переходят в хроническую форму, а затем поражение переходит на костную ткань и на мягкие ткани стопы.
Из-за плохой чувствительности легко получить травмы стопы – ожог, порез, наколоть или натереть ногу и т.д. Любая незначительная рана стопы может привести к тяжелым последствиям. Заживление происходит крайне медленно, а из-за ослабления защитных функций организма инфекция, попадая в рану, вызывает воспаление.
- Плохая компенсация сахарного диабета;
- Высокий гликированный гемоглобин;
- Резкие перепады сахара от гипогликемии к гипергликемии;
- Потеря чувствительности ног;
- Повреждения кожных покровов.
Формы диабетической стопы
В зависимости от того, какие поражения ног преобладают – нарушения кровотока или нарушения иннервации, различают три формы проявления синдрома диабетической стопы:
- Нейропатическая форма;
- Ишемическая форма;
- Смешанная форма.
Нейропатическая форма диабетической стопы
Нейропатическая форма развивается при поражении нервной системы нижних конечностей. Это самая распространенная форма диабетической стопы.
Из-за длительного влияния нейропатии происходят нарушения строения стопы, то есть происходит деформация стопы, а это вызывает неправильное перераспределение давления на разные участки стопы, что и приводит к возникновению нейропатической формы диабетической стопы: образуются мозоли, отеки. Такая форма возникает чаще всего на стопе или между пальцами ног.
Нейропатическая форма диабетической стопы может приводить к :
- Образованию нейропатической язвы;
- Возникновению нейропатических отеков;
- Развитие такого осложнения, как стопа Шарко.
Самой частой причиной развития нейропатической диабетической стопы является ношение неправильно подобранной обуви – слишком узкой, жесткой, с неудобным каблуком.
Проявления нейропатической формы диабетической стопы
- Отсутствие болей в области поражения;
- Сохраняется нормальная пульсация;
- Образовавшаяся язва имеет ровные края;
- В пораженной области отмечается усиление кровотока;
- Происходит деформация стопы;
- Часто на стопе образуются мозоли;
- Кожа стоп теплая, сухая.
Лечение нейропатической формы диабетической стопы
- Нельзя забывать, что любые нарушения, связанные с проявлением диабетической стопы, связаны в первую очередь с декомпенсацией сахарного диабета. Поэтому для успешного лечения проявлений нейропатической формы диабетической стопы необходимо наладить компенсацию. Надо привести сахара в норму. Так как при воспалении часто повышается потребность организма в инсулине, то привычные дозы надо будет увеличить.
- Часто нейропатическое поражение проявляется у людей, страдающих инсулинонезависимым диабетом в стадии декомпенсации, которые не могут добиться нормогликемии при помощи диет и сахаропонижающих препаратов. В таких случаях целесообразно перейти на инсулинотерапию и привести в норму свой сахар.
- Кожа стопы при нейропатических поражениях обладает слабыми защитными свойствами, и любые микроорганизмы легко проникают внутрь и вызывают воспаление. Поэтому необходимо провести антибактериальное лечение. Препараты и дозы должен назначить врач.
- Также под наблюдением врача следует проводить регулярную обработку раны (обработка краев, удаление отмерших слоев кожи).
- Для скорейшего излечения следует до минимума снизить нагрузку на больное место. В данном случае помогут костыли, кресло-каталка и ортопедическая обувь.
Ишемическая форма диабетической стопы
Ишемическая форма диабетической стопы встречается несколько реже, чем нейропатическая или смешанная. Она развивается вследствие нарушения кровоснабжения ног.
Возникает такая форма нарушений обычно на пальцах ног. Сильной деформации стопы не происходит.
Кровообращение в стопах нарушается при ношении неудобной, слишком узкой обуви, из-за постоянных отеков стоп.
Проявления ишемической формы диабетической стопы
- Человек испытывает боль и дискомфорт в месте поражения кожного покрова, которые ощущаются не только при ходьбе, но и в состоянии покоя;
- Язва отличается рваными, неровными краями;
- Пульсация в стопе сильно снижена или полностью отсутствует;
- Кровоток в стопе и пальцах ног сильно снижен;
- Для этой формы диабетической стопы не характерны мозоли, если они и есть, то в очень малом количестве;
- Кожа стоп холодная.
Лечение ишемической формы диабетической стопы
- Также как и при нейротической форме важно поддерживать нормальный уровень сахара в крови.
- Часто ишемическое поражение проявляется у людей, страдающих инсулинонезависимым диабетом в стадии декомпенсации, которые не могут добиться нормогликемии при помощи диет и сахаропонижающих препаратов. В таких случаях целесообразно перейти на инсулинотерапию и привести в норму свой сахар.
- При наличии сильных отеков стоп, проводят дегидратационную терапию.
- При неэффективности поддерживающих мер требуется хирургическое вмешательство. В зависимости от степени поражения проводят кожную транслюминальную ангиопластику — восстановление кровотока в сосудах без разреза кожи.
- Еще одна хирургическая операция, которую проводят для облегчения состояния больного — тромбартериэктомия или дистальное шунтирование веной in situ (по большой подкожной вене пускается кровоток в мелкие сосуды стопы).
Смешанная форма диабетической стопы
Смешанная форма диабетической стопы по распространенности стоит на втором месте после нейропатической.
Для этой формы характерно то, что у больного отмечаются признаки как нейротической, так и ишемической форм диабетической стопы.
Лечение смешанной формы диабетической стопы
- Контроль за уровнем сахара, необходимо стремиться к достижению нормогликемии;
- Надо разгрузить больную ногу, дать ей больше отдыхать;
- Тщательно обрабатывать язвы и другие поражения кожи;
- Антибиотикотерапия.
Диагностика проявлений диабетической стопы
- Важно регулярно самому проводить осмотр стоп с целью выявления малейших изменений на начальных стадиях.
- Следует обращать внимание на изменение цвета стоп (покраснение, бледность); на болевые ощущения; наличие отеков; грибковые поражения кожи и ногтей; деформации пальцев ног; на сохранение нормальной пульсации; на сухость кожи стоп. При каких-либо изменениях следует сразу же обратиться к врачу для дальнейшего обследования.
- Необходимо проводить неврологическое обследование, которое включает в себя исследование вибрационной чувствительности (проводится с помощью камертона); исследование температурной чувствительности; определение тактильной чувствительности.
- Определение лодыжечно-плечевого индекса. Это важный показатель для определения состояния кровотока. Для этого измеряют систолическое давление в плечевой артерии и в артериях ног. Соотношение этих показателей и показывает лодыжечно-плечевой индекс. В норме он составляет от 1,0 и выше. При поражении кровотока нижних конечностей индекс будет ниже 1,0.
- Важную информацию дает такое обследование, как ангиография сосудов ног. Она показывает наличие и степень тромбоза.
Профилактика поражений диабетической стопы
Во-первых, важно проводить постоянное наблюдение за состоянием ног больных, входящих в группу риска по диабетической стопе. В группу риска входят люди с избыточной массой тела, употребляющие алкоголь, курящие, люди в возрасте, имеющие начальные поражения ног, страдающие нефропатией.
Необходимо правильно подбирать обувь. Нельзя носить слишком тесную, узкую обувь. Желательно, особенно при наличии начальных поражений ног, носить специальную ортопедическую обувь.
И, самое главное, что необходимо для предотвращения развития осложнений, это компенсация сахарного диабета. Возможно, что надо будет перейти на инсулинотерапию, если диета и пероральные сахаропонижающие препараты не помогают держать уровень сахара в норме.
Источник
