Манухин геворкян синдром поликистозных яичников
Библиографическое описание:
Синдром поликистозных яичников: особенности диагностики / И. Б. Решетников, З. А. Нестеренко, И. А. Мацнева [и др.]. — Текст : непосредственный // Молодой ученый. — 2016. — № 26.2 (130.2). — С. 38-41. — URL: https://moluch.ru/archive/130/36153/ (дата обращения: 10.05.2020).
Ключевые слова: СПКЯ, гиперандрогения, бесплодие, ановуляция.
Введение: Синдром поликистозных яичников (СПКЯ), или синдром Штейна-Левенталя, – патология структуры и функции яичников, характеризующаяся овариальной гиперандрогенией с нарушением менструальной и генеративной функций [1].Заболевание встречается у 2–20 % женщин и является наиболее распространённой эндокринопатией у женщин репродуктивного возраста. Общая заболеваемость в мире составляет 3,5 % [2].
Заболевание было известно еще с 1328 года, французский раввин Леви Бен Гершом (1288–1344) упоминал о нем в своих трудах. В России о поликистозном перерождении яичников было упомянуто еще в конце XIX веке профессором Кронидом Фёдоровичем Славянским. Позже, уже в советской России, в 1928 году профессор Сергей Кузьмич Лесной после успешного лечения посредством клиновидной резекции яичников у пациенток с аменореей и опсоменореей, подробно описал морфологическую картину структурных изменений при поликистозе яичников и назвал этот феномен «склерокистозными яичниками». Двумя годами позже профессор Евгений Елисеевич Гиговский подробно описал гистологические изменения при склерополикистозе яичников. Наконец, в 1935 году американские гинекологи И. Штейн (I. F. Stein) и М. Левенталь (М. L. Leventhal) официально опубликовали результаты исследования, в котором описали семь клинических случаев пациенток с аменореей в сочетании с двусторонне увеличенными поликистозными яичниками, а также гирсутизмом и акне. С тех пор это состояние называют — синдром Штейна–Левенталя [3].
Анализ литературных источников:
В настоящее время этиология и патогенез СПКЯ времени остаются до конца не изученными, но в результате ряда исследований была доказана мультифакториальная природа данного феномена [4].
За последние 5 лет в результате исследований GWAS было найдено около 16 генов (например, FSHR и LHCGR), участвующих в развитии СПКЯ. Таким образом, точно определен полигенный характер СПКЯ [5].
Известно, что вклад генетических факторов в этиологию СПКЯ составляет 79 %, в то время, как состояния окружающей среды, образа жизни и индивидуальной истории болезни — около 21 % [3]. А само формирование фенотипа СПКЯ может формироваться, начиная с раннего детства и до периода полового созревания. Кроме того, доказана связь между развитием СПКЯ и низкой массой тела при рождении, влекущая за собой компенсаторный рост и гиперинсулинемию, которая, в свою очередь, снижает выработку глобулина, связывающего половые гормоны, в печени и образованию свободных андрогенов.
Существует гипотеза, что СПКЯ может развиться в результате генетически детерминированной гиперсекреции андрогенов яичниками, начавшейся в пубертатном периоде или еще задолго до него [6].
Суммируя основные современные представления об этой патологии, можно выделить основные положения патогенеза. Но сначала напомним основы стероидогенеза в яичниках. Синтез андрогенов происходит в клетках теки фолликулов определенной стадии зрелости диаметром 5–8 мм и в строме. Регулируют синтез андрогенов ЛГ инсулиноподобный фактор роста-I (ИПФР-I) и энзим (цитохром Р450с17). В превращении андрогенов (тестостерона и андростендиона) в эстрогены (эстрадиол и эстрон), так называемый процесс ароматизации андрогенов, участвует цитохром Р450с17. Синтез энзима регулируется ФСГ.
В ПКЯ гиперандрогения является следствием:
- Повышения уровня ЛГ в результате нарушения цирхорального ритма выделения ГнРГ и гонадотропинов, формирующегося в пубертатном возрасте, в период становления гормональной функции репродуктивной системы. Возможной причиной являются генетические факторы. Гиперстимуляция ЛГ нарушает фолликулогенез в яичниках, формируется кистозная атрезия фолликулов с гиперплазией тека-клеток, стромы и увеличением синтеза андрогенов. В результате дефицита ФСГ, необходимого для синтеза энзимов, ароматизирующих андрогены в эстрогены, происходит накопление андрогенов и дефицит эстрадиола.
- Важным механизмом гиперандрогении является характерная для СПКЯ инсулинорезистентность (ИР) — уменьшение утилизации глюкозы в организме. В результате возникает компенсаторнаягиперинсулинемия. Поскольку имеется дефект рецепторов инсулина, его действие реализуется через рецепторы ИПФР-I. Инсулин и ИПФР-I способствуют усилению ЛГ-зависимого синтеза андрогенов в тека-клетках и строме, а также стимулируя выброс ЛГ.
- Увеличение концентрации свободного биологически активного Т за счет уменьшения образования ПССГ. Синтез ПССГ уменьшается вследствие снижения уровня эстрадиола и гиперинсулинемии.
- Определенная роль принадлежит жировой ткани. При ожирении нарушается толерантность к глюкозе по диабетогенному типу. Развивается инсулинорезистентность и компенсаторная гиперинсулинемия. Вследствие этих метаболических нарушений усиливается синтез андрогенов в адипоцитах (жировых клетках) и соответственно превращение (ароматизация) тестостерона в эстрадиол и андростендиона в эстрон. Этот процесс имеет автономный характер, не зависит от гонадотропной стимуляции. Таким образом, жировая ткань является источником андрогенов и эстрогенов (в основном эстрона) внегонадного происхождения [10].
Исторически сложившийся термин «поликистоз» не соответствует реальной клинической ситуации, поскольку суть процесса заключается не в формировании кист яичника, а в накоплении незрелых фолликулов. При поликистозных яичниках процесс фолликулогенеза останавливается на стадии антрального фолликула. Таких фолликулов становится много, они часто расположены по периферии органа; на УЗИ их определяют в виде «нитки жемчуга». Жалобы женщин с СПКЯ, как правило, довольно стандартны:
— усиленный рост волос на теле по мужcкому типу, повышенная жирность кожи, угревые высыпания на лице, спине;
— нарушения менструального цикла (редкие менструации, длительное отсутствие менструаций, постоянные кровяные выделения);
— отсутствие беременности в течение продолжительного времени [3].
Однако диагноз может быть поставлен при наличии 2-х или 3-х следующих критериев:
1) хроническая ановуляция;
2) характерное изменение морфологии яичников на УЗИ;
3) гиперандрогения (лабораторная/клиническая) [7].
Для установления овуляторной дисфункции исследуют продолжительность менструального цикла: менструальный цикл> 35 дней предполагает хроническую ановуляцию, менструальный цикл немного превышающий норму (32–35 дней) или нерегулярный (32, 35, 36 дней) требует дальнейшего обследования, включающего определение сывороточного прогестерона [7].Определение сывороточного прогестерона проводится с 21 по 22 день цикла для исключения ановуляции. Прогестерон > 2,5 нг/мл свидетельствует об овуляции.
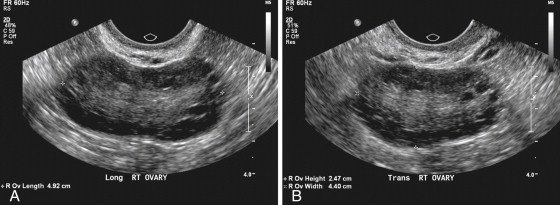
УЗИ признаки: увеличение объёма яичника более 10 мл, число анэхогенных фолликулов диаметром от 2 до 9 мм не менее 25 в одном яичнике,структура яичников оценивается при помощи УЗИ с трансвагинальным датчиком. Необходимо знать, что результат УЗИ зависит от чувствительности УЗ датчика, поэтому рекомендовано использовать датчики с частотой 8 mHz для оптимальной оценки морфологии яичников.

Рис. 1. А)трансвагинальное УЗИ в продольной плоскости, показывает морфологию поликистозных яичников. Многочисленные небольшие фолликулы окружают центральную эхогенную строму. B)трансвагинальное УЗИ в поперечной плоскости у той же пациентки [8].
Для эхографии крайне важно представлять макро- и микроскопическую структуру измененных гонад при данном патологическом состоянии. Основным макроскопическим признаком СПКЯ является двустороннее увеличение (в 2–6 раз) яичников, с наличием множества кистозно-атрезирующихся фолликулов. Поверхность яичников сглажена, признаки овуляции отсутствуют, капсула плотная, белесоватая и при осмотре невооруженным глазом представляется утолщенной. Капсула настолько утолщена, что фолликулярные кисты (кистозно-атрезирующиеся фолликулы), типичные для данной патологии, иногда не просвечивают через нее. Характерно симметричное двустороннее увеличение яичников с формированием мелкокистозных изменений в корковом слое и значительное утолщение белочной оболочки. Объем яичников при СПКЯ достигает 9,5–17,3 см3 (среднее значение 12,9 см3), что намного больше нормальных значений (3–8 см3).
Для гистологической картины первичных ПКЯ характерны: склероз капсулы яичников с утолщением ее до 600 мкм; гиперплазия стромы яичников; кистозная атрезия фолликулов; гиперплазия (иногда с лютеинизацией) клеток внутренней оболочки фолликулов. При так называемых вторичных ПКЯ размеры яичников, как правило, не достигают такой величины, как при первичных ПКЯ, и их увеличение часто бывает асимметричным. Капсула яичников также не столь резко утолщена, отмечается просвечивание множества фолликулов. Микроскопические особенности состоят в неравномерном утолщении капсулы, нерезко выраженной гиперплазии стромы, наличии атрезирующихся фолликулов, белых и изредка желтых тел.
Следует отметить, что некоторые исследователи высказываются более критично в отношении возможностей эхографии при диагностике СПКЯ, так как у 30 % женщин с данной патологией обнаруживаются неизмененные по величине и акустической структуре яичники. Из числа остальных больных с увеличенными яичниками отчетливая визуализация мелких кист оказалась возможной лишь у 40 % [9].
Если специалист не уверен в точности УЗИ-диагностики, то это исследование можно заменить определением антимюллерова гормона (АМН). Диагноз подтверждает АМН > 4,5 нг/мл [7].
Вывод. Таким образом, СПКЯ до настоящего времени является диагностической проблемой из-за отсутствия универсального диагностического метода. Клиническая картина данного патологического состояния должна указывать на объем необходимого дополнительного обследования. Ановуляция и гиперандрогенемия могут быть подтверждены соответствующими гормональными исследованиями. Усовершенствование ультразвуковой диагностики с использованием новых технических решений и подходов может способствовать выделению характеристик ПКЯ, определяющих клинико-патогенетические формы этого синдрома.
Литература:
- Национальное руководство по гинекологии 2013 год. Под редакцией акад. РАМН Г. М. Савельевой, акад. РАМН Г. Т. Сухих, проф. И. Б. Манухина.
- Gynecologic and Obstetric Pathology. Christopher P. Crum MD, Anna R. Laury MD, Michelle S. Hirsch MD, PhD, Charles Matthew Quick MD and William A. Peters MD. Copyright © 2016 by Saunders, an imprint of Elsevier Inc.
- СПКЯ: новый взгляд на проблему. Многообразие симптомов, дифференци-альная диагностика и лечение СПКЯ. Информационный бюллетень / И. Г. Шестакова, Т. С. Рябинкина; под ред. В. Е. Радзинского. — М.: Редакция журнала StatusPraesens, 2015. — 24 с.
- De Leo V, Musacchio MC, Cappelli V, Massaro MG, Morgante G and Petraglia F. Genetic, hormonal and metabolic aspects of PCOS: an update. Reprod. Biol. Endocrinol. 2016; 14 (1): 38.
- Medline (PubMed, USA) [Электрон. ресурс]. — Режим доступа: https://www.ncbi.nlm.nih.gov/pubmed/27513023 [06.11.2016].
- The polycystic ovary syndrome: a position statement from the European Society of Endocrinology. Gerard Conway, Didier Dewailly, EvanthiaDiamanti-Kandarakis, Héctor F. Escobar-Morreale, Stephen Franks, Alessandra Gambineri, FahrettinKelestimur, DjuroMacut, Dragan Micic, Renato Pasquali, et al. Eur J Endocrinol. 2014 Oct; 171(4): P1–29. Published online 2014 May 21. doi: 10.1530/EJE-14–0253.
- Consensus of French Endocrine Society on female hyperandrogenism. Recommendations for investigation of hyperandrogenism, 2010.
- Ferri’s Clinical Advisor 2016. Fred F. Ferri M. D., F. A. C. P. Copyright © 2016 by Elsevier, Inc. All rights reserved.
- Гус А. И., Серов В. Н., Назаренко Т. А., Бутарева Л. Б., Джунаидова Л. А., Смирнова А. А. Научный центр акушерства, гинекологии и перинатологии (дир. — акад. РАМН В. И. Кулаков), РАМН, Москва. Современные принципы ультразвуковой, клинической и лабораторной диагностики синдрома поликистозных яичников (обзор литературы). Гинекология. 2002; 02:
- Манухин И. Б., Геворкян М. А., Кушлинский Н. Е. Синдром поликистозных яичников. — М., 2004. — 240 с.
Основные термины (генерируются автоматически): яичник, менструальный цикл, синтез андрогенов, трансвагинальное УЗИ, сывороточный прогестерон, патологическое состояние, кистозная атрезия фолликулов, жировая ткань, GWAS, FSHR.
Источник
Многообразие клинических проявлений синдрома поликистозных яичников (СПКЯ) сопряжено с трудностями его диагностики. За последние годы предложено несколько диагностических критериев СПКЯ [1].
По данным консенсусного симпозиума Европейского общества репродукции и эмбриологии и Американского общества репродуктивной медицины (ESHRE/ASRM) 2010 г. [2], частота СПКЯ у женщин составляет 6-10% в соответствии с диагностическими критериями Национального института здоровья США; если опираться на критерии Роттердамского симпозиума 2003 г. [3], то этот показатель составляет 15%.
Определить распространенность СПКЯ среди девушек-подростков в настоящее время затруднительно, в связи с отсутствием достоверных критериев диагностики и недостаточным вниманием к манифестации эндокринно-метаболических проявлений в пубертатном пери оде.
По данным консенсуса Европейской ассоциации эндокринологов (ESHRE) 2012 г., у 45% пациенток с СПКЯ наблюдалось бесплодие [2]. Частота СПКЯ в структуре причин эндокринного бесплодия достигает 62% [2]. Тесная ассоциация СПКЯ с дисметаболическими состояниями влечет развитие таких осложнений, как ожирение и сахарный диабет 2-го типа, развивающийся в дальнейшем у 10% женщин в репродуктивном возрасте [4-7, 28, 29]. У 2-7% пациенток с СПКЯ вероятно развитие гиперпластических процессов эндометрия и молочных желез [2, 28, 29].
Этиология и патогенез СПКЯ: ключевые моменты
Ключевым моментом в формировании поликистоза яичников является длительная (хроническая) ановуляция различного генеза, проявляющаяся характерными морфологическими изменениями в яичниках и сопутствующими гормональными, дисметаболическими нарушениями, которые являются звеньями единого многофакторного патогенетического механизма.
Этиологическими и патогенетическими звеньями этого процесса могут быть: нарушение ритма секреции гонадотропного рилизинг-гормона (ГнРГ) и гонадотропинов, главным образом лютеинизирующего гормона (ЛГ); гиперандрогения (ГА), инсулинорезистентность и гиперинсулинемия, нарушения липидного обмена, гиперпролактинемия. Установить, какой из компонентов этого сложного процесса является первичным, не всегда представляется возможным [4, 6, 8, 9]. Среди вероятных причин также рассматриваются изменения в обмене нейромедиаторов и опиоидов и, как следствие, снижение их ингибирующего действия на секрецию ГнРГ [6].
Периферическая конверсия андрогенов в эстрогены происходит преимущественно в жировой ткани. Ожирение, в особенности висцеральное, в период адренархе считается одним из ведущих факторов риска развития СПКЯ, а также состоянием, сильно осложняющим течение синдрома. Висцеральный жир метаболически активен, и в результате липолиза происходит высвобождение жирных кислот и продукция ряда цитокинов (фактора некроза опухоли, интерлейкина-6, лептина, резистина), которые способствуют развитию инсулинорезистентности [7, 10, 11]. Повышенная концентрация жирных кислот посредством фактора некроза опухоли вызывает фосфорилирование серина в инсулиновом рецепторе и, как следствие, нарушение нормального механизма его активации и формирование инсулинорезистентности. Избыток свободноциркулирующих жирных кислот способен приводить к повышению уровня андрогенов за счет фосфорилирования цитохрома Р-450с17, в результате чего активируется 17,20-лиаза, и синтез андрогенов идет по пути повышенной выработки андростендиона, дегидроэпиандростендиона (ДГЭА) и тестостерона (это важно учитывать при лабораторной диагностике СПКЯ) [6].
Немаловажную роль в патогенезе СПКЯ играет инсулинорезистентность, развивающаяся на фоне гиперинсулинемии. ГА при гиперинсулинемии формируется за счет как усиления овариальной продукции андрогенов, так и подавления секреции полового стероидсвязывающего глобулина (ПССГ), снижающего содержание биологически активных андрогенов в крови. ЛГ и инсулин являются синергистами — инсулин потенцирует действие ЛГ. Инсулинорезистентность и гиперандрогенемия находятся в прямой зависимости друг от друга [12]. Инсулин может играть роль агониста рецепторов к инсулиноподобному фактору роста и, таким образом, клетки теки яичника становятся более чувствительными к воздействию инсулина. В основе инсулинорезистентности может лежать дефект активации сигнальных путей инсулина (вместо фосфорилирования тирозина происходит фосфорилирование серина), опосредованный избытком свободноциркулирующих жирных кислот. Таким образом, избыток массы тела усугубляет уже имеющуюся инсулинорезистентность [13].
Повышенный уровень пролактина также может способствовать развитию патологических состояний — от уменьшения длительности лютеиновой фазы менструального цикла до хронической ановуляции [14]. Механизм патологического воздействия избытка пролактина на нормальный менструальный цикл состоит примерно в следующем: в ответ на повышение содержания пролактина с целью привести его уровень к нормальным значениям активируется тесно ассоциированная с ним дофаминергическая система, параллельно снижается уровень ГнРГ путем ингибирования его секреции. Выявление клинического (галакторея) и лабораторного повышения уровня пролактина очень важно в определении генеза ановуляции [14].
Одной из причин развития хронической ановуляции является нарушение синтеза тиреоидных гормонов. В том числе и потому, что гипотиреоз тесно ассоциирован с гиперпролактинемией [15].
В периоде полового созревания, при переходе к зрелому типу функционирования репродуктивной системы, даже при установившемся менструальном цикле и гормональном статусе, приближающемся к таковому фертильного периода, репродуктивная система значительно лабильна и высокочувствительна к воздействию любых неблагоприятных экзогенных и эндогенных факторов. Характерная для периода полового созревания неустойчивость цирхорального (суточного) ритма гонадотропинов, усиление активности коры надпочечников и метаболизма инсулина: физиологическое повышение уровня андрогенов (дегидроэпиандростерона сульфата -ДГЭА-С) и инсулина в крови, — являются дополнительными факторами, способствующими формированию СПКЯ.
В периоде раннего пубертата отмечается физиологический скачок роста, обусловленный активацией функции коры надпочечников, а также повышение секреции андрогенов. Действие любого неспецифического фактора может перевести физиологическую андрогению в патологическую ГА и в итоге привести к формированию поликистоза яичников [9, 16].
В период до 18-20 лет даже малые стрессорные воздействия: гиперинсоляция, чрезмерные физические перегрузки, психоэмоциональное напряжение, перенесенные ОРВИ и другие неблагоприятные факторы, — могут оказывать выраженное негативное влияние на физиологию репродуктивной системы, постепенно приводя гипоталамо-гипофизарную систему к декомпенсации [8, 17, 18].
Особенности диагностики СПКЯ у подростков
Формирование СПКЯ и манифестация его клинических проявлений часто начинаются именно в подростковом возрасте [19, 20].
Для исключения гипердиагностики и неоправданного лечения некоторые эндокринологи [8, 20] склоняются к тому, что определить диагноз СПКЯ возможно только после 18 лет, а до этого целесообразно использовать термин «формирующийся СПКЯ». Однако, по данным последнего консенсусного симпозиума ESHRE/ASRM (2010), у юных пациенток целесообразно ставить диагноз СПКЯ при подтверждении всех трех диагностических критериев [3]: олигоменореи и/или аменореи; гиперандрогенизма (гирсутизм, acne vulgaris, алопеция) или ГА (повышенный уровень общего или свободного тестостерона); поликистозных яичников при ультрасонографии [21].
Одним из патогномоничных клинических симптомов СПКЯ является нарушение менструального цикла по типу олигоменореи или аменореи. Однако в первые годы после менархе ановуляцию можно выявить почти у 40-50% девушек [8, 20]. В норме, при становлении менструальной функции девушки, число овуляторных циклов постепенно растет от 20-25% в первый год после менархе, до 60-65% к пятому году. В то же время число овуляторных циклов у женщин с диагностированным СПКЯ не превышает 30-32% [4].
При отсутствии тенденции к формированию устойчивого регулярного менструального цикла в течение более 1 года после менархе необходимо клинико-лабораторное обследование юных пациенток.
Основные клинические ГА при СПКЯ — различные варианты андрогензависимой дермопатии: гирсутизм, акне (acne vulgaris) и андрогенная алопеция. Распространенность акне среди подростков достаточно велика (среди европейцев — до 80% [22]) и зачастую считается транзиторным явлением. Гораздо более значимым признаком ГА является гирсутизм, оцененный по шкале Ферримана [2, 6, 8]. Лабораторная диагностика ГА часто затруднена: определение лишь уровня общего тестостерона в отсутствие данных о концентрации ПССГ и свободного тестостерона малоинформативно вследствие того, что избыток тестостерона конвертируется в более биологически активный дегидротестостерон [6]. Также при проведении мультистероидного анализа у 20% девушек с формирующимся СПКЯ было выявлено повышение уровня андростендиона [16]. Возможно, одним из звеньев этого механизма является избыточная масса тела и увеличение уровня свободных жирных кислот, способных приводить к активации 17,20-лиазы и, как следствие, синтеза андрогенов по пути выработки андростендиона, ДГЭА и тестостерона.
Традиционно одним из важнейших критериев диагностики СПКЯ признается изменение величины отношения ЛГ/ФСГ≥1,5 [4], тогда как данные Роттердамского консенсуса и Национального института здравоохранения США его не включают. Этот критерий считается малоинформативным, поскольку существует несколько изоформ ЛГ, различающихся строением боковых олигосахаридных цепей и, как следствие, уровнем биологической активности. По-настоящему информативным маркером СПКЯ может являться именно уровень биоактивных форм ЛГ (который не выделяется при рутинной лабораторной диагностике), а не соотношение концентрации всех изоформ к ФСГ [2, 6].
В диагностике поликистоза яичников значимую роль играет ультразвуковое исследование. Основными ультразвуковыми критерими для верификации СПКЯ являются: объем яичника более 10 см3 и количество — наличие множества, более 12 равновеликих (или кистозно-атрезирующихся) фолликулов диаметром до 10 мм (расположенных по периферии) [20, 23].
Ультразвуковую картину поликистоза яичников важно дифференцировать: от мультифолликулярных яичников, характерных для раннего пубертата; от гипогонадотропной аменореи и картины, характерной для длительного приема комбинированных оральных контрацептивов (КОК). Мультифолликулярные яичники характеризуются небольшим числом фолликулов (до 8-10 в каждом яичнике) диаметром 4-10 мм, расположенных по всему яичнику, и нормальным объемом яичника [4, 23]. Особенностью пубертатного периода является установление овуляторных менструальных циклов на фоне мультифолликулярных яичников. Учитывая, что мультифолликулярные яичники являются вариантом нормы для девушек в пубертатном периоде до установления регулярного овуляторного цикла, то этот критерий не может быть основным признаком СПКЯ. Однако важна интерпретация ультразвуковых критериев в совокупности с сопутствующими гормональными и дисметаболическими нарушениями, которые могут трактоваться в контексте как признаки формирующегося поликистоза яичников у юных пациенток.
Пациентки, демонстрирующие те или иные проявления метаболического синдрома, могут представлять собой группу риска по формированию СПКЯ [4, 10, 11]. Традиционные физикальные методы: определение индекса массы тела, оценка соотношения объема талии и бедер, измерение толщины кожной складки — позволяют выявить первые признаки метаболических нарушений. Установлена прямая связь между степенью нарушения менструального цикла и индексом массы тела пациенток с СПКЯ, а также между инсулинорезистентностью и ГА. Маркерами дисметаболических состояний при СПКЯ служат следующие показатели: индекс F. Caro менее 0,33; HOMA-IR (индекс инсулинорезистентности — Homeostasis Model Assessment of Insulin Resistance) более 2,86 балла; гиперинсулинемия более 12,8 мкЕД/мл и нарушения липидного обмена (повышение уровня холестерина и триглицеридов, снижение уровня липопротеидов высокой плотности) [3, 6, 24].
Возможности терапии СПКЯ у юных пациенток
Актуальным вопросом является выбор эффективных и безопасных лечебных мероприятий, направленных на коррекцию СПКЯ у девушек-подростков.
У пациенток репродуктивного возраста ведущей причиной для обращения к врачу является бесплодие. Поэтому основной лечебной стратегией у них является восстановление репродуктивной функции с помощью: стимуляции овуляции, коррекции сопутствующих гормональных и метаболических нарушений. В некоторых случаях при отсутствии эффекта от стимуляции овуляции применяется хирургическое лечение — лапароскопическая каутеризация (drilling) яичников для редукции избыточного количества примордиальных фолликулов, снижения ГА. Эффективность лечения в основном определяется достижением желанной беременности. С целью лечения и профилактики поликистоза яичников используются также комбинированные монофазные оральные контрацептивы.
В особом внимании нуждаются девушки-подростки, у которых проявления СПКЯ — нарушения менструального цикла, ГА и мультифолликулярные яичники по данным ультразвукового исследования сочетаются с метаболическим синдромом (избыточной массой тела и ожирением, сахарным диабетом 2-го типа, дислипидемией) в силу выраженной декомпенсации имеющихся эндокринно-метаболических нарушений [25]. Именно на их коррекцию должны быть в первую очередь направлены терапевтические меры. Своевременная коррекция метаболических нарушений, достигаемая изменением образа жизни, назначением сбалансированного питания, редукционной диеты, применением гипогликемических препаратов, приводит к нормализации гормонального статуса и восстановлению менструальной функции на клиническом уровне.
В случае отсутствия желаемого эффекта вторым этапом терапии может являться применение КОК. Все механизмы, которые реализуют КОК для контроля над менструальным циклом, до сих пор не изучены, однако известно, что они подавляют секрецию ЛГ, что в свою очередь ведет к снижению уровня андрогенов. Эстрогенный компонент комбинированных контрацептивов приводит к повышению уровня ПССГ и, следовательно, снижению концентрации свободно-циркулирующего тестостерона. Применение этих препаратов ведет к подавлению надпочечниковой секреции андрогенов — возможно, это происходит потому, что КОК ингибируют АКТГ [2, 16, 26].
На данный момент существует ряд КОК, содержащих прогестагенный компонент, обладающий антиандрогенной активностью (дроспиренон, циптотерона ацетат), рекомендованных к назначению у девушек и женщин с клинически выраженной ГА [2, 16, 21, 27]. В основе их действия лежит ряд механизмов: угнетение синтеза яичниковых андрогенов по механизму прямой связи, блокирование периферических рецепторов к андрогенам, снижение образования дегидротестостерона в результате подавления 5-α-редуктазы. Также дроспиренон дает гипогликемический эффект. Возможно назначение комбинированных контрацептивов по стандартной схеме (21 день, затем 7-дневный перерыв) на 3-6 менструальных циклов и по пролонгированной схеме (63 дня, затем 7-дневный перерыв) [25, 28]. Однако эффективность этих препаратов пока остается предметом множества дискуссий и подвергается сомнению, возможно, в силу недостаточности достоверных данных об их эффективности и ограничений применения у юных пациенток. В целях терапии гиперандрогенных состояний возможно применение антиандрогенных препаратов (ципротерона ацетат) в сочетании с КОК, эстрадиола валератом или по отдельности [6].
После окончания курса КОК (в сочетании с антиандрогенными препаратами или без них) возможно проведение индукции овуляции [28].
Формирование СПКЯ в пубертатном периоде является следствием воздействия на репродуктивную функцию различных патогенетических факторов, в результате чего нарушается становление менструальной функции, рост и созревание фолликулов, что ведет к формированию ановуляции.
Манифестные признаки поликистозных яичников могут наблюдаться при нормальном периоде полового созревания, а отдельные их признаки могут оказаться транзиторными явлениями. Вопросы ранней диагностики, определения клинически значимых маркеров СПКЯ и его предикторов у пациенток подросткового возраста требуют углубленного изучения для оптимизации подходов к проведению скрининговых исследований, выявления групп риска и разработки системного подхода к коррекции различных эндокринных и метаболических нарушений.
Наиболее достоверными критериями при дифференциальной диагностике формирующихся поликистозных яичников у юных пациенток являются: сочетание ультразвуковой (морфологической) картины поликистоза яичников с нарушением гормонального профиля (соотношение половых гормонов и ГА) в сопоставлении с динамикой становления менструального цикла в течение 12-18 мес наблюдения (олигоменорея, аменорея) на фоне дисметаболических нарушений (ожирение, гиперинсулинемия, нарушение толерантности к глюкозе).
У юных пациенток основными направлениями терапии формирующегося СПКЯ являются: восстановление менструальной функции, коррекция гиперандрогенных состояний и метаболических нарушений [24-29].
На первом этапе профилактики формирующегося поликистоза яичников у девочек необходимо проводить коррекцию метаболических нарушений с помощью сбалансированной редукционной диеты, активного образа жизни, аэробных видов спорта (бег, плавание и др.), использования фитопрепаратов [7, 10, 11, 27].
При выявлении стойких признаков прогрессирования поликистоза яичников целесообразно использование монофазных гормональных КОК на фоне циклической витаминотерапии и энзимотерапии с последующей стимуляцией овуляции в репродуктивном периоде для реализации детородной функции.
Хирургическое лечение — каутеризацию яичников (drilling) в подростковом периоде производить нецелесообразно.
Репродуктивный прогноз у пациенток с формирующимся поликистозом яичников во многом зависит от ранней диагностики, эффективности патогенетической терапии и восстановления овуляции.
Источник
