Ивл при респираторном дистресс синдроме
Читать медицинскую статью, новость, лекцию по медицине: «ИВЛ при синдроме острого повреждения легких (СОПЛ) и остром респираторном дистресс-синдроме (ОРДС)» размещена 22-10-2011, 10:53, посмотрело: 4 870

ОРДС развивается у 25% больных с сепсисом и 8,7% пациентов, находящихся на ИВЛ. Летальность при этом патологическом состоянии составляет приблизительно 35%, хотя к смерти обычно приводит полиорганная недостаточность, нежели непосредственно нарушения дыхания.
Продолжает нарастать количество клинических и экспериментальных данных, подтверждающих роль тактики проведения ИВЛ при СОПЛ и ОРДС. Считается, что к развитию вентилятор-индуцированного повреждения легких (ВИПЛ) приводит воздействие физиологического дыхательного объема на раскрытые (не спавшиеся) альвеолы. Использование стандартного дыхательного объема, составляющего 10-12 мл/кг, неизбежно вызывает перерастяжение участвующих в газообмене зон легочной паренхимы. Проведенные рандомизированные контролированные исследования показали, что снижение летальности может быть достигнуто только за счет ограничения дыхательного объема [2]. Происходящее во время ИВЛ многократное раскрытие и спадение альвеол может послужить источником возникновения значительных повреждающих сил, «разрывающих» альвеолярные эпителиальные клетки. Указанные данные стимулировали выработку так называемой стратегии «защиты легких» во время искусственной вентиляции легких, направленную на предупреждение их дальнейшего повреждения [3].
Защита легких при искусственной вентиляции легких на фоне синдроме острого повреждения лёгких (СОПЛ) и остром респираторном дистресс-синдроме (ОРДС)
Стратегия защиты легких включает следующие элементы:
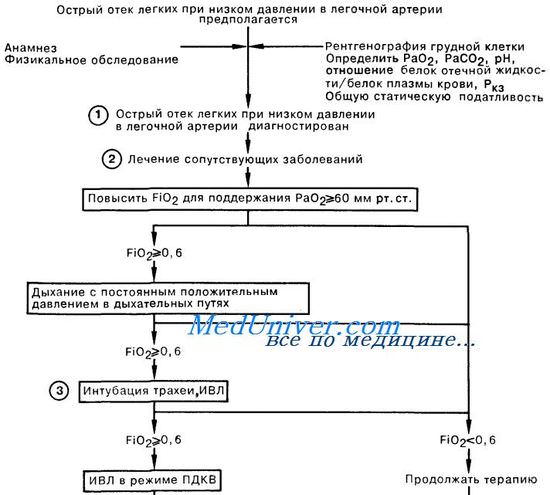
- Концентрация кислорода во вдыхаемой смеси. Проведение ИВЛ с высоким FiO2 сопровождается развитием абсорбционных ателектазов и кроме того, возможно, оказывает токсический эффект на легочную ткань. Общепринято подбирать FiO2 до достижения уровня артериальной сатурации 90%. Однако, у пациентов, вентилируемых с низким дыхательным объемом, требуется более высокая концентрация кислорода в дыхательной смеси, чем у больных, в случае которых был использован стандартный дыхательный объем (56 и 51%, соответственно [2]).
- Объем/давление в конце вдоха. Проведение ИВЛ с более низким, по сравнению с обычно используемым дыхательным объемом, приводит к снижению смертности у пациентов с ОРДС и увеличению количества дней, проведенных без ИВЛ. В данной группе тяжело больных принято проведение ИВЛ с дыхательным объемом 6 мл/кг и давлением в конце вдоха около 25 см H2O. Соответственно, достижение адекватной сатурации артериальной крови требует повышения частоты дыхания. Применение низких дыхательных объемов может нарушать альвеолярную вентиляцию и приводить к развитию «допустимой» гиперкапнии, которая, тем не менее, признается менее опасной, чем вентилятор-индуцированное поражение легких, при условии, что у пациента нет глубокого респираторного ацидоза (pH поддерживается на уровне выше 7,25). К нежелательным эффектам гиперкапнии относятся рост внутричерепного давления, нарушения сократимости миокарда и повышение потребности в седативных препаратах.
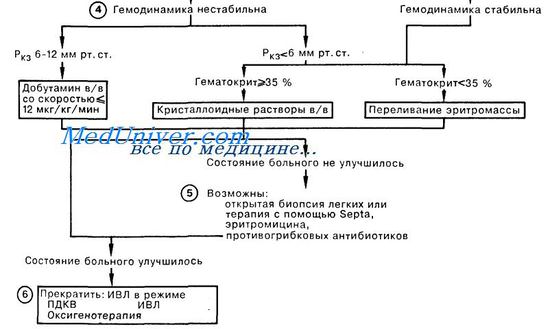
- Объем/давление в конце выдоха (PEEP). Создание положительного давления в конце выдоха (ПДКВ/ PEEP) может устранить и предупредить процесс циклического спадения-раскрытия альвеол. Этот эффект реализуется за счет подавления возникновения сил «растяжения» альвеолярного эпителия (теория «open lung» — «открытого легкого»). К сожалению, применение ПДКВ может сопровождаться депрессией кровообращения и повышать риск баротравмы. Оптимальный уровень ПДКВ в контексте предупреждения вентилятор-индуцированного поражения легких все еще остается предметом споров. Очевидно, что большинство клиницистов приняли тактику, в соответствии с которой оптимальным считается наименьший уровень ПДКВ, позволяющий поддерживать приемлемую SaO2 на фоне ограниченной FiO2. Применение низких дыхательных объемов обуславливает необходимость более высокого уровня ПДКВ [2] (9,4 см H2O при низком ДО и 8,4 см H2O при традиционном). Непрерывность приложения ПДКВ имеет ключевое значение: даже один вдох без положительного давления в конце выдоха может привести к коллапсу расправившихся альвеол.
- Режим ИВЛ. В случае ИВЛ, контролированной по давлению (PCV), целевое давление в дыхательных путях является одной из установок режима и может быть настроено с позиций профилактики баротравмы легких. В этой ситуации ДО зависит от комплайнса и сопротивления дыхательной системы. Ухудшение на фоне ИВЛ по давлению комплайнса или сопротивления или уменьшении продолжительности вдоха приводит к снижению ДО. Возникающее как следствие этого снижение альвеолярной вентиляции может вызывать тяжелую гиперкапнию и ацидоз. В случае проведения ИВЛ с инверсированным соотношением времени вдох:выдох (IRV) продолжительность вдоха увеличивается, а выдоха — уменьшается. Возникающее на фоне IRV вовлечение в вентиляцию ранее незадействованных участков легочной ткани, снижение шунтирования крови, а также повышение среднего давления в дыхательных путях приводит к улучшению оксигенации. Уменьшение продолжительности выдоха может сопровождаться возникновением внутреннего ПДКВ (auto-PEEP). Снижение частоты дыхания позволяет увеличить продолжительность вдоха ценой ухудшения альвеолярной вентиляции.
- Положение ничком (prone). Известно, что положение пациента с ОРДС на животе («ничком») приводит к быстрому улучшению оксигенации. Это связано с улучшением регионарного распределения вентиляции, которое влечет за собой снижение фракции шунта. Влияние данного приема на выживаемость больных пока не доказано.
- Тщательно проведенные клинические исследования таких новых методов респираторной поддержки при ОРДС, как частичная жидкостная вентиляция и высокочастотная ИВЛ дали разочаровывающие результаты. Применение этих высокотехнологичных методик требует значительных затрат и, таким образом, не может быть рекомендовано для клинического использования до тех пор, пока не будет продемонстрировано их положительное влияние на исход лечения.
Медицинская литература:
- Brower RG, Fressler HE. Mechanical ventilation in acute lung injury and acute respiratory distress syndrome. Clinics in Chest Medicine 2000; 21: 491510
- The Acute Respiratory Distress Syndrome Network. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and acute respiratory distress syndrome. New England Journal of Medicine 2000; 342:1301-1308
- Finey JF, Evans TW. Mechanical ventilation in acute respiratory distress syndrome. Current Opinion in Anesthesiology 14:165-171
Автор(ы): Lothr
Понравилась медицинская статья, новость, лекция по медицине из категории
«Медицинские статьи / Анестезиология, реанимация, интенсивная терапия»:
ИВЛ при синдроме острого повреждения легких (СОПЛ) и остром респираторном дистресс-синдроме (ОРДС)
поделись в:
| HTML-cсылка |
| BB-cсылка |
| Прямая ссылка |
Категория: Медицинские статьи / Анестезиология, реанимация, интенсивная терапия
Уважаемый посетитель, Вы зашли на сайт как незарегистрированный пользователь.
Мы рекомендуем Вам зарегистрироваться либо войти на сайт под своим именем.
Источник
Содержание
- Респираторный дистресс-синдром
- Причины и механизм развития РДСВ
- Симптомы респираторного дистресс-синдрома
- Осложнения респираторного дистресс-синдрома
- Диагностика респираторного дистресс-синдрома
- Лечение респираторного дистресс-синдрома
- Прогноз и профилактика респираторного дистресс-синдрома
Респираторный дистресс-синдром взрослых (РДСВ) – крайне тяжелое проявление дыхательной недостаточности, сопровождающееся развитием некардиогенного отека легких, нарушений внешнего дыхания и гипоксии. Несмотря на многообразие факторов, приводящих к РДВС, в его основе лежат повреждения легочных структур, вызывающие несостоятельность транспортировки кислорода в легкие. Другими названиями респираторного дистресс-синдрома являются «шоковое», «влажное», «травматическое» легкое.
Респираторный дистресс-синдром
Респираторный дистресс-синдром взрослых (РДСВ) – крайне тяжелое проявление дыхательной недостаточности, сопровождающееся развитием некардиогенного отека легких, нарушений внешнего дыхания и гипоксии. Несмотря на многообразие факторов, приводящих к РДВС, в его основе лежат повреждения легочных структур, вызывающие несостоятельность транспортировки кислорода в легкие. Другими названиями респираторного дистресс-синдрома являются «шоковое», «влажное», «травматическое» легкое.
Резкое снижение оксигенации и вентиляции организма вызывает кислородную недостаточность сердца и головного мозга и развитие угрожающих для жизни состояний. При РДСВ летальность в случае несвоевременно или неадекватно оказанной помощи достигает 60-70%.
Причины и механизм развития РДСВ
Механизмом, запускающим развитие респираторного дистресс-синдрома, служит эмболизация мелких сосудов легких микросгустками крови, частичками поврежденных тканей, каплями жира на фоне образующихся в тканях токсичных биологически активных веществ — кининов, простагландинов и др. Микроэмболизация легочных сосудов развивается в результате прямого или опосредованного воздействия на капиллярно-альвеолярную мембрану легочных ацинусов различного рода повреждающих факторов.
Прямое повреждающее воздействие оказывает аспирация крови, рвотных масс и воды, вдыхание дыма и токсических веществ, контузия легких, перелом ребер, разрыв диафрагмы, передозировка наркотических средств. Опосредованное, непрямое повреждение капиллярно-альвеолярных мембран вызывает активация и агрегация форменных элементов крови при бактериальных и вирусных пневмониях, сепсисе, ожогах, сочетанных травмах и травматическом шоке, сопровождающихся массивной кровопотерей, панкреатите, аутоиммунных процессах, электротравме, эклампсии и т. д.
Повышение проницаемости мембраны для белка и жидкости вызывает отек интерстициальной и альвеолярной тканей, снижение растяжимости и газообменной функции легких. Эти процессы приводят к развитию гипоксемии, гиперкапнии и острой дыхательной недостаточности. Респираторный дистресс-синдром может развиваться на протяжении нескольких часов или суток от момента воздействия повреждающего фактора. В течении РДСВ выделяют три патоморфологические фазы:
- Острая фаза РДСВ (до 2-5 суток) – интерстициальный и альвеолярный отек легких, поражение капилляров легких и эпителия альвеол, развитие микроателектазов. В случае благоприятного течения респираторного дистресс-синдрома спустя несколько дней острота явлений стихает, транссудат рассасывается; в противном случае возможен переход в подострое либо хроническое течение.
- Подострая фаза РДСВ – развитие бронхоальвеолярного и интерстициального воспаления.
- Хроническая фаза РДСВ – соответствует развитию фиброзирующего альвеолита. Происходит утолщение и уплощение капиллярно-альвеолярных мембран, разрастание в них соединительной ткани, формирование микротромбозов и запустевание сосудистого русла. Исходом хронической фазы респираторного дистресс-синдрома служит развитие легочной гипертензии и хронической дыхательной недостаточности. Выраженный альвеолярный фиброз может возникнуть уже спустя 2-3 недели.
Симптомы респираторного дистресс-синдрома
Развитие респираторного дистресс-синдрома взрослых характеризуется последовательной сменой стадий, отражающих патологические изменения в легких и типичную картину остро нарастающей дыхательной недостаточности.
I (стадия повреждения) – первые 6 часов со времени воздействия стрессового фактора. Жалобы, как правило, отсутствуют, клинико-рентгенологические изменения не определяются.
II (стадия мнимого благополучия) – от 6 до 12 часов со времени воздействия стрессового фактора. Развиваются нарастающая одышка, цианоз, тахикардия, тахипноэ (учащение дыхания более 20 в мин.), беспокойство пациента, кашель с пенистой мокротой и прожилками крови. Одышка и цианоз не купируются кислородными ингаляциями, содержание кислорода в крови неуклонно падает. Аускультативно в легких – хрипы, крепитация; рентгенологические признаки соответствуют диффузному интерстициальному отеку.
III (стадия дыхательной недостаточности) – спустя 12-24 часа после воздействия стрессового фактора. Клокочущее дыхание с выделением пенистой розовой мокроты, нарастающая гипоксемия и гиперкапния, поверхностное дыхание, увеличение центрального венозного и снижение артериального давления. По всей поверхности легких выслушиваются влажные, множественные хрипы различного калибра. На рентгенограммах определяется слияние очаговых теней. В этой стадии происходит образование гиалиновых мембран, заполнение альвеол фибрином, экссудатом, распадающимися кровяными тельцами, поражение эндотелия капилляров с образованием кровоизлияний и микроателектазов.
IV (терминальная стадия) — метаболический ацидоз, гипоксемия и гиперкапния не устраняются предельно большими объемами интенсивной терапии и ИВЛ. Ложноположительная рентгенологическая динамика (появление очагов просветлений) вызвана разрастанием соединительной ткани, замещающей паренхиму легких. В этом терминальном периоде респираторного дистресс-синдрома развивается полиорганная недостаточность, характеризующаяся:
- артериальной гипотонией, выраженной тахикардией, фибрилляцией предсердий, желудочковой тахикардией;
- гипербилирубинемией, гиперферментемией, гипоальбуминемией, гипохолестеринемией;
- ДВС-синдромом, лейкопенией, тромбоцитопенией ;
- повышением мочевины и креатинина, олигурией;
- желудочно-кишечными и легочными кровотечениями;
- угнетением сознания, комой.
Осложнения респираторного дистресс-синдрома
В ходе купирования респираторного дистресс-синдрома возможны осложнения в виде баротравм легких, бактериальных пневмоний, развития ДВС-синдрома, левожелудочковой сердечной недостаточности. Проявлениями баротравмы, развивающейся вследствие проведения аппаратной вентиляции легких, служат подкожная эмфизема, пневмоторакс, пневмомедиастинум. Повышенный риск развития баротравм у пациентов с респираторным дистресс-синдромом обусловлен перерастяжением альвеол при снижении эластичности легочной ткани.
Острая левожелудочковая недостаточность (или кардиогенный отек легких) при РДСВ обусловлена застоем кровообращения в малом круге. ДВС-синдром (синдром диссеминированного внутрисосудистого свертывания) развивается при сепсисе, панкреонекрозе и других повреждающих факторах и выражается в полиорганном поражении различных систем.
Диагностика респираторного дистресс-синдрома
Респираторный дистресс-синдром является критическим состоянием и требует экстренной оценки состояния пациента. Ранними объективными проявлениями РДСВ служат нарастающие одышка, тахикардия и цианоз. Аускультативная картина легких изменяется соответственно стадиям респираторного дистресс-синдрома: от жесткого «амфорического» дыхания к клокочущим влажным хрипам и симптому «немого» («молчащего») легкого в терминальной стадии.
Характерным показателем газового состава крови при РДСВ является РаО2 ниже 50 мм рт. ст. (гипоксемия), несмотря на проводимую оксигенотерапию (при FiО2 более >60%.), нарастание гиперкапнии. У пациентов с РДСВ выраженная дыхательная недостаточность и гипоксемия сохраняются даже при ингаляциях высококонцентрированной кислородной смеси.
Биохимические показатели венозной крови характеризуются гипоальбуминемией, повышением свертывающих факторов, нарастанием трансаминаз и билирубина. При рентгенографии легких на периферии выявляются диффузные множественные тени (симптом «снежной бури»), снижение прозрачности легочной ткани, плевральный выпот обычно отсутствует.
Показатели функции внешнего дыхания свидетельствуют об уменьшении всех дыхательных объемов и статического растяжения легочной ткани менее 5 мл/мм вод. ст. Измерение давления в легочной артерии катетером Суона–Ганца показывает его «заклинивание» на уровне менее 15 мм рт.ст. Респираторный дистресс-синдром следует отличать от кардиогенного отека легких, пневмонии, ТЭЛА.
Лечение респираторного дистресс-синдрома
Лечение респираторного дистресс-синдрома осуществляется в условиях отделения интенсивной терапии и реанимации. Мероприятия по купированию РДСВ включают:
- устранение стрессового повреждающего фактора;
- коррекцию гипоксемии и острой дыхательной недостаточности;
- лечение полиорганных нарушений.
На первом этапе лечения респираторного дистресс-синдрома устраняются прямые повреждающие факторы легких, назначается массивная антибактериальная терапия при бактериальных пневмониях, сепсисе, осуществляется соответствующее лечение ожогов и травм. Для устранения гипоксии проводится подбор адекватного режима кислородотерапии с динамическим контролем газов крови (с поддержанием РО2 не менее 60 мм рт.ст.). Подача кислорода может осуществляться чрез маску или носовой катетер, при неэффективной оксигенации показана ИВЛ (при ЧД 30 в минуту).
Для профилактики развития ДВС-синдрома назначаются ацетилсалициловая кислота, дипиридамол и реополиглюкин, гепарин. Несмотря на интерстициальный и альвеолярный отек, проводится инфузионная терапия для улучшения питания органов, нормализации диуреза и поддержания уровня АД. Эффективность лечения респираторного дистресс-синдрома зависит от его своевременности: оно успешно лишь на ранних стадиях данного состояния до наступления необратимых поражений легочной ткани.
Прогноз и профилактика респираторного дистресс-синдрома
Летальность в III стадии респираторного дистресс-синдрома составляет около 80%, в терминальной стадии, соответствующей полиорганной недостаточности, обычно все пациенты погибают. При благоприятном исходе после купирования РДСВ функция легких может практически полностью восстановиться, однако чаще требуется длительная поддерживающая терапия.
Специфические профилактические мероприятия респираторного дистресс-синдрома отсутствуют. Следует остерегаться воздействия стрессовых повреждающих факторов, ведущих к развитию РДСВ.
Источник
Длительность ИВЛ при респираторном дистресс-синдроме. Сурфактант при лечении дистресс синдрома легких.Известно, что длительная ИВЛ даже при вентиляционных расстройствах сама по себе стимулирует задержку жидкости в легких, угнетает диурез. Поскольку при РДС всегда есть элементы мильтиорганной дисфункции, в том числе и поражение почек, то становится ясным, что для обеспечения адекватного водного баланса требуется регулярное введение диуретиков (40-60 мг лазикса). Выведение избыточной жрщкости из организма помогает купировать и отек легких. Кроме того, почти закономерным осложнением длительной ИВЛ является пневмония, которая развивается не только вследствие микробной инсеминации дыхательных путей, но и при развитии синдрома системной воспалительной реакции (септического шока) с выделением таких цитокинов, как интерлейкины 6 и 8 (IL-6, IL-8). При этом отмечено, что повышение их уровня наступает еще за 3-4 дня до развития пневмонии. Присоедршение пневмонии на фоне РДС трудно диагностировать, поскольку такие ее признаки, как лейкоцитоз, высокая температура pi рентгенологические проявления (инфильтрации легких), уже имеются при РДС и без инфекции. В связи с разработкой методов получения синтетических или полусинтетических сурфактантов в последние годы вновь усилился интерес к возможности их использования в терапии РДС. И действительно, ингаляция сурфактанта способствует улучшению газообменной функции легких. Однако такой эффект не всегда бывает стойким. Так, Baudouin S.V. (1997) использовал синтетический препарат сурфактанта (дипальмитоил-фосфатидилхолин 13,5 мг/л) у 364 больных с РДС. Группу сравнения составили 361 больной, сопоставимых по возрасту и степени тяжести по шкале APACHE III (пo 70,5% этих пациентов в обеих группах). Однако какого-либо влияния на частоту выживания, длительность ИВЛ и нахождения в отделении интенсивной терапии или состояние физиологических функций легких не было обнаружено. Использование сурфактанта у новорожденных обеспечивало более быстрое снижение FiO2 до 40% и сокращение продолжительности ИВЛ, однако увеличения выживаемости к 7 и 28 дням также не было достигнуто [Шаламов В. Ю. и др., 1999]. Это и понятно, поскольку описанные выше исследования показали, что сурфактант разрушается вследствие проникновения в альвеолу циркулирующих в крови токсичных продуктов. Поэтому, сколько бы сурфактанта не добавлять в легкие, но если не удалить токсичные вещества из крови, вновь введенный сурфактант будет так же разрушаться, как и собственный. Кроме того, следует признать, что, прекрасно справляясь с вентиляционной дыхательной недостаточностью, при паренхиматозной дыхательной недостаточности, характерной для РДС, ИВЛ не в состоянии адекватно корригировать гипоксемию. Эти факты заставили зарубежных ученых еще в семидесятые годы обратиться к использованию экстракорпорального газообмена с помощью мембранных оксигенаторов, которые к тому времени стали производиться с целью улучшения результатов операций на открытом сердце. В экспериментах на животных оказалось возможным и безопасным поддерживать газообмен продолжительностью до трех недель с помощью мембранных оксигенаторов. Это дало основание использовать их для вспомогательной экстракорпоральной мембранной оксигенации (ЭКМО) при острой паренхиматозной дыхательной недостаточности. Первые результаты лечения дистресс синдрома легких с помощью ЭКМО в зарубежных клиниках были достаточно обнадеживающими. Действительно, сразу после подключения мембранных оксигенаторов восстанавливался газообмен, стабилизировалось состояние больных. Однако обратной динамики патологических изменений в легких в заметных масштабах не отмечалось. После окончания процедуры вновь прогрессировали воспалительные и деструктивные процессы. Благополучного исхода удавалось достигнуть лишь в 20-30%, чаще у детей. Тем не менее, последние годы эффективность ЭКМО возросла до 47-60% [Bartlett R. Н. et al., 1996; Kolla S. et al., 1997]. G. J. Peek и соавт. (1997) подвели семилетний итог применения ЭКМО у 50 больных с дистресс синдромом легких с общей выживаемостью 66%. С помощью чрескожной катетеризации удавалось достичь скоростей вено-венозной перфузии до 120 мл/кг/мин и обеспечивать экстракорпоральный газообмен в течение в среднем 207 часов. В этот период больному требовалось перелить до 19 доз донорской крови, значительные объемы донорской плазмы, концентраты тромбоцитов, обеспечивать парентеральное питание, круглосуточный мониторинг и обслуживание высококвалифицированными специалистами, что требовало немалых финансовых затрат, намного превышающих 100000 $. Применение ЭКМО для лечения дыхательных расстройств новорожденных также требовалось не менее 50000 долларов. Учитывая такие сложности и трудоемкость самих операций ЭКМО, они не получили широкого распространения. Однако экстракорпоральная мембранная оксигенация заняла определенное место среди методов лечения РДС, рекомендуемых упомянутой выше Согласительной Комиссией. Неотложная помощь при отеке легких — респираторном дистресс синдроме взрослых (РДСВ)
— Также рекомендуем «Современные методы лечения дистресс синдрома легких.» Оглавление темы «Лечение респираторного дистресс синдрома легких.»: |
Источник