Интенсивная терапия при дистресс синдроме
Нереспираторные методы интенсивной терапии РДСВ
Экстракорпоральная мембранная оксигенация (ЭКМО).
Методика проведения ЭКМО, в сущности, идентична кардио- пульмональному байпасу, используемому в кардиохирургии. Самым важным компонентом контура ЭКМО является оксигенатор; все остальное направлено на поддержание его функции. Поскольку нет данных об улучшении выживаемости больных с РДСВ при использовании ЭКМО, интерпретация результатов не-контролируемых исследований невозможна, и вопрос преимущества применения этого метода у взрослых пациентов с РДСВ остается открытым.
Вазодилататоры.
Все эти препараты приводят к снижению давления в легочной артерии, однако уменьшают и системное артериальное давление. Действие нитропруссида натрия хорошо управляемо, так как гипотензивный эффект наступает сразу же вследствие освобождения монооксида азота. У каждого пациента эффект строго зависит от дозы и прекращается сразу же после окончания введения препарата. Однако значимая польза от вазодилататоров ограничена из-за снижения парциального напряжения кислорода в артериальной крови и нарушения вентиляционно-перфузионных отношений вследствие ограничения эффекта гипоксической легочной вазоконстрикции.
Пентоксифиллин.
Пентоксифиллин традиционно используется в комплексной терапии нарушений периферического кровообращения при различных заболеваниях. Эффекты пентоксифиллина связаны с увеличением содержания цАМФ в эритроцитах, в результате чего улучшается их способность к деформации, что ведет к улучшению капиллярного кровообращения и перфузии тканей.
Инфузионно-трансфузионная терапия.
Инфузионная терапия при РДСВ требует тщательного мониторинга, включающего адекватный контроль гемодинамики. С одной стороны, нарушение микроциркуляции предполагает достаточно объемную инфузионную терапию, с другой – накопление интраальвеолярной и интерстициальной жидкости является показанием к ограничению объема инфузии и применения диуретиков. Кристаллоиды. В состав растворов этой группы входят вещества с низкой молекулярной массой (‹3000 Д). Коллоидно-осмотическое давление этих растворов практически равно нулю, несмотря на то, что осмолярность может варьировать в широких пределах. Поскольку при введении больших объемов этих растворов может развиться гипотоничное состояние (из-за содержания в каждом литре 114 мл свободной воды), их использование в интенсивной терапии РДСВ должно быть ограничено. Цель инфузии этих препаратов – возмещение электролитного состава крови путем введения комбинированных солевых препаратов (р-р Рингер, Ionosteril). Имеет смысл введение высококонцентрированных растворов глюкозы (20, 40%) как компонента парентерального питания, что рассмотрено ниже. Декстраны. Растворы, относящиеся к данной группе (полиглюкин, реополиглюкин) хорошо возмещают объем циркулирующей плазмы при нормальной проницаемости стенок капилляров. Каждый грамм введенного декстранового препарата прибавляет в кровоток 20–25 мл воды. Однако, учитывая такие недостатки декстранов, как «ожог» почечных канальцев с выходом на ОПН и усиление фибринолиза (изменяют активность VIII фактора свертывания), их использование в комплексном лечении РДСВ не должно проводиться. Растворы желатина. При респираторном дистресс-синдроме взрослых эти препараты должны применяться с особой осторожностью. Желатин вызывает увеличение выброса интерлейкина-1, который усугубляет воспалительные изменения эндотелия. Инфузия препаратов желатина приводит к снижению концентрации фибронектина, что при РДСВ может увеличивать проницаемость эндотелия. Кроме того, растворы на основе желатина приводят к высвобождению эндогенного гистамина. Поэтому приведенные негативные эффекты не дают возможности рекомендовать использование препаратов этой группы при РДСВ. Плазма. Свежезамороженная плазма представляет собой смесь трех главных белков: альбумина, глобулина и фибриногена. При РДСВ на фоне полиорганной недостаточности высока вероятность развития ДВС-синдрома, в связи с чем трансфузия этого препарата крови является обязательным. Однако важно учитывать тот факт, что, хотя вся плазма и проходит тщательные скрининговые процедуры, имеется определенный риск передачи ВИЧ и парентеральных вирусных гепатитов. Реамберин. Реамберин – 1,5% раствор для инфузии – сбалансированный полиионный (изотонический) препарат с добавлением янтарной кислоты. Янтарная кислота является универсальным промежуточным метаболитом, образующимся при взаимопереваривании углеводов, жиров и белков в животных клетках. Превращение янтарной кислоты в организме связано с продукцией энергии. Основной фармакологический эффект препарата обусловлен способностью усиливать компенсаторную активацию аэробного гликолиза, снижать степень угнетения окислительных процессов. В этой связи, препарат обладает антигипоксическим, антиоксидантным и дезинтоксикационным действием. Растворы гидроксиэтилированного крахмала. Гидроксиэтилированный крахмал (ГЭК) – природный полисахарид, получаемый из амило- пектинового крахмала и состоящий из полимеризованных остатков глюкозы. Молекулы ГЭК способны закрывать поры в стенках капилляров и снижать уровень поражений, связанных с высокой проницаемостью эндотелия. Это свойство, наряду с нормализацией коллоидно-осмотического давления плазмы, позволяет отдать им предпочтение при инфузионной терапии, проводимой при РДСВ. Растворы ГЭК могут уменьшать «капиллярную утечку» жидкости и отек тканей. В условиях ишемически- реперфузионного повреждения растворы ГЭК снижают степень повреждения легких и внутренних органов.
Нутритивная поддержка.
В комплекс интенсивной терапии пациентов с тяжелой полиорганной дисфункцией в обязательном порядке должна быть включена нутритивная поддержка, основными составляющими которой являются парентеральное и энтеральное питание.
При его проведении рекомендуют соблюдать следующие принципы:
1. донаторы энергии (углеводы и жиры) должны вводиться параллельно с донаторами пластического материала (амино-кислотами), желательно через У-образный проводник;
2. гиперосмолярные растворы (10–15%) следует вводить в центральную вену;
3. инфузионные системы для полного парентерального питания меняют каждые 24 часа;
4. при проведении полного парентерального питания включение в состав смеси концентратов глюкозы обязательно.
Нестероидные противовоспалительные средства (НПВС).
Мета-анализ 18 клинических исследований по использованию НПВС в терапии сепсиса, включивший в себя 6429 пациентов, также продемонстрировал улучшение некоторых витальных показателей без значимых изменений в летальности этих больных. Рекомендовано и использование внутривенной инфузии 0,3% раствора ацетилсалициловой кислоты из расчета 5–7 мг/кг в сутки.
Антиоксиданты.
Более перспективным в этом направлении является применение препаратов селена. Предполагается, что селен накапливается в зоне активации перекисного оксиления липидов (ПОЛ) с включением в селен-зависимую GHS-пероксидазу либо оказывает свое действие через стимуляцию активности GHS-редуктазы, что восстанавливает пул GHS в поврежденной клетке. Нередко используют аналоги естественных антиоксидантов – аскорбиновую кислоту и а-токоферол в значительных дозах. При РДСВ наиболее широко изученным антиокидантом является N-ацетилцистеин. Выраженной антиоксидант- ной активностью обладает и широко известное вещество диме- тилсульфоксид (димексид), вводимый как лекарственное средство внутривенно. Доказан антиоксидантный эффект непрямого электрохимического окисления крови, реализованный посредством внутривенного введения гипохлорита натрия. Накоплена достаточная информации об эффективности внутривенного лазерного облучения крови (ВЛОК). В результате проведенных сеансов ВЛОК повышается активность антиокислительных ферментов (церрулоплазмина и пероксидазы).
Антикоагулянты и антиагреганты.
Препараты для улучшения реологических свойств крови (антиагреганты и антикоагулянты) не только улучшают легочный тканевой кровоток, но и качество крови, притекающей к легким. Антикоагулянты. Через 12 часов после начала лечения под контролем показателей коагуляции рекомендуют применение прямых антикоагулянтов: гепарина по 5000 ЕД каждые 4 часа подкожно или непрерывно внутривенно (30 000 ЕД в сутки). Среднемолекулярный гепарин можно с успехом заменить низкомолекулярным (Клексан, Фраксипарин и др.). Причем, преимущества низкомолекулярных гепаринов перед среднемолекулярными очевидны: благодаря меньшей массе и большей биодоступности они дольше циркулируют в крови и обеспечивают более продолжительный противотромботический эффект в значительно меньших суточных дозах. Антиагреганты. Среди препаратов этой группы выделяют ингибиторы циклооксигеназы (НПВС: ацетилсалициловая кислота, индометацин, диклофенак, кетопрофен и др.), ингибиторы фосфодиэстеразы (ди- пиридамол, пентоксифиллин) и другие. Основной мишенью действия этих препаратов является циклооксигеназа, тромбоксан- и простациклинсинтетаза тромбоцитов и сосудистой стенки. В последнее время появился новый препарат из группы антиагрегантов – клопидогрель (плавикс).
Инотропная поддержка.
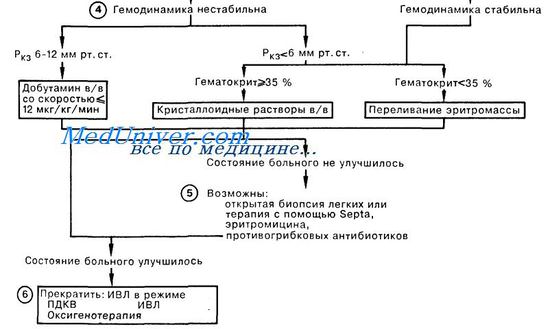
Низкое перфузионное давление у пациентов с РДСВ на фоне полиорганной недостаточности требует немедленного включения препаратов, повышающих сосудистый тонус и инотропную функцию миокарда. Допамин, адреналин или норадреналин являются препаратами первоочередного выбора коррекции гипотензии при нестабильной гемодинамике у данной категории пациентов.
Глюкокортикостероиды.
Кортикостероиды оказывают разнообразное влияние на иммунную систему. Они тормозят миграцию лейкоцитов в очаги воспаления и блокируют адгезию нейтрофилов к эндотелию с последующей продукцией гуморальных факторов. Однако клинические исследования применения высоких доз этих препаратов на ранних этапах РДСВ в комплексной интенсивной терапии не показали существенного позитивного воздействия на течение патологического процесса у пациентов с респираторным дистрессом. На сегодняшний день совершенно очевиден тот факт, что нужно отказаться от необоснованного эмпирического назначения преднизолона и дексаметазона. Исходя из многочисленных исследований Kollef M. H. и
Schuster D. P. (1995), которые суммировали все отрицательные и положительные свойства использования ГКК при РДСВ, основные постулаты в назначении глюкокортикоидов следующие: 1. не применять ГКК ни для профилактики РДСВ, ни в его последней стадии; 2. использовать ГКК при РДСВ с выраженной эозинофилией в мокроте; 3. не применять ГКК на фоне сепсиса; 4. при тяжелом течении РДСВ и отсутствии улучшения от остальной терапии в течение первых двух недель можно попробовать терапию преднизолоном в дозе 2 мг/кг/сут в течение 1–2 недель.
Иммунокорригирующая терапия.
Одной из главных мето-дик в лечении тяжелой полиорганной недостаточности является коррекция иммунного дистресса. В последние годы завоевал лидирующие позиции метод иммунозамещения и иммунорегуляции. В первом случае наиболее позитивные эффекты, описанные в литературе, свойственны препаратам внутривенно вводимых иммуноглобулинов. Препараты внутривенных иммуноглобулинов (пентаглобин, сандоглобин и др.) эффективны, благодаря связыванию и нейтрализации микробных агентов, нейтрализации токсинов, благодаря блокаде связывания вирусов и бактерий с целевой клеткой и в результате их активности как опсонинов, инициирующих схватывание и деградацию патогенов фагоцитирующими клетками, снижают гиперсекрецию провоспалительных цитокинов (TNF, IL-1, IL-6). В последнее время завоевала одну из лидирующих позиций иммунокорригирующая терапия препаратом «Ронколейкин» (IL-2). Главная функция IL-2 состоит в обеспечении клеточной составляющей адаптивного иммунитета. IL-2 является фактором роста и дифференцировки Т-лимфоцитов и NK-клеток. Кроме влияния на пролиферацию и дифференцировку названных клеток, IL-2 участвует также в регуляции координированного функционирования других факторов и механизмов иммунитета. Суммарный результат действия IL-2 на вышеперечисленные типы клеток заключается в формировании адекватной иммунореактивности, поэтому данный интерлейкин может быть отнесен к ключевым компонентам иммунной системы.
Антибактериальная терапия.
Принимая во внимание тот факт, что в условиях полиорганной недостаточности генерализация инфекции развивается очень быстро, даже если сепсис и не является первопричиной РДСВ, антибактериальная терапия должна начинаться как можно раньше и носить как лечебный, так и профилактический характер. Пациентам с респираторным дистрессом показано применение антибиотиков широкого спектра действия – антибиотиков резерва до получения посевов из дыхательных путей и гнойных очагов. При тяжелом РДСВ должны использоваться максимально рекомендуемые дозы антибиотиков. Препаратами выбора для лечения синдрома полиорганной недостаточности являются цефалоспорины IV поколения, фторхинолоны, имепенемы, а также «защищенные» пенициллины. В случае развития РДСВ на фоне сепсиса возможна комбинация антибиотиков различных групп в зависимости от локазлизации септического очага.
Экстракорпоральная детоксикация.
Из представленных выше механизмов патогенеза респираторного дистресс-синдрома взрослых понятно, что основное место отводится биологически агрессивным веществам и продуктам метаболизма, которые участвуют в развитии генерализованного воспаления, какой бы этиологией не являлся респираторный дистресс. Генерализация эндогенной интоксикации, как стадия декомпенсации механизмов гомеостаза, существенно меняет характер лечебной тактики комплексной терапии РДСВ. Несостоятельность механизмов естественной детоксикации и выведения продуктов нарушенного метаболизма в условиях гипоксии не позволяет надеяться на вероятность благоприятного исхода только за счет восстановления кровообращния, вентиляции, стимуляции функции печени и почек и антибиотикотерапии. Это, в свою очередь, является мишенью для применения методов детоксикации, что становится особенно актуальным при отсутствии естественного печеночно- почечного клиренса в условиях полиорганной недостаточности. Эффективность экстракорпоральной детоксикации определяется только дифференцированным подходом к выбору метода в зависимости от природы токсического агента, играющего ведущую роль в клинике эндо- или экзогенной интоксикации. Выбор метода экстракорпоральной детоксикации определяется характером патологии и поражением того или иного звена естественной системы детоксикации в организме. При этом, эффективное использование методов эфферентной терапии возможно лишь на фоне мероприятий комплексной интенсивной терапии. В настоящее время наиболее оптимальными методами в лечении РДСВ и синдрома полиорганной недостаточности являются гемосорбция, плазмаферез (плазмафильтрация), гемодиализ и гемодиафильтрация. Публикации последних лет отеченственных ученых указывают и на эффективность метода магнитной обработки крови, как метода коррекции гипоксии, у данной категории больных.
Источник
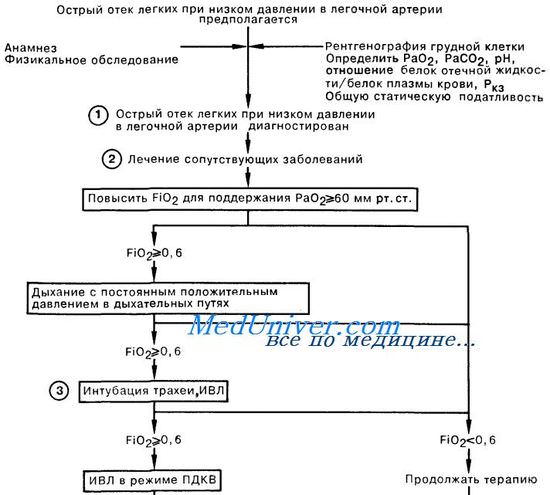
Длительность ИВЛ при респираторном дистресс-синдроме. Сурфактант при лечении дистресс синдрома легких.Известно, что длительная ИВЛ даже при вентиляционных расстройствах сама по себе стимулирует задержку жидкости в легких, угнетает диурез. Поскольку при РДС всегда есть элементы мильтиорганной дисфункции, в том числе и поражение почек, то становится ясным, что для обеспечения адекватного водного баланса требуется регулярное введение диуретиков (40-60 мг лазикса). Выведение избыточной жрщкости из организма помогает купировать и отек легких. Кроме того, почти закономерным осложнением длительной ИВЛ является пневмония, которая развивается не только вследствие микробной инсеминации дыхательных путей, но и при развитии синдрома системной воспалительной реакции (септического шока) с выделением таких цитокинов, как интерлейкины 6 и 8 (IL-6, IL-8). При этом отмечено, что повышение их уровня наступает еще за 3-4 дня до развития пневмонии. Присоедршение пневмонии на фоне РДС трудно диагностировать, поскольку такие ее признаки, как лейкоцитоз, высокая температура pi рентгенологические проявления (инфильтрации легких), уже имеются при РДС и без инфекции. В связи с разработкой методов получения синтетических или полусинтетических сурфактантов в последние годы вновь усилился интерес к возможности их использования в терапии РДС. И действительно, ингаляция сурфактанта способствует улучшению газообменной функции легких. Однако такой эффект не всегда бывает стойким. Так, Baudouin S.V. (1997) использовал синтетический препарат сурфактанта (дипальмитоил-фосфатидилхолин 13,5 мг/л) у 364 больных с РДС. Группу сравнения составили 361 больной, сопоставимых по возрасту и степени тяжести по шкале APACHE III (пo 70,5% этих пациентов в обеих группах). Однако какого-либо влияния на частоту выживания, длительность ИВЛ и нахождения в отделении интенсивной терапии или состояние физиологических функций легких не было обнаружено. Использование сурфактанта у новорожденных обеспечивало более быстрое снижение FiO2 до 40% и сокращение продолжительности ИВЛ, однако увеличения выживаемости к 7 и 28 дням также не было достигнуто [Шаламов В. Ю. и др., 1999]. Это и понятно, поскольку описанные выше исследования показали, что сурфактант разрушается вследствие проникновения в альвеолу циркулирующих в крови токсичных продуктов. Поэтому, сколько бы сурфактанта не добавлять в легкие, но если не удалить токсичные вещества из крови, вновь введенный сурфактант будет так же разрушаться, как и собственный. Кроме того, следует признать, что, прекрасно справляясь с вентиляционной дыхательной недостаточностью, при паренхиматозной дыхательной недостаточности, характерной для РДС, ИВЛ не в состоянии адекватно корригировать гипоксемию. Эти факты заставили зарубежных ученых еще в семидесятые годы обратиться к использованию экстракорпорального газообмена с помощью мембранных оксигенаторов, которые к тому времени стали производиться с целью улучшения результатов операций на открытом сердце. В экспериментах на животных оказалось возможным и безопасным поддерживать газообмен продолжительностью до трех недель с помощью мембранных оксигенаторов. Это дало основание использовать их для вспомогательной экстракорпоральной мембранной оксигенации (ЭКМО) при острой паренхиматозной дыхательной недостаточности. Первые результаты лечения дистресс синдрома легких с помощью ЭКМО в зарубежных клиниках были достаточно обнадеживающими. Действительно, сразу после подключения мембранных оксигенаторов восстанавливался газообмен, стабилизировалось состояние больных. Однако обратной динамики патологических изменений в легких в заметных масштабах не отмечалось. После окончания процедуры вновь прогрессировали воспалительные и деструктивные процессы. Благополучного исхода удавалось достигнуть лишь в 20-30%, чаще у детей. Тем не менее, последние годы эффективность ЭКМО возросла до 47-60% [Bartlett R. Н. et al., 1996; Kolla S. et al., 1997]. G. J. Peek и соавт. (1997) подвели семилетний итог применения ЭКМО у 50 больных с дистресс синдромом легких с общей выживаемостью 66%. С помощью чрескожной катетеризации удавалось достичь скоростей вено-венозной перфузии до 120 мл/кг/мин и обеспечивать экстракорпоральный газообмен в течение в среднем 207 часов. В этот период больному требовалось перелить до 19 доз донорской крови, значительные объемы донорской плазмы, концентраты тромбоцитов, обеспечивать парентеральное питание, круглосуточный мониторинг и обслуживание высококвалифицированными специалистами, что требовало немалых финансовых затрат, намного превышающих 100000 $. Применение ЭКМО для лечения дыхательных расстройств новорожденных также требовалось не менее 50000 долларов. Учитывая такие сложности и трудоемкость самих операций ЭКМО, они не получили широкого распространения. Однако экстракорпоральная мембранная оксигенация заняла определенное место среди методов лечения РДС, рекомендуемых упомянутой выше Согласительной Комиссией. Неотложная помощь при отеке легких — респираторном дистресс синдроме взрослых (РДСВ)
— Также рекомендуем «Современные методы лечения дистресс синдрома легких.» Оглавление темы «Лечение респираторного дистресс синдрома легких.»: |
Источник