Гипергомоцистеинемия код мкб 10
Содержание
- Описание
- Характеристика
- Классификация
- Симптомы
- Диагностика
- Лечение
- Основные медицинские услуги
- Клиники для лечения
Названия
Тромбофилия.

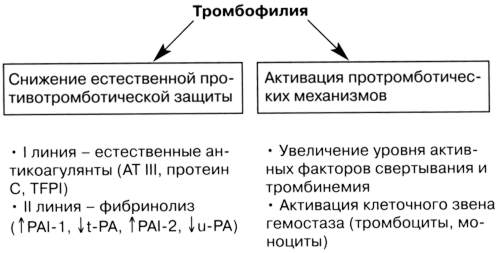
Патогенез тромбофилии
Описание
Тромбофилия является состоянием, при котором кровь имеет повышенную склонность к образованию тромбов. Сгустки крови могут вызвать проблемы, такие как тромбоз глубоких вен (ТГВ) и легочная эмболия (ЛЭ). Существуют различные типы тромбофилии, которые подразделяются на наследственные и приобретенные. Часто тромбофилия протекает мягко, и многие люди с тромбофилией не имеют проблем со здоровьем. Анализы крови могут диагностировать проблему. Тромбофилия не всегда требует лечения, но некоторые люди должны принимать аспирин или варфарин.
Характеристика
В организме существует естественный процесс свертывания в крови, который нарушается при тромбофилии.
Процесс нормальной свертываемостикрови называется гемостазом. Гемостаз помогает остановить кровотечение в случае травмы или другого патологического состояния. Когда кровеносный сосуд получает травму, срабатывает процесс свертывания крови. Это цепная реакция различных химических веществ в крови, которые называются факторами свертывания. Свертывание крови способствует образованию сгустка (тромба), который прилипает к поврежденной части кровеносного сосуду. Формированию сгустка также способствуют свойства тромбоцитов.
В крови есть также природные химические вещества, которые действуют против свертывания системы, чтобы остановить чрезмерное свертывание крови.
Тромбофилия происходит, если нормальный баланс свертывающей системы нарушен. В крови может быть слишком много факторов свертываемости крови, или слишком мало веществ, которые выступают против свертывания крови.
Тромбофилия может вызвать нежелательные сгустки крови. Это не значит, что у каждого человека с тромбофилией формируются тромбы. Но это означает, что у пациента есть более высокий риск тромбообразования, чем у остальной популяции.
Классификация
Наследственные тромбофилии.
1. Фактор V Лейдена. Довольно часто эта патология встречается у людей европейского происхождения, и примерно 1 из 20 европейцев являются носителями фактора V Лейдена. Этот ген влияет на часть V фактора свертывания, что делает процесс свертывания более длительным. При этом повышается риск развития тромбов в венах примерно в восемь раз, что все еще является относительно низким риском, поэтому у большинства людей с фактором V Лейдена не развиваются осложнения. Некоторые люди наследуют два фактора V Лейдена — один ген от каждого родителя (известный как «гомозиготных фактор V Лейдена). Это состояние менее распространенное, но при нем риск осложнений гораздо выше (риск тромбообразования увеличивается в 80 раз).
2. Дефицит протеина С. Белок С является природным химическим антикоагулянтом в крови. Дефицит может быть генетическим, или в силу других условий, таких как болезни почек. Для определения риска при этой патологии следует установить, были ли случаи тромбообразования у близких родственников. Если ребенок наследует два гена с дефицитом протеина С (по одному от каждого родителя, что бывает очень редко), он будет иметь более серьезные проблемы. Возможно тромбообразование уже вскоре после рождения(состояние, называемое пурпура Fulminans). Это состояние лечится концентратом протеина С и антикоагулянтами.
3. Дефицит протеина S. Белок S также является естественным химическим антикоагулянтом в крови. Дефицит протеина S развивается редко. Риск формирования кровяного сгустка колеблется в различных семьях.
4. Дефицит антитромбина. Антитромбин — еще одинестественный антикоагулянт крови. Существуют различные типы дефицита антитромбина: наследственный и приобретенный. Наследственная форма встречается редко, и выявляется примерно у 1 из 2000 человек.
Риск возникновения тромбов колеблется, но может быть увеличен в 25-50 раз по сравнению с остальной популяцией. При этой патологии сгусток крови может формироваться не только в ногах и легких, а также в венах рук, кишечника, мозг или печени. Примерно 1 из 2 человек с дефицитом антитромбина тромб формируется в возрасте до 30 лет, но другие могут дожить до старости без проблем.
При дефиците антитромбина рекомендован долгосрочный прием варфарина. Кроме того, может быть назначено лечение концентратом антитромбина, когда есть более высокий риск возникновения тромбов — например, если у пациента планируется операция.
При беременности, лечение антикоагулянтами, как правило, необходимо. Концентрат антитромбина также может быть использован.
5. Дисфибриногенемия. Это редкий генетический дефект, при котором нарушается нормальная функция фибрина. При этом может быть увеличено свертывание крови и/или повышенная кровоточивость.
6. Комбинированные наследственные тромбофилии. Некоторые люди наследуют более одного гена тромбофилии. При комбинированной тромбофилии риск развития тромбов умножается.
Приобретенные тромбофилии.
Приобретенные тромбофилии не наследуются, и обычно начинается в зрелом возрасте.
1. Антифосфолипидный синдром.
Этот синдром также известен как синдром Хьюза. Он обусловлен антифосфолипидными антителами. APS, как иногда называют антифосфолипидный синдром для краткости, может стать причиной кровяных сгустков в артериях и мелких кровеносных сосудов, а также в венах.
APS может повлиять на беременность в некоторых случаях. Многие женщины с APS не имеют проблем во время беременности. Тем не менее, APS может привести к выкидышу или другим проблемам — ограничение роста плода, преэклампсии или, реже, гибели плода. Эти проблемы могут быть уменьшены путем профилактики.
APS можно лечить с помощью низких доз аспирина. Если у пациентки уже был тромб, то, как правило, рекомендуется варфарин.
Смешанные тромбофилии.
Они обусловлены как генетическими, так и не генетическими причинами.
1. Гипергомоцистеинемия. При этой патологии наблюдается повышенный уровень химического вещества, называемого гомоцистеин, в крови, который, как считается, увеличивает риск артериальных и венозных тромбов, потому что гомоцистеин повреждает кровеносные сосуды. Для лечения назначают витамин В12 и фолиевую кислоту.
2. Пароксизмальная ночная гемоглобинурия. Это редкое состояние, влияющее на костный мозг. Оно может привести к сгусткам венозной крови, часто в необычных местах, таких как вены кишечника, печени или головного мозга.
3. Повышенный фактор VIII. Эта патология связана с аномально высоким уровни фактора VIII, который является одним из естественных факторов свертывания крови. При повышении фактора 8 риск тромбообразования увеличивается примерно в 6 раз.
Симптомы
Даже если пациент страдает тромбофилией, у него могут не наблюдаться никакие симптомы. У многих людей с тромбофилией не формируются тромбы.
Однако, если возникает тромб, появляются характерные симптомы. Тромбы могут образовываться в артериях и венах. Артерии кровеносные сосуды принимают кровь от сердца к органам и тканям тела. Венами являются кровеносные сосуды, приносящие кровь обратно к сердцу, от других частей тела.
Тромб в вене является наиболее распространенной проблемой при тромбофилии. Это состояние называется венозным тромбозом.
Возможные симптомы:
1. Боль и отек ног. Эти симптомы возникают при тромбозе глубоких вен.
2. Тромб может добраться до сердца и легких, что приводит к легочной эмболии. Возможные симптомы включают в себя боли в груди, боли при глубоком вдохе, одышку или, реже, коллапс.
3. Некоторые виды тромбофилии могут вызвать кровяной сгусток в необычном месте, например, в головном мозге, кишечнике или печени. Это может вызвать симптомы боли живот, цефалгии. Тромбоз в венах печени называется синдромом Бадда-Киари.
Тромб в артерии может наблюдаться при некоторых типах тромбофилии. Это состояние называется артериальным тромбозом. В зависимости от пораженной артерии тромб может вызвать инсульт, сердечный приступ или проблемы с плацентой во время беременности. Таким образом, возможные симптомы артериальных тромбозов из-за тромбофилии являются:
1. Инсульт в сравнительно молодом возрасте.
2. Повторные выкидыши.
3. Осложнения беременности: преэклампсия, снижение роста плода или, реже, внутриутробная гибель плода.
Тромбоцитоз.
Диагностика
Тромбофилию можно заподозрить, если кровный родственник страдал тромбозом в молодом возрасте (до 40 лет), или, если развивается тромбоз, который не стал неожиданностью, учитывая возраст и общее состояние здоровья пациента.
Тромбофилия диагностируется по анализам крови.
Обследование проводится через несколько недель или месяцев после эпизода тромбоза глубоких вен или легочной эмболии, так как наличие этой патологии может повлиять на результаты. Обычно необходим перерыв от приема антикоагулянтов в течение 4-6 недель. Тест на тромбофилию должен быть отложен на срок 8 недель после родов, так как результаты во время беременности могут быть недостоверны.
Для теста берется образец крови, анализируются части процесса свертывания. Как правило, испытания проводятся в два этапа. Первый этап предполагает оценку основных показателей. Если на первой этапе обнаруживается патология, проводится второй этап, который предполагает более тщательное исследование.
Таким образом, отрицательные тесты не исключают возможности того, что у вас есть унаследованных увеличить риск возникновения тромбов.
Тестирование на тромбофилию показано в следующих ситуациях:
-в случае венозного тромбоза или легочной эмболии в возрасте до 40 лет;
- приповторных эпизодах венозного тромбоза или легочной эмболии, или тромбофлебита (воспаление вен);
- при тромбозах в нетипичных местах (например, органы брюшной полости или мозг);
- необъяснимые тромбозы у новорожденных;
- у младенцев и детей с редким состоянием, которое называется пурпурой Fulminans;
- при некрозе кожи за счет лекарств, таких как варфарин;
- если у пациента есть родственники с определенными типами высокого риска тромбофилии, например, дефицит белков С и S.
- при тромбозах у беременной женщины;
- при наличии семейного анамнеза венозного тромбоза, по крайней мере, у двух родственников;
- при других заболеваниях: при повторном выкидыше или смерти плода, идиопатической тромбоцитопенической пурпуре (ИТП), системной красной волчанке (СКВ).
Лечение
На первом этапе для пациента и врача, важно определить риск образования тромбов. Этот риск зависит от сочетания факторов, таких как:
1. Какой тип тромбофилии имеется у пациента (некоторые из них имеют более высокий риск тромбообразования, чем другие).
2. Возраст, вес, образ жизни и другие заболевания у пациента.
3. Настоящая беременность или недавние роды.
4. Образование тромбов в анамнезе.
5. Наследственный анамнез по тромбообразованию.
Возможными методами лечения тромбофилии являются:
1. Низкие дозы аспирина.
Низкие дозы аспирина подавляют действие тромбоцитов, таким образом, могут помочь предотвратить образование тромбов. Это может также помочь предотвратить выкидыш или осложнения беременности при некоторых видах тромбофилии.
2. Лечение антикоагулянтами.
Антикоагулянтную терапию часто называют разжижением крови. Однако, этот метод лечения на самом деле не разжижает кровь. Он изменяет определенные химические вещества в крови, чтобы замедлить процесс свертывания. Антикоагулянты не растворяет тромб. Антикоагулянты могут значительно уменьшить вероятность тромбообразования. Эти препараты обычно используются для лечения венозных тромбозов и легочной эмболии.
При тромбофилии антикоагулянт может быть рекомендован, если:
- при наличии тромба, чтобы предотвратить еще один;
- при высоком риске образования тромба;
- в случае беременности, в течение 6 недель после родов, или в случае вынужденного неподвижного образа жизнив течение длительного периода.
Есть два основных типа антикоагулянта: гепарин и варфарин. Гепарин применяется в виде инъекций один или два раза в день. Варфарин принимается в виде таблеток один раз в день.
Варфарин является обычным антикоагулянтом. Тем не менее, период, когда варфарин начинает проявлять свои антикоагулянтные свойсвтва, может занять до нескольких дней. Таким образом, инъекции гепарина (часто даются только подкожно) используются наряду с варфарином в первые несколько дней (обычно 5 дней) для немедленного эффекта, если у пациента уже образовался. При отсутствии тромба прием варфарина не сопровождают инъекциями гепарина.
Цель терапии состоит в том, чтобы подобратьдозу варфарина так, кровь не сворачивалась легко, или, наоборот, слишком долго, что может вызвать проблемы с кровотечением. Пациенту необходимо проводить регулярные анализы крови, в первую очередь, МНО, в то время как он принимает варфарин. Дозу устанавливают индивидуально в зависимости от результатов анализа крови. МНО кровиизмеряет способность свертывания крови.
Гепарин является инъекционным антикоагулянтом.
Гепарин с низкой молекулярной массой вводится в кожу на нижней части живота. Различные дозы используются для профилактики и лечения существующих сгустков крови.
Лечение тромбофилии во время беременности.
Лечение тромбофилии может быть различным в период беременности, потому что:
1. Некоторым женщинам с определенным типом тромбофилии рекомендуется принимать низкие дозы аспирина во время беременности, чтобы предотвратить выкидыш или осложнения беременности.
2. Сама беременность увеличивает риск венозного тромбоза — это относится ко всей беременности и особенно к периоду до 6 недель после родов. Таким образом, пациентке может быть рекомендовано лечение антикоагулянтами во время беременности или после родов. Это будет зависеть от типа тромбофилии.
3. При приеме варфарина обычно рекомендуется перевод на гепарин. Это связано с тем, что гепарин более безопасен для плода (имеется значительная вероятность того, что варфарин может вызвать аномалии развития плода). Как гепарин, и варфарин являются безопасными для грудного вскармливания.
Основные медуслуги по стандартам лечения | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Клиники для лечения с лучшими ценами
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Источник
МАТЕРИАЛ ИЗ АРХИВА
В последние годы в качестве фактора риска развития острых и хронических сосудистых заболеваний головного мозга, особенно у лиц молодого возраста, стало рассматриваться повышение в крови уровня гомоцистеина – гипергомоцистеинемия (ГГЦ).
Гомоцистеин образуется в результате метаболизма метионина. В метаболизме гомоцистеина участвуют фолиевая кислота, витамины В6 и В12. Вне зависимости от происхождения гомоцистеинемии механизм ее возникновения состоит, в первую очередь, в понижении активности реакции реметилирования, которая восстанавливает гомоцистеин до метионина, обеспечивая последнему новый цикл передачи метильной группы на многочисленные реакции метаболизма. Поддержание нормальных количеств метионина происходит, в основном, за счет реакций реметилирования гомоцистеина в клетках, что обеспечивается 5-метилтетрагидрофолатом при участии витамина В12. При функциональной недостаточности этого вещества или понижении количества витамина В12 гомоцистеин накапливается, но еще не элиминируется за пределы клетки, а подвергается воздействию фермента при участии витамина В6 и необратимо трансформируется через промежуточный продукт цистатионин в цистеин. Если обе реакции не протекают в клетке, то гомоцистеин элиминируется в межклеточные пространства и попадает в кровоток. Учитывая низкую фильтруемость гомоцистеина даже здоровыми почками, концентрации его в крови будут нарастать.
Норма содержания гомоцистеина в крови – до 15 мкмоль/л натощак. Уровень от 15 до 100 мкмоль/л – умеренная ГГЦ, более 100 мкмоль/л – выраженная ГГЦ (Wilken D.E.L. 1998; Калашникова Л.А. и соавт., 2004)
Во Фремингемском проспективном исследовании выявлено статистически значимое увеличение частоты стенозов в сонной артерии более 25% ее диаметра при ГГЦ свыше 14,4 мкмоль/л, при этом одновременно была снижена концентрация фолиевой кислоты и пиридоксина фосфата. Таким образом, ГГЦ может лежать в основе развития тромботических цереброваскулярных заболеваний, особенно при высокой концентрации гомоцистеина.
Патологическая роль ГГЦ в возникновении сосудистых заболеваний связана с возникновением при ГГЦ(Faraa F.M., Lentz S.R., 2004):
■ повреждения эндотелия сосудов, которое предполагает к отложению атеросклеротических бляшек и развитию раннего атеросклероза;
■ тромбофилического состояния с развитием артериальных и венозных тромбозов;
■ нарушения липидного обмена (гиперхолестеринемия);
■ оксидантного стресса и воспалительного процесса (так называемое аутоиммунное воспаление) в сосудистой стенке, что сопровождается нарушением функции эндотелия.
Реакция деметилирования метионина обслуживает множество обменных процессов, например, метаболизм катехоламинов, синтез нуклеотидов и нуклеиновых кислот, стимуляцию белков клеточной мембраны, среди которых находятся и ферменты, подавляющие перекисное окисление липидов (супероксиддисмутаза и каталаза), которое, как известно, задерживают процесс атерогенеза. Перекисное окисление уменьшает гидрофобность липидов, изменяет их конформацию, приводит к образованию ковалентных сшивок между молекулами липидов или белков и липидов. Кроме того, ослабленное участие в синтезе белковой компоненты липопротеинов вследствие недостатка метила может быть причиной превалирования в мембранах и межклеточном пространстве липопротеидов низкой плотности (ЛПНП) и липопротеидов очень низкой плотности (ЛПОНП), также ведущих к развитию атеросклероза. В эндотелиальных клетках ГГЦ не только стимулирует образование свободных радикалов в эндотелиоцитах и повышает в них концентрацию ЛПНП и ЛПОНП, но также приводит к понижению продукции релаксирующего фактора и сульфатированных глюкозаминогликанов-гепариноидов: ГГЦ понижает эластичность внутрисосудистой выстилки. При ней понижается синтез простациклина, а также усиливается рост артериальных клеток. Так формируется сосудистый компонент тромбоваскулярной болезни, который полностью идентичен механизму зарождения атеросклеротического процесса.
Коагуляционный (тромботический) компонент тромбоваскулярной болезни во многом связан с нарушением функции эндотелия. Считается, что повышенные концентрации гомоцистеина могут приводить к угнетению синтеза тромбомодулина, без которого тромбин не образует комплекса, активирующего белковые антикоагулянты протеин С и протеин S. Активации свертываемости крови способствует также понижение активности антитромбина III и эндогенного гепарина, в результате чего происходит повышение активности тромбина.
При выраженной ГГЦ возможно также непосредственное нейротоксическое воздействие на нервные клетки.
Роль ГГЦ во время беременности: связанную в основном с понижением концентрации витамина В12 ГГЦ матери относят к одной из причин рождения детей с дефектами нейральной трубки (токсический эффект метилмалоновой кислоты), привычных выкидышей, инфарктов и отслойки материнской части плаценты. Уменьшение уровня ГГЦ при введении витамина В12 сопровождается улучшением состояния сосудов плаценты.
Причины ГГЦ:
■ наследственные факторы;
■ приобретенные факторы – особенности питания, заболевания почек и т.д.
Наследственные факторы развития ГГЦ (Федин А.И. и соавт., 2002; Калашникова Л.А. и соавт., 2004; Зорилова И.В. 2005):
■ тяжелая ГГЦ развивается при гомозиготной недостаточности цистатион-В-синтетазы (1 случай на 335 000 жителей), при гомозиготной недостаточности 5,10-метилен-тетра-гидрофолат-редуктазы;
■ умеренная ГГЦ развивается у гетерозиготных носителей мутации гена, контролирующего фермент метилен-тетра-гидрофолат-редуктазы.
К приобретенным факторам развития ГГЦ которые, как правило, развиваются у больных с умеренной ГГЦ) относятся (Федин А.И. и соавт., 2002; Калашникова Л.А. и соавт., 2004):
■ недостаточность потребления или усвояемости витаминов В6 и В12, фролиевой кислоты, участвующих в метаболизме гомоцистеина;
■ заболевания почек, почечная недостаточность;
■ курение;
■ прием некоторых лекарственных препаратов (таких как, метотрексат, гидразид никотиновой кислоты, фенитоин, теофиллин, трициклические антидепрессанты, оральные контрацептивы);
■ гипотиреоз.
Независимо от причин ГГЦ триггерный механизм развития тромбоза объясняется токсическим воздействием повышенных концентраций гомоцистеина на сосудистую стенку и, как следствие, избыточным высвобождением факторов эндотелиального происхождения, активизирующих как тромбоцитарный, так и плазменный гемостаз.
Выраженная ГГЦ является причиной равития более половиы сосудистых заболеваний мозга и инфаркта миокарда у больных в возрасте до 30 лет (Mudd S. et al., 1995; Зорилова И.В. 2005).
При выраженной ГГЦ часто наблюдаются артериалные и венозные тромбозы, тромбоэмболии легочной артерии, а также несосудистые осложнения (Федин А.И, 2002; Калашникова Л.А. и соавт., 2004):
■ зрительные расстройства – подвывих хрусталика глаза, отслойка сетчатки, глаукома, катаракта;
■ нервно-психические нарушения, не связанные с сосудистым заболеванием головного мозга, а возникающие в результате прямого токсического воздействия на мозг: эпилепсия, психотические расстройства, деменция несосудистого генеза;
■ скелетно-мышечные аномалии – остеопороз, сколиоз, арахнодактилия, миопатии;
■ эндокринные нарушения.
При умеренной ГГЦ риск ишемического инсульта в 4 раза выше, чем у лиц того же возраста без ГГЦ. У больных с умеренной ГГЦ чаще, чем у больных с нормальными показателями гомоцистеина, при МРТ-исследовании наблюдается лейкоареоз и множественные мелкие постинфарктные кисты в полушариях мозга, то есть наблюдается нейровизуализационная картина дисциркуляторной энцефалопатии; при клиническом исследовании ей соответствует снижение когнитивных функций (Evers et al., 1997). В основе дисциркуляторной энцефалопатии при ГГЦ лежит микроангиопатия. Даже небольшое повышение уровня гомоцистеина в крови приводит к гипертрофии стенки мозговых артерий и ухудшению кровоснабжения мозга (Faraa F.M., Lentz S.R., 2004).
Профилактика осложнений ГГЦ: для успешной профилактики и лечения осложнений ГГЦ необходимо определение уровня гомоцистеина в крови, желательно до развития инсультов и дисциркуляторной энцефалопатии. Желательно так же проводить исследование больным не только натощак, но и с нагрузкой метионином.
Определение уровня гомоцистеина в крови необходимо выполнять:
■ всем больным молодого возраста (по классификации ВОЗ до 45 лет) с ПНМК (приходящее нарушение мозгового кровообращения) и ишемическими инсультами недостаточно ясного генеза;
■ всем больным молодого возраста с нарастанием когнитивных нарушений неясного генеза;
■ всем больным молодого возраста с грубым атеросклерозом сонных и периферических артерий, выявленным при ультразвуковом исследовании, неависимо от наличия клинической симптоматики;
■ больным (независимо от возраста), постоянно принимающим антиконвульсанты, особенно тем, у кого наблюдается снижение когнитивных функций.
Лечение ГГЦ включает:
■ постоянный прием фолиевой кислоты 3-5 мг ежедневно;
■ курсы (1-2 месяца) внутримышечных ежедневных инъекций витаминов В6 (до 250 мг) и В12 500 мкг (2-3 курса в год), в межкурсовый период – прием внутрь поливитаминов;
■ отказ от курения и злоупотребления алкоголем.
Контроль адекватности терапии проводится 1 раз в 6-8 недель по гомоцистеину плазмы. Целевым является уровень гомоцистеина ≤10 ммоль/л.
Некоторые исследователи рекомендуют применять еще и бетаин (до 6 г в день) – гепато-протективное средство, активирующе метаболические процессы в печени. При цереброваскулярных осложнениях ГГЦ к лечению добавляют антиагреганты, вазоактивные и нейротрофические средства.
Диетотерапия проводится с учетом необходимости потребления больным ГГЦ большого количества фолиевой кислоты, витаминов В6 и В12. Фолиевая кислота содержится в зелени (салат, петрушка, шпинат), во многих овощах (капуста, морковь, помидоры), черном хлебе, субпродуктах (печень, почки), говяжьем мясе, яйцах (желток); витамин В6 (пиридоксин) – в печени, рябее, черном хлебе, бобовых; витамин В12 – в говяжьей печени и почках, в печени рыб.
С учетом более раннего и бурного развития атеросклероза при ГГЦ необходимо ограничение в меню больного животных жиров (жирных сортов мяса и рыбы, колбас, жирных сортов сыра, сливочного масла), высококалорийных кондитерских и мучных изделий.
Источник
