Двойное отхождение магистральных сосудов код мкб
Определение
Двойное отхождение сосудов от правого желудочка, далее ДОСПЖ (частичная транспозиция, двойной выход из правого желудочка, аномалия Тауссиг — Бинга), — группа врожденных пороков сердца, чаще генетически обусловленных (мутации генов GDF1 (19p13.11) и CFC1 (2q21.2) кардиальных клеток-предшественников), характеризующаяся аномальным типом вентрикуло-артериальной связи, при которой аорта и легочный ствол полностью или преимущественно происходят от правого желудочка, возникающей вследствие нарушения ротации конуса и его вклинения между атриовентрикулярными клапанами и сопровождающейся нарушением формирования выхода из левого желудочка.
Код по МКБ-10 Q20.1 — Удвоение выходного отверстия правого желудочка.
Код по МКБ-11 LA85.2 — Double outlet right ventricle.
Эпидемиология
Клинически частота встречаемости данного порока составляет 0,7 %, что довольно редко, а вот по патологоанатомическим — 2,7 %, что говорит о низкой частоте выявления и ранней смертности лиц с данным заболеванием. Если взять все врожденные пороки сердца в Российской Федерации, то лишь у 1,5 % больных проводится оперативная коррекция данного порока, при средней летальности, составляющей почти 10 %. Прогноз течения порока во многом зависит от его типа и, соответственно, варианта гемодинамики.
Продолжительность жизни выше у больных с гемодинамически более благоприятным течением, а именно с обструкцией выхода из правого желудочка. В целом, время, в течении которого умирают 50 % пациентов с данной аномалией, не превышает и 5 лет, и лишь 17 % больных со всеми типами порока доживают до 15 лет.
Классификация
– ДОСПЖ типа тетрады Фалло ДМЖП в данном случае расположен подаортально или подартериально, сочетаясь с обструкцией выхода из правого желудочка;
– ДОСПЖ типа ДМЖП характеризуется тем же, но при условии отсутствия обструкции выхода из правого желудочка;
– ДОСПЖ типа транспозиции магистральных сосудов характеризуется отсутствием обструкции выхода из правого желудочка, а ДМЖП располагается подлегочно;
– ДОСПЖ с некоммитированным ДМЖП проявляется наличием ДМЖП в синусном или трабекулярном отделе перегородки, может сочетаться с обструкцией выхода из правого желудочка.
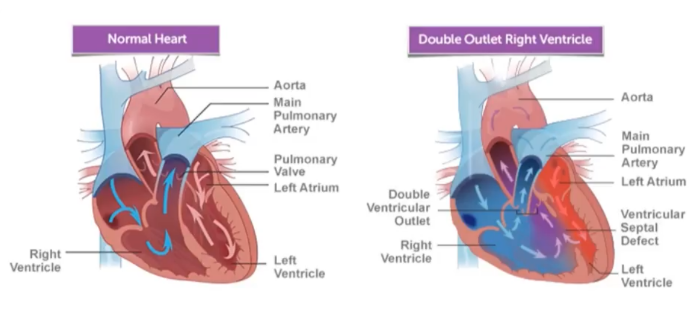
Рис. 1
Гемодинамика при анатомически нормальном строении сердца (слева), и при ДОСПЖ (справа).
Диагностика
Диагностика данного заболевания складывается из характерных симптомов сердечной недостаточности, которые проявляются с рождения. Золотым стандартом выявления данного порока является ЭхоКГ, которая позволяет оценить анатомическую структуру сердца и его гемодинамику. Пренатальная диагностика возможна, однако ее выполнение очень затруднительно.
Клинический случай
В отделение кардиологии БСМП поступил больной И., 18 лет, с жалобами на одышку смешанного характера, возникающей при подъеме на второй этаж, при прохождении около 100 метров, на периодический сухой приступообразный кашель, на повышенную утомляемость.
Из анамнеза: с детства отмечались низкая скорость роста, низкая прибавка в весе и толерантность к физической нагрузке. В возрасте двух лет установлен диагноз: ВПС, ДОСПЖ. От предложенного оперативного лечения родители отказались, боясь того, что ребенок не перенесет операцию. В возрасте 17 лет стал отмечать нарастание одышки, снижение толерантности к физической нагрузке. Обратился к кардиологу, назначена терапия ХСН.
Заочно консультирован кардиохирургом Научного центра сердечно-сосудистой хирургии, где по предоставленным данным «у больного сложный врожденный порок сердца, который в отсутствии коррекции в детском возрасте привел к высокой легочной гипертензии со значительной дилатацией легочной артерии, недостаточности клапана легочной артерии III ст. Выполнить оперативное лечение не представляется возможным. Рекомендована консервативная терапия».
При осмотре обращает на себя внимание астеничность телосложения, цианоз носогубного треугольника. В легких дыхание с жестким оттенком, единичные застойные хрипы в нижних отделах. При аускультации сердца выслушивается акцент II тона над легочной артерией, систолический шум над всеми точками аускультации, ЧСС 80 ударов в минуту. Артериальное давление симметричное на обеих руках, с тенденцией к гипертензии, 135 и 85 мм.рт.ст.
Из лабораторных данных обращает на себя внимание общий анализ крови, где отмечается компенсаторная полицитемия за счет роста числа эритроцитов 7,8×1012/л повышение уровня гемоглобина до 173 г/л и гематокрита.
При инструментальном обследовании:
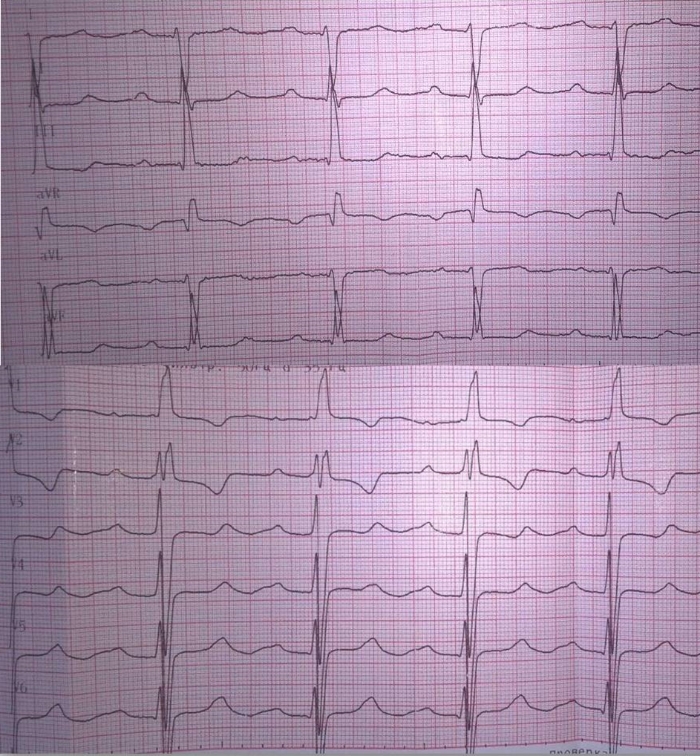
Рис. 2
Электрокардиограмма пациента при поступлении. На фоне синусового ритма с ЧСС 85 ударов в минуту отмечаются признаки гипертрофии левого желудочка и неполной блокады правой ножки пучка Гиса.
При проведении ЭхоКГ: Большой высокий дефект межжелудочковой перегородки. Фиброзные изменения створок аортального клапана, умеренный стеноз устья аорты, аортальная недостаточность II-III ст. Фиброз створок клапана легочной артерии. Недостаточность клапана легочной артерии II-III ст. Концетрическая значительная гипертрофия миокарда правого желудочка. Умеренная дилатация правого предсердия. Относительная трикуспидальная недостаточность II степени. Значительная дилатация ствола и ветвей легочной артерии. Значительная легочная гипертензия.
По рентгенографии органов грудной клетки отмечается расширение тени сердца влево. Признаки гиперволемии по малому кругу кровообращения.
Пациенту была скорректирована терапия ХСН с учетом выраженной легочной гипертензии с последующей титрацией дозы препаратов на амбулаторном этапе.
Лечение
Больным с ДОСПЖ при явлениях сердечной недостаточности на этапе предоперационной подготовки рекомендуются диуретики, иАПФ, сердечные гликозиды, β-адреноблокаторы, катехоламины.
Больным с ДОСПЖ типа тетрады Фалло рекомендуются β-адреноблокаторы и бензодиазепины при приступе гипоксии.
Больным с ДОСПЖ для лечения легочной гипертензии рекомендуются антагонисты кальция, блокаторы эндотелиновых рецепторов (например, Бозентан, Амбризентан), ингибиторы фосфодиэстеразы типа 5 (например, Силденафил, Варденафил), аналоги простагландинов (например, Илопрост).
Вид оперативной коррекции определяется размерами левого желудочка и, соответственно, локализацией дефекта межжелудочковой перегородки. Многие пациенты перед выполнением реконструктивной коррекции данного порока подвергаются паллиативным операциям, особенно если левый желудочек гипоплазирован или имеет пограничный размер.
Паллиативные операции строятся из шунта Блелока-Тауссинга (анастомоз между подключичной и легочной артерий) и бандинга легочной артерии (сужения легочной артерии), а иногда вначале выполняется резекция коарктации аорты либо первая стадия процедуры Норвуда (коррекция гемодинамики, путем уменьшения нагрузки на легочную артерию, вызванную повышенным кровотоком).
Учитывая то, что обструктивное поражение сосудов легких развивается столь же быстро, как и при ДМЖП, пациентов с ДОГПЖ следует оперировать рано в младенческом возрасте (до 6 месяцев). В настоящее время ранний возраст не следует рассматривать как фактор госпитальной летальности. Предпочительным методом операции является создание внутрижелудочкового туннеля с помощью заплаты из дакрона либо ткани Гортекс, соединяющего ЛЖ с аортой. Некоторым детям предварительно производится бандинг легочной артерии, однако не следует считать это правилом — гораздо важнее ранняя коррекция порока.
При рестриктивном дефекте межжелудочковой перегородки (когда размер менее диаметра аортального клапана), его расширяют при помощи антеросептального разреза либо иссечением в этой области межжелудочкового гребня. Создающие обструкцию в выводном тракте мышечные пучки иссекают с целью формирования прямого туннеля между аортой и ДМЖП.
Заключение
По частоте встречаемости данный порок весьма редок. По данным некоторых авторов данная аномалия встречается у 2-3 % детей, родившихся с врожденными пороками сердца. Однако редкость возникновения данного порока не исключает вероятности встречи с ним. Следует помнить, что данная патология требует оперативного лечения в раннем возрасте (до 6-ти месяцев), а медикаментозная терапия является поддерживающей и лишь отдаляет исход неизбежно нарастающей ХСН.
Источники:
- Клинические рекомендации ассоцииации сердечно-сосудистых хирургов России, «Двойное отхождение сосудов от правого желудочка» 2016 г.
- Бокерия Л.А., Лекции по сердечно-сосудистой хирургии. В 2-х томах. Москва, 2001, Т. 1, стр 482-490.
- Смирнов Н.Н. Двойное отхождение сосудов от правого желудочка: особенности пренатальной диагностики. Пренатальная диагностика, 2009.-N 1.-С.37-40
- The portal for rare diseases and orphan drugs. Double outlet right ventricle.
Источник
- Описание
- Причины
- Симптомы (признаки)
- Диагностика
- Лечение
Краткое описание
Транспозиция магистральных сосудов (ТМС) — ВПС, характеризующийся дискордантностью желудочково — артериального соединения при конкордантности соединения остальных сегментов сердца. Иными словами, аорта отходит от морфологически правого желудочка, а лёгочный ствол — от морфологически левого. Статистические данные • 7–15% всех ВПС • 9,9% ВПС, диагностированных в грудном возрасте • Соотношение мужского пола к женскому при рождении — 3:1.
Код по международной классификации болезней МКБ-10:
- Q25.8 Другие врожденные аномалии крупных артерий
Причины
Этиология: причины, вызывающие ВПС (см. Тетрада Фалло).
Патогенез • При корригированной ТМС дискордантность желудочково — артериального соединения сочетается с дискордантностью соединения предсердий и желудочков (транспозиция аорты и лёгочной артерии сопровождается инверсией желудочков), и кровообращение при этом не страдает, если нет сопутствующих пороков • В данной статье рассмотрена лишь полная ТМС • В зависимости от изменения лёгочного кровотока выделяют полную ТМС с увеличенным или нормальным лёгочным кровотоком (при её сочетании с открытым артериальным протоком, дефектами межпредсердной и межжелудочковой перегородок, аортопульмональным свищом) и полную ТМС с уменьшенным лёгочным кровотоком, когда сопутствующие ей септальные дефекты сочетаются со стенозом выходного отдела левого желудочка (сложная форма ТМС) • Если в норме большой и малый круги кровообращения связаны между собой последовательно, то при ТМС они функционируют параллельно, будучи полностью разделены. Поэтому обязательное условие даже для непродолжительной жизни — наличие сообщений между большим и малым кругами кровообращения в виде естественно существующих или искусственно созданных дефектов. При этом сброс крови осуществляется при ТМС в обоих направлениях • Чем больше размер шунта, тем менее выражена гипоксемия • Наиболее благоприятный прогноз отмечают в случаях, когда большой дефект межпредсердной или межжелудочковой перегородки обеспечивает необходимое смешивание крови, а умеренный стеноз лёгочной артерии предотвращает чрезмерный кровоток в лёгких.
Симптомы (признаки)
Клиническая картина • Общий цианоз • Дифференцированный цианоз, когда верхняя половина тела более синюшна, чем нижняя, патогномоничен для ТМС в сочетании с открытым артериальным протоком • Тахикардия • Одышка • Увеличение размеров сердца и печени • Отёки, асцит • При аускультации — усиление обоих тонов, систолический шум органического или относительного (при дефекте межпредсердной перегородки) стеноза лёгочной артерии, шум ДМЖП или открытого артериального протока.
Диагностика
Инструментальная диагностика
• ЭКГ •• До 1–1,5 мес жизни изменения могут отсутствовать •• Признаки гипертрофии и перегрузки правых отделов.
• Рентгенография органов грудной клетки •• Тень сердца приобретает форму яйца, лежащего на боку, с узким сосудистым пучком в переднезадней и широким — в боковой проекции, а дуга аорты почти всегда находится слева (высокоспецифичные признаки) •• Обеднение (при стенозе лёгочной артерии) или обогащение (при септальных дефектах) сосудистого рисунка лёгких.
• ЭхоКГ •• Иизуализация аномального отхождения магистральных сосудов •• Оценка степени гипертрофии стенок и дилатации камер сердца •• Диагностика сопутствующих дефектов (см. Дефект межжелудочковой перегородки, Дефект межпредсердной перегородки, Проток артериальный открытый) или стеноза выходного отдела правого желудочка.
• Пульсоксиметрия, исследование газового состава периферической крови •• Низкие насыщение кислородом (патогномоничный признак — менее 30%) и pO2 (патогномоничный признак — менее 20 мм рт.ст.) в периферической крови •• При сочетании ТМС с открытым артериальным протоком — высокая разница показателей крови верхних и нижних конечностей.
• Зондирование полостей сердца •• Повышение pO2 и насыщения крови кислородом в правых отделах и понижение — в левых •• Проводят пробы с аминофиллином и ингаляцией кислорода для определения прогноза в отношении обратимости лёгочной гипертензии •• См. также Дефект межжелудочковой перегородки, Дефект межпредсердной перегородки, Проток артериальный открытый.
• Правые и левые атриография и вентрикулография, восходящая аортография, коронарная ангиография •• Визуализация патологического поступления контраста из правых отделов в аорту, а из левых — в лёгочную артерию •• Диагностика сопутствующих дефектов (см. Дефект межжелудочковой перегородки, Дефект межпредсердной перегородки, Проток артериальный открытый) или стеноза выходного отдела правого желудочка •• Оба задних синуса аорты, обращённых к лёгочной артерии, становятся коронарными, и существует шесть нормальных вариантов отхождения коронарных артерий от синусов аорты •• В 15% случаев выявляют аномалии отхождения коронарных артерий.
Медикаментозная терапия: при наличии естественных дефектов между большим и малым кругами кровообращения с целью предотвращения их закрытия проводят инфузию ПгЕ1 (алпростадил) 0,05–0,1 мг/кг/мин.
Лечение
Хирургическое лечение
• Показания: все пациенты с полной формой ТМС.
• Противопоказания: необратимая лёгочная гипертензия.
• Методы оперативного лечения •• Паллиативные вмешательства — увеличение размеров естественных или создание искусственных дефектов между большим и малым кругами кровообращения: ••• операция Парка–Рашкинда (чрескожная баллонная атриосептостомия), обычно проводят в сроки до 3 мес, не имеет преимуществ перед лечением Пг; ••• операция Блелока–Хенлона (открытая резекция межпредсердной перегородки), представляет лишь исторический интерес •• Радикальная коррекция заключается в пластике предсердий синтетической заплатой таким образом, что кровь из лёгочных вен поступает в правое предсердие, а кровь из полых вен — в левое (операции Мастарда и Сеннинга) •• Анатомическая коррекция ТМС (операция Жатене) заключается в пересечении с последующей ортотопической реплантацией магистральных сосудов, одновременной перевязкой открытого артериального протока, а также пересадкой устьев коронарных артерий в основание лёгочного ствола •• При сочетании ТМС с ДМЖП проводят пластику дефекта перегородки с одновременной анатомической коррекцией ТМС по Жатене •• При сложной форме ТМС (сочетании с ДМЖП и стенозом лёгочной артерии) показана операция Растелли — пластика дефекта перегородки с формированием выходного отдела левого желудочка синтетической или аутоперикардиальной заплатой, ликвидация проходимости устья лёгочного ствола, имплантация искусственного ствола между правым желудочком и лёгочным стволом или правой лёгочной артерией.
Специфические послеоперационные осложнения • Синдром слабости синусового узла • Стеноз устьев полых и лёгочных вен • Стеноз выходной отдел правого и левого желудочков.
Прогноз • Клинически выраженная недостаточность кровообращения наступает обычно к 1–1,5 мес жизни • Половина детей погибают в течение первого месяца после рождения • Две трети не доживают до годовалого возраста • Средняя продолжительность жизни этих больных — 3–19 мес • Летальность после операций Мастарда и Сеннинга не превышает 10% • В отдалённые сроки хороших результатов достигают в 85–90% случаев • Госпитальная летальность при анатомической коррекции ТМС по Жатене — 2–3%, по Растелли — менее 10% • 5 — летняя выживаемость при анатомической коррекции ТМС — 80–90%.
Сокращение. ТМС — транспозиция магистральных сосудов.
МКБ-10 • Q25.8 Другие врождённые аномалии крупных артерий.
Источник
Содержание
- Описание
- Дополнительные факты
- Причины
- Классификация
- Симптомы
- Диагностика
- Лечение
- Прогноз
- Основные медицинские услуги
- Клиники для лечения
Названия
Название: Транспозиция магистральных сосудов.
Транспозиция магистральных сосудов
Описание
Транспозиция магистральных сосудов. Тяжелая врожденная патология сердца, характеризующаяся нарушением положения главных сосудов — отхождением аорты от правых отделов сердца, а легочной артерии — от левых. Клинические признаки транспозиции магистральных сосудов включают цианоз, одышку, тахикардию, гипотрофию, сердечную недостаточность. Диагностика транспозиции магистральных сосудов основана на данных ФКГ, ЭКГ, рентгенологического исследования органов грудной клетки, катетеризации полостей сердца, вентрикулографии. Методами оперативной коррекции транспозиции магистральных сосудов служат паллиативные вмешательства (баллонная атриосептостомия) и радикальные операции (Мастарда, Сеннинга, Жатене, Растелли, артериального переключения).
Дополнительные факты
Транспозиция магистральных сосудов – врожденный порок сердца, анатомическую основу которого составляет неправильное расположение аорты и легочной артерии относительно друг друга и их обратное отхождение от желудочков сердца. Среди различных ВПС транспозиция магистральных сосудов составляет 7–15%. В 3 раза чаще встречается у мальчиков. Транспозиция магистральных сосудов входит в число «большой пятерки» — наиболее часто встречающихся врожденных аномалий сердца, наряду с дефектом межжелудочковой перегородки, коарктацией аорты, открытым артериальным протоком, тетрадой Фалло.
В кардиологии транспозиция магистральных сосудов относится к критическим порокам сердца синего типа, не совместимым с жизнью, поэтому требует хирургического вмешательства в первые недели жизни.
Особенности гемодинамики при транспозиции магистральных сосудов.
С позиций оценки гемодинамики важно различать полную транспозицию магистральных сосудов и корригированную. При корригированной транспозиции аорты и легочной артерии имеет место желудочково-артериальная и предсердно-желудочковая дискордантность. Другими словами, корригированная транспозиция магистральных сосудов сочетается с инверсией желудочков, поэтому внутрисердечная гемодинамика осуществляется в физиологическом направлении: в аорту поступает артериальная кровь, а в легочную артерию венозная. Характер и выраженность гемодинамических нарушений при корригированной транспозиции магистральных сосудов зависят от сопутствующих пороков – ДМЖП, митральной недостаточности и тд.
Полная форма сочетает в себе дискордантные желудочково-артериальные взаимоотношения при конкордантном взаимоотношении других отделов сердца. При полной транспозиции магистральных сосудов венозная кровь из правого желудочка поступает в аорту, разносится по большому кругу кровообращения, а затем вновь поступает в правые отделы сердца. Артериальная кровь выбрасывается левым желудочком в легочную артерию, по ней – в малый круг кровообращения и вновь возвращается в левые отделы сердца.
Во внутриутробном периоде транспозиция магистральных сосудов практически не нарушает фетальное кровообращение, поскольку легочный круг у плода не функционирует; циркуляция крови осуществляется по большому кругу через открытое овальное окно или открытый артериальный проток. После рождения жизнь ребенка с полной транспозицией магистральных сосудов зависит от наличия сопутствующих коммуникаций между малым и большим кругом кровообращения (ООО, ДМЖП, ОАП, бронхиальных сосудов), обеспечивающих смешение венозной крови с артериальной. При отсутствии дополнительных пороков дети погибают сразу после рождения.
При транспозиции магистральных сосудов шунтирование крови осуществляется в обоих направлениях: при этом, чем больше размер коммуникации, тем меньше степень гипоксемии. Наиболее благоприятными являются случаи, когда ДМПП или ДМЖП обеспечивают достаточное смешивание артериальной и венозной крови, а наличие умеренного стеноза легочной артерии предотвращает чрезмерную гиперволемию малого круга.
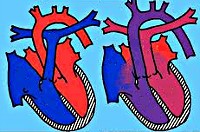
Транспозиция магистральных сосудов
Причины
Аномалии развития магистральных сосудов формируются в первые 2 месяца эмбриогенеза в результате хромосомных аберраций, неблагоприятной наследственности или отрицательных внешних воздействий. Экзогенными факторами могут выступать вирусные инфекции, перенесенные беременной (ОРВИ, краснуха, ветряная оспа, корь, эпидемический паротит, герпес, сифилис), токсикозы, радиоактивное облучение, лекарственные вещества, алкогольная интоксикация, полигиповитаминоз, заболевания матери (сахарный диабет), возрастные изменения в организме женщины старше 35 лет. Транспозиция магистральных сосудов встречается у детей с синдромом Дауна.
Непосредственные механизмы транспозиции магистральных сосудов до конца не изучены. По одной из версий, порок обусловлен неправильным изгибом аортально-пульмональной перегородки в процессе кардиогенеза. Согласно более современным представлениям, транспозиция магистральных сосудов является результатом неправильного роста субаортального и субпульмонального конуса при разветвлении артериального ствола. При закладке сердце в норме резорбция инфундибулярной перегородки приводит к формированию аортального клапана кзади и книзу от клапана легочной артерии, над левым желудочком. При транспоцизии магистральных сосудов процесс резорбции нарушается, что сопровождается расположением клапана аорты над правым желудочком, а клапана легочной артерии — над левым.
Классификация
В зависимости от количества сопутствующих коммуникаций, выполняющих компенсирующую роль, и состояния малого круга кровообращения различают следующие варианты транспозиции магистральных сосудов:
1. Транспозиция магистральных сосудов, сопровождающаяся гиперволемией или нормальной величиной легочного кровотока:
• с дефектом межпредсердной перегородки или открытым овальным окном (простая транспозиция).
• с ДМЖП.
• с открытым артериальным протоком и наличием дополнительных коммуникаций.
2. Транспозиция магистральных сосудов, сопровождающаяся уменьшением легочного кровотока:
• со стенозом выносного тракта левого желудочка.
• с ДМЖП и стенозом выносного тракта левого желудочка (сложная транспозиция).
В 80% случаев транспозиция магистральных сосудов сочетается с одной или несколькими дополнительными коммуникациями; у 85-90% больных порок сопровождается гиперволемией малого круга кровообращения. Для транспозиции магистральных сосудов характерно параллельное расположение аорты относительно легочного ствола, тогда как в нормальном сердце обе артерии перекрещиваются. Чаще всего аорта находится впереди легочного ствола, в редких случаях сосуды располагаются в одной плоскости параллельно, или аорта локализуется кзади от легочного ствола. В 60% наблюдений обнаруживается D-транспозиция – положение аорты справа от легочного ствола, в 40%- L-транспозиция – левостороннее положение аорты.
Симптомы
Дети с транспозицией магистральных сосудов рождаются доношенными, с нормальным или несколько повышенным весом. Сразу после рождения, с началом функционирования отдельного легочного круга кровообращения, нарастает гипоксемия, что клинически проявляется тотальным цианозом, одышкой, тахикардией. При транспозиции магистральных сосудов, сочетающейся с ОАП и коарктацией аорты, выявляется дифференцированный цианоз: синюшность верхней половины тела выражена в большей степени, чем нижней.
Уже в первые месяцы жизни развиваются и прогрессируют признаки сердечной недостаточности: кардиомегалия, увеличение размеров печени, реже – асцит и периферические отеки. При осмотре ребенка с транспозицией магистральных сосудов обращает внимание деформация фаланг пальцев, наличие сердечного горба, гипотрофия, отставание в моторном развитии. При отсутствии стеноза легочной артерии переполнение кровью малого круга кровообращения приводит к частому возникновению повторных пневмоний.
Одышка. Ретикулоцитоз.
Диагностика
Наличие у ребенка транспозиции магистральных сосудов обычно распознается еще в родильном доме. Физикальное обследование выявляет гиперактивность сердца, выраженный сердечный толчок, который смещен медиально, расширенную грудную клетку. Аускультативные данные характеризуются усилением обоих тонов, систолическим шумом и шумом ОАП или ДМЖП.
У детей в возрасте 1-1,5 месяцев по ЭКГ обнаруживаются признаки перегрузки и гипертрофии правых отделов сердца. При оценке рентгенографии грудной клетки высокоспецифичными признаками транспозиции магистральных сосудов являются: кардиомегалия, характерная конфигурация тени сердца яйцеобразной формы, узкий сосудистый пучок в переднезадней проекции и расширенный в боковой проекции, левое положение дуги аорты (в большинстве случаев), обеднение рисунка легких при стенозе легочной артерии или его обогащение при дефектах перегородки.
Эхокардиография показывает аномальное отхождение магистральных сосудов, гипертрофию стенок и дилатацию камер сердца, сопутствующие дефекты, наличие стеноза легочной артерии. С помощью пульсоксиметрии и исследования газового состава крови определяются параметры насыщения крови кислородом и парциальное давление кислорода: при транспозиции магистральных сосудов SО2 менее 30%, PaO2 — менее 20 мм При зондировании полостей сердца обнаруживается повышенное насыщение крови кислородом в правом предсердии и желудочке и пониженное в левых отделах сердца; одинаковое давление в аорте и правом желудочке.
Рентгеноконтрастные методы исследования (вентрикулография, атриография, аортография, коронарография) визуализируют патологическое поступление контраста из левых отделов сердца в легочную артерию, а из правых — в аорту; сопутствующие дефекты, аномалии отхождения венечных артерий. Транспозицию магистральных сосудов следует отличать от тетрады Фалло, атрезии легочной артерии, атрезии трикуспидального клапана, гипоплазии левых отделов сердца.
Лечение
Всем пациентам с полной формой транспозиции магистральных сосудов показано экстренное оперативное лечение. Противопоказанием служат случаи развития необратимой легочной гипертензии. До операции новорожденным проводится медикаментозная терапия простагландином Е1, помогающим сохранить артериальный проток незаращенным и обеспечить адекватный кровоток.
Паллиативные вмешательства при транспозиции магистральных сосудов необходимы в первые дни жизни для увеличения размера естественного или создания искусственного дефекта между малым и большим кругами кровообращения. К такого рода операциям относятся эндоваскулярная баллонная атриосептостомия (операция Парка–Рашкинда) и открытая атриосептэктомия (резекция межпредсердной перегородки по Блелоку–Хенлону).
К числу гемокорригирующих вмешательств, выполняемых при транспозиции магистральных сосудов, относятся операции Мастарда и Сеннинга — внутрипредсердное переключение потоков артериальной и венозной крови с помощью синтетической заплаты. При этом топография магистральных артерий остается прежней, по внутрипредсердному туннелю из легочных вен кровь поступает в правое предсердие, а из полых вен — в левое.
Варианты анатомической коррекции транспозиции магистральных сосудов включают различные способы артериального переключения: операцию Жатене (пересечение и ортотопическую реплантацию магистральных сосудов, перевязку ОАП), операцию Растелли (пластику ДМЖП и устранение стеноза легочной артерии), артериальное переключение с пластикой МЖП. Специфическими послеоперационными осложнениями, сопровождающими коррекцию транспозиции магистральных сосудов, могут служить СССУ, стеноз устьев легочных и полых вен, стеноз выносящих трактов желудочков.
Прогноз
Полная транспозиция магистральных сосудов – критический, несовместимый с жизнью порок сердца. При отсутствии специализированной кардиохирургической помощи половина новорожденных погибает в первый месяц жизни, более 2/3 детей – к 1 году от тяжелой гипоксии, недостаточности кровообращения и нарастания ацидоза.
Хирургическая коррекция простой транспозиции магистральных сосудов позволяет достичь хороших отдаленных результатов в 85–90% случаев; при сложной форме порока – в 67% случаев. После операций пациенты нуждаются в наблюдении кардиохирурга, ограничении физических нагрузок, профилактике инфекционного эндокардита. Важное значение имеет пренатальное выявление транспозиции магистральных сосудов с помощью фетальной ЭхоКГ, соответствующее ведение беременности и подготовка к родам.
Основные медуслуги по стандартам лечения | ||
Клиники для лечения с лучшими ценами
|
Источник
