Дисплазия легочная код мкб
Связанные заболевания и их лечение
Описания заболеваний
Стандарты мед. помощи
Содержание
- Описание
- Дополнительные факты
- Причины
- Классификация
- Симптомы
- Диагностика
- Лечение
- Основные медицинские услуги
- Клиники для лечения
Названия
Название: Бронхолегочная дисплазия.
Бронхолегочная дисплазия
Описание
Бронхолегочная дисплазия (БЛД). Хроническое заболевание дыхательной системы у новорожденных, которое возникает при проведении ИВЛ с использованием высоких концентраций кислорода на фоне респираторных нарушений. Основные проявления – синдром дыхательной недостаточности (ДН) и бронхиальной обструкции, деформация грудной клетки. Основа диагностики бронхолегочной дисплазии – рентгенография ОГК. Лечение при данной патологии включает в себя неспецифические терапевтические меры: рациональное питание и режим, адекватную респираторную поддержку, симптоматические медикаментозные препараты.
Дополнительные факты
Бронхолегочная дисплазия (БЛД). Это гетерогенная патология периода новорожденности, которая возникает при проведении ИВЛ с высокими концентрациями кислорода, сопровождается дыхательной недостаточностью, бронхообструктивным синдромом и гипоксемией. Впервые ввел этот термин, а также описал его рентгенологическую картину по стадиям американский педиатр и радиолог Нортвей в 1967 году. По своей сути БЛД является не врожденным, а ятрогенным заболеванием, что противоречит его названию, однако другого термина на данный момент не предложено. Она возникает у 16-40% новорожденных с массой тела менее 1500 г, которым необходима ИВЛ по поводу РДС. Общий показатель летальности при бронхолегочной дисплазии в течение первых 12 месяцев жизни составляет 10-25%.

Бронхолегочная дисплазия
Причины
Бронхолегочная дисплазия – это полиэтиологическое заболевание, которое формируется на фоне воздействия нескольких потенциальных этиологических факторов. К таковым относятся баротравма при нерациональной ИВЛ, морфологическая незрелость паренхимы легкого, системы сурфактанта и антиоксидантной системы, токсическое воздействие высоких концентраций кислорода, инфекции (микоплазмы, пневмоцисты, уреаплазмы, хламидии, ЦМВ), отек легких различного генеза, легочная гипертензия, ГЭРХ, гиповитаминозы А и Е, генетическая склонность.
Морфологически бронхолегочная дисплазия проходит четыре стадии. На I стадии развивается классический РДС. На II стадии происходит деструкция эпителия альвеол и его последующая регенерация, формируются персистирующие гиалиновые мембраны. Также возникает отек интерстиция, некроз бронхиол. III стадия характеризуется образованием ограниченных эмфизематозных изменений, ателектазов и фиброза. На IV стадии в альвеолах накапливаются ретикулярные, эластические и коллагеновые волокна – окончательно формируются ателектазы, эмфизема, участки фиброза легкого.
Классификация
Согласно общепринятой классификации, существует две основные формы бронхолегочной дисплазии:
• Классическая или «тяжелая» форма. Данный вариант БЛД характерен для недоношенных детей. Развивается при проведении интенсивной респираторной поддержки без введения препаратов сурфактанта. Основное проявление – наличие вздутия участков легких, формирование булл и фиброза.
• Новая или «легкая» форма бронхолегочной дисплазии. Наблюдается у детей, родившихся после 32 недели беременности, которым с целью профилактики вводился сурфактант. Рентгенологически проявляется гомогенным затемнением легких и отсутствием участков вздутия.
Также в отечественной педиатрии и неонатологии клинически выделяют три степени тяжести бронхолегочной дисплазии:
• Легкая БЛД. В состоянии покоя ЧД в переделах физиологической нормы (до 40 в мин. ), реже отмечается незначительное тахипноэ при нагрузке (до 60 в мин. ). Возможны признаки бронхиальной обструкции при респираторных инфекциях, умеренная эмфизема. Потребности в кислородной поддержке при гестационном возрасте старше 36 недель не возникает.
• Среднетяжелая бронхолегочная дисплазия. На фоне плача, кормления, беспокойства развивается тахипноэ (60-80 в мин. ). В состоянии покоя могут прослушиваться сухие или мелкопузырчатые хрипы. Часто наблюдается бронхиальная обструкция на фоне инфекционных заболеваний. Рентгенологически отмечается эмфизема, пневмосклероз. Существует потребность в респираторной поддержке.
• Тяжелая бронхолегочная дисплазия. Выраженное тахипноэ (80 в мин. И более) в состоянии покоя. Ярко выраженная бронхиальная обструкция, аускультативные признаки недостаточности дыхательной системы. Зачастую формируется легочное сердце, возникает задержка физического развития. Рентгенологически выявляется эмфизема, бедность легочного рисунка, пневмосклероз, множество ателектазов и перибронхиальных изменений. Требуется респираторная поддержка с использованием концентрации кислорода 30%.
Симптомы
Специфических проявлений бронхолегочной дисплазии не существует. Заболевание характеризуется выраженной дыхательной недостаточностью на фоне высоких концентраций кислорода при ИВЛ. Общее состояние зависит от степени тяжести, однако, в большинстве случаев оно среднетяжелое или тяжелое. Грудная клетка приобретает характерный для эмфизематозных заболеваний вид: «бочкообразная форма» и горизонтальный ход ребер, увеличение размера в переднезаднем направлении, выпячивание межреберных промежутков и их втяжение при выдохе-вдохе. Также при бронхолегочной дисплазии возникает тахипноэ до 90-100 в 1 мин, наблюдается акро- или диффузный цианоз. При попытках перевести ИВЛ на более щадящий режим развивается острая недостаточность дыхательной системы, которая сопровождается выраженной гиперкапнией и гипоксемией. При прекращении респираторной поддержки на фоне спонтанного дыхания сохраняются признаки бронхиальной обструкции.
Гипокалиемия. Гипонатриемия. Рвота.
Диагностика
Диагностика бронхолегочной дисплазии включает в себя сбор анамнестических данных, объективный осмотр, лабораторные и инструментальные методы исследования. При сборе анамнеза неонатолог или педиатр обращает внимание на сроки, в которые произошли роды, наличие возможных этиологических и способствующих факторов. При объективном обследовании выявляются характерные клинические проявления бронхолегочной дисплазии: дыхательная недостаточность, деформация грудной клетки В ОАК определяется нормохромная гипорегенераторная анемия, увеличение числа нейтрофилов и эозинофилов. В биохимическом анализе крови могут быть обнаружены гипокалиемия, гипонатриемия, гипохлоремия, уменьшение рН, повышение креатинина и мочевины. Одним из характерных признаков бронхолегочной дисплазии является низкое парциальное давление кислорода в крови (РаО2) – 40-55.
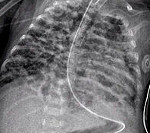
Среди инструментальных методов диагностики при бронхолегочной дисплазии наиболее информативными считаются рентгенография ОГК, компьютерная и магнитно-резонансная томография. Чаще всего используется именно рентгенологический метод исследования, который позволяет выявить характерные признаки БЛД, определить степень тяжести и стадию морфологических изменений легких. КТ и МРТ дают возможность выявить аналогичные проявления и детально оценить структуру паренхимы легких. Однако они применяются не так часто в связи с отсутствием выраженных преимуществ перед рентгенографией и высокой стоимостью.
Лечение
Специфического лечения бронхолегочной дисплазии не существует. Основные терапевтические средства при данном заболевании включают в себя кислородную поддержку, рациональное питание, режим, симптоматические медикаментозные препараты. Несмотря на то, что ИВЛ – это основная причина развития БЛД, она является одним из наиболее важных аспектов лечения. Ее основная цель – поддержание показателей крови в допустимых пределах: рН крови на уровне 7,25, сатурация – 90% и более, парциальное давление крови – 55-70.
Также важную роль в лечении бронхолегочной дисплазии играет питание ребенка. У больных детей имеется высокая метаболическая потребность на фоне необходимости адекватного роста легких. В таких условиях наиболее благоприятной считается суточная калорийность в пределах 115-150 ккал/кг/день. Суточный режим ребенка должен включать максимальный покой, многоразовое кормление, поддержание температуры тела на уровне 36,5 °C. Среди медикаментозных препаратов, которые могут применяться при БЛД, наиболее часто используются бронхолитики, муколитические и диуретические средства, глюкокортикостероиды, β2-агонисты, антибиотики и витамины А, Е.
Профилактика бронхолегочной дисплазии подразумевает антенатальную охрану плода, предотвращение преждевременных родов, использование щадящих режимов ИВЛ и сведение длительности ее проведения к минимуму, витаминотерапию, использование препаратов сурфактанта. При угрозе преждевременного рождения ребенка показано введение матери глюкокортикостероидов с целью профилактики СДР и БЛД в дальнейшем.
Основные медуслуги по стандартам лечения | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Клиники для лечения с лучшими ценами
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Источник
Рубрика МКБ-10: P27.1
МКБ-10 / P00-P96 КЛАСС XVI Отдельные состояния, возникающие в перинатальном периоде / P20-P29 Дыхательные и сердечно-сосудистые нарушения, характерные для перинатального периода / P27 Хронические болезни органов дыхания, развившиеся в перинатальном периоде
Определение и общие сведения[править]
Бронхолегочная дисплазия (БЛД) — это полиэтиологическое хроническое заболевание морфологически незрелых легких, развивающееся у новорожденных, главным образом глубоконедоношенных детей, в результате интенсивной терапии РДС и/или пневмонии.
Бронхолегочная дисплазия протекает с преимущественным поражением бронхиол и паренхимы легких, развитием эмфиземы, фиброза и/или нарушением репликации альвеол; проявляется зависимостью от кислорода в возрасте 28 сут жизни и старше, бронхообструктивным синдромом и симптомами дыхательной недостаточности; характеризуется специфичными рентгенографическими изменениями в первые месяцы жизни и регрессом клинических проявлений по мере роста ребенка.
Эпидемиология
Частота развития заболевания у недоношенных детей, находящихся на ИВЛ, достигает 30%. Заболеваемость обратно пропорциональна гестационному возрасту и массе тела при рождении, среди детей с ЭНМТ она развивается у 47-80%. Смертность составляет 4,1% у детей первых 3 мес жизни, 1,2-2,6% — на первом году жизни.
Классификация
Диагноз «бронхолегочная дисплазия» выставляется, если ребенок нуждался в дополнительном кислороде (и/или респираторной терапии) в течение первых 28 дней жизни. Тяжесть БЛД определяет степень кислородозависимости, оцененная в 36 нед постконцептуального возраста у детей, родившихся с гестационным возрастом менее 32 нед, и на 56-й день жизни у детей, родившихся с гестационным возрастом более 32 нед или при выписке, если она наступит раньше.
• Легкая — при дыхании воздухом.
• Среднетяжелая — при потребности в кислороде с FiO2 менее
0,3.
• Тяжелая — при потребности в кислороде с FiO2 более 0,3 или при необходимости проведения CPAp/ИВЛ.
Существует также определение «новой» БДЛ и «старой» БЛД. Новая БЛД характерна для детей, родившихся на сроке гестации 22-26 нед, респираторная терапия которым проводилась с учетом современной концепции защиты легких, со своевременным введением сурфактанта и бережной респираторной терапией. Обусловлена «новая БЛД» прежде всего нарушением и задержкой развития и созревания легких и характеризуется манифестацией кислородозависимости к концу первой недели жизни.
«Старая» форма БЛД в первую очередь является результатом несоблюдения современных правил проведения респираторной терапии у новорожденных, являясь таким образом ятрогенным заболеванием.
Этиология и патогенез[править]
К факторам риска развития БЛД относятся:
• незрелость и задержка развития легких, недостаточность сурфактанта у детей с очень низкой массой тела, гестационным возрастом менее 30 нед;
• ИВЛ более 3 сут с FiO2 >0,5 и PIP >30 см вод.ст.;
• хорионамнионит у матери, колонизация и инфекция респираторного тракта недоношенных новорожденных, вызванная Ureaplasma urealyticum, ЦМВ (цитомегаловирусная инфекция), врожденная, ИВЛ-ассоциированная пневмония, сепсис;
• синдромы утечки воздуха;
• отек легких в результате избыточного объема инфузионной терапии, нарушения выведения жидкости, гемодинамически значимого ОАП (открытый артериальный проток);
• недостаточная энергетическая ценность питания и повышенная энергетическая потребность у детей, находящихся на ИВЛ, низкие темпы роста.
Патогенез
Комбинированное воздействие первичного респираторного заболевания, агрессивной интенсивной терапии и системной воспалительной реакции на незрелые легкие недоношенного ребенка нарушает процесс формирования и роста альвеол. Происходит повреждение всех структурных компонентов легкого. Некроз эпителия дыхательных путей, воспаление и интерстициальный отек переходят в облитерирующий бронхиолит и перибронхиальный фиброз. Повреждение эпителия и гипертрофия мышечного слоя бронхиол вызывают нарушение распределения газа в легких, образование воздушных ловушек, развитие ателектазов и эмфиземы. Снижается растяжимость легких, увеличивается сопротивление дыхательных путей и работа дыхания. Сужение просвета легочных капилляров и гипертрофия стенки сосудов ведут к легочной гипертензии (ЛГ) и легочному сердцу.
В связи с совершенствованием техники респираторной терапии и выхаживания увеличилось количество выживших глубоконедоношенных детей, и повсеместно стали регистрироваться случаи развития БЛД у младенцев, не нуждавшихся в высоких концентрациях кислорода, длительной оксигенотерапии, ИВЛ и не имевших РДС. Это послужило основанием для выделения новой БЛД, развивающейся у детей с экстремально низкой массой тела, гестационным возрастом 22-26 нед при рождении, в том числе после применения сурфактанта. При новой БЛД происходит нарушение роста и развития альвеол, сосудов малого круга кровообращения, уменьшение количества альвеол с истонченными септами, при минимально выраженном фиброзе.
Клинические проявления[править]
Бронхолегочная дисплазия, возникшая в перинатальном периоде: Диагностика[править]
Критерии для диагностики БЛД:
• указания в анамнезе больного на проведение ИВЛ и/или CPAP в течение первой недели жизни;
• необходимость в возрасте 28 сут проведения кислородной терапии для поддержания SpO2 >90%;
• сохранение в возрасте 28 сут симптомов дыхательной недостаточности, бронхообструктивный синдром;
• характерные рентгенологические изменения.
Начало развития БЛД можно предположить обычно к 1014-му дню жизни, когда у ребенка, находящегося на ИВЛ по поводу РДС, отсутствует положительная динамика, начинает развиваться стойкая дыхательная недостаточность, в ряде случаев после первичного улучшения.
Физикальное обследование
Кожные покровы бледные, с цианотичным оттенком. Грудная клетка вздута, выявляются тахипноэ до 80-100 в минуту, одышка с втяжениями уступчивых мест грудной клетки, удлиненным выдохом; аускультативно — ослабление дыхания, крепитация, проводные сухие свистящие, влажные мелкопузырчатые хрипы. Типичны приступы апноэ с брадикардией. При развитии СН присоединяются кардиомегалия, гепатоспленомегалия, периферические отеки.
Инструментальные исследования
Типичные рентгенологические изменения (низкое стояние диафрагмы, широкие межреберные промежутки, сумма передних и задних отрезков ребер более 14; линейные уплотнения — участки фиброза, чередующиеся с зонами просветления за счет эмфиземы; в тяжелых случаях — буллы; ателектазы, неравномерность вентиляции) появляются обычно на 3-4-й неделе жизни.
Кардиоваскулярный мониторинг включает ЭКГ, контроль системного АД; ЭхоКг с определением давления в легочной артерии и кровотока через ОАП. Для исключения врожденных пороков развития легких может возникнуть потребность в проведении бронхоскопии, компьютерной томографии (КТ) легких.
Дифференциальный диагноз[править]
БЛД бывает сложно отличить от тяжелой интерстициальной эмфиземы, пневмонии, других форм хронических заболеваний легких новорожденных (синдрома Вильсона-Микити, хронической легочной недостаточности недоношенных), врожденной лобарной эмфиземы.
Бронхолегочная дисплазия, возникшая в перинатальном периоде: Лечение[править]
Цели лечения
Минимизация повреждения легких, предупреждение гипоксемии, купирование интерстициального отека легких, воспаления, бронхиальной обструкции, поддержание роста и стимуляция репарации легких.
Немедикаментозное лечение
а) Респираторная терапия. ИВЛ необходимо проводить с параметрами, обеспечивающими paCO2 на уровне 60-65 мм рт.ст., а paO2 — 50-70 мм рт.ст. Респираторную терапию проводят в соответствии с концепцией защиты легких.
б) Оксигенотерапия. При всех способах респираторной терапии рекомендуют поддерживать уровень SpO2 91-95%. Падение SpO2 <90% недопустимо, поскольку низкое paO2 способствует спазму сосудов легких и развитию ЛГ.
в) Питание. Выздоровление при БЛД возможно только при адекватном процессе роста легких. В связи с повышенными метаболическими потребностями принципиальное значение имеет обеспечение достаточной калорийности питания, равной 140 ккал/кг в сутки. Необходимо стремиться к максимуму калорий в минимальном объеме. Больших объемов жидкости (>160 мл/кг в сутки) необходимо избегать из-за опасности развития отека легких, особенно при ОАП (открытый артериальный проток). Важно раннее начало минимального ЭП — энтеральное питанте (с 0,1-1,0 мл/кг в сутки) для обеспечения трофики кишечника, а также стимуляция сосания, так как в последующие месяцы могут возникнуть трудности при кормлении через соску.
Медикаментозное лечение
а) Глюкокортикоиды. Назначение дексаметазона в связи с его противовоспалительными эффектами недоношенным детям с ОНМТ, находящимся на ИВЛ, приводит к улучшению газообмена в легких, уменьшает потребность в высоком FiO2 и длительность вентиляции, частоту БЛД, но не снижает неонатальную смертность. Терапия дексаметазоном должна начинаться не ранее 7-го дня жизни, малыми дозами и коротким курсом. Это связано с высокой частотой ранних (нозокомиальные инфекции, перфорации ЖКТ, артериальная гипертензия, гипергликемия, гипертрофическая кардиомиопатия, задержка роста, транзиторная супрессия функции надпочечников) и поздних (снижение объема серого вещества головного мозга, повышение частоты ДЦП (Детский церебральный паралич), ухудшение психомоторного развития, слепота) побочных эффектов препарата у недоношенных детей.
Терапию дексаметазоном следует назначать не ранее второй недели жизни. Показанием для терапии системными глюкокортикоидами является зависимость от ИВЛ c FiO2 >0,3 более 7 сут жизни у детей с ОНМТ (очень низкой массой тела) и ЭНМТ (экстремально низкой массой тела) при отсутствии маркёров воспаления и признаков течения инфекционного процесса. Рекомендуется использовать следующую схему назначения дексаметазона: 0,15 мг/кг в сутки (1-3-й день), 0,1 мг/кг в сутки (4-6-й день), 0,05 мг/кг в сутки (7-8-й день), 0,02 мг/кг в сутки (9-10-й день), при этом курсовая доза дексаметазона составляет 0,89 мг/кг. Терапия считается эффективной в случае экстубации или снижения FiO2 более чем на 20%. Если нет ответа на данную терапию в течение 72 ч, стероиды отменяются.
б) Метилксантины. За счет стимуляции дыхательного центра кофеин уменьшает потребность в ИВЛ и опосредованно — вентилятор-ассоциированное повреждение легких, снижая частоту БЛД и продолжительность кислородозависимости, ускоряя экстубацию. В РФ не зарегистрирована форма кофеина в виде цитрата, доступной является бензоат-натриевая соль кофеина, которую рекомендуется назначать из расчета 20 мг/кг — нагрузочная доза и 5-10 мг/кг — поддерживающая. Назначать кофеин следует всем новорожденным с массой тела менее 1500 г, находящимся на ИВЛ, как можно раньше, т.е. с первых суток жизни. Отменяют кофеин при достижении пациентом постконцептуального возраста (ПКВ) 34 нед и отсутствии апноэ.
в) Диуретики. Убедительных данных об эффективности назначения диуретиков детям с БЛД нет. Показанием к назначению диуретиков может являться сопутствующая недостаточность кровообращения. Препаратом выбора в этом случае является спиронолактон, назначаемый в дозировке 2-4 мг/кг в сутки.
г) Ингаляционная терапия — доставка лекарственных аэрозолей в дыхательные пути. Аэрозоли — это дисперсные системы, состоящие из газовой среды и взвешенных в ней твердых или жидких частиц. Преимущества аэрозольной терапии обусловлены быстрым поступлением лекарственного вещества непосредственно в бронхиальное дерево, его местной активностью, низкой частотой и выраженностью системных побочных эффектов. Для ингаляций у новорожденных используют компрессионные небулайзеры, но могут применяться и дозирующие ингаляторы, подключаемые в дыхательный контур спейсер или аэрочамбер.
В качестве препаратов для ингаляционной терапии используют бронходилататоры, ингаляционные глюкокортикоиды. Показанием к назначению бронходилататоров и ингаляционных кортикостероидов является наличие бронхообструктивного синдрома.
д) Вазодилататоры. В лечении ЛГ у детей с БЛД используется силденафил — мощный селективный ингибитор цГМФ-специфической фосфодиэстеразы типа 5. Использование силденафила у новорожденных рассматривается как экспериментальный метод терапии стойкой ЛГ, рефрактерной к стандартной терапии. Дозировка силденафила: вводится внутривенно, нагрузочная доза 0,4 мг/кг за 3 ч, с последующей постоянной инфузией 1,6 мг/кг в сутки (0,067 мг/кг в час); перорально: 0,5-2 мг/кг массы тела каждые 612 ч. При назначении данного препарата рекомендуется постоянный контроль артериального давления и уровня оксигенации, оценить эффективность позволяет ЭхоКГ с определением показателя давления в легочной артерии.
Дальнейшее ведение
Ребенок может быть выписан домой под амбулаторное наблюдение при условии, что ему не нужен дополнительный кислород, при этом выше 90% при дыхании атмосферным воздухом, рентгенографическая картина в легких стабильна в динамике, наблюдаются самостоятельное сосание и положительная динамика массы тела. Пациенты с SрO2<90% (при наличии ЛГ SрO2 <92%) нуждаются в домашней оксигенотерапии с помощью концентратора кислорода и продолжительной пульсоксиметрии.
Диагноз БЛД устанавливается до достижения ребенком 3 лет. Рекомендуют минимизировать контакты с инфекционными больными, исключить пассивное курение.
Больные с тяжелой БЛД с клиническими признаками хронической дыхательной недостаточности (тахипноэ, одышка) нуждаются в наблюдении пульмонологом, контроле SрO2, повторной рентгенографии органов грудной клетки в возрасте 6-12 мес, ЭхоКГ с определением давления в легочной артерии для исключения ЛГ/легочного сердца. После 5 лет при персистирующих симптомах дыхательной недостаточности, бронхиальной обструкции рекомендуют исследование функции внешнего дыхания, КТ легких (при подозрении на развитие облитерирующего бронхиолита). Проводят обязательный контроль прибавок массы и роста, психомоторного развития, лечение сопутствующей патологии.
БЛД — хроническое обструктивное заболевание легких. В связи с этим детям после выписки из стационара необходима базисная противовоспалительная терапия, аналогичная таковой при бронхиальной астме.
Показаниями для ее назначения будут:
• симптомы хронической дыхательной недостаточности (тахипноэ, одышка), бронхообструкции вне обострения заболевания;
• развитие осложнений БЛД — тяжелой гипотрофии, легочного сердца;
• кислородозависимость в домашних условиях;
• частые обострения заболевания;
• развитие облитерирующего бронхиолита, бронхиальной астмы.
Рекомендуют ингаляционные глюкокортикоиды через спейсер (флутиказон по 50-100 мкг в сутки; беклометазон по 100-200 мкг) либо с помощью небулайзера (будесонид 500 мкг в сутки) до клинического и рентгенологического улучшения курсом от 3 мес с постепенной отменой. Терапия обострений БЛД проводится в стационаре.
Основным этиологическим фактором обострений БЛД является респираторно-синцитиальный вирус (РСВ). Детям с БЛД в возрасте до 2 лет, которым требовалось лечение по поводу БЛД в течение последних 6 мес (данная терапия может включать дополнительный кислород, системные и/или ингаляционные глюкокортикоиды, системные и ингаляционные бронходилататоры, диуретики), показана пассивная иммунопрофилактика РСВ-инфекции с помощью препарата моноклональных антител к F-протеину РСВ паливизумаба. Разовая доза паливизумаба составляет 15 мг/кг массы тела. Схема применения состоит из 3-5 внутримышечных инъекций препарата, проводимых с интервалом 30±5 дней в течение сезонного подъема заболеваемости, вызываемой РСВ (с октября-декабря до марта-апреля). Предпочтительно, чтобы первая инъекция была проведена до начала подъема заболеваемости. При нахождении ребенка на втором этапе выхаживания первая инъекция проводится за 3-5 дней до выписки.
Профилактика[править]
С позиций доказательной медицины вмешательствами, снижающими частоту БЛД, являются поддержание SрО2 на уровне 88-92%, назначение системных глюкокортикоидов и кофеина. Остальные широко используемые вмешательства, направленные на предотвращение или минимизацию повреждения легких, частоту собственно БЛД не снижают, но могут обладать другими важными преимуществами (снижение продолжительности ИВЛ, оксигенотерапии, тяжести БЛД).
Раннее использование назального CPAP позволяет в ряде случаев избежать интубации и ИВЛ.
Стратегия защиты легких: вентиляции с минимальным PIP и FiO2, поддержание SPО2 на уровне 88-92%, допустимая гиперкапния (paCO2 = 45-60 мм рт.ст.), седация на начальном этапе и агрессивная тактика при отучении от ИВЛ.
При неэффективности традиционной ИВЛ (paO2 <50 мм рт.ст., при PIP >25 см вод.ст.), при развитии пневмоторакса или выраженной интерстициальной эмфиземе показан переход на осцилляторную высокочастотную ИВЛ.
Прочее[править]
Прогноз
С возрастом состояние больных улучшается. Функция легких, нарушенная на ранних этапах БЛД, улучшается по мере роста дыхательных путей и формирования новых альвеол. Резидуальные рентгенологические изменения, повышенная резистентность и гиперреактивность дыхательных путей сохраняются длительно, что определяет частое развитие бронхообструктивного синдрома и обострений заболевания, имеющие хроническое течение как следствие структурных изменений в дыхательных путях и легких, которые сохраняются в зрелом возрасте. Бронхолегочная дисплазия — фактор риска развития хронической обструктивной болезни легких у взрослых.
Источники (ссылки)[править]
Неонатология. Национальное руководство. Краткое издание [Электронный ресурс] / Под ред. Н.Н. Володина — М. : ГЭОТАР-Медиа, 2013. — https://www.rosmedlib.ru/book/ISBN9785970424438.html
Дополнительная литература (рекомендуемая)[править]
Действующие вещества[править]
- Паливизумаб
Источник
