Что за болезнь синдром в ч
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 23 апреля 2020;
проверки требует 1 правка.
Синдром Вольфа-Паркинсона-Уайта (WPW-синдром) — врождённая аномалия строения сердца. Впервые описана в 1930 году Луисом Вольфом, Джоном Паркинсоном и Полом Дадли Уайтом, а в 1940 году термин «синдром Вольфа-Паркинсона-Уайта» был введён в употребление для обозначения случая наличия у пациента как асистолии, так и пароксизмов тахикардии[3].
Общие сведения[править | править код]
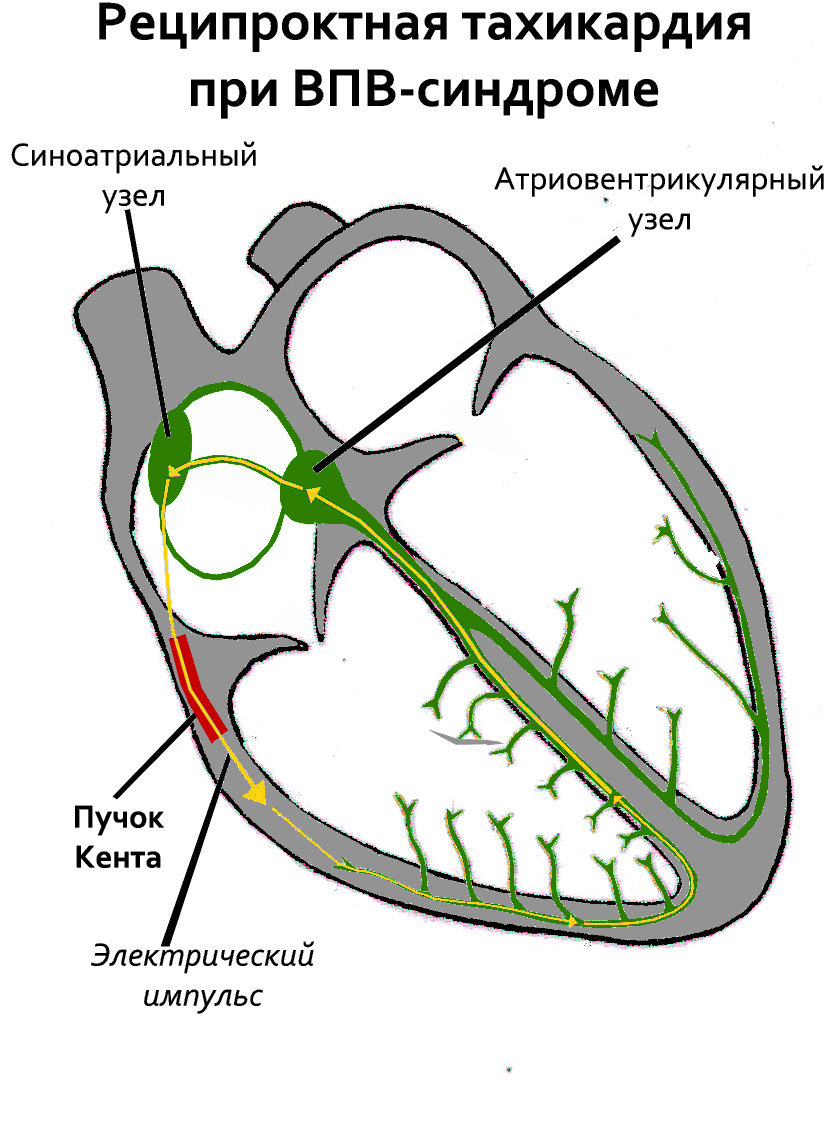
Синдром Вольфа-Паркинсона-Уайта — наиболее частый синдром преждевременного возбуждения желудочков (его наблюдают у 0,1 — 0,3 % населения в общей популяции [4][5]), возникающий при наличии дополнительного пучка Кента. Большинство людей при этом не имеют признаков заболевания сердца. У мужчин синдром обнаруживают чаще, чем у женщин.
Пучок Кента — аномальный пучок между левым/правым предсердиями и одним из желудочков.[источник не указан 2213 дней] Этот пучок играет важную роль в патогенезе синдрома WPW. Более быстрое распространение импульса через этот дополнительный проводящий путь приводит к:
- 1) укорочению интервала P — R (P — Q);
- 2) более раннему возбуждению части желудочков — возникает волна.
Биохимической подоплёкой синдрома является мутации в CBS домене γ2 субъединицы АМФ-активируемой протеинкиназы (AMPK, AMP-activated protein kinase). Консервативный (от прокариотов до человека ) CBS-домен (~ 60 аминокислот) является участком аллостерической регуляции со стороны AMP/ATP.[6]
Этиология[править | править код]
Несмотря на большой прогресс в изучении болезни, молекулярные и генетические основы, ответственные за синдром у большинства пациентов, остаются неизвестными. На март 2020 года известно лишь о нескольких генах, нарушения в которых приводит к синдрому Вольфа — Паркинсона — Уайта[7].
Клиническая картина[править | править код]
У части больных может не выявляться клинических проявлений. Основное проявление синдрома Вольфа — Паркинсона — Уайта — аритмии. Более чем в 50 % случаев возникают пароксизмальные тахиаритмии: наджелудочковые реципрокные, фибрилляция предсердий, трепетание предсердий. Довольно часто синдром возникает при заболеваниях сердца — аномалии Эбштайна, гипертрофической кардиомиопатии, пролапсе митрального клапана.
Диагностика[править | править код]
Синдром WPW может протекать скрыто (скрытый синдром обычно диагностируют с помощью электрофизиологического исследования). Это связано с неспособностью дополнительных проводящих путей проводить импульсы в антеградном направлении. На ЭКГ во время синусового ритма признаков преждевременного возбуждения желудочков нет. Скрытый синдром WPW проявляется тахиаритмией, его выявление возможно при электростимуляции желудочков.
Явный синдром имеет ряд типичных ЭКГ-признаков:
- Короткий интервал P — R (P — Q) — менее 0,12 с.
- Волна Δ. Её появление связано со «сливным» сокращением желудочков (возбуждение желудочков сначала через дополнительный проводящий путь, а затем через AB-соединение). При быстром проведении через AB-соединение волна Δ имеет больший размер. При наличии AB-блокады желудочковый комплекс полностью состоит из волны Δ, так как возбуждение на желудочки передается только через дополнительный путь.
- Расширение комплекса QRS более 0,1 с за счет волны Δ.
- Тахиаритмии: ортодромная и антидромная наджелудочковые тахикардии, фибрилляция и трепетание предсердий. Тахиаритмии возникают обычно после наджелудочковой экстрасистолы.
Иногда на ЭКГ фиксируется переходящий синдром WPW. Это говорит о том, что попеременно функционируют оба пути проведения импульса — нормальный (АВ-путь) и дополнительный (пучок Кента). В таком случае видны то нормальные комплексы, то деформированные.
Лечение[править | править код]
Профилактика и лечение пароксизмов тахиаритмии
- Для предупреждения приступов тахикардии при синдроме WPW можно использовать соталол, дизопирамид. Следует помнить, что ряд антиаритмических лекарственных средств может увеличивать рефрактерный период AB-соединения и улучшать проведение импульсов через дополнительные проводящие пути (блокаторы медленных кальциевых каналов, β-адреноблокаторы, сердечные гликозиды), в связи с чем их применение при синдроме WPW противопоказано.
- При возникновении на фоне синдрома фибрилляции предсердий необходимо срочно провести электрическую дефибрилляцию. В последующем рекомендуют провести деструкцию (радиочастотную катетерную аблацию) дополнительных проводящих путей.
Показания для хирургического лечения синдрома Вольфа-Паркинсона-Уайта
- Наличие частых приступов фибрилляции предсердий.
- Приступы тахиаритмии с гемодинамическими нарушениями (коллапс).
- Сохранение приступов тахиаритмии при проведении антиаритмической терапии.
- Ситуации, когда длительная лекарственная терапия нежелательна (молодой возраст, планируемая беременность).
Внутрисердечная радиочастотная абляция — самый эффективный (в 98 % случаев) радикальный способ лечения синдрома WPW. Однако несколько исследований говорят о том, что несмотря на применение этого способа лечения, риск фибрилляции предсердий остаётся высоким по сравнению с населением в целом[7].
Течение и прогноз[править | править код]
Достоверность этого раздела статьи поставлена под сомнение. Необходимо проверить точность фактов, изложенных в этом разделе. |
Синдром WPW может быть обнаружен в любом возрасте, даже у новорожденных. Любое способствующее заболевание сердца, протекающее с нарушением АВ-проводимости, может способствовать его проявлению. Постоянный синдром WPW, особенно с приступами аритмии, нарушает внутрисердечную гемодинамику, что ведет к расширению камер сердца и снижению сократительной способности миокарда.
Течение заболевания зависит от наличия, частоты и длительности существования тахиаритмий. Внезапная сердечная смерть при синдроме WPW наступает обычно вследствие фатальных аритмий (фибрилляция предсердий, трепетание предсердий, желудочковая тахикардия, фибрилляция желудочков).
Смертность[править | править код]
Внезапная сердечная смерть от синдрома Вольфа — Паркинсона — Уайта наступает примерно у 0.25 — 0.39 % больных ежегодно[7].
Примечания[править | править код]
Ссылки[править | править код]
- К 70-летию открытия синдрома Вольфа-Паркинсона-Уайта
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 27 апреля 2020;
проверки требует 1 правка.
Острый рассеянный энцефаломиелит (сокр. ОРЭМ) (острый диссеминированный рассеянный энцефаломиелит, ОДЭМ) — острое однофазное демиелинизирующее заболевание нервной системы[1]. Для ОРЭМ обязательно наличие общемозговых и очаговых симптомов.
В настоящее время выделяют также рецидивирующий ОРЭМ, который проявляется стереотипными, характерными для ОРЭМ эпизодами неврологического дефицита, и при этом нет признаков, характерных для РС (в частности, по МРТ — отсутствие т. н. «старых» очагов, неконтрастирующихся).
Этиология[править | править код]
ОРЭМ может возникать после воздействия вирусных или бактериальных агентов:
- Вирусы: энтеровирусы, вирус кори, эпидемического паротита (англ.)русск., краснухи (англ.)русск., ветряной оспы, вирус Эпштейна — Барр, цитомегаловирус, вирус простого герпеса первого типа, гепатита A, вирусы Коксаки и вирус Зика[2]; и др.
- Бактерии: Borrelia burgdorferi (англ.)русск.[3]; и др.
- Возможно спонтанное возникновение заболевания без предшествующей атаки инфекционного агента.
Клинические проявления[править | править код]
В клинической картине ОДЭМ можно выявить несколько групп симптомов.
- Очаговые симптомы могут быть представлены всем возможным разнообразием поражения участков головного мозга в различном сочетании друг с другом. Чаще всего это:
- Пирамидный синдром — от появления пирамидных знаков до гемипарезов.
- Мозжечковый синдром — от нистагма и минимальной интенции до грубой атаксии, туловищной атаксии.
- Экстрапирамидный синдром — симптомы паркинсонизма, дистонические проявления.
- Глазодвигательные нарушения — различной степени офтальмопарез.
- Общемозговые симпомы. Без их наличия диагноз ОДЭМ ставится под вопрос, и более вероятен дебют рассеянного склероза. Нужно также понимать, что эти признаки должны появляться так же остро, как и остальные симптомы заболевания.
- Эпиприступы.
- Нарушение сознания.
- Когнитивные нарушения.
- Симптомы поражения периферической нервной системы — не характерны, но возможны. Полинейропатия — самое частое проявление.
- Общеинфекционный синдром. Начало ОРЭМ может быть связано с предшествующей инфекцией или вакцинацией, но также может самостоятельно проявляться с повышением температуры, астенией.
Диагностика[править | править код]
Диагноз ОРЭМ подтверждается:
- МРТ головного мозга с контрастированием. Классическая МР-картина ОРЭМ легко узнаваема — большие, часто сливные очаги в разных участках головного мозга, все очаги контрастируются, что свидетельствует об остроте процесса.
- Люмбальная пункция.
Дифференциальный диагноз[править | править код]
Необходимо исключить энцефалиты инфекционного генеза, в том числе прогрессирующую мультифокальную лейкоэнцефалопатию.
Лечение[править | править код]
- Патогенетическое лечение:
- Глюкокортикостероиды в высоких дозах (1000 мг, реже 2000 мг) коротким курсом 3-5-7 раз (пульс-терапия).
- Симптоматическая терапия — для купирования отдельных симптомов заболевания, по необходимости:
- Противоэпилептические препараты
- Противоотечная терапия
- НПВС для снижения температуры
- другие.
Исход и прогноз[править | править код]
- Выздоровление с остаточной симптоматикой или без неё (чаще). Очаги по МРТ головного мозга могут сохраняться в течение всей жизни.
- В будущем возможно возникновение эпизодов с другой картиной неврологического дефицита, а так же по МРТ, то есть переход в рассеянный склероз.
- Возникновение повторных эпизодов неврологического дефицита с характерной картиной ОРЭМ (очаговая + общемозговая симптоматика), отсутствие «старых» очагов по МРТ — переход в Рецидивирующий ОРЭМ.
При своевременно начатом лечении смерть от ОРЭМ бывает очень редко, и наступает от отёка мозга.
Примечания[править | править код]
Источник
У этого термина существуют и другие значения, см. БАС (значения).
Боково́й (латера́льный) амиотрофи́ческий склеро́з (БАС; также известен как боле́знь мото́рных нейро́нов, мотонейро́нная боле́знь, боле́знь Шарко́, в англоязычных странах — болезнь Лу Ге́рига [англ. Lou Gehrig’s disease]) — прогрессирующее, неизлечимое дегенеративное заболевание центральной нервной системы, при котором происходит поражение как верхних (моторная кора головного мозга), так и нижних (передние рога спинного мозга и ядра черепных нервов) двигательных нейронов, что приводит к параличам и последующей атрофии мышц.
Характеризуется прогрессирующим поражением двигательных нейронов, сопровождаемым параличом (парезом) конечностей и атрофией мышц. Смерть наступает от инфекций дыхательных путей или отказа дыхательной мускулатуры. Боковой амиотрофический склероз следует отличать от синдрома БАС, который может сопровождать такие заболевания, как клещевой энцефалит.
Болезнь впервые описана в 1869 году Жан-Мартеном Шарко.
На международном уровне показатели заболеваемости боковым амиотрофическим склерозом (amyotrophic lateral sclerosis, ALS) или заболеванием двигательных нейронов (motor neurone disease, MND) по всему миру оцениваются в диапазоне от 0,86 до 2,5 на 100 тысяч человек в год[3], то есть БАС является редким заболеванием.
Этиология[править | править код]
Точная этиология БАС неизвестна. Примерно в 5% случаев встречаются семейные (наследственные) формы заболевания. 20% семейных случаев БАС связаны с мутациями гена супероксиддисмутазы-1, расположенного в 21-й хромосоме[4][5]. Как полагают, этот дефект наследуется аутосомно-доминантно.
В патогенезе заболевания ключевую роль играет повышенная активность глутаматергической системы, при этом избыток глутаминовой кислоты вызывает перевозбуждение и гибель нейронов (т. н. эксайтотоксичность). Сохранившиеся мотонейроны могут спонтанно деполяризироваться, что клинически выявляется фасцикуляциями.
Учёные из Университета Джонса Хопкинса в Балтиморе установили молекулярно-генетический механизм, лежащий в основе возникновения данного заболевания. Он связан с появлением в клетках большого количества четырёхспиральной ДНК и РНК в гене C9orf72, что приводит к нарушению процесса транскрипции, а, следовательно, и синтеза белка. Однако, вопрос о том, как именно эти изменения ведут к деградации мотонейронов, остаётся открытым[6].
Также важное значение в патофизиологии имеет TDP-43, который был определен как основной компонент убиквитинированных цитоплазматических белковых агрегатов у всех пациентов со спорадическим БАС, но расположенный вне ядра (в нормальных нейронах он находится в ядре). Несмотря на то, что вопрос того, являются ли данные агрегаты причиной нейродеградации при БАС, остается открытым, мутации в TARDBP были обнаружены всего лишь в 3 % случаях наследственной формы склероза и у 1,5 % пациентов со спорадическим БАС, позволяя предположить, что агрегаты TDP-43 играют ключевую роль в инициации БАС. Помимо мутаций в гене TARDBP ионы цинка также могут вызывать агрегацию TDP-43[7][8].
Обнаружение мутаций гена FUS (Fusion in Sarcoma — ген «слияния в саркоме») в 16-й хромосоме, которые связаны с наследственными формами БАС, поддерживает данную теорию. Агрегаты FUS не были явно определены у пациентов с патологическими изменениями в TDP-43 или SOD1, что указывает на новый путь возникновения болезни.
Факторы риска[править | править код]
На БАС приходится примерно 3% всех органических поражений нервной системы. Болезнь обычно развивается начиная с возраста 30—50 лет[9][10].
Суммарный риск получить БАС в течение жизни составляет 1:400 для женщин и 1:350 для мужчин.
5—10 % заболевших — носители наследственной формы БАС; на тихоокеанском острове Гуам выявлена особая, эндемичная форма заболевания. Абсолютное большинство случаев (90—95 %) не связаны с наследственностью и не могут быть положительно объяснены какими-либо внешними факторами (перенесёнными заболеваниями, травмами, экологической ситуацией и т. п.)[11].
Несколько научных исследований[12][13][14][15] нашли статистические корреляции между БАС и некоторыми сельскохозяйственными пестицидами.
Течение болезни[править | править код]
Ранние симптомы болезни: подёргивания, судороги, онемение мышц, слабость в конечностях, затруднение речи — также свойственны многим более распространённым заболеваниям, поэтому диагностика БАС затруднена — до тех пор, пока болезнь не развивается до стадии мышечной атрофии.
В редких случаях возможно наличие продромальной фазы, до 1 года, во время которой будут наблюдаться изолированные фасцикуляции и/или судороги.
В зависимости от того, какие части тела поражены в первую очередь, различают
- БАС конечностей (до трёх четвертей больных) начинается, как правило, с поражения одной или обеих ног. Больные чувствуют неловкость при ходьбе, негибкость в голеностопе, спотыкаются. Реже встречаются поражения верхних конечностей, при этом затруднено выполнение обычных действий, требующих гибкости пальцев или усилия кисти.
- Бульбарный БАС проявляется в затруднении речи (больной говорит «в нос», гнусавит, плохо управляет громкостью речи, в дальнейшем испытывает трудности с глотанием).
Во всех случаях мышечная слабость постепенно охватывает всё больше частей тела (больные бульбарной формой БАС могут не доживать до полного пареза конечностей). Симптомы БАС включают признаки поражения как нижних, так и верхних двигательных нервов:
- поражение верхних двигательных нейронов: гипертонус мышц, гиперрефлексия, аномальный рефлекс Бабинского.
- поражение нижних двигательных нейронов: слабость и атрофию мышц, судороги, непроизвольные фасцикуляции (подёргивания) мышц.
Рано или поздно больной теряет способность самостоятельно передвигаться. Болезнь не влияет на умственные способности, но приводит к тяжёлому состоянию в ожидании неминуемой смерти. На поздних этапах болезни поражается дыхательная мускулатура, больные испытывают перебои в дыхании, в конечном итоге их жизнь может поддерживаться только искусственной вентиляцией лёгких и искусственным питанием. Обычно от выявления первых признаков БАС до смерти проходит от трёх до пяти лет. Однако широко известный физик-теоретик Стивен Хокинг (1942-2018) и гитарист Джейсон Беккер (род. 1969) — единственные известные больные с однозначно диагностированным БАС, у которых состояние со временем стабилизировалось.
Симптомы[править | править код]
- слабость;
- мышечные спазмы;
- нарушения речи и глотания;
- нарушение равновесия;
- спастика;
- повышение глубоких рефлексов или расширение рефлексогенной зоны[16];
- патологические рефлексы;
- атрофия;
- зависание стопы;
- респираторные расстройства;
- приступы непроизвольного смеха или плача;
- депрессия.
Диагностика[править | править код]
Существует множество заболеваний, вызывающих те же симптомы, что и ранние стадии БАС. Диагностика заболевания возможна только методом исключения более распространённых заболеваний. Оба ключевых признака БАС (поражения и верхних, и нижних двигательных нейронов) проявляются на достаточно развитых стадиях болезни.
Международной федерацией неврологии (англ. World Federation of Neurology) разработаны Эль-Эскориальские критерии для постановки диагноза БАС[17]. Для этого необходимо наличие:
- признаков поражения центрального мотонейрона по клиническим данным
- признаков поражения периферического мотонейрона по клиническим, электрофизиологическим и патоморфологическим данным
- прогрессирующего распространения симптомов в пределах одной или нескольких областей иннервации, что выявляют при наблюдении за больным
При этом должны быть исключены другие причины данных симптомов.
Для электрофизиологического обследования используется электромиография, которая полезна в исследовании проводимости нервов и определении наличия признаков поражения периферического мотонейрона (потенциалы фибрилляций, потенциалы фасцикуляций, положительные острые волны и др).
Также важно дифференцировать фасцикуляции при БАС от фасцикуляций при синдроме доброкачественных фасцикуляций (англ. BFS), который зачастую диагностируется при наличии фасцикуляций и одновременном отсутствии объективной слабости и изменений на ЭМГ, и имеет чаще всего психологическую причину.
Второстепенными методами диагностики являются:
- МРТ головного и спинного мозга
- биохимический анализ крови (КФК, креатинин, общий белок, АЛС, АСТ, ЛДГ)
- клинический анализ крови
- исследование ликвора (белок, клеточный состав)
- серологические анализы (антитела к боррелиям, к ВИЧ)
- транскраниальная магнитная стимуляция (ТМС)
- биопсия мышцы или нерва
Возможные изменения при обследовании второстепенными методами диагностики:
- повышение КФК в 2-3 раза (у 50 % больных)
- незначительное повышение АЛТ, АСТ, ЛДГ
- выявление отмирания пирамидных путей на МРТ
- признаки атрофии и денервации при гистологическом исследовании
Лечение[править | править код]
Больным БАС требуется поддерживающая терапия для облегчения симптомов[18].
Постепенно у больных начинает ослабляться дыхательная мускулатура, развивается дыхательная недостаточность и становится необходимым применение оборудования для облегчения дыхания во время сна (IPPV или BIPAP). Затем, после полного отказа дыхательной мускулатуры, требуется круглосуточное использование аппарата искусственной вентиляции лёгких.[18]
Ведутся исследования по методу лечения, использующего блокировку генов, вызывающих это заболевание[19].
Замедление прогрессирования[править | править код]
Рилузол (рилутек) — единственный препарат, достоверно замедляющий прогрессирование БАС[20][21]. Доступен с 1995 года. Он ингибирует высвобождение глутамата, тем самым уменьшая повреждение двигательных нейронов. Продлевает жизнь больных в среднем на месяц, немного отдаляет момент, когда больному потребуется искусственная вентиляция легких[22].
HAL-терапия, новый метод роботизированного лечения, официально допущен к применению в реабилитации БАС в Европе и Японии[23].
В 2017 году для лечения БАС впервые за 22 года был одобрен новый препарат — Радикава (Эдаравон)[24].
Также проводятся клинические исследования по применению препарата Маситиниб[25].
В России[править | править код]
В Москве действуют:
- Благотворительный фонд помощи людям с БАС и другими нейромышечными заболеваниями «Живи сейчас»
- Благотворительный фонд помощи больным БАС Г. Н. Левицкого. https://www.alsportal.ru
- служба помощи больным БАС при АНО «Больница Святителя Алексия».
В то же время в России многим больным БАС не оказывается надлежащая медицинская помощь[26]. Например, до 2011 года БАС даже не был включен в список редких заболеваний, а единственный препарат, замедляющий течение болезни, Рилузол, не зарегистрирован[27].
Акции в поддержку[править | править код]
Летом 2014 года проходила популярная вирусная акция по повышению осведомлённости о заболевании и сбор средств, получившая название Ice Bucket Challenge или ALS Ice Bucket Challenge. Летом 2018 года акция прошла повторно для сбора средств на построение клиники по борьбе с заболеванием в Южной Корее.
См. также[править | править код]
- Супероксиддисмутаза-1 — фермент, связанный с частью случаев заболевания.
- Спинальная мышечная атрофия
Примечания[править | править код]
- ↑ Disease Ontology release 2019-05-13 — 2019-05-13 — 2019.
- ↑ Monarch Disease Ontology release 2018-06-29sonu — 2018-06-29 — 2018.
- ↑ Epidemiology of Sporadic ALS. (англ.) (недоступная ссылка). Stanford Medicine » School of Medicine. Дата обращения 24 октября 2015. Архивировано 8 октября 2015 года.
- ↑ Conwit, Robin A. Preventing familial ALS: A clinical trial may be feasible but is an efficacy trial warranted? (англ.) // Journal of the Neurological Sciences (англ.)русск. : journal. — 2006. — December (vol. 251, no. 1—2). — P. 1—2. — ISSN 0022-510X. — doi:10.1016/j.jns.2006.07.009. — PMID 17070848.
- ↑ Al-Chalabi, Ammar; P. Nigel Leigh. Recent advances in amyotrophic lateral sclerosis (англ.) // Current Opinion in Neurology (англ.)русск.. — Lippincott Williams & Wilkins (англ.)русск., 2000. — August (vol. 13, no. 4). — P. 397—405. — ISSN 1473-6551. — doi:10.1097/00019052-200008000-00006. — PMID 10970056.
- ↑ «Болезнь Хокинга» объяснили появлением четырехспиральной ДНК // Лента.ру, 2014-03-07
- ↑ Cyrille Garnier, François Devred, Deborah Byrne, Rémy Puppo, Andrei Yu. Roman. Zinc binding to RNA recognition motif of TDP-43 induces the formation of amyloid-like aggregates (En) // Scientific Reports. — 2017-07-28. — Т. 7, вып. 1. — ISSN 2045-2322. — doi:10.1038/s41598-017-07215-7.
- ↑ Aphrodite Caragounis, Katherine Ann Price, Cynthia P.W. Soon, Gulay Filiz, Colin L. Masters. Zinc induces depletion and aggregation of endogenous TDP-43 // Free Radical Biology and Medicine. — Т. 48, вып. 9. — С. 1152—1161. — doi:10.1016/j.freeradbiomed.2010.01.035.
- ↑ Хондкариан О. А., Боковой амиотрофический склероз, в кн.: Многотомное руководство по неврологии, под ред. С. Н. Давиденкова, т. 3, кн. 1, М., 1962
- ↑ Амиотрофический боковой склероз — статья из Большой советской энциклопедии.
- ↑ https://www.ninds.nih.gov/disorders/amyotrophiclateralsclerosis/detail_ALS.htm Архивная копия от 4 января 2015 на Wayback Machine «In 90 to 95 percent of all ALS cases, the disease occurs apparently at random with no clearly associated risk factors. … About 5 to 10 percent of all ALS cases are inherited. The familial form of ALS usually results from a pattern of inheritance that requires only one parent to carry the gene responsible for the disease. Mutations in more than a dozen genes have been found to cause familial ALS.»
- ↑ Exposure to pesticides and risk of amyotrophic lateral sclerosis: a population-based case-control study.By Bonvicini F, Marcello N, Mandrioli J, Pietrini V, Vinceti M. In Ann Ist Super Sanita. 2010; 46(3):284-7.PMID 20847462
- ↑ Pesticide exposure as a risk factor for amyotrophic lateral sclerosis: A meta-analysis of epidemiological studies: Pesticide exposure as a risk factor for ALS. By Malek AM, Barchowsky A, Bowser R, Youk A, Talbott EO. In Environ Res. 2012 Aug; 117:112-9. PMID 22819005
- ↑ Are environmental exposures to selenium, heavy metals, and pesticides risk factors for amyotrophic lateral sclerosis?. By Vinceti M, Bottecchi I, Fan A, Finkelstein Y, Mandrioli J. In Rev Environ Health. 2012; 27(1):19-41. PMID 22755265
- ↑ Pesticide exposure and amyotrophic lateral sclerosis. By Kamel F, Umbach DM, Bedlack RS, Richards M, Watson M, Alavanja MC, Blair A, Hoppin JA, Schmidt S, Sandler DP. In Neurotoxicology. 2012 Jun; 33(3):457-62. PMID 22521219
- ↑ Рефлексогенные зоны — статья из Большой советской энциклопедии.
- ↑ Brooks B.R., Miller R.G., Swash M., Munsat T.L. El Escorial revisited: revised criteria for the diagnosis of amyotrophic lateral sclerosis (англ.) // Amyotroph. Lateral Scler. Other Motor Neuron Disord. : journal. — 2000. — December (vol. 1, no. 5). — P. 293—299. — PMID 11464847.
- ↑ 1 2 https://www.ninds.nih.gov/disorders/amyotrophiclateralsclerosis/detail_ALS.htm Архивная копия от 4 января 2015 на Wayback Machine How is ALS treated?
- ↑ Эрон Гитлер, Леонард Петручелли. Разгадка тайны БАС // В мире науки. — 2017. — № 8/9. — С. 50—56.
- ↑ Неврология. Национальное руководство. — ГЭОТАР-Медиа, 2010. — 2116 с. — 2000 экз. — ISBN 978-5-9704-0665-6.
- ↑ Riluzole // PATIENT & CAREGIVER EDUCATION (рус.)
- ↑ https://www.ninds.nih.gov/disorders/amyotrophiclateralsclerosis/detail_ALS.htm Архивная копия от 4 января 2015 на Wayback Machine However, the Food and Drug Administration (FDA) approved the first drug treatment for the disease—riluzole (Rilutek)—in 1995. Riluzole is believed to reduce damage to motor neurons by decreasing the release of glutamate. Clinical trials with ALS patients showed that riluzole prolongs survival by several months
- ↑ Nagata, Kazuaki. Japan recognizes Cyberdyne’s robotic suit as medical device, widespread use anticipated (англ.), The Japan Times Online (26 November 2015). Дата обращения 10 февраля 2016.
- ↑ https://mosmedpreparaty.ru/news/4923
- ↑ https://www.ab-science.com/file_bdd/content/1490200983_SLAPresentationv03.2017vdef.pdf
- ↑ Епископ РОСХВЕ просит главу Минздрава РФ изменить ситуацию с отношением к больным «непризнанным» недугом, NewsRu, 21 августа 2013
- ↑ Где взять право на надежду? // «Честное слово» № 3 (832), 23.01.2013
Ссылки[править | править код]
- National Amyotrophic Lateral Sclerosis (ALS) Registry // CDC, США (англ.)
- ALS Therapy Development Institute (англ.)
- Информационный портал о БАС www.als-info.ru
- боковой амиотрофический склероз.рф // Инга Видус
Источник
