Что такое синдром чедиака хигаси

Синдром Чедиака-Хигаси — редкое аутосомно-рецессивное заболевание, которое характеризуется тяжелым врожденным иммунодефицитом по причине дефекта гена CHS1/LYST. Проявляется болезнь частыми бактериальными инфекциями, коагулопатией, нарушениями пигментации кожи, а также прогрессирующими неврологическими расстройствами [1].
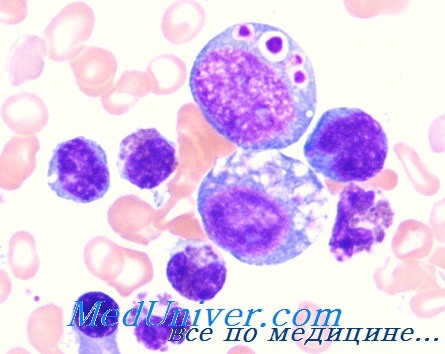
Иммунологические нарушения выражаются в нейтропении и нехватке естественных киллеров (NK-клеток). Зачастую заболевание оказывается летальным — большая часть пациентов умирает в детстве. Заподозрить синдром Чедиака-Хигаси можно по тем же признакам, что и любой врожденный иммунодефицит, однако имеется и довольно специфичный критерий — гигантские внутриклеточные включения (или органеллы) в популяциях разных клеток и определенные дефекты в них [2].
Чтобы более наглядно описать происходящие процессы при данном заболевании, еще во второй половине прошлого столетия была предложена оригинальная модель «бежевой мыши». Вследствие мутации в определенном гене (в то время конкретная точка генома, разумеется, не была известна) пигментация экспериментальной мыши изменялась, и исследователи определили ее цвет как «бежевый» («beige»). Помимо цвета у таких животных имелся еще ряд аномалий в виде огромных гранул меланина в лимфоцитах, нейтрофилах и эозинофилах (рис. 1), также подобные включения наблюдались в ряде других клеток [3].
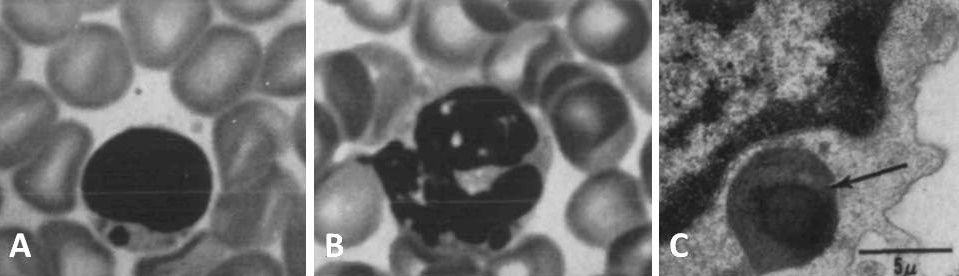
Рисунок 1 | Периферическая кровь бежевой мыши. Световая микроскопия: определяются гранулы в цитоплазме лимфоцита (А) и нейтрофила (В). Электронная микроскопия: объемная гранула с темным содержимым в цитоплазме лимфоцита. Относится к непостоянным аномальным включениям [3].
Позднее данный ген у мыши был идентифицирован и назван Lyst (кодирует регулятор лизосомального транспорта — lysosomal trafficking regulator), человеческий ген обозначают как LYST. Фермент, за экспрессию которого отвечает LYST, обеспечивает нормальный экзо- и эндоцитоз лизосомы; в случае мутации лизосома не может выполнять свои функции [4].
Сегодня этот ген настолько прочно ассоциируется с синдромом Чедиака-Хигаси, что в современной литературе его обозначают как CHS1/LYST(человеческий ген Chediak-Higashi syndrome-1 или LYST — оба варианта равнозначны) [1].
Роль регулятора лизосомального транспорта (LYST)
Данный белок кодируется достаточно объемным геном LYST, который содержит 55 экзонов и расположен в локусе 1q43. Большая длина нуклеотидной последовательности этого гена — фактор неоднозначный: с одной стороны, это существенно затрудняет диагностику, с другой — большое количество мутаций вообще никак не влияет на жизнедеятельность человека и не вызывает синдром Чедиака-Хигаси [5].
Ген кодирует одноименный большой каталитический белок — регулятор лизосомального транспорта (425 kDa, 3801 аминокислотное основание). Протеин относится к семейству BEACH — (Beige and Chediak-Higashi) — и, по-видимому, стал первым его представителем [4]. Белки данного семейства имеют три общих С-концевых домена: PH (Pleckstrin-homology домен), BEACH (Beige and Chediak-Higashi домен) и WD40-повторения (рис. 2) [5].
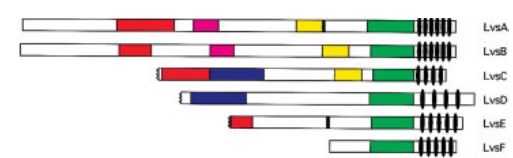
Рисунок 2 | Строение шести родственных белков семейства BEACH слизевика рода Dictyostelium [6].
На рис. 2 изображена диаграмма, наглядно показывающая общность строения шести белков семейства BEACH (в данном случае — шесть белков слизевика рода Dictyostelium). Зеленым цветом обозначен собственно BEACH-домен, наиболее консервативный во всех белках. «Овалами» у С-конца обозначены WD40-повторения — участки, предположительно вовлеченные в белок-белковые взаимодействия. Другими цветами показаны иные идентичные аминокислотные последовательности [6].
Сегодня известно, что белки данного семейства есть у разных представителей животного мира. Имея примерно одинаковое строение, они выполняют многочисленные и крайне сложные функции, обсуждение которых выходит за рамки данной темы.
Собственно LYST обеспечивает секрецию лизосомальных ферментов. Без белка-регулятора транспорт протеолитических ферментов невозможен, вследствие этого цитотоксическая активность фагоцитарных клеток нарушается. Этим также объясняется нарушение транспорта различных метаболитов (накопление в клетках гранул с меланином, что обеспечивает яркий клинический признак синдрома Чедиака-Хигаси), а также нарушения метаболизма некоторых других белков, что обусловливает клиническую картину заболевания и сопутствующие патологии, точный механизм развития которых все еще неизвестен [1,3].
Стоит также заметить, что в последнее время появляются сообщения о преимущественном влиянии дефекта LYST именно на NK-клетки. По последним данным, в лимфоцитах происходит нарушение экзоцитоза протеолитических ферментов, хотя цитокиновая регуляция остается в норме [7].
Клиническая картина
Существует два основных клинических проявления синдрома Чедиака-Хигаси: «парциальный альбинизм» и рецидивирующие пиогенные инфекции. Оба, на первый взгляд, не связанных между собой критерия имеют единую причину — дефект LYST, вследствие чего нарушается транспорт меланина и лизосомальных ферментов.
Цвет волос пациента может быть от сероватого до буквально седого — зависит от этнической принадлежности пациента. Также нарушается пигментация радужной оболочки, следствием чего становится фоточувствительность и сниженная функция зрительного аппарата.
Рецидивирующие бактериальные (в том числе оппортунистические) инфекции часто поражают дыхательные пути, кожу. Возможны дефекты свертывающей системы из-за нарушенного синтеза тромбоцитов, проявляется это небольшими кровоподтеками (зачастую — на слизистых), однако иногда развивается полноценный геморрагический синдром.
Помимо этого возможны неврологические нарушения: атаксия, сенсорные расстройства, прогрессирующая нейродегенерация [1].
Первые проявления заболевания начинаются с раннего детства. Наиболее опасными осложнениями считаются инфекции, для предупреждения которых допустима профилактическая антибиотикотерапия. И все же большинство пациентов умирает в первые десять лет жизни. Наиболее распространенными причинами смерти являются кровотечения, инфекции или гемофагоцитарный лимфогистиоцитоз [7].
Гемофагоцитарный лимфогистиоцитоз
Гемофагоцитарный лимфогистиоцитоз (ГФЛГ) — патологическое состояние, которое может быть вызвано разнообразными причинами, часто — первичными иммунодефицитами (к числу которых относится и синдром Чедиака-Хигаси). Суть данного состояния — гиперпродукция гистиоцитов и иммунокомпетентных клеток [5].
Как уже было сказано выше, мутация LYST нарушает цитотоксическую функцию клеток, но не метаболизм регуляторных факторов. В ответ на антиген развивается обыкновенная воспалительная реакция — однако элиминация чужеродного агента невозможна. В связи с этим продолжается продукция провоспалительных факторов (ИФН-γ, ФНО, интерлейкины), что увеличивает количество лимфоцитов, нейтрофилов, повышает активность макрофагов. Гиперпродукция цитокинов, не ингибированная по механизму обратной связи, иногда называется «цитокиновым штормом» [5].
Следствием этого является лимфогистиоцитарная инфильтрация различных тканей с развитием в них разнообразных повреждений, а макрофаги могут разрушать нормальные функционирующие клетки (в том числе — форменные элементы крови) [5].
Диагностика синдрома Чедиака-Хигаси и сопутствующих заболеваний
В диагностировании синдрома Чедиака-Хигаси особых сложностей не возникает. Как уже было сказано выше, основная задача клинициста — распознать врожденное иммунодефицитное состояние, дальнейшая диагностика основана на данных иммунограммы и генетического анализа. Достаточно специфичным признаком является накопление больших внутриклеточных везикул в различных клетках, в том числе — лейкоцитах [2].
Одним из наиболее серьезных осложнений при данном синдроме является развитие ГФЛГ. Диагностические критерии при этом патологическом состоянии можно представить следующим образом [5]:
- Наличие генетического дефекта, связанного с ГФЛГ (зачастую это первичные иммунодефициты).
- Наличие как минимум пяти из нижеперечисленных критериев:
- лихорадка;
- спленомегалия;
- цитопения хотя бы в двух клеточных популяциях:
а) гемоглобин < 90 г/л (для новорожденных — < 100 г/л);
б) тромбоциты < 100×109/л;
в) нейтрофилы < 1×109/л;
- гипертриглицеридемия (> 3 ммоль/л) или гипофибриногенемия (< 1,5 г/л);
- гиперферритинемия > 500 мкг/л;
- растворимые молекулы CD25 > 2400 Ед/мл;
- гемофагоцитоз в костном мозге, селезенке, лимфоузлах
- низкая (вплоть до полного отсутствия) цитотоксическая активность NK-клеток.
Важно отметить: ГФЛГ является настолько частым серьезным осложнением, что в современной литературе принято разделять синдром Чедиака-Хигаси на две формы: «классическую» (с развитием ГФЛГ) и «атипичную» (без такового) [5].
Лечение синдрома Чедиака-Хигаси и сопутствующих патологий
Как и в большинстве наследственных иммунодефицитов, вариантов терапии немного. Наиболее распространенным методом лечения врожденных иммунологических нарушений является пересадка гемопоэтических клеток; данный синдром не является исключением.
В 2007 году в «Bone Marrow Transplantation» появилась публикация, авторы которой сообщали о 35 случаях проведения пересадки гемопоэтических клеток пациентам с синдромом Чедиака-Хигаси [8]. Перед проведением операции лечение осуществлялось в лучшем случае патогенетическое, призванное замедлить прогрессирование заболевания, избежать осложнений и подготовить пациента к пересадке гемопоэтических клеток.
Всего 13 пациентов получили материал от HLA-идентичного донора (родного брата или сестры), 10 — от родственника, еще 12 — от несвязанного донора. По результатам проведенной терапии, 27 (77 %) из 35 пациентов достигли ремиссии, однако 5-летняя выживаемость составила 62 % (22 пациента).
Наиболее распространенными причинами смерти были посттрансплантационные осложнения и хронические заболевания. Среди умерших — большинство получило аллотрансплантат от не полностью подходящего донора.
Таким образом, исследователи пришли к выводу, что подобная методика может быть достаточно эффективной, если донор и реципиент являются родственниками. Также следует отметить, что шесть пациентов на момент проведения операции были старше девяти лет, что свидетельствует о существенных успехах в сдерживании и предотвращении развития осложнений у пациентов (одному из реципиентов на момент трансплантации было 19 лет).
На современном этапе пересадка гемопоэтических клеток является наиболее эффективным способом лечения синдрома Чедиака-Хигаси [9]. Вероятно, в будущем станет возможна коррекция непосредственно LYST с помощью генно-инженерных методик (например, подобная терапия уже существует для хронической гранулематозной болезни — другого наследственного иммунодефицитного состояния [10]), однако пока что такой альтернативы для синдрома Чедиака-Хигаси нет.
Часто синдром Чедиака-Хигаси осложняется ГФЛГ — тяжелым состоянием, которое требует немедленного лечения. Среди наиболее эффективных методов терапии в гайдлайне 2004 года описаны химиотерапия и пересадка гемопоэтических клеток [11].
Также на протяжении лечения, до и после него в профилактических целях используется антибиотикотерапия [1,11].
Источники:
- J. Kaplan, I. De Domenico, and D. M. Ward, ‘Chediak-Higashi syndrome’, Curr. Opin. Hematol., vol. 15, pp. 22–29, 2008.
- D. L. Nagle et al., ‘Identification and mutation analysis of the complete gene for Chediak-Higashi syndrome’, Nat. Genet., vol. 14, no. 3, pp. 307–311, 1996.
- M. A. Lutzner, C. T. Lowrie, and H. W. Jordan, ‘Giant granules in leukocytes of the beige mouse’, J. Hered., vol. 58, no. 6, pp. 299–300, 1967.
- M. D. F. S. Barbosa et al., ‘Identification of the homologus beige and Chediak-Higashi syndrome genes’, Nature, vol. 382, pp. 262–265, 1996.
- S. Ehl and G. de Saint Basile, ‘Genetic Diseases Predisposing to HLH’, Stiehm’s Immune Defic., pp. 437–460, 2014.
- N. Wang, W. I. Wu, and A. De Lozanne, ‘BEACH family of proteins: Phylogenetic and functional analysis of six Dictyostelium BEACH proteins’, J. Cell. Biochem., vol. 86, no. 3, pp. 561–570, 2002.
- A. Gil-Krzewska et al., ‘Chediak-Higashi syndrome: Lysosomal trafficking regulator domains regulate exocytosis of lytic granules but not cytokine secretion by natural killer cells’, J. Allergy Clin. Immunol., vol. 137, no. 4, pp. 1165–1177, 2016.
- M. Eapen et al., ‘Hematopoietic cell transplantation for Chediak-Higashi syndrome’, Bone Marrow Transplant., vol. 39, no. 7, pp. 411–415, 2007.
- M. L. Lozano, J. Rivera, I. Sánchez-Guiu, and V. Vicente, ‘Towards the targeted management of Chediak-Higashi syndrome’, Orphanet J. Rare Dis., vol. 9, no. 1, 2014.
- M. G. Ott et al., ‘Correction of X-linked chronic granulomatous disease by gene therapy, augmented by insertional activation of MDS1-EVI1, PRDM16 or SETBP1’, Nat. Med., vol. 12, no. 4, pp. 401–409, 2006.
- Jan-Inge Henter, ‘HLH-2004: Diagnostic and Therapeutic Guidelines for Hemophagocutic Lymphohistiocytosis’, Pediatr. Blood Cancer, vol. 48, pp. 124–131, 2007.
Источник
Синдром Чедиака-Хигаси. Клиника и диагностика
При редком аутосомно-рецессивном синдроме Чедиака-Хигаси повышенная восприимчивость к инфекциям связана с нарушением дегрануляции нейтрофилов. Характерна легкая кровоточивость, депигментация кожи и глаз, прогрессирующая периферическая невропатия и гиперплазия лимфоидной ткани. В нейтрофилах, моноцитах и лимфоцитах обнаруживаются гигантские цитоплазматические гранулы. Депигментация волос, кожи и глазного дна обусловлена патологической агрегацией меланосом и связана с нарушением перекреста зрительных и слуховых нервов. Повышенная восприимчивость к инфекциям частично объясняется нарушениями хемотаксиса, дегрануляции и бактерицидной активности нейтрофилов.
Гигантские гранулы в них препятствуют прохождению клеток в ткани через узкие межклеточные промежутки эндотелия.
Генетика и патогенез синдрома Чедиака-Хигаси. Мутантный ген, расположенный на хромосоме 1 (участок q2-q44), клонирован. Он гомологичен гену, ответственному за соответствующий синдром у мышей (фенотип beige); его продукт обладает структурным сходством с дрожжевым белком сортировки вакуолей, носящим название VPS15. Считается, что этот белок участвует в транспорте везикул и опосредует межбелковые взаимодействия и связь белков с мембранами.
Почти все клетки больных с синдромом Чедиака-Хигаси содержат крупные лизосомы неправильного строения, плотные гранулы или везикулярные структуры. Из-за нарушения дисперсии гигантских меланосом они не поступают в кератиноциты и волосяные фолликулы, вследствие чего стержни волос лишаются пигментных гранул. В результате волосы и кожа больных выглядят светлее, чем у родителей. Те же нарушения меланоцитов обусловливают частичный глазной альбинизм, сопровождающийся светобоязнью.
Слияние гигантских первичных гранул друг с другом и с компонентами цитоплазматических мембран на ранних стадиях развития нейтрофилов приводит к образованию огромных вторичных лизосом с уменьшенным содержанием гидролитических ферментов — протеаз, эластазы и катепсина G. Это и может лежать в основе нарушенной бактерицидной активности нейтрофилов. Повышенная текучесть клеточных мембран при синдроме Чедиака-Хигаси сказывается на экспрессии рецепторов, приводя к повышению внутриклеточного уровня цАМФ, нарушению сборки микротрубочек и их взаимодействия с мембранами лизосом.

Клинические проявления синдрома Чедиака-Хигаси. Кожа у больных светлая, волосы имеют серебристый оттенок. Нередко отмечаются солнечные ожоги и светобоязнь. Характерны частые инфекции и невропатия. Инфекции поражают слизистые оболочки, кожу и дыхательные пути. Повышена восприимчивость как к грамположительным, так и грамотрицательным бактериям и грибам. Наиболее частый возбудитель S. aureus. Невропатия бывает сенсорной и моторной, приводя к атаксии. Нередко она развивается в подростковом возрасте и становится основной жалобой.
Время кровотечения увеличено; количество тромбоцитов нормально, но их агрегация (из-за дефицита плотных гранул, содержащих АДФ и серотонин) нарушена. Нарушена и функция NK-клеток.
Наиболее опасное осложнение синдрома Чедиака-Хигаси — ускорение пролиферации лимфоцитов с панцитопенией, высокой температурой тела и лимфогистиоцитарной инфильтрацией печени, селезенки и лимфатических узлов. Это может произойти в любом возрасте и, по-видимому, связано с отсутствием сопротивляемости вирусу Эпштейна-Барр. Клиническая картина в таких случаях напоминает вирусный гемофагоцитарный синдром. Пролиферация лимфоцитов сопровождается учащением бактериальных и вирусных инфекций и обычно приводит к смерти. Многочисленные лимфогистиоцитарные инфильтраты, обнаруживаемые при аутопсии в печени, селезенке и лимфатических узлах, лишены гистологических признаков злокачественности.
Лабораторные исследования синдрома Чедиака-Хигаси. Диагностическим признаком синдрома Чедиака-Хигаси служат крупные включения во всех ядерных клетках крови. Они видны при окраске мазков крови по Райту, но лучше выявляются на пероксидазе.
Лечение синдрома Чедиака-Хигаси. Некоторым больным в стабильной фазе синдрома помогают высокие дозы аскорбиновой кислоты (200 мг/сут для грудных детей и 2000 мг/сут для взрослых). Ее эффективность вызывает сомнения, но безопасность витамина С оправдывает его введение всем больным.
Единственно надежный метод лечения синдрома Чедиака-Хигаси при ускоренной пролиферации лимфоцитов — трансплантация костного мозга от HLA-идентичных родственников или доноров, совместимых по локусу D. Трансплантация костного мозга в таких случаях нормализует гемопоэтические и иммунологические функции и восполняет дефицит NK-клеток, но не излечивает и не предотвращает невропатию.
— Также рекомендуем «Недостаточность миелопероксидазы (МПО). Клиника и диагностика»
Оглавление темы «Нейтропении»:
- Синдром Чедиака-Хигаси. Клиника и диагностика
- Недостаточность миелопероксидазы (МПО). Клиника и диагностика
- Хроническая гранулематозная болезнь. Причина и клиника
- Диагностика и лечение хронической гранулематозной болезни
- Нейтропения и ее причины. Лекарственная нейтропения
- Иммунная нейтропения детей и новорожденных
- Наследственная нейтропения. Тяжелая врожденная нейтропения — синдром Костманна
- Синдром Швахмана-Даймонда. Метафизариая хондродисплазия тип Мак-Кьюсика и гликогеноз
- Клиника и диагностика нейтропении
- Лечение нейтропении. Терапия хронической врожденной нейтропении у детей
Источник
Что такое синдром Чедиака-Хигаси?
Синдром Чедиака-Хигаси (сокр. СЧХ) — это редкое, наследственное, комплексное, иммунное заболевание, которое обычно возникает в детстве, характеризуется снижением пигментации кожи и глаз (глазокожный альбинизм), иммунодефицитом с повышенной восприимчивостью к инфекциям, склонностью к ушибам и легкому кровотечению. Распространены также неврологические нарушения. СЧХ передается как аутосомно-рецессивное генетическое заболевание.
Признаки и симптомы

Симптомы синдрома Чедиака-Хигаси могут быть очевидны уже в раннем детстве. Волосы обычно светлые или светло-коричневые с серебристым оттенком. Больные дети могут быть ненормально чувствительными к свету (светочувствительность) из-за уменьшения пигмента в глазах и коже, могут проявлять быстрые непроизвольные движения глаз (нистагм). Более важным и более серьезным является влияние СЧХ на иммунную и нервную системы пациента.
При СЧХ лейкоциты (белые кровяные клетки) содержат ненормальные гранулы, заметно увеличенные в размерах. Эти гранулы можно увидеть, глядя на клетки крови под микроскопом. Эти аномальные гранулы влияют на способность лейкоцитов бороться с инфекцией. Дети подвержены частым бактериальным, вирусным и грибковым инфекциям, особенно кожи и дыхательных путей. Дети с СЧХ могут также иметь аномально низкий уровень лейкоцитов.
Дети с этим заболеванием могут легко получать синяки и ушибы или чрезмерно кровоточить даже при незначительных травмах. Количество тромбоцитов у больных обычно нормальное, но не функционируют должным образом, вызывая легкие кровоподтеки или длительное кровотечение.
Заболевание можно разделить на классические и атипичные (легкие) формы. Люди с атипичной формой могут меньше поддаваться серьезным инфекциям и иметь более легкие симптомы. Дети с классической формой заболевания подвержены риску развития ускоренной фазы. Ускоренная фаза встречается у 85% пациентов и может наступить в любом возрасте. Ускоренная фаза вызвана избыточной продукцией лимфоцитов иммунной системой. У пациентов могут развиться такие симптомы, как:
- лихорадка (повышенная температура);
- воспаление лимфатических узлов;
- увеличение печени;
- увеличение селезенки;
- анемия;
- низкий уровень лейкоцитов в крови;
- низкий уровень тромбоцитов в крови.
Это серьезное заболевание и требует немедленного лечения.
Неврологические симптомы возникают в раннем взрослом возрасте. Симптомы, затрагивающие нервную систему, включают:
- неустойчивую осанку и ходьбу (атаксия);
- потерю чувствительности в руках и ногах (периферическая нейропатия).
Это может привести к физической слабости и инвалидности. У некоторых пациентов могут быть симптомы, напоминающие болезнь Паркинсона.
Причины СЧХ
Синдром Чедиака-Хигаси наследуется как аутосомно-рецессивный генетический признак. Ответственный ген картирован в хромосомном локусе 1q42.1-Q42.2 и известен как ген Lyst.
Аномальный ген влияет на «схемы движения» или движение белков в клетках. Белки (или ферменты), предназначенные для перехода из одной части клетки в другую, могут быть неправильно направлены или не транспортироваться.
Например, грануле, в которой образуется пигмент кожи (меланин), мешают, так что пигмент не может быть перенесен в соответствующую клетку кожи. Точно так же дефект в транспорте в лейкоцитах делает клетку беспомощной в уничтожении инфекционных агентов, таких как вирусы или бактерии, и вызывает проблемы с иммунитетом.
Хромосомы, которые присутствуют в ядре клеток человека, несут генетическую информацию каждого человека. Клетки человеческого тела обычно имеют 46 хромосом. Пары человеческих хромосом пронумерованы от 1 до 22, а половые хромосомы обозначены X и Y. У мужчин есть одна Х и одна Y-хромосома, а у женщин две Х-хромосомы. Каждая хромосома имеет короткое плечо, обозначенное «p», и длинное плечо, обозначенное «q». Хромосомы далее подразделяются на множество пронумерованных полос. Например, «хромосома 1q42.1» относится к полосе 42.1 на длинном плече хромосомы 1. Пронумерованные полосы указывают местоположение тысяч генов, присутствующих в каждой хромосоме.
Генетические заболевания определяются сочетанием генов определенного признака, которые находятся на хромосомах, полученных от отца и матери.
Рецессивные генетические нарушения возникают, когда человек наследует аномальный ген по одному признаку от каждого родителя. Если человек получает один нормальный ген и один ненормальный ген заболевания, человек будет носителем болезни, но обычно бессимптомным. Риск того, что оба родителя-носителя передадут дефектный ген и, следовательно, заведут больного ребенка, составляет 25% с каждой беременностью. Риск рождения ребенка-носителя, как и родители, составляет 50% с каждой беременностью. Вероятность ребенка получить нормальные гены от обоих родителей и быть генетически нормальным для конкретно данного признака составляет 25%. Риск одинаков для мужчин и женщин.
Все люди несут 4-5 ненормальных генов. Родители, являющиеся близкими родственниками (т.е. с одной семьи, например, брат и сестра), имеют больше шансов завести больного ребенка, чем родители из разных семей.
Затронутые группы населения
Синдром Чедиака-Хигаси — очень редкое заболевание, которое поражает мужчин и женщин в равных количествах. Часто появляется при рождении или вскоре после. По-видимому, не существует более высокого риска для какой-либо конкретной этнической или расовой группы. Зарегистрировано менее 500 случаев заболевания. У 85% больных синдром прогрессирует до ускоренной фазы.
Диагностика СЧХ
Диагноз СЧХ обычно ставится по наличию «гигантских гранул» при микроскопическом анализе лейкоцитов. «Гигантские тельца включения» можно также увидеть в клетках, которые превращаются в лейкоциты (клетки-предшественники лейкоцитов) в костном мозге.
Слипание пигмента в волосах, которое можно увидеть при световой микроскопии, является еще одним методом диагностики, который проводится, если в мазке крови обнаруживают увеличенные гранулы.
Схожие по симптомам расстройства
Симптомы следующих расстройств могут быть похожи на симптомы синдрома Чедиака-Хигаси. Сравнения могут быть полезны для дифференциальной диагностики:
- Синдром Грисцелли — редкое наследственное заболевание, характеризующееся частичным альбинизмом и аномалиями тромбоцитов и лейкоцитов. Симптомы схожи с симптомами СЧХ. Есть 3 различных типа синдрома Грисцелли. Тип 2 очень похож на СЧХ, поскольку у пациентов наблюдаются пигментные и иммунные нарушения. Пациенты также подвержены риску ускоренной фазы. При лабораторном анализе белые кровяные клетки не имеют гигантских гранул, подобных тем, которые наблюдаются при синдроме Чедиака-Хигаси; Таким образом, диагнозы ставятся по-разному на основе этих гранул.
- Синдром Германского-Пудлака — редкое наследственное заболевание, характеризующееся снижением пигментации кожи, волос и/или глаз (альбинизм), патологическими тромбоцитами и чрезмерным накоплением жирных веществ (цероидов) в различных частях тела. Симптомы синдрома Германского-Пудлака включают снижение цвета кожи, волос и глаз, нарушение зрения и чрезмерное кровотечение. Жировые отложения цероида в легких, кишечнике, сердце и/или почках могут вызывать нарушение функций во многих органах организма. Один тип синдрома Германского-Пудлака также может иметь иммунные нарушения. Часто первыми симптомами синдрома у ребенка являются легкие кровоподтеки, кровоточащие десны, носовые кровотечения и чрезмерное кровотечение после операции или травмы.
- Глазокожный альбинизм — заболевание, которое приводит к ухудшению зрения и депигментации радужной оболочки глаза/сетчатки глаза. Депигментация может варьироваться от умеренной до полной. Глазокожный альбинизм может быть дифференцирован от СЧХ по отсутствию инфекционной истории или неврологических нарушений.
- Семейный гемофагоцитарный лимфогистиоцитоз характеризуется высокоактивными макрофагами и Т-лимфоцитами, которые действуют как острые заболевания с лихорадкой, снижением количества кровяных клеток, увеличением селезенки и печени. Возраст наступления заболевания варьируется. Неврологические симптомы также могут проявляться в виде давления в головном мозге, раздражительности, скованности шеи, низкого мышечного тонуса, спастических мышц, эпилепсии, паралича черепно-мозговых нервов, потери контроля над мышцами (атаксия), геми/квадриплегия, слепота и коматозное состояние. Симптомами также являются дисфункция печени и разрушение иммунных клеток. Медиана выживаемости детей составляет менее двух месяцев, как правило, из-за инфекции. Заболевание является аутосомно-рецессивным и вызвано мутацией в одном из генов FHL1-FHL5.
Лечение
Лечение синдрома Чедиака-Хигаси варьируется в зависимости от стадии заболевания на момент постановки диагноза. В идеале, должна быть выполнена пересадка костного мозга до того, как у пациента разовьется ускоренная фаза. Трансплантация костного мозга устраняет нарушения иммунитета и кровотечения и предотвращает развитие ускоренной фазы. Если наступает ускоренная фаза, гемофагоцитоз должен быть в стадии ремиссии, прежде чем делать пересадку костного мозга. Этим пациентам дают химиотерапию, чтобы получить ускоренную фазу в ремиссии. Пересадка костного мозга можно провести после того, как у пациента наступит ремиссия. Перед серьезными процедурами можно применять препарат для предотвращения чрезмерного кровотечения, Десмопрессин.
Помимо этих вариантов, лечение СЧХ является симптоматическим. При возникновении бактериальных или грибковых инфекций их следует быстро лечить антибиотиками или противогрибковыми препаратами. Острые вирусные инфекции можно лечить антивирусными препаратами. Переливание тромбоцитов может быть необходимо, если кровотечение становится чрезмерным после травмы или операции.
Люди с синдромом Чедиака-Хигаси должны минимизировать незащищенное пребывание на солнце. Когда пострадавшие подвергаются воздействию солнечных лучей, солнцезащитные очки и солнцезащитные средства, нанесенные на кожу, могут быть полезны.
Прогноз
Синдром Чедиака-Хигаси обычно приводит к ранней смерти от инфекции или, реже, кровотечения. Нерешенные респираторные и кожные инфекции обычно заканчиваются смертельным исходом до того, как ребенок с СЧХ достигнет возраста 10 лет. Возможно более длительное выживание, но лимфатические узлы, селезенка и печень увеличиваются и развивается злокачественная лимфома. Однако есть пациенты дожившие до 20 лет.
Источник
