Что такое нефротический синдром финского типа
Терминология. Под врожденным нефротическим синдромом понимается НС, развившийся у ребенка до 3-месячного возраста. Врожденный HC может быть первичным, генетически детерминированным и вторичным при врожденной цитомегалии, токсоплазмозе, сифилисе, туберкулезе, тромбозе почечных вен, СПИДе. Особое место среди врожденного HC занимает первичный наследственный, так называемый врожденный нефротический синдром финского типа. Это аутосомно-рецессивно наследуемая патология, проявляющаяся с первых дней жизни ребенка тяжелым нефротическим синдромом с большой протеинурией и резкой гипопротеи-немией. При «естественном» течении летальный исход наступает до 1 года, причем к нему приводят либо развитие почечной недостаточности, либо септические осложнения.
История и эпидемиология. Впервые заболевание описано в 1966 г. R. Norio. При анализе церковно-приходских книг в юго-западном регионе Финляндии, где наиболее часто встречалось это заболевание, был обнаружен родоначальник патологии — финн, который проживал в этом регионе во второй половине XVI в. До проведения антенатальной диагностики заболевание встречалось с частотой 1:8200 рождений. Аналогичные случаи регистрируются в северо-западном районе России, в Ленинградской области. He всегда удается подтвердить этническую (финскую) принадлежность семьи. Этот вариант патологии неоднократно описывался в различных странах мира у лиц нефинской национальности.
Клиническая характеристика. Течение беременности тяжелое, роды, как правило, преждевременные, масса плаценты составляет более 1/4-1/2 массы новорожденного. Чаще ребенок рождается уже с выраженными отеками, но они могут появиться несколько позднее — к концу первого месяца жизни. Протеинурия достигает 10 г за сутки. Резко выражена гипоальбуминемия, имеет место повышение липидов сыворотки крови. При уменьшении отечного синдрома после введения диуретиков обращают на себя внимание резкая дистрофия ребенка, множественные стигмы дизэмбриогенеза. Резко снижены показатели иммунной защиты, что является основой развития гнойных осложнений. Возможны тромбоэмболии. АД снижено или в пределах нормы. В амниотической жидкости и сыворотке крови беременных в высоком титре содержится альфа-фетопротеин. Обнаружение этого феномена позволило проводить своевременную антенатальную диагностику.
Морфология и патогенез. При гистологическом исследовании почек обнаруживаются микрокистоз проксимальных канальцев в кортикомедуллярной зоне, мультигломерулярность и другие признаки незрелости почечной ткани, пролиферация мезангиальных клеток, фиброзные изменения.
Врожденный нефротический синдром финского типа относится к гломерулярным болезням, причем продукт гена — нефрин — локализован на подоцитах. Недостаточность нефри-на вызывает протеинурию еще в антенатальном периоде развития ребенка.
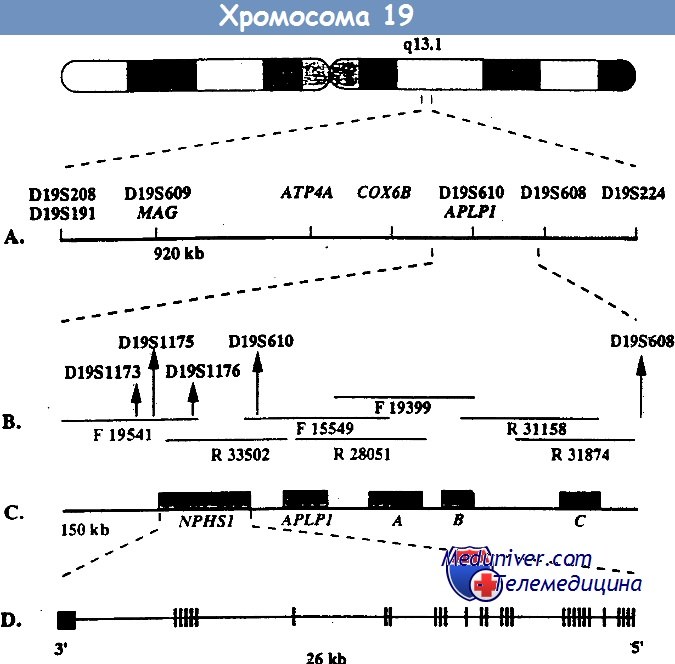
Генетика. Врожденный HC финского типа наследуется аутосомно-рецессивным путем. М. Kestila и соавт. при исследовании 17 семей с указанной патологией не обнаружили дефекта ни в одном из генов альфа-1-, альфа-2-, альфа-3- и альфа-4-цепи коллагена IV типа, а также основных генов цепей ламинина и гепа-рансульфат-протеогликана, кодирующих основные компоненты БМ клубочков. Получены убедительные данные, что мутантный ген локализован на 19ql3, этот ген — NPHSI — кодирует трансмембранный протеин — нефрин, присущий подоцитам.
Современными исследованиями выяснено, что в различных регионах мира, где выявлялся врожденный НС, близкий по сути финскому, имеется около 40 мутаций гена NPHSI. Однако в Финляндии у больных и носителей обнаружены только 2 идентичные мутации этого гена. В семьях, где имеется врожденный НС, в процессе медико-генетического консультирования беременные женщины обязательно обследуются на наличие у них в крови альфа-фетопротеина. При его обнаружении рекомендуется прерывание беременности.
Диагностика. Рождение в семье ребенка с врожденным HC требует прежде всего выяснения этнических корней. Обязательно исключение вторичного НС, связанного с внутриутробными инфекциями. Врожденный HC финского типа следует дифференцировать от семейного НС, который описан в различных странах мира у людей различной национальности (см. ниже). О финском типе HC говорят тяжелая беременность, наличие очень крупной плаценты, обнаружение при морфобиоптическом исследовании микрокистоза проксимальных канальцев.
Лечение. Несмотря на то что в Финляндии проводится активное выявление семей, где возможно развитие врожденного HC финского типа, все же и в настоящее время рождаются дети с этой тяжелой патологией. Ни симптоматическая терапия, ни стероиды и иммуносупрессоры не вызывают улучшения у больных с врожденным HC финского типа.
Рекомендуется высокобелковая и высококалорийная диета наряду со строжайшим водноэлектролитным сбалансированным режимом до 10—12 мес жизни ребенка. К этому возрасту удается довести его массу тела до 10 кг, ликвидировать дистрофию и отечный синдром. После нефрэктомии проводят почечную трансплантацию. Десятилетнее наблюдение за группой, включавшей около 40 детей, убедительно свидетельствует о хорошей реабилитации таких больных.
Источник
Врожденный нефротический синдром финского типа — клиника, диагностикаВрожденный нефротический синдром финского типа — заболевание наследуется по аутосомно-рецессивному типу и является основной причиной высокой протеинурии у детей первого месяца жизни. Хотя наибольшая распространенность этого заболевания отмечается в Финляндии (1,2 случая на 10 000 беременностей), описано много случаев заболевания у детей других национальностей. При этом заболевании протеинурия возникает еще внутриутробно, что проявляется повышенным уровнем а-фетопротеина в околоплодных водах. Уже на первой неделе жизни часто возникают отеки. Истощение, тяжелые инфекции и тромбозы обусловливают тяжесть заболевания и высокую смертность, ранее больные погибали на первом году жизни. Сегодня при интенсивном лечении больные могут дожить до того момента, когда им можно провести трансплантацию почки. Выживаемость как трансплантата, так и больных очень высокая. Локус, мутация в котором обусловливает данное заболевание, был найден с помощью позиционного клонирования на длинном плече 19-й хромосомы (19q13.1) и в финских, и в других семьях. При определении нуклеотидной последовательности этого локуса был найден ранее неизвестный ген NPHS1, который избирательно экспрессируется в подоцитах. Продукт этого гена получил название нефрин. Он относится к молекулам адгезии из суперсемейства иммуноглобулинов. Нефрин локализован в области щелевых диафрагм — видоизмененных плотных контактов между отростками ножек подоцитов. У больных с мутацией гена NPHS1 нет отростков ножек подоцитов и щелевых диафрагм. Это позволяет думать, что именно нефрин является важнейшим компонентом щелевых диафрагм, предотвращающих выход белка из сосудов клубочка. Среди всех мутаций гена NPHS1 у финнов преобладают две: Fin-major и Fin-minor. Они присутствуют более чем у 90% больных. Мутация Fin-major вызвана делецией двух пар нуклеотидов во 2-м экзоне, который кодирует терминирующий кодон, она встречается примерно у 80% больных финнов. Мутация Fin-minor — нонсенс-мутация в 26-м экзоне, она встречается примерно у 17% больных финнов. У больных других национальностей встречаются различные мутации по типу делеций, вставок, нонсенс- и миссенс-мутаций, а также мутации, нарушающие сплайсинг. Врожденный нефротический синдром финского типа — основная, но не единственная причина нефротического синдрома на первом месяце жизни.
— Также рекомендуем «Синдром Дени-Дрэша — клиника, диагностика» Оглавление темы «Наследственные болезни почек»:
|
Источник
Нефротический синдром (НС) — клинико-лабораторный cимптомокомплекс, клинически характеризующийся периферическими или генерализованными отеками вплоть до асцита и анасарки, а лабораторно — протеинурией более 2,5 г/сут или более 50 мг/кг/сут, гипопротеинемией, гипоальбуминемией (ниже 40 г/л), диспротеинемией, гиперлипидемией и липидурией.
Одним из наиболее частых наследственных типов НС является врожденный (семейный) нефротический синдром финского типа. Наибольшее распространение НС отмечается в Финляндии (заболеваемость среди новорожденных составляет 1:8200 родившихся), где доказан эффект основателя. В других странах, в том числе и РФ, это заболевание встречается гораздо реже.
Нефротический синдром финского типа (НСФТ) – аутосомно-рецессивное заболевание, проявляющееся полным клинико-лабораторным симптомокомплексом нефротического синдрома и выявляется с рождения до 3 месяцев Гистологически при этом типе НС выявляют четкообразные цепочечные расширения проксимальных отделов нефрона (псевдокистоз), гломерулярные, тубулярные и интерстициальные изменения, степень выраженности которых нарастает по мере прогрессирования заболевания, а также большое количество фетальных гломерул и гломерул с увеличенным диаметром. Причиной заболевания являются мутации гена NPHS1 [OMIM 602716].
Ген NPHS1 расположен на длинном плече хромосомы 19 (19q13), содержит 29 экзонов. Генный продукт – белок нефрин имеет массу 185 КД. Ему отводится роль структурно-функциональной основы в щелевой мембране. Предполагается, что молекулы нефрина от смежных подоцитов соедининяются через их Ig-like внеклеточные области и формируют структуру, подобную «застежке – молнии», благодаря которой происходит селективная фильтрация в щелевой диафрагме.
В Финляндии 95% с нефротического синдрома Финского типа обусловлены только двумя мутациями: мажорной (делеция 2 п.н. в экзоне 2 (с.121delCТ, fin major), приводящей к сдвигу рамки считывания и минорной (стоп кодон в 1109-ой позиции аминокислотной последовательности в экзоне 26, с.3325 C>T или R1109X, fin minor). Остальные мутации представляют собой редкие миссенс-мутации и делеции. На сегодня нет данных о частоте и спектре мутаций в гене NPHS1у российских больных.
Лечение НС финского типа разрабатывается. Применение глюкокортикоидов и иммунодепрессантов не эффективно и нередко утяжеляет течение заболевания. В Финляндии предложена программа лечения НС финского типа, включающая активную борьбу с инфекцией, усиленное насыщение ребенка белком, а при достижении массы тела ребенка 10 кг — трансплантацию почки. Используется также рекомбинантный гормон роста.
Прогноз для жизни, если не произведена трансплантация почки, неблагоприятный. Срок наблюдения за детьми после успешной трансплантации почки составляет более 5 лет.
NPHS2 вторая по частоте форма врожденного кортикостероидо-резистентного (с отсутствием ответа на стероидную терапию) нефротического синдрома, обуславливающая от 45% до 55% семейных форм и от 8% до 20% спорадических случаев заболевания.
Развитие данного заболевания обусловлено мутациями в гене NPHS2 расположеном на длинном плече 1 хромосомы ( 1q25-q31) и кодирующем белок подоцин. На данный момент описано более 120 патологических мутаций, приводящих к изменениям структуры белка. Замечено, что среди населения Франции и Германии наиболее часто встречается мутация R138Q, а в итальянской и турецкой популяциях — мутация P20L.
Кроме отсутствия ответа на терапию кортикостероидами у NPHS2 формы нет специфических клинических признаков. При биопсии почек так же обнаруживают только неспецифичные гистологические изменения, такие как фокально-сегментарный гломерулосклероз, минимальные изменения и диффузную мезангиальную пролиферацию. Описаны больные как с поздней манифестацией заболевания, так и с врожденным и инфантильным НС.
В ООО «Центр Молекулярной Генетики» методом прямого автоматического секвенирования проводится анализ кодирующей последовательности генов NPHS1 и NPHS2.
При проведении пренатальной (дородовой) ДНК-диагностики в отношении конкретного заболевания, имеет смысл на уже имеющемся плодном материале провести диагностику частых анеуплоидий (синдромы Дауна, Эдвардса, Шерешевского-Тернера и др), пункт 4.54.1. Актуальность данного исследования обусловлена высокой суммарной частотой анеуплоидий — около 1 на 300 новорожденных, и отсутствием необходимости повторного забора плодного материала.
Публикации по теме раздела
Нефротический синдром
Источник
Общая характеристика заболевания
Нефротический синдром — синдром (сочетание симптомов), встречающийся при многих болезнях, которые поражают почки; он сопровождается тяжелой длительной потерей белков с мочой, уменьшением содержания в крови белков (особенно альбуминов), задержкой соли и воды в организме и увеличением содержания жиров (липидов) в крови.
Нефротический синдром может возникать в любом возрасте. У детей он наиболее распространен между 18 месяцами и 4 годами; мальчики заболевают чаще, чем девочки. У пожилых людей такой разницы между полами нет.
Формы
Выделяют первичный, вторичный и идиопатический нефротический синдромы.
Первичный нефротический синдром — развивается в результате заболевания, которое первично поражает почки. Разделяется на приобретенный и врожденный.
- Врожденный — встречается у родственников, передается по наследству:
- нефротический синдром « финского типа» — наибольшее распространение получил в Финляндии, в других странах встречается редко, обусловлен генной мутацией (изменениями в генах — наследственном коде);
- болезнь Фабри (отложение в тканях гликолипидов (сложные соединения жира и белка), нарушающих работу органов).
- Приобретенный нефротический синдром. Человек рождается здоровым, поражение почек и развитие нефротического синдрома происходит в течение жизни в результате заболевания, поражающего непосредственно почки, например, при таких заболеваниях, как:
- гломерулонефрит (двустороннее иммуновоспалительное (организм сам атакует почки из-за сбоя в работе иммунной системы) заболевание почек);
- нефропатическая форма первичного амилоидоза (отложение в почках вещества, напоминающего крахмал, что приводит к нарушению их функции);
- опухоли почек.
Вторичный нефротический синдром — почки поражаются вторично, на фоне других заболеваний.
Идиопатический нефротический синдром — заболевание, причину которого установить невозможно. Чаще встречается у детей.
Также выделяют 2 группы в зависимости от эффективности гормональной терапии:
- гормоночувствительный нефротический синдром — хорошо поддается лечению гормональными препаратами,
- гормонорезистентный (нечувствительный) нефротический синдром — устойчив к гормональному лечению, в этом случае используют цитостатики (препараты, подавляющие размножение и рост клеток.).
По объему циркулирующей крови (та кровь, которая движется по сосудам) нефротический синдром разделяется на:
- гиперволемический (объем крови увеличен);
- гиповолемический (объем крови значительно снижен).
Причины развития нефротического синдрома
Первичный нефротический синдром
- Липоидный нефроз (идиопатический нефротический синдром у детей, нефропатия с минимальными изменениями).
- Мембранозный гломерулонефрит (идиопатический нефротический синдром взрослых).
- Другие причины: мезангиальный пролиферативный гломерулонефрит, мембранозно-пролиферативный гломерулонефрит, фокально-сегментарный гломерулосклероз. Встречаются реже, чем предыдущие, могут наблюдаться и у взрослых, и у детей.
Вторичный нефротический синдром
- Инфекционные болезни: постстрептококковый гломерулонефрит, инфекционный эндокардит, вторичный сифилис, лепра, гепатит В, малярия, шистосоматоз, филяриоз и др.
- Системные заболевания соединительной ткани, другие заболевания иммунной природы, семейно-наследственные заболевания: системная красная волчанка, ревматоидный артрит, болезнь Шенлейна-Геноха, другие васкулиты, амилоидоз, саркоидоз, сахарный диабет, серповидноклеточная анемия и др.
- Лекарственные и токсические воздействия: тяжелые металлы (препараты золота, отравление соединениями ртути), пеницилламин, каптоприл, нестероидные противовоспалительные препараты, рентгено-контрастные средства, антитоксины и др.
- Опухоли: лимфогранулематоз, лимфома, лейкоз, карцинома, меланома (паранеопластический нефротический синдром).
Следует отметить, что нефропатия с минимальными изменениями, характерная для детского возраста, может встречаться и у взрослых, причем соотношение детей и взрослых составляет примерно 4 к 1.
Вне зависимости от причины, нефротический синдром имеет общие морфологические проявления, обусловленные массивной протеинурией, развитием реабсорбционной недостаточности канальцев в отношении белка и отражающие структурную перестройку гломерулярного фильтра и канальцевого аппарата. В подоцитах наблюдается вакуолизация, отек цитоплазмы, исчезновение внутриклеточных структур и десквамация клеток с оголением базальной мембраны. В канальцах же находят гиалиновокапельную дистрофию эпителия с его некробиозом, десквамацией, атрофией и кистозным расширением канальцев. Гиалиноз, склероз клубочков и развитие соединительной ткани в интерстиции нередко приводят к картине вторичного сморщивания почек. Оставайтесь рядом с нами на facebook:
Симптомы
Признаки нефротического синдрома однотипны, несмотря на различие вызывающих его причин.
Ведущим проявлением служит протеинурия, достигающая 3,5-5 и более г/сутки, причем до 90% выводимого с мочой белка составляют альбумины. Массивная потеря белка с мочой вызывает снижение уровня общего сывороточного белка до 60-40 и менее г/л. Задержка жидкости при нефротическом синдроме может проявляться периферическими отеками, асцитом, анасаркой (генерализованным отеком подкожной клетчатки), гидротораксом, гидроперикардом.
Прогрессирование нефротического синдрома сопровождается общей слабостью, сухостью во рту, жаждой, потерей аппетита, головной болью, тяжестью в пояснице, рвотой, вздутием живота, поносом. Характерным признаком нефротического синдрома служит олигурия с суточным диурезом менее 1 л.
Возможны явления парестезии, миалгия, судороги. Развитие гидроторакса и гидроперикарда вызывает одышку при движении и в покое. Периферические отеки сковывают двигательную активность больного. Пациенты с нефротическим синдромом вялые, малоподвижные, бледные; отмечают повышенное шелушение и сухость кожи, ломкость волос и ногтей.
Нефротический синдром может развиваться постепенно или бурно; сопровождаться менее и более выраженной симптоматикой, что зависит от характера течения основного заболевания.
По клиническому течению различаются 2 варианта нефротического синдрома – чистый и смешанный. В первом случае нефротический синдром протекает без гематурии и гипертензии; во втором может принимать нефротически-гематурическую или нефротически-гипертоническую форму. Оставайтесь рядом с нами на facebook:
Диагностика
- Анализ анамнеза заболевания и жалоб — когда впервые появились отеки, как они развивались с течением времени, было ли проведено обследование и лечение, с какими результатами и т. д.
- Анализ анамнеза жизни — направлен на выявление факторов риска развития нефротического синдрома (частые инфекционные заболевания, наличие аллергии и т.д.). Анализ семейного анамнеза — встречались ли заболевания почек у ближайших родственников.
- Общий осмотр – определяется наличие бледных (« перламутровых»), холодных и сухих на ощупь кожных покровов, обложенности языка, увеличения размеров живота, гепатомегалии (увеличение печени), отеков.
- Общий анализ крови — определяется, есть ли признаки воспаления, такие как: повышение СОЭ (скорость оседания эритроцитов, неспецифический признак воспаления), увеличенное содержание лейкоцитов (белых кровяных клеток); также может быть обнаружено небольшое снижение уровня гемоглобина (железосодержащий белок красного цвета, находящийся в эритроците, красной кровяной клетке).
- Биохимический анализ крови — определяются характерные изменения: гипоальбуминемия (пониженное содержание в крови альбумина — белка, отвечающего за поддержание давления крови в сосудах) и гипопротеинемия (пониженное содержание белка в жидкой части крови (менее 60-50 г/л)), гиперхолестеринемия (содержание холестерина (природный жирный спирт, избыток некоторых его фракций опасен для организма) в крови более 6,5 ммоль/л).
- Общий анализ мочи — определяется повышенная относительная плотность (1030-1040), лейкоцитурия (повышенное содержание в моче лейкоцитов, белых клеток крови), цилиндрурия (повышение содержания в моче цилиндров — спрессованных белков, которые, проходя через канальцы почек, « слиплись» между собой), наличие в осадке кристаллов холестерина и капель нейтрального жира, редко – микрогематурия (наличие в моче единичных эритроцитов — красных клеток крови); в биохимическом анализе мочи определяется протеинурия (повышенное содержание белка) свыше 3,5 г в сутки.
- Электрокардиография (регистрация электрической активности сердца на бумажной ленте) — урежение (становится редким) сердечного ритма, признаки дистрофии миокарда (недостаточное питание сердечной мышцы).
- Ультразвуковое обследование (УЗИ) почек — позволяет определить наличие какой-либо органической патологии в почке.
- Ультразвуковая допплерография (УЗДГ) почечных сосудов — применяется для диагностики аномалий их развития, выявления сужений и закупорок почечных артерий, исследования параметров почечного кровотока и состояния микроциркуляции (ток крови в мелких сосудах).
- Нефросцинтиграфия — введение в организм небольшого количества радиоактивного медицинского препарата (радиоактивной метки) и получение изображения почек при помощи гамма-камеры. Метод позволяет оценить функцию почек.
- Биопсия (взятие маленького кусочка ткани исследуемого органа специальной длинной иглой для дальнейшего исследования его под увеличением микроскопа) почки, прямой кишки, печени, десны — для исключения амилоидоза (заболевание, характеризующееся отложением в тканях белка амилоида, который вытесняет функциональные клетки органа и ведет к его гибели).
Лечение
Раньше лечение нефротического синдрома носило исключительно диетический характер, изменением рациона питания специалисты пытались заместить потерю белка. Это и приводило к повышенной смертности, хотя ее причинами считались интеркуррентные инфекции. Для подбора правильного курса лечения нефротического синдрома, необходимо точное выявление фактора, послужившего причиной его развития.
Рекомендуемая при данном заболевании диета, обеспечивает не только снижение количества потребляемой соли, но и получение до 3-х грамм белка на кг веса в сутки.
В настоящее время при лечении нефротического синдрома особой популярностью пользуются кортикостероидные препараты. Рекомендуется прием Преднизолона в течение 8-ми недель, по следующей схеме:
- 1-2 неделя (суточная доза должна составлять не более 2 мг/кг.)
- 3-4 неделя (суточная доза составляет 75% от предыдущей)
- 5-6 неделя (суточная доза составляет 50% от предыдущей)
- 7-8 неделя (суточная доза составляет 25% от первоначальной).
При благоприятном течении заболевания улучшение состояния становится заметным на 8-10 день, увеличивается количество мочи, исчезает протеинурия, а показатели крови приходят в норму. Данный способ лечения нефротического синдрома у детей и взрослых может привести к полному выздоровлению, но в некоторых случаях требуется его повторное проведение.
Если даже после годового лечения иногда проявляются симптомы острого нефротического синдрома, а больной не может обойтись без поддерживающих доз Преднизолона, рекомендуется проведение биопсии. В том случае если ремиссия продолжается на протяжении 2-х лет, полное выздоровление наступает лишь в 60-70% случаев.
При наличии почечной недостаточности рекомендуется диализ и трансплантация почек. В тех случаях, когда к данному заболеванию параллельно присоединились другие инфекции, назначаются антибиотики. Несомненно, эффективность лечения напрямую зависит от причины заболевания, поэтому важно своевременно обратиться за помощью и провести глубокую диагностику. Оставайтесь рядом с нами на facebook:
Течение болезни
Осложнениями нефротического синдрома могут явиться периферические флеботромбозы, вирусные, бактериальные, грибковые инфекции, отек мозга или сетчатки, нефротический криз (гиповолемический шок).
Течение и прогноз нефротического синдрома
Течение и прогноз нефротического синдрома определяются многими факторами: возрастом больных, причиной развития нефротического синдрома, клиническими особенностями нефропатии (прогноз хуже при сочетании нефротического синдрома с артериальной гипертензией, выраженной гематурией), морфологическими особенностями нефропатии, адекватностью проводимой терапии, наличием осложнений.
Липоидный нефроз имеет наиболее благоприятный прогноз (особенно у детей) вследствие наклонности к самопроизвольным ремиссиям и обычно хорошей реакции на кортикостероиды, хроническая почечная недостаточность у таких больных развивается редко.
Прогноз при первичном мембранозном гломерулонефрите существенно хуже: в пределах 10 лет примерно у трети взрослых пациентов развивается терминальная стадия хронической почечной недостаточности или наблюдается смерть от интеркуррентного заболевания. Прогноз первичного нефротического синдрома, развившегося на фоне других нефропатии, еще менее благоприятен: у значительной части больных в пределах 5—10 лет развивается артериальная гипертензия и прогрессирующая хроническая почечная недостаточность, требующая гемодиализа и/или трансплантации почки.
Течение и прогноз вторичного нефротического синдрома определяются не только собственно нефропатией, но и характером и течением основного заболевания.
Профилактика
Необходимо рациональное и настойчивое лечение острого и хронического гломерулонефрита и других заболеваний почек, тщательная санация очагов инфекции, а также профилактика тех заболеваний, которые могут быть причиной нефротического синдрома. Следует проявлять осторожность в назначении лекарственных препаратов, обладающих нефротоксичностью и способностью вызывать аллергические реакции. Больные должны избегать переохлаждения, избыточной инсоляции. Они нуждаются в трудоустройстве с ограничением физических и нервных нагрузок. Оставайтесь рядом с нами на facebook:
Источник
