Беременность при синдроме тестикулярной феминизации

Тестикулярная феминизация впервые описана Стегленером (G. Steglehner, 1817). В русской медицинской литературе эта патология впервые описана С.И. Благоволиным в 1893 г. Сам термин тестикулярная феминизация был введен Моррисом (J. Morris) в 1953 г. [4, 8]. Синдром тестикулярной феминизации (СТФ) (тестикулярная феминизация, синдром Морриса) обусловлен дефектом гена рецептора к андрогенам, который расположен на коротком плече Х-хромосомы. В процессе эмбриогенеза у этих больных гонады дифференцируются как яички, которые не способны к сперматогенезу, но секретируют тестостерон и вещество, ингибирующее мюллеровы протоки. Однако из-за дефекта гена андрогенных рецепторов отсутствует чувствительность к тестостерону, так как не продуцируется фермент 5-α редуктаза, превращающий тестостерон в биологически более активный дигидротестостерон, ответственный за формирование мужского фенотипа. Секреция эстрогенов надпочечниками и частично гонадами формирует женский фенотип при отсутствии производных мюллеровых протоков (маточных труб, матки и верхней трети влагалища) [1, 5, 7]. В результате этих процессов в ходе эмбрионального развития формируются наружные половые органы по нейтральному, женскому фенотипу: неполноценное укороченное влагалище, заканчивающееся слепо. Гонады (яички) расположены у стенок таза или (чаще) в паховых каналах или толще больших половых губ. Взрослые пациентки с полной формой СТФ [2, 6, 7], несмотря на кариотип 46XY и не опустившиеся яички (гонады), отличаются женским телосложением с развитыми молочными железами, скудным лобковым и подмышечным оволосением, отсутствием внутренних половых органов и слепо заканчивающимся влагалищным мешком. Глубина влагалища может варьировать от нормальной до укороченной.
СТФ относится к редким формам генетических заболеваний. Комплексное обследование таких больных состоит из медико-генетического консультирования, кариотипирования, определения половых гормонов в сыворотке крови, ультрасонографии органов малого таза.
Согласно современным представлениям, гонады у пациентов с интерсексуальными состояниями обладают высоким риском малигнизации. Гонадобластома тестикул встречается в 20—50% наблюдений. В связи с этим половые железы рекомендуют сохранять до завершения пубертатного периода и конституционального формирования, а затем проводить удаление гонад. Хирургическая тактика в отношении тестикул в настоящее время сводится к лапароскопической гонадэктомии [3, 6]. Заместительная гормональная терапия эстрогенами достаточна для дальнейшего формирования женского фенотипа и профилактики остеопороза.
Представленный случай СТФ прослежен с 1997 г. от момента диагностики и проведения оперативного лечения (гонадэктомии) методом оперативной лапароскопии до 2014 г.
Пациентка К., 14 лет, впервые в 1997 г. обратилась в Межрегиональный центр планирования семьи и репродукции человека (отделение Центра Охраны материнства и детства, Симферополь, Крым) с жалобами на первичную аменорею. Из анамнеза: в четырехлетнем возрасте проведена правосторонняя паховая герниопластика. Детскими хирургами в составе грыжевого содержимого обнаружена ткань, напоминающая по структуре яичко. Генетическое обследование пациентки установило кариотип 46XY. К врачам родители не обращались до 14 лет ребенка. При осмотре — фенотип женский, телосложение нормостеническое, рост — 170 см, вес — 50 кг, молочные железы развиты соответственно возрасту. Интеллект сохранен. Самоосознание, поло-ролевое поведение и психосоциальная ориентация женские. Подмышечное и лобковое оволосение отсутствует. Наружные половые органы полностью соответствуют женскому фенотипу, девственная плева отсутствует. Зондирование влагалища (длина по зонду 7 см), осмотр с помощью детского зеркала Куско № 1: влагалище узкое, заканчивается слепо, шейка матки не визуализируется. Ректальный осмотр выявил отсутствие матки и придатков. При ультразвуковом исследовании в малом тазу в области правой гонады визуализируется гипоэхогенное образование 25×17 мм, с анэхогенным включением 21 мм, в области проекции левой гонады — гиперэхогенное образование 21×18 мм (рис. 1).
 Рис. 1. Ультразвуковое исследование в области правой гонады при первичном осмотре пациентки К., 1997 г.
Рис. 1. Ультразвуковое исследование в области правой гонады при первичном осмотре пациентки К., 1997 г.
Гормональное обследование методом ИФА: тестостерон — 26,21 нмоль/л (норма для женщин старше 10 лет — 0,45—3,75 нмоль/л, у мужчин старше 14 лет — 5,76 — 28,14 нмоль/л); пролактин — 107 МЕ/л.
На основании клинических данных, результатов УЗИ, исследования кариотипа и лабораторных показателей был поставлен диагноз: полная форма синдрома тестикулярной феминизации (СТФ).
Учитывая риск малигнизации гонад в постпубертатном периоде у пациентов с СТФ рекомендована гонадэктомия.
После беседы с родителями и получения их согласия, девочке проведена оперативная лапароскопия (1997 г.). В ходе операции при ревизии малого таза подтверждено отсутствие матки, маточных труб, связок и яичников с двух сторон. Слева, в области проекции паховой связки, экстраперитонеально визуализировалось опухолевидное образование размером 30×25×25 мм, мягкой консистенции, с тяжем, идущим к стенкам таза. Справа, в области проекции внутреннего кольца пахового канала — расположенное экстраперитонеально опухолевидное образование 25×25×20 мм, подпаяно к передней брюшной стенке, мягковатой консистенции. Гистологическое исследование по cito полученных тканей: слева — в состав фиброзных оболочек включено дизонтогенетически незрелое образование, морфологически без признаков малигнизации. Участок незрелой ткани яичка, cправа — многокомпонентная тератома яичка.
Произведено удаление образований путем наложения с обеих сторон по три петли Редера с последующим отсечением и коагуляцией культей. Окончательное гистологическое заключение: левая гонада — дисплазия дистопированных яичек в сочетании; правая гонада — участок фиброзно-мышечной ткани с кистозно-расширенным протоком, жировой клетчатки по периферии (возможно, во время герниопластики в детстве правое яичко было удалено или частично удалено).
Послеоперационный период протекал без осложнений.
В качестве заместительной гормональной терапии (ЗГТ) после операции назначен эстриол (Овестин по 2 мг в день).
Динамическое наблюдение за пациенткой после операции:
8 месяцев после операции. Принимает в непрерывном режиме КОК (Марвелон по 1 таблетке 1 раз в сутки). На фоне терапии уровни ЛГ, ФСГ в пределах нормы; тестостерон 3,9 нмоль/л (норма у женщин 0,45—3,75 нмоль/л). При проведении сонографии органов малого таза патологических образований не выявлено.
3 года после операции. В качестве ЗГТ принимает эстрадиол (Дивигель 0,5 г 1 раз в 3 дня). Волосяной покров в подмышечных впадинах и на лобке отсутствует. Тестостерон — 29,7 нмоль/л (норма у женщин — 0,45—3,75 нмоль/л). При проведении сонографии органов малого таза патологических образований не выявлено.
Пациентка переезжает в Москву, к врачам не обращается, приезжая к родителям в Крым иногда приходит на прием.
5 лет после операции. Принимает 17-β эстрадиол (Эстрожель 1,25 г геля 1 раз в 3 дня). При проведении сонографии органов малого таза патологических образований не выявлено. Гормональная диагностика не проводилась. Молочные железы развиты за счет жировой ткани (рис. 2).
 Рис. 2. Эхографическая картина молочных желез у пациентки К., 2004 г.
Рис. 2. Эхографическая картина молочных желез у пациентки К., 2004 г.
В 2004 г. пациентка выходит замуж.
8 лет после операции. ЗГТ принимает в прежнем режиме. Объективно: рост — 170 см, вес — 60 кг. Фенотип женский. Телосложение астеническое. Волосяной покров в подмышечных впадинах и на лобке отсутствует. Тестостерон (ИФА) — 44,5 нмоль/л (норма у женщин 0,45—3,75 нмоль/л). При проведении УЗИ в области проекции «правых придатков» обнаружено овоидной формы образование, средней эхогенности, размерами 23×33×14 мм. (рис. 3). Рекомендован УЗИ контроль через 2—3 мес и исследование тестостерона.
 Рис. 3. УЗИ нижнего этажа брюшной полости: образование в области проекции «правых придатков» у пациентки К., 2005 г.
Рис. 3. УЗИ нижнего этажа брюшной полости: образование в области проекции «правых придатков» у пациентки К., 2005 г.
Через год. 9 лет после операции. Жалоб не предъявляет. Принимает 17-β эстрадиол (Эстрожель 1,25 г. 1 раз в 3 дня). Гормоны крови (ИФА): тестостерон 45,6 нмоль/л (норма для женщин старше 10 лет — 0,45—3,75 нмоль/л). УЗИ в области проекции «правых придатков» визуализируется овоидной формы образование, средней эхогенности, размерами 27×19 мм (рис. 4). Ставится вопрос о необходимости проведения оперативной лапароскопии, от которой пациентка отказывается.
 Рис. 4. УЗИ нижнего этажа брюшной полости: образование в области проекции «правых придатков» у пациентки К., 2006 г.
Рис. 4. УЗИ нижнего этажа брюшной полости: образование в области проекции «правых придатков» у пациентки К., 2006 г.
Через год. 10 лет после операции. Жалоб не предъявляет. Принимает Дивигель 0,5 г 1 раз в 3 дня. Тестостерон 47,4 нмоль/л (норма для женщин 0,45—3,75 нмоль/л) УЗИ в области проекции «правых придатков» показывает овоидной формы образование, средней эхогенности, размерами 29×21 мм (рис. 5). От предложенной лечащим врачом оперативной лапароскопии с учетом объемного образования в области малого таза отказывается (пациентка проходила осмотры сначала в Симферополе до 2004 г., затем в Москве по настоящее время, по месту работы хирурга гинеколога, проводившего оперативную лапароскопию в 1997 г.).
 Рис. 5. УЗИ нижнего этажа брюшной полости: образование в области проекции «правых придатков» у пациентки К., 2007 год.
Рис. 5. УЗИ нижнего этажа брюшной полости: образование в области проекции «правых придатков» у пациентки К., 2007 год.
12 лет после операции. Жалоб не предъявляет. Принимает ЗГТ в прежнем режиме. УЗИ: в области проекции «правых придатков» овоидной формы образование, средней эхогенности, размерами 32×28 мм. Отмечена тенденция к увеличению образования в сравнении с предыдущими наблюдениями. Тестостерон не определяли. В категоричной форме ставится лечащим врачом вопрос о проведении оперативной лапароскопии с целью диагностики и удаления, визуализируемого на УЗИ образования справа.
23 декабря 2008 г. проведена вторая лапароскопия в Москве: справа забрюшинно, тотчас ниже внутреннего отверстия пахового канала определяется образование размером 25×35 мм железистой структуры. Выполнено удаление образования справа. Окончательное гистологическое заключение: ткань яичка. Послеоперационное течение без осложнений. Выписана через сутки после операции.
1 год и 3 мес после повторной операции (2010 г.). Получает 17-β эстрадиол (Эстрожель 1,25 г 1 раз в 3 дня). Тестостерон 0,55 нмоль/л. УЗИ — в малом тазу патологических образований не выявлено (рис. 6).
 Рис. 6. Отсутствие образований в «малом тазу» у пациентки К. УЗ-исследование, 2010 г.
Рис. 6. Отсутствие образований в «малом тазу» у пациентки К. УЗ-исследование, 2010 г.
Живет и активно работает на престижной работе. Второй раз вышла замуж. Хочет создать полноценную семью.
В 2013 г. проведена программа ВРТ — донорство ооцитов, сперма мужа, суррогатное материнство. Наступила беременность двойней. Стала мамой двоих детей.
5 лет и 4 мес после второй операции (март 2014 г.). Прекрасно сложена, внешность «фотомодели». Рост — 171 см, вес — 64 кг (соблюдает диету с 2013 г., снизила вес на 8 кг). Жалобы на некоторую утомляемость к вечеру. Тестостерон 0,45 нмоль/л (не превышает нормы для женщин). Получает Эстрожель 1,25 г 1 раз в 3 дня. Уровень эстрадиола крови менее 37 пг/мл. Доза Эстрожеля увеличена до 2,5 г ежедневно из соображений профилактики остеопороза. Рекомендовано провести денситометрию, контроль уровня эстрадиола, тестостерона через 6 мес.
Данные динамического наблюдения показывали рост концентрации тестостерона уже в первые годы после первой операции, что свидетельствовало о функционировании не полностью удаленной гонады в 1997 г. (очаг гиперпродукции андрогенов), и что подтвердилось через 8 лет при ультразвуковом контроле.
Отдельную проблему, которой также пришлось заниматься гинекологу, представляло психологическое состояние пациентки. Родители не сообщали дочери ее истинный пол. После первой операции на консультативных приемах (до замужества) на вопросы об отсутствии менструаций пациентке объяснили, что проведение операции связано с «изменениями в яичниках», которые пришлось оперировать и это привело к тому, что у нее больше не будет менструации, разъяснена необходимость принимать ЗГТ в постоянном режиме. На тот момент вопрос о репродуктивной функции не стоял. Позже, через 5—7 лет после операции и замужества, пациентке сказали о невозможности для нее беременности и родов. Было объяснено, что возможен вариант ВРТ с использованием донорских ооцитов и программы суррогатного материнства.
После рождения детей пациентка впервые задала вопрос о том, как называется ее истинное состояние. Ей было сообщено о ее генетическом заболевании — синдроме тестикулярной феминизации, кариотипе 46XY. Пациентка задала много вопросов относительно своего состояния и среди них самый трудный для понимания и объяснения: является ли она мужчиной? На что она получила ответ, что кариотип 46XY еще не определяет, кто она есть на самом деле». Позже родительское воспитание девочкой, создание семьи и самое главное, тот факт, что она стала мамой, позволили ей утвердиться в своей самоидентификации как женщине.
Выражаю признательность врачу — хирургу Панину Александру Викторовичу (в 2008 г. зав. эндоскопическим отделением ЦПСиР, Москва), который провел пациентке повторное оперативное вмешательство.
Источник

Синдром тестикулярной феминизации (Синдром Морриса) – наследственное заболевание, характеризующееся развитием женских половых признаков при наличии мужского кариотипа (XY). Симптомы этой патологии обладают широким спектром выраженности – от фенотипически полноценной женщины до полноценного мужчины с целым рядом промежуточных вариантов, на чем построена классификация данного состояния. Диагностика синдрома тестикулярной феминизации производится на основании результатов гинекологического или урологического осмотра, ультразвуковых исследований органов малого таза, изучения кариотипа и молекулярно-генетических анализов. Специфического лечения этого заболевания не существует, для улучшения качества жизни больных применяются разнообразные хирургические вмешательства.
Общие сведения
Синдром тестикулярной феминизации – генетическое заболевание, поражающее лиц с мужским кариотипом и приводящее к развитию у них разнообразных по выраженности женских половых признаков вплоть до полной феминизации. Нарушения подобного типа регистрировались давно, сразу после открытий хромосомных основ пола и исследований кариотипа, но данное заболевание впервые описал американских гинеколог Джон Моррис в 1953 году. Он изучил известных на тот момент (более 80) пациентов с мужским псевдогермафродитизмом и выявил ряд семейных случаев, что позволило ему определить синдром тестикулярной феминизации как X-сцепленное рецессивное наследственное заболевание. В некоторых источниках эту патологию можно найти под названием синдрома Морриса. В настоящий момент установлено, что встречаемость синдрома тестикулярной феминизации составляет примерно 1 случай на 20-60 тысяч новорожденных мужского пола, однако частота носительства патологического гена среди женщин неизвестна. Данное заболевание является причиной почти 20% случаев мужского псевдогермафродитизма и обуславливает заметную долю от всех разновидностей первичной аменореи.
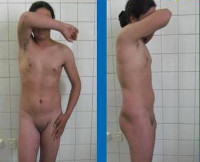
Синдром тестикулярной феминизации (Морриса)
Причины синдрома тестикулярной феминизации
Исследования в области современной генетики позволили выявить молекулярно-генетические механизмы синдрома тестикулярной феминизации – таковыми оказались мутации гена AR, локализованного на X-хромосоме. Продуктом экспрессии данного гена является белок-рецептор к тестостерону и его метаболитам (в основном, дигидротестостерону), наличие которого и обеспечивает реакцию организма на мужские половые гормоны. На сегодняшний день выявлено более 300 различных типов мутаций гена AR, приводящих к синдрому тестикулярной феминизации. Все они имеют рецессивный характер, поэтому женщины (по кариотипу), имеющие гомологичную Х-хромосому, могут выступать только в качестве носителя и передавать это заболевание своим сыновьям с вероятностью 50%.
Из-за нарушений в структуре гена AR кодируемый им белок-рецептор получается дефектным, в зависимости от типа мутаций его реакция на воздействие тестостерона и сходных с ним соединений изменяется. При наиболее тяжелом течении синдрома тестикулярной феминизации рецептор становится совсем неспособным взаимодействовать с мужскими половыми гормонами, поэтому клетки организма теряют к ним чувствительность, сохраняя ее к эстрогенам (в основном, к эстрадиолу). Это приводит к развитию организма полностью по женскому типу при наличии и функционировании яичек. Некоторые другие типы синдрома тестикулярной феминизации обусловлены сохранением чувствительности к тестостерону, но на крайне низком уровне, что становится причиной широкого спектра клинических проявлений. Активность клеток Сертоли, выделяющих тестостерон, при любой форме синдрома тестикулярной феминизации сохраняется и может быть даже несколько повышена.
Крайняя форма синдрома тестикулярной феминизации имеет следующий патогенез – еще на этапе эмбрионального развития из-за отсутствия влияния тестостерона по причине нечувствительности к нему организма происходит формирование женских половых органов. Образуется «слепое» влагалище, расщепленная мошонка становится большими половыми губами, зачатки фаллоса – клитором. На этапе полового созревания также полностью отсутствует реакция клеток на тестостерон, поэтому при синдроме тестикулярной феминизации (полный тип) ткани организма испытывают влияние только женских половых гормонов. Данное обстоятельство приводит к формированию выраженных вторичных половых признаков – пышной груди, «модельных» форм, распределению жировой клетчатки по женскому типу, тонкому голосу. Однако менструации и, тем более, возможность беременности в этом случае полностью исключены, так как у больных отсутствует матка и необходимые для менструального цикла гормональные факторы.
Классификация и симптомы синдрома тестикулярной феминизации
Синдром тестикулярной феминизации характеризуется обширным спектром выраженности проявлений и разновидностей заболевания, для их систематизации была разработана специальная классификация данной патологии. В первую очередь, все формы этого состояния делятся на две группы – полные и неполные. Полная форма синдрома тестикулярной феминизации возникает при полном отсутствии чувствительности организма к тестостерону и характеризуется полноценным женским фенотипом. Обычно рождается здоровая девочка, не имеющая, на первый взгляд, каких-либо отклонений в развитии. С началом полового созревания такие больные нередко становятся весьма красивыми (с «модельной внешностью») из-за превалирующего влияния эстрогенов. Однако при этом у них отсутствует оволосение в области подмышечных впадин и на лобке, не наступает менархе – зачастую именно аменорея в возрасте 14-16 лет становится поводом для обращения к врачу, где в рамках гинекологического исследования и выявляется синдром тестикулярной феминизации.
Неполная форма синдрома тестикулярной феминизации характеризуется намного более разнообразной клинической картиной. Как правило, причиной этой формы патологии выступают дефекты рецепторов к тестостерону, не приводящие к полной потере чувствительности, а только к ее значительному снижению или нарушению. Согласно классификации, принятой в 1996 году, выделяют пять основных форм или степеней неполного синдрома тестикулярной феминизации:
1. 1-я степень (мужской тип) характеризуется типично мужским фенотипом без каких-либо отклонений. В крайне редких случаях может наблюдаться высокий голос и признаки гинекомастии в подростковом возрасте. При этом практически всегда нарушены процессы сперматогенеза, поэтому у больных данным типом синдрома тестикулярной феминизации наблюдается мужское бесплодие.
2. 2-я степень (преимущественно мужской тип) – данный вариант заболевания проявляется более выраженными нарушениями вирилизации и формирования половых органов, хотя фенотипически больные являются мужчинами. У них часто обнаруживается гипоспадия, возможно развитие микропениса или сочетание этих признаков. Пациенты с этим вариантом синдрома тестикулярной феминизации нередко имеют гинекомастию и неравномерное отложение подкожной жировой клетчатки.
3. 3-я степень (амбивалентный тип) – характеризуется выраженным уменьшением полового члена, который становится похожим на клитор. Мошонка разделена настолько, что ее половины напоминают большие половые губы, часто наблюдается гипоспадия, крипторхизм. При этом типе синдрома тестикулярной феминизации также отмечается расширение таза, гинекомастия, относительно узкие плечи.
4. 4-я степень (преимущественно женский тип) – при этой форме синдрома тестикулярной феминизации больные являются женщинами по своим фенотипическим признакам, однако их клитор часто гипертрофирован, урогенитальный синус формирует короткое слепое влагалище. Нередко при этом варианте заболевания наблюдается такое нарушение, как сращение половых губ.
5. 5-я степень (женский тип) – больные этой формой синдрома тестикулярной феминизации фенотипически являются женщинами, практически никаких признаков вирилизации у них не обнаруживается за исключением несколько увеличенного размера клитора. В период полового созревания он может увеличиваться еще больше, достигая размеров микропениса.
У больных синдромом тестикулярной феминизации также часто возникают паховые грыжи из-за нарушения проходимости яичек по паховому каналу. Осложнениями гипоспадии могут быть разнообразные воспалительные процессы в мочевыделительной системе (уретриты, пиелонефриты). Крипторхизм грозит в будущем злокачественным перерождением тканей яичка, что является наиболее тяжелым осложнением данного заболевания.
Диагностика и лечение синдрома тестикулярной феминизации
Основными методами диагностики этого состояния являются гинекологический или урологический осмотр, ультразвуковое исследование, изучение наследственного анамнеза, молекулярно-генетический анализ и определение уровня половых гормонов. Раньше всего удается диагностировать неполные формы синдрома тестикулярной феминизации 2-5 степеней, так как нарушения в строении половых органов заметны уже при рождении ребенка. При осмотре врач-неонатолог может заподозрить наличие генетического заболевания и назначить дополнительные уточняющие исследования. Сочетание таких пороков развития с нормальным или даже повышенным уровнем тестостерона в крови и крипторхизмом говорит в пользу наличия синдрома тестикулярной феминизации.
Неполная форма заболевания 1 степени и полный тип патологии в большинстве случаев определяются намного позднее. Поводом для обращения мужчин (по своим фенотипическим признакам) с синдромом тестикулярной феминизации к специалистам часто служит подозрение на бесплодие. Анализ спермы при этом выявляет азооспермию, в анамнезе больного присутствует крипторхизм (нередко устраненный оперативным путем), паховые грыжи. Подтвердить наличие синдрома тестикулярной феминизации в этом случае возможно только при помощи генетической диагностики. Полная форма заболевания чаще всего диагностируется в 14-15 лет, когда девушки обращаются к специалисту из-за отсутствия менструаций. При гинекологическом осмотре у них определяется «слепое», закрытое в верхней трети влагалище, ультразвуковые исследования обнаруживают отсутствие матки и ее придатков. При этом могут выявляться семенники, находящие на различных этапах спуска в мошонку – располагающиеся в пределах брюшной полости, пахового канала, изредка в половых губах.
Концентрация тестостерона при синдроме тестикулярной феминизации соответствует уровню здорового мужчины или даже несколько превышает его. При этом количество эстрогенов не достигает нижней отметки нормы для девушек аналогичного возраста. Изучение наследственного анамнеза может обнаружить признаки Х-сцепленной передачи заболевания. Молекулярно-генетическая диагностика синдрома тестикулярной феминизации производится врачом-генетиком при помощи автоматического секвенирования последовательности гена AR или других методик. Возможно также выявление носительства патологической формы гена у здоровых женщин и пренатальная диагностика этого заболевания.
Лечение синдрома тестикулярной феминизации полного типа часто ограничивается простым удалением семенников с последующей коррекцией гормонального фона (при необходимости). Это требуется для профилактики семиномы и других форм злокачественного перерождения тканей яичка. Такие больные, с детства воспитывающиеся как девочки, после постановки диагноза могут нуждаться в психологической помощи. Терапия синдрома тестикулярной феминизации неполного типа характеризуется большим количеством пластических операций для воссоздания привычного вида половых органов, груди, оптимального функционирования мочевыделительной системы. Больные с любой формой этого заболевания бесплодны, что также зачастую требует помощи психологов.
Прогноз и профилактика синдрома тестикулярной феминизации
Прогноз синдрома тестикулярной феминизации относительно выживаемости больных довольно благоприятный – при полной форме патологии больные могут прожить нормальную жизнь женщины, обладая при этом мужским кариотипом. Неполные формы при правильно проведенной хирургической коррекции нарушений и пороков развития зачастую также не приводят к тяжелым и жизнеугрожающим осложнениям. Особенно высокую угрозу при синдроме тестикулярной феминизации представляет рак яичек в случае крипторхизма, поэтому его необходимо устранять – выводом семенников в мошонку (при мужском фенотипе) или удалением желез (в случае женского фенотипа). Профилактика синдрома тестикулярной феминизации производится посредством генетического выявления носительства патологического гена при отягощенном наследственном анамнезе и в случае подтверждения – пренатальной диагностикой этой патологии.
Источник
