Антифосфолипидный синдром в акушерской практике
В настоящее время все большее внимание уделяется изучению роли иммунопатологических процессов в патогенезе акушерских осложнений и перинатальной патологии.
При решении этой проблемы особое значение приобретает исследование влияния аутоиммунных реакций к фосфолипидам — универсальным компонентам важнейших структур организма — клеточных мембран и митохондрий.
В клинике невынашивания беременности доказана роль антифосфолипидных антител (АФА) в патогенезе неразвивающихся беременностей, задержке внутриутробного развития плода, вплоть до антенатальной гибели плода во 2-м и 3-м триместрах.
Во всех вышеуказанных случаях предвестником осложнений является развитие хронический формы ДВС синдрома.
С ранних сроков беременности отмечается повышение функциональной активности тромбоцитов, снижается белковосинтезирующая и гормональная функция плаценты.
При отсутствии адекватной терапии присоединяется гиперкоагуляция в плазменном звене гемостаза, что ведет к нарастанию нарушений в микроциркуляторном русле, развитию плацентарной недостаточности, хронической гипоксии и гибели плода.
Согласно литературным данным, без проведения лечения гибель эмбриона/плода наблюдается у 90—95% женщин, имеющих АФА.
Впервые способность сывороток больных реагировать с фосфолипидными экстрактами была установлена в 1906 г. при разработке серологических методов диагностики сифилиса — реакции Вассермана.
В начале 50-х годов было показано, что положительные серологические реакции могут выявляться у больных с аутоиммунными, хроническими воспалительными и гематологическими заболеваниями при отсутствии каких-либо признаков сифилитической инфекции. Это послужило основанием для формирования представления о ложноположительной реакции Вассермана.
Так, в тот же период было обнаружено, что сыворотка больных СКВ способна in vitro подавлять фосфолипидзависимые коагуляционные реакции, не влияя на активность специфических факторов свертывания крови.
Циркулирующий в крови сывороточный ингибитор, названный «волчаночным антикоагулянтом», представляет собой популяцию антител, относящихся к различным классам иммуноглобулинов, специфически реагирующих с фосфолипидным компонентом протромбиназы активаторного комплекса.
Эти данные позволили предположить, что своеобразная активность ВА и развитие ложноположительной реакции Вассермана обусловлены продукцией антител к фосфолипидам, в частности к кардиолипину, являющемуся основным антигеном РВ и входящему в состав комплекса прокоагулянтных фосфолипидов.
В начале 60-х годов в процессе клинических наблюдений за больными, в сыворотке которых обнаруживали ВА, E.W. Bowie и соавт. обратили внимание на парадоксальный факт — присутствие ВА ассоциируется не с кровоточивостью, как это можно было ожидать с учетом способности антител in vitro удлинять время свертывания крови, а с частым развитием тромботических осложнений.
Это наблюдение привлекло внимание к возможному участию иммунологических механизмов, в частности аутоиммунных реакций в нарушении свертывания крови.
В процессе клинических наблюдений за больными СКВ, в сыворотке крови которых обнаруживали ВА, антитела к кардиолипину, было установлено, что присутствие этих антител часто ассоциируется с развитием своеобразного довольно четко очерченного симптомокомплекса, проявляющегося венозным и артериальным тромбозом различной локализации, акушерской патологией, тромбоцитопенией, неврологической и сосудистой патологией, причем перечисленные проявления часто выходили на первый план в клинической картине заболевания и определяли его тяжесть.
Обобщая накопленные данные, GR,VHughes и соавт. в 1986 г. впервые высказали мнение о существовании особого синдрома, в основе которого лежит развитие аутоиммунной реакции к широко распространенным фосфолипидным детерминантам, присутствующим на мембранах тромбоцитов, клеток эндотелия сосудов, клеток нервной ткани.
Этот синдром, впервые описанный в рамках СКВ, был вначале назван «антикардиолипиновым» синдромом.
В дальнейшем было доказано первостепенное значение гетерогенной группы антител к фосфолипидам в развитии нарушений системы гемостаза и других клинических проявлений, в связи с чем те же авторы предложили более общее определение «антифосфолипидный синдром» (АФС). Позже оказалось, что различные признаки синдрома могут развиваться не только при СКВ, но и при отсутствии достоверных клинических и лабораторных признаков этого заболевания. В настоящее время АФС изучается учеными различных медицинских специальностей: невропатологами, акушерами, кардиологами, сосудистыми хирургами, ревматологами.
В последние годы разработаны и стандартизированы чувствительные и специфичные радиоиммунологический и иммуноферментный методы определения антител к «чистым» фосфолипидным антигенам, что позволило провести широкие исследования распространенности антител при различных заболеваниях человека.
В настоящее время считается общепризнанным, что антитела к фосфолипидам представляют собой гетерогенную группу антител, различающихся по иммунохимической специфичности. Это в первую очередь связано с существованием нескольких классов мембранных фосфолипидов, различных по структуре и иммуногенности.
Антитела, содержащиеся в сыворотке больных, реагируют с различными фосфолипидными антигенами: фосфатидилхолином, фосфатидилэтаноламином, фосфатидилсерином, фосфатидилинозитолом.
Данная группа антител, называемая «волчаночный антикоагулянт» (ВА), удлиняет in vitro фосфолипидзависимые коагуляционные реакции, воздействуя на Са++ зависимое связывание протромбина и фактора Ха, Va в процессе сборки протромбинактиваторного комплекса (протромбиназы).
В отдельную группу выделены антитела к кардиолипину, присутствующему на внутренней мембране митохондрий. Антикардиолипиновые антитела (АКЛ) определяются иммунологическими тестами на основе кардиолипина. АКЛ и ВА обладают не одинаковой иммунологической активностью. Можно полагать, что антикардиолипиновые антитела являются чувствительным, но в отличие от ВА не специфичным серологическим маркером АФС, так как встречаемость АКЛ при различных заболеваниях значительно выше, чем частота развития АФС. Однако выявление АКЛ может иметь и прогностическое значение, указывая на возможность развития АФС.
Результаты недавно проведенных исследований свидетельствуют о возможных перекрестных реакциях антител к фосфолипидам с другими аутоантигенами, в частности с ДНК, Fc фрагментом IgG, мембраной тромбоцитов, эндотелия сосудов, эритроцитов.
Аутоантитела к фосфолипидам могут образовываться под влиянием эндогенных и экзогенных стимулов.
Антителообразование под действием экзогенных стимулов (наиболее часто инфекционных агентов) носит преходящий характер, не вызывает тромбоэмболических нарушений и не требует терапии. При повторном исследовании через 6—8 недель ВА в венозной крови не выявляется.
Антитела, образующиеся под воздействием эндогенных стимулов, связаны с нарушением эндотелиального гемостаза, их концентрация в сыворотке высокая, персистирующая, присутствует патогенетическая связь с АФС.
В клинической практике для определения антител к фосфолипидам используют несколько взаимодополняющих подходов. Для выявления ВА наиболее распространены функциональные тесты, основанные на подавлении in vitro сывороткой больных фосфолипидзависимых коагуляционных реакций. Определение АКЛ производится радиоиммунологическим или иммуноферментным методом.
Однако с клинической точки зрения для диагностики антифосфолипидного синдрома важной представляется комплексная оценка анамнестических, клинических и лабораторных данных, что позволяет правильно оценить риск осложнений и своевременно назначить необходимую терапию.
Для классического симптомокомплекса АФС характерно:
— выявление ВА в венозной крови;
— наличие в анамнезе у женщины в молодом возрасте до 45 лет венозных или артериальных тромбозов, в частности инфарктов, инсультов, преходящих нарушений мозгового кровообращения, тромбоэмболии легочной артерии, тромбоза сосудов сетчатки;
— тромбоцитопения, которая может проявляться клинически или быть бессимптомной;
— наличие в анамнезе потерь плода на разных сроках беременности.
Частота встречаемости АФС среди пациенток с привычным невынашиванием беременности составляет 27—42%. В популяции по данным американских авторов частота АФС составляет 5%.
Различают первичный АФС и вторичный при наличии какого-либо системного аутоиммунного заболевания. Предположить развитие АФС можно при наличии привычного невынашивания беременности неясного генеза, аутоиммунных заболеваний, при раннем развитии гестоза, гипотрофии плода в течение предыдущих беременностей, тромбоцитопении неясной этиологии, ложноположительных реакциях Вассермана.
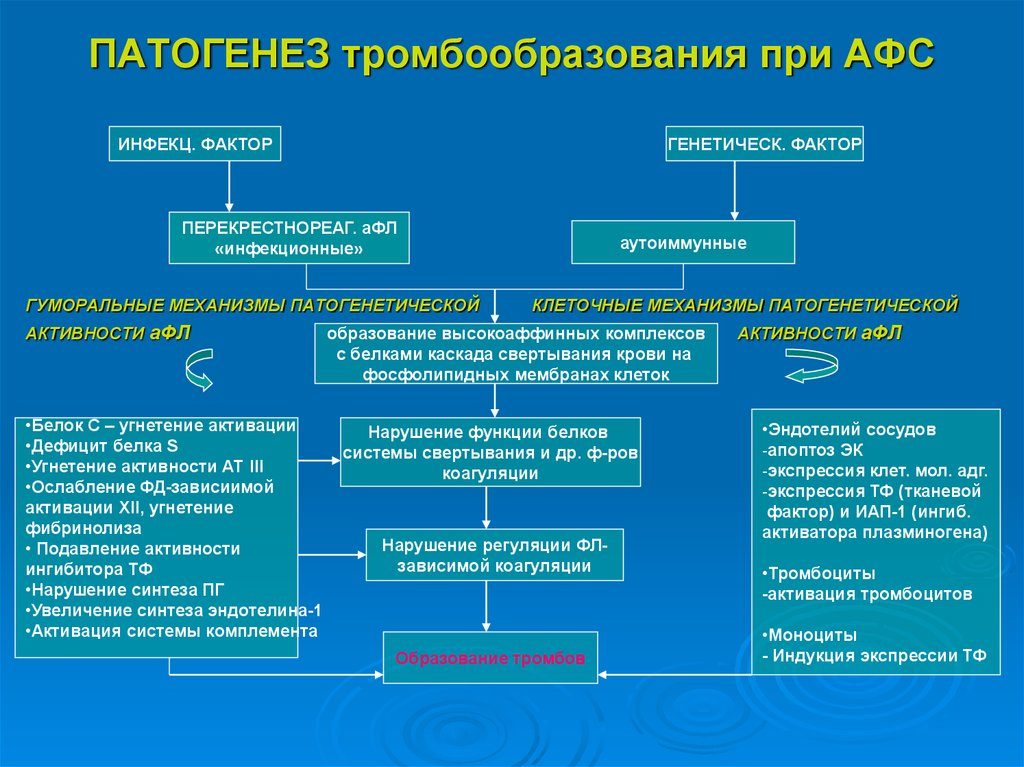
При истинном аутоиммунном процессе патогенетическое действие антифосфолипидных антител реализуется через развитие хронической формы ДВС синдрома. Существует множество теорий, объясняющих роль АФА в развитии коагулопатии.
Доказано, что ВА in vitro подавляет активность белков С и S, а также тромбомодуллина, который является кофактором эндотелия. Активированный белок С обладает высокой антикоагулянтной активностью, вызывая деградацию факторов Va и Villa в присутствии фосфолипидов и белка S. Недостаточность белков С и S приводит к развитию тромбозов, особенно в системе микроциркуляции.
L.O. Carreras и J.G. Vermylen (1982) показали, что ВА in vitro, культивируемыми эндотелиальными клетками и миометрием, подавляют синтез простациклина. Дефицит простациклина, обладающего мощным сосудорасширяющим и антиагрегатным действием, также может являться одной из причин коагулопатии.
Учитывая осложненное течение беременности, послеродового периода, увеличение риска антенатальных и перинатальных потерь у женщин, страдающих АФС, чрезвычайно важной представляется проблема обследования данного контингента больных вне беременности, своевременная диагностика и коррекция гемостазиологических, метаболических и иммунных нарушений, динамический контроль на протяжении всей беременности и послеродового периода.
В случаях выявления ВА вне беременности и при наличии в анамнезе потерь плода, тромбозов и других клинических проявлений АФС считается целесообразным назначение глюкокортикоидной терапии. Наиболее эффективно назначение преднизолона уже во II фазе предполагаемого фертильного цикла в начальной дозе 5 мг. Доза преднизолона или метипреда должна быть адекватной, то есть подавлять аутоиммунные реакции. Если доза в 5 мг недостаточна, то она увеличивается на 2,5 мг до исчезновения ВА, но не более 10—15 мг.
Стероидная терапия должна быть длительной на протяжении всей беременности и 10—15 дней послеродового периода с последующей постепенной отменой. Особое внимание уделяется коррекции гемостазиологических нарушений. При гиперфункции тромбоцитов назначаются антиагреганты — курантил 75—150 мг в сут. за 1 ч до еды, трентал 300—600 мг или теоникол 0,015 мг 3 раза в день во время еды. Контроль гемостазиологических показателей целесообразно осуществлять 1 раз в 2 недели, при необходимости — ежедневно.
В случаях когда патологическая активность тромбоцитов сочетается с гиперкоагуляцией в плазменном звене и появлением маркеров внутрисосудистого свертывания (ПДФ, РКМФ, комплекс тромбин-антитромбин III), а также снижением антитромбина III и протеина С патогенетически обосновано раннее применение малых доз гепарина (15000 ЕД в сутки подкожно). Возможно применение малых доз гепарина — 10000 ЕД в сутки в/в капельно на 400 мл реополиглюкина.
Длительность гепаринотерапии определяется степенью выраженности гемостазиологических нарушений.
Назначение гепарина позволяет стабилизировать параметры хронометрической коагуляции, вызвать лизис фибриновых сгустков, предотвратить инфаркты в плацентарной ткани, улучшить фетоплацентарный кровоток и предупреждает развитие тромбоэмболических нарушений у беременной.
Возможно также назначение малых доз аспирина 100 мг в сутки.
Несмотря на выраженный положительный эффект гепаринотерапии, у ряда пациенток отмечается толерантность к препарату, а в некоторых случаях аллергическая реакция в виде покраснения, отека, зуда в местах инъекций.
В связи с этим приобретает особую актуальность использование эфферентных методов терапии, в частности плазмафереза.
Плазмаферез может быть использован как в качестве подготовки к беременности, так и во время беременности. Применение данного метода позволяет нормализовать реологические свойства крови, снизить гиперкоагуляцию, уменьшить дозу кортикостероидных препаратов и гепарина, что особенно важно при плохой их переносимости.
Под действием плазмафереза происходит деблокирование естественных систем детоксикации, изменение направленности иммунного ответа и повышается чувствительность к медикаментозным веществам. Плазмаферез можно проводить в дискретном или непрерывном режиме с использованием в качестве плазмозамещающих растворов кристаллоидных, коллоидных и белковых препаратов.
Процедуру целесообразно повторить 3 раза с интервалами в 2 дня. Объем удаляемой плазмы за 1 сеанс составляет 30% объема циркулирующей плазмы (600—900 мл).
Для профилактики тромбообразования в/в вводится гепарин в дозе 5—10 тысяч ед. Соотношение объема удаляемой плазмы к объему плазмозамещающих растворов должно быть вне беременности 1:1,2, во время беременности 1:2.
Необходимость повторения курса процедур определяется индивидуально в зависимости от клинических и лабораторных данных.
По нашим данным, после сеансов плазмафереза происходит улучшение гемостазиологических показателей — нормализация параметров в плазменном и тромбоцитарном звене, снижение уровня АФА в циркулирующей крови, нормализация биохимических показателей, в том числе кислотно-основного состояния, транспорта кислорода, восстановление активности иммунокомпетентных клеток
Таким образом, применение плазмафереза является эффективным методом лечения у больных АФС и может быть использован как в качестве базовой терапии, так и в комплексе с другими медикаментозными средствами.
Помимо мониторинга гемостазиологических показателей необходим контроль за состоянием фетоплацентарной системы. Особую ценность приобретает ультразвуковая допплерометрия, которая проводится с 24 недель с интервалом 3—4 недели до родоразрешения. Допплерометрия позволяет своевременно диагностировать снижение фетоплацентарного кровотока и служит критерием эффективности проводимой терапии.
Для лечения плацентарной недостаточности у пациенток с АФС используется в/в капельное введение растворов актовегина, инстенона, эссенциале-форте, альвезина, а также пероральный прием троксевазина, эссенциале.
Данные КТГ, информативные с 34 недель беременности, также позволяют оценить состояние плода и способствуют выбору сроков и способов родоразрешения.
В родах необходим тщательный кардиомониторный контроль в связи с наличием хронической внутриутробной гипоксии плода той или иной степени выраженности, а также повышенного риска отслойки нормально расположенной плаценты, развития острой в/у гипоксии плода на фоне хронической.
Желателен контроль гемостазиограммы непосредственно перед родами или в родах для предотвращения кровотечений в III и в раннем послеоперационном периодах.
Особое значение приобретает наблюдение за состоянием родильниц, т.к. именно в послеродовом периоде возрастает риск тромбоэмболических осложнений. Стероидная терапия продолжается в течение двух недель с постепенной отменой. Целесообразно проводить контроль системы гемостаза на 3 и 5 сутки после родов. При выраженной гиперкоагуляции необходим короткий курс гепаринотерапии — 10 дней 10—15 тыс. ЕД в сутки подкожно, назначение аспирина 100 мг в течение месяца.
Родильнице рекомендуется диета с ограничением продуктов, повышающих потенциал свертывания крови и исследование гемостаза 1 раз в 6 мес.
Таким образом, своевременная диагностика, подготовка и рациональное ведение беременности у женщин с АФС с использованием как медикаментозных, так и эфферентных методов терапии уменьшает риск осложнений во время беременности и способствует рождению доношенных жизнеспособных детей.
В.Н. Кулаков, В.Н. Серов, A.M. Абубакирова, Т.А. Федорова
Опубликовал Константин Моканов
Источник
Несмотря на то что клинические рекомендации по диагностике, лечению антифосфолипидного синдрома разработаны ревматологами, к акушерству он имеет прямое отношение. Антифосфолипидный синдром при беременности приводит к привычному невынашиванию, что влечет за собой бездетность пары.
Что это за болезнь

Антифосфолипидный синдром, или АФС – это патология, которая характеризуется повторяющимися тромбозами венозного, артериального, микроциркуляторного русла, патологией беременности с потерей плода и синтезом антифосфолипидных антител (афла): кардиолипиновых антител (аКЛ) и/или волчаночного антикоагулянта (ВА), и/или антител к бета2-гликопротеин Ⅰ. АФС – вариант часто приобретенной тромбофилии.
Код по МКБ 10 пересмотра – Д68.8.
Основой патогенеза антифосфолипидного синдрома является атака антителами мембран клеток. Чаще всего антифосфолипидный синдром развивается у женщин – в 5 раз чаще, чем у мужчин.
Манифестация синдрома происходит возникновением тромбозов, невынашиванием беременности. Часто до развития гестации женщины не подозревали о наличии этой патологии и присутствии антител в крови.
Классификация
Существует несколько вариантов антифосфолипидного синдрома. Основная классификация их такова:
- Первичный – связан с наследственными дефектами гемостаза.
- Вторичный АФС возник на фоне аутоиммунных болезней (ревматоидный артрит, системная красная волчанка), васкулитов, органоспецифичных патологий (сахарный диабет, болезни Крона), онкологических процессов, лекарственного воздействия, инфекций (ВИЧ, сифилис, малярия), при конечной стадии почечной недостаточности.
- Другие варианты АФС:
- серонегативный
- катастрофический
- другие микроангиопатические синдромы (ДВС-синдром, HELLP).
Причины невынашивания беременности

Патогенез развития акушерской патологии при АФС.
Доказано влияние АФС в развитии таких осложнений беременности:
- бесплодие неясного генеза;
- ранние преэмбриональные потери;
- неудачные ЭКО;
- выкидыши на разных сроках;
- внутриутробная гибель плода;
- послеродовая гибель плода;
- синдром задержки развития плода;
- преэклампсия и эклампсия;
- тромбозы во время беременности и после родов;
- пороки развития плода.
В послеродовом периоде у ребенка также возникают последствия антифосфолипидного синдрома: тромбозы, нейроциркуляторные расстройства с формированием аутизма в будущем. 20% детей, рожденных от матерей с АФС, в крови присутствуют антифосфолипидные антитела без симптомов, что говорит о внутриутробной передаче аФЛ.
Патогенетической основой развития всех проявлений АФС при беременности является плацентарная децидуальная васкулопатия, что вызывается недостатком продукции простагландина, тромбозами плаценты и нарушением механизма имплантации. Все эти механизмы препятствуют беременности.
Критерии диагноза
Выделяют критерии, по которым устанавливается диагноз «Антифосфолипидный синдром». Среди клинических критериев выделены следующие:
- Сосудистый тромбоз любой локализации: как венозный, так и артериальный, подтвержденный визуальными методами исследования. При использовании гистологического исследования в биоптатах должны отсутствовать признаки воспаления сосудистой стенки.
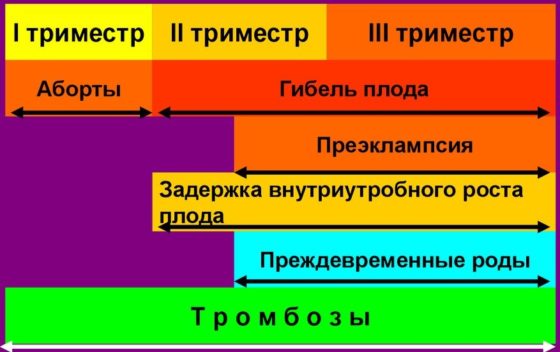
- Осложнения беременности:
- один или более эпизод гибели нормально развивающегося плода после 10 недель гестации или
- один или больше эпизодов преждевременных родов до 34 нед из-за значительной преэклампсии, эклампсии, плацентарной недостаточности или
- три или больше случаев подряд спонтанных абортов в сроке менее 10 недель, при отсутствии патологий анатомии матки, генетических мутаций, половых инфекций.
Лабораторные критерии таковы:
- В крови выявлены антитела к кардиолипину иммуноглобулины классов G и M в средних и высоких титрах, по крайней мере, 2 раза за 12 месяцев.
- Антитела к b2-гликопротеину I классов G и/или M в средних или высоких титрах, по крайней мере, 2 раза за год.
- Определен волчаночный антикоагулянт ВА в плазме в 2 более лабораторных исследованиях в промежутке хотя бы 12 месяцев. Заподозрить наличие ВА в крови можно при увеличении АЧТВ в коагулограмме в 2 и более раза.
Высокопозитивным считается анализ на антитела – 60 МЕ/мл, среднепозитивный ответ – 20-60 МЕ/мл, низкопозитивный – менее 20 МЕ/мл.
Для постановки диагноза «Антифосфолипидный синдром» необходимо присутствие одного клинического и одного лабораторного критерия.
Симптомы

Основным симптомом антифосфолипидного синдрома является тромбоз. У женщин эта патология проявляется невынашиванием беременности. Кроме таких очевидных признаков, у женщин могут проявляться дополнительные клинические критерии:
- сетчатое ливедо;
- наличие в анамнезе мигреней, хореи;
- трофические язвенные дефекты нижних конечностей;
- эндокардит и прочее.
Очень тяжело протекает катастрофическая форма антифосфолипидного синдрома. Она сопровождается клиникой острой почечной недостаточности, респираторным дистресс-синдромом, печеночной недостаточностью, нарушением мозгового кровотока, тромбозом крупных сосудов, в том числе и легочной артерии. Без срочной помощь прожить с этой формой длительно невозможно.
Лечение
Лечением АФС занимаются многие специалисты: ревматологи, гематологи, акушеры и гинекологи, кардиологи, кардиохирурги и прочие.
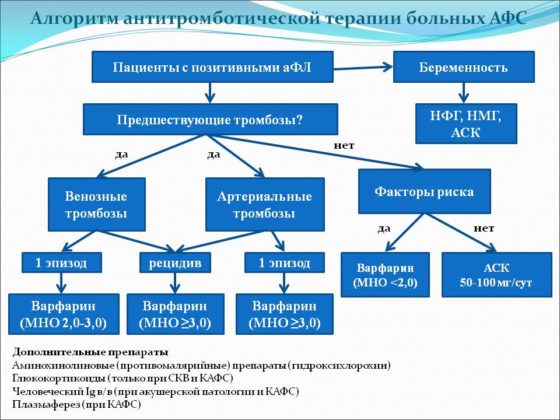
Первая группа пациентов
Пациенты, которые не имеют лабораторно выраженных признаков или клинических симптомов, не нуждаются в постоянном лабораторном контроле и непрерывной антикоагулянтной терапии. В этой группе пациентов проводят стандартную профилактику венозных тромбозов.
Вторая группа
У пациентов с высоким титром волчаночного антикоагулянта и/или антифосфолипидных антител более 10 МЕ/мл без тромбоза требуется назначение специфической профилактики – Аспирин в дозировке 75-100 мг один раз в день.
Третья группа
У этих людей результаты анализов на антитела отрицательны, но имеется подтвержденные случаи тромбоза и высокий риск их образования. У этих больных проводится лечение антикоагулянтами низкомолекулярного гепарина в терапевтических дозах. Сразу после постановки диагноза используют:
- Дальтепарин 100 МЕ/кг 2 раза в сутки;
- Надропарин 86 МЕ/кг или 0,1 мл на 10 кг 2 раза в день подкожно;
- Эноксапарин 1 мг/кг 2 раза в день подкожно;
- Со второго дня назначают Варфарин с 5 мг в сутки.
У пациентов этой группы проводят гепаринотерапию не менее 3 месяцев. В начале терапии выполняют контроль МНО каждые 4-5 дня для поддержания целевого значения в 2,0-3,0.
Четвертая группа
В эту группу входят люди, у которых тромбозы происходят на фоне повышенных титров волчаночного антикоагулянта и антифосфолипидного антитела. У этой категории больных назначается Варфарин и низкие доза (75-100 мг) Ацетилсалициловой кислоты. Пациенты с высоким уровнем риска должны получать пожизненно антикоагулянтную терапию.
Прегравидарная подготовка
Подготовка к беременности при АФС проводится в 2 последовательных этапа. На первом проводят оценку коагулограммы, определяют антигенный компоненты крови, удаляют и санируют инфекционные очаги.
Второй этап – это непосредственная подготовка к беременности и ее ведение. Для этого необходима антикоагулянтная терапия. Она проводится индивидуально в течение 1-2 менструальных циклов. Для этого нужно отнести женщину в одну из следующих групп:
- Серонегативный вариант АФС с наличием в анамнезе акушерских проявления синдрома. В сыворотке могут быть обнаружены только антитела к бета2-гликопротеину I. В этой группе проводят подготовку с помощью таких препаратов:
- один из препаратов низкомолекулярного гепарина 1 раз/сутки подкожно (дальтепарин (Фрагмин)120 антиХа МЕ/кг или эноксапарин (Клексан) 100 антиХа МЕ/кг;
- рыбий жир по 1-2 капсулы 3 раза/сутки;
- фолиевая кислота 4 мг/сутки;
- Если отсутствует волчаночный антикоагулянт, но присутствует АФЛА без тромбозов и акушерских клинических проявлений:
- при умеренном титре АФЛА назначается Аспирин 75-100 мг/сутки, а при развитии беременности он отменяется с заменой на дипиридомол 50-75 мг/сутки;
- при высоком и умеренном титре антифосфолипидного антигена комбинируют Ацетилсалициловую кислоту 75 мг/сутки и низкомолекулярный гепарин один раз в сутки подкожно;
- рыбий жир по 1-2 капсуле 3 раза в день;
- фолиевая кислота 4 мг/сутки.
- Если нет в крови волчаночного антикоагулянта, но есть в высоком или умеренном количестве антифосфолипидный антиген и имеется клиника тромбозов и акушерские осложнения:
- один из НМГ (Клексан, Фрагмин, Фраксипарин) 1 раз в сутки подкожно;
- Аспирин 75 мг/сутки с отменой его при развитии беременности и назначением Дипиридамола 50-75 мг/сутки;
- рыбий жир 1-2 капсулы 3 раза в день;
- фолиевая кислота 4 мг/сутки.
- В плазме женщины обнаружены АФЛА и определяется волчаночный антикоагулянт ВА от 1,5 до 2 усл.ед. До нормализации ВА следует воздержаться от беременности. Для нормализации ВА менее 1,2 усл.ед применяют:
- Клексан 100 антиХа МЕ/кг или Фрагмин 120 антиХа МЕ/кг один раз в сутки подкожно;
- рекомендован иммуноглобулин человеческий внутривенно 25 мл через день 3 дозы, повторяют введение препарата в 7-12 недель беременности, в 24 недели и последнее введение перед родами;
- после установления ВА в пределах нормы назначают Ацетилсалициловую кислоту 75 мг/сутки до наступления беременности;
- Клексан или Фрагмин один раз в день подкожно в прежних дозировках;
- рыбий жир 1-2 кап. 3 раза в день;
- фолиевая кислота 4 мг/кг.
- Если ВА в крови более 2 усл.ед, то зачатие откладывается минимум на 6-12 месяцев. Риск развития тромбоза у таких женщин очень велик. Целевое значение ВА – 1,2 усл.ед. Терапия проводится не менее 6 месяцев.
Лабораторная диагностика и обследование при планировании беременности обязательно включает такие показатели свертывания крови:
- тромбоциты – 150-400*109/л;
- фибриноген – 2-4 г/л;
- МНО – 0,7-1,1;
- продукты деградации фибриногена и фибрина – менее 5 мкг/мл;
- д-димеры – менее 0,5 мкг/мл;
- растворимые фибринмономерные комплексы должны отсутствовать;
- протеин С – 69,1-134,1%;
- антитромбин Ⅲ – 80-120%;
- агрегационная активность тромбоцитов с солью аденозиндифосфата – 50-80%, с гидрохлоридом адреналина – 50-80%;
- антикардиолипиновые антитела – все классы иммуноглобулинов менее 10 МЕ/мл;
- ВА – отрицательный или менее 0,8-1,2 усл.ед;
- гипергомоцистеинемия – отрицательная;
- мутация FV (Leiden) гена, ответственного за синтез фактора V, или мутация G20210A гена, ответственного за синтез фактора II – отсутствует;
- общий анализ мочи для определения гематурии;
- контроль за развитием инфекционных болезней: лимфоциты, СОЭ.
Ведение беременности при АФС
Чтобы во время беременности не возникало тромбозов и потери плода, необходима профилактика – немедикаментозная и медикаментозная.
Немедикаментозная:
- физическая активность стимулирует собственный тканевой плазминоген;
- эластичный медицинский трикотаж 1-2 класс компрессии;
- диета с большим количеством растительных масел, свеклы, чернослива, инжира, бананов, поскольку эти продукты обладают слабительным эффектом – это важно, чтобы при дефекации не создавать повышенное давление на стенки вен.
Медикаментозная профилактика тромбозов при беременности
Существует несколько вариантов профилактики в зависимости от течения антифосфолипидного синдрома.
- Отсутствуют серологические маркеры ВА и антикардиолипиновый антиген, тромботические осложнения, могут определяться антитела к бета2-гликопротеину I.
- В первом триместре назначают Клексан или Фрагмин в дозировке для оптимального поддержания д-димеров и фолиевая кислота 4 мг/кг.
- Второй и третий триместры – Фригмин или Клексан до нормальных цифр д-димеров, рыбий жир, Аспирин 75-100 мг/кг при повышенной агрегации тромбоцитов, СЗП 10 мл/кг или концентрат антитромбина при снижени антитромбина 3 менее 80%.
- Перед родами Аспирин отменяют за 3-5 суток, вечернюю дозу НМГ меняют на СЗП 10мг/кг с гепарином 1-2 Ед на каждый мл СЗП.
- При родоразрешении – нормальный уровень д-димеров СЗП 10 мг/кг, при высоком уровне перед операцией – СЗП 5 мл/кг плюс гепарин 1 Ед на 1 мл СЗП или концентрат антитромбина 3, во время операции СЗП 5 мл/кг.
- При наличии в крови АФЛА и тромбозами или без них, отсутствует волчаночный антикоагулянт.
- 1 триместр – Клесан или Фрагмин для поддержания нормального уровня д-димеров+фолиевая кислота 4 мг/сутки.
- 2 и 3 триместры – Клексан или Фрагмин в индивидуальных дозировках+Аспирин 75 мг/сутки+рыбий жир 1-2 кап 3 раза в день, при снижении антитромбина 3 менее 80% активности – СЗП 10 мл/кг или концентрат антитромбина Ⅲ – 10-50 МЕ/кг, при повышении д-димеров более 0,5 мкг/мл – повышении дозировки НМГ.
- Перед родами – отмена Аспирина за 3-5 дней, НМГ заменяют на СЗП 10 мл/кг+НФГ 1-2 ЕД на каждый мл СЗП, при повышении антифосфолипидных антител назначается Преднизолон (Метилпред) 1-1,5 мг/кг внутривенно.
- При родоразрешении если нормальные D-димеры – СЗП 10 мл/кг; если повышены д-димеры, то до операции СЗП 5 мл/кг+НФГ 1 ед на каждый мл CPG или концентрат антитромбина 3, во время операции – СЗП 5 мл/кг, при значительном повышении антител – Преднизолон 1,5-2 мл/кг внутривенно.
- При повышении ВА от 1,5 до 2 усл.ед.
- 1 триместр – базовый прием Фрагмин или Клексана в дозе, как в прошлом варианте+фолиевая кислота+иммуноглобулин человеческий 25 мл через день 3 дозы в 7-12 нед. Если имеется повышение ВА более 1,5 усл.ед в первом триместре, то беременность стоить прервать.
- 2 и 3 триместр – Фрагмин и Клексан в дозировке для нормального поддержания д-димеров+Аспирин 75 мг+рыбий жир 1-2 кап 3 раза в день, при сниженном антитромбине – СЗП 10 мл/кг или концентрат антитромбина Ⅲ 10-50 МЕ/кг в/в, при повышении Д-димеров – повысить дозировку НМГ, иммуноглобулин 25 мл через 1 день 3 раза в 24 недели, если повышен ВА от 1,2 до 2 усл.ед – Преднизолон 30-60 мг/сут в/в, с 13 до 34 недели возможен перевод на Варфарин под контролем МНО.
- Перед родами если был Варфарин, то его отменяют за 2-3 нед, переводят на НМГ, Аспирин отменяется за 3-5 дней до родов, СЗП 10 мл/кг+НФГ 2 ед на каждый мл плазмы, Преднизолон – 1,5-2 мл/кг в/в, при сниженном антитромбине Ⅲ – концентрат антитромбина Ⅲ 10-30 МЕ/кг.
- При родах – до операции СЗП 500 мл+НФГ 1000 ЕД, во время операции – СЗП 10 мл/кг, Преднизолон 1,5-2 мг/кг в/в.
- При повышении ВА более 2 усл.ед беременность следует прерывать.
Если у женщины развился катастрофический антифосфолипидный или HELLP-синдром, то может быть назначен плазмоферез или плазмофильтрация.
Послеродовый период
После родоразрешения возобновить профилактику тромбоэмболии следует уже спустя 8-12 часов Фраксипарином (Надропарином) – 0,1 мл/10 кг, Клексан (Эноксапарин) 100 МЕ/кг, Фрагмин (Дальтепарин) 120 МЕ/кг, если нет кровотечения.
Если у женщины были отмечены тромбозы в анамнезе, то назначаются терапевтические дозы этих средств Фраксипарин – 0,1 мл/10 кг 2 раза в день, Клексан – 100 МЕ/кг 2 раза в день, Фрагмин – 120 МЕ/кг 2 раза в день.
Применение НМГ необходимо продолжать не меньше 10 дней. А если был эпизод доказанной тромбоэмболии, то антикоагулянты используются не менее 3-6 месяцев.
Повышение концентрации антигенов в крови требует консультации гематолога или ревматолога для решения вопроса о гормональной терапии.
Цена на анализы
Чтобы выявить АФС, можно пройти диагностику на платной основе. Многие частные лаборатории предлагают панель для определения антифосфолипидных антител. В лаборатории Инвитро в Москве цены на конец 2018 года таковы:
- обнаружение иммуноглобулинов G и M к кардиолипину стоит 1990 руб;
- диагностика вторичного АФС – цена 3170 руб;
- развернутое серологическое исследование на АФС – 4200 руб;
- лабораторные критерии АФС – 3950 руб.
В лаборатории Синэво в Москве цены на анализы этой панели несколько разняться:
- иммуноглобулинов G и M к кардиолипину – 960 руб;
- антитела к бета2-гликопротеиду I – 720 руб;
- антитела класса G к фосфолипидам – 720 руб;
- антитела класса M к фосфолипидам – 720 руб.
Примерно такие цены могут предложить и другие частные лаборатории в городах России.
Источник
