Анализ на синдром ломкой х хромосомы
[42-073]
Генодиагностика синдрома ломкой Х-хромосомы (синдром Мартина — Белл)
3740 руб.
Увеличение числа CGG-триплетных повторов (экспансия) в 5-нетранслируемой части гена FMR1 является причиной развития синдрома ломкой Х-хромосомы (синдром Мартина — Белл), Х-сцепленного наследственного заболевания.
Синонимы русские
Ломкая Х-хромосома (с. Мартина — Белл), ген FMR1, экспансия триплетных повторов, генетическое обследование.
Синонимы английские
FMR1-Related Disorders, fragile X syndrome, gene FMR1, expansion of CGG (cytosine- guanine -guanine) triplet repeats.
Название гена
Ген FMR1.
Локализация гена на хромосоме
Локус Xq27.3.
Метод исследования
Полимеразная цепная реакция (ПЦР) — Фрагментный анализ гена FMR1.
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Синдром ломкой Х-хромосомы (синдром Мартина — Белл — СМБ) представляет собой наиболее частую моногенную причину нарушения развития у детей, а также наиболее частую известную моногенную причину развития аутизма. Данное наследственное заболевание характеризуется увеличением количества CGG-повторов в 5-нетранслируемой части FMR1-гена, располагающегося на Х-хромосоме и кодирующего одноименный белок синдрома ломкой Х-хромосомы (БХЛХ). Данная генетическая аберрация приводит к гипермителированию зоны экспансии, а также прилежащего промоутера FMR1-гена. Гипермителирование ингибирует транскрипцию гена и нарушает синтез белка БХЛХ.
В норме количество повторов не более 59. У пациентов с СМБ количество CGG-триплетов обычно превышает 200. Распространенность данного заболевания у мужчин составляет 1:3600, у женщин – 1:4000.
Заболевание СМБ является Х-сцепленным и наследуется по доминантному типу, то есть имеется 50% риска его наследования от больной матери. Для СМБ нехарактерен феномен антиципации. Размер экспансии не коррелирует с тяжестью симптоматики, уровнем пенетрантности и временем первых проявлений заболевания.
БХЛХ является РНК-связывающимся протеином, способным образовывать рибонуклеопротеиновые комплексы, связываться с полисомами и ингибировать трансляцию многих белков. Считается, что белок БХЛХ участвует в эмбриональном развитии органов ЦНС, яичников, а также в нормальном синтезе белков локально в дендритах нейронов. Экспансия CGG-повторов ингибирует транскрипцию FMR1-гена и нарушает синтез белка БХЛХ.
Клинические проявления:
СМБ может проявляться в виде несиндромального отставания в развитии.
- Отставание в развитии, гиперактивность, синдром дефицита внимания.
- Задержка психоречевого развития с элементами аутизма.
- Черепно-лицевой дисморфизм — вытянутое лицо, выступающий подбородок, большие оттопыренные уши, страбизмус, широкий лоб, высокое небо.
- Гиперподвижность суставов, пролапс митрального клапана.
- Макроорхидизм.
- Гипотония мышц.
- Pectus excavatum — деформация грудной клетки.
- Судорожный синдром.
Для чего используется исследование?
В соответствии с международными клиническими рекомендациями, генетическое обследование на синдром ломкой Х-хромосомы проводится при наличии у пациента клинической симптоматики, характерной для данного заболевания, а также родственникам и детям больного.
Когда назначается исследование?
- Дифференциальный диагноз отставания развития;
- при подозрении на синдром ломкой Х-хромосомы;
- при когнитивных и нейропсихических нарушениях;
- при раннем выявлении заболевания у родственников;
- при планировании семьи.
Что означают результаты?
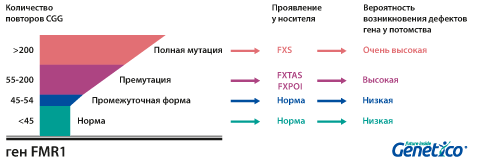
Генетическое обследование является основным методом подтверждения диагноза и основано на подсчете числа тройных CGG-повторов с помощью метода фрагментного анализа в гене FMR1. Диагностическая значимость обнаруженного числа CGG-повторов в гене FMR1 представлена в таблице:
Количество CGG-повторов | Диагноз и прогноз |
5-44 — нормальные аллели | Диагноз «СМБ» исключен (> 99%). Риск развития СМБ у следующих поколений крайне низок |
45-59 — умеренное увеличение | Диагноз «СМБ» исключен (> 99%). Имеется вероятность развития СМБ через поколение или у дальних родственников |
60-199 — предэкспансия | Возможен легкий фенотип СМБ. Повышенный риск развития ПЯН и СТА, ассоциированных с СЛХХ. Имеется вероятность развития СМБ у следующего поколения (зависит от размера экспансии — 3% для материнской аллели размером 55-59 и ~ 100% для аллели 90 CGG и более) |
≥ 200 — выраженная экспансия | Диагноз «СМБ» подтвержден. 50% вероятности передачи СМБ следующему поколению матерью |
Что может влиять на результат?
Хотя генетический тест является точным методом лабораторной диагностики, время клинических проявлений заболевания (пенетрантность болезни) зависит от внешней среды, индивидуальных генетических факторов. Для оценки характера наследования у детей и родственников, характера развития заболевания в последующем, назначения лечения рекомендуется получить консультацию специалиста.
Важные замечания
- Для получения заключения по результату обследования необходимо проконсультироваться у клинического генетика.
Кто назначает исследование?
Невролог, психиатр, врач-генетик.
Также рекомендуется
[16-001] Исследование кариотипа (количественные и структурные аномалии хромосом) по лимфоцитам периферической крови (1 человек)
Литература
- Saul RA, Tarleton JC. FMR1-Related Disorders. 1998 Jun 16 [Updated 2012 Apr 26]. In: Adam MP, Ardinger HH, Pagon RA, et al., editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2018.
- D’Hulst C, Kooy RF Fragile X syndrome: from molecular genetics to therapy Journal of Medical Genetics 2009;46:577-584.
- Pugin A, Faundes V, Santa María L, Curotto B, Aliaga S, Salas I, et al. Clinical, molecular, and pharmacological aspects of FMR1-related disorders. Neurol (English Ed 2017;32:241–52.
- Wheeler AC, Bailey Jr DB, Berry-Kravis E, Greenberg J, Losh M, Mailick M, et al. Associated features in females with an FMR1 premutation. J Neurodev Disord 2014;6:30.
Источник
Генетические особенности синдрома ломкой Х-хромосомы
Среди группы наследственных болезней есть два заболевания, относящихся к самым частым причинам интеллектуальной недостаточности. Самая известная и наиболее распространённая патология – синдром Дауна, связанный с наличием лишней 21-ой хромосомы в геноме человека. В этой статье мы расскажем о втором по распространенности наследственном заболевании, которое приводит к умственной отсталости, а также может сопровождаться другими клиническими проявлениями.
Синдром ломкой X-хромосомы или синдром Мартина-Белл является результатом нарушения в гене FMR1 (fragile X mental retardation-1), который расположен на Х-хромосоме и играет важную роль в появлении и развитии нервных связей, обучении и запоминании. Частота этого синдрома среди мальчиков составляет 1:4000.
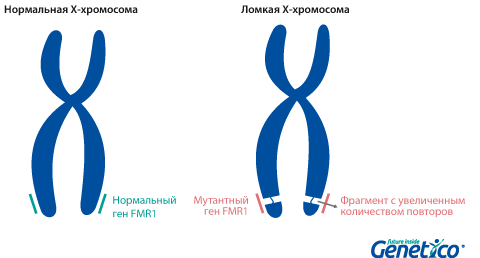
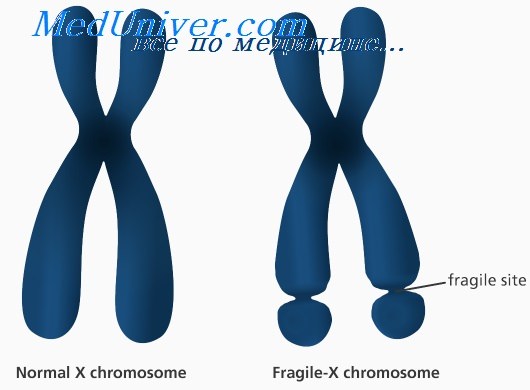
Так называемая «ломкость» X-хромосомы проявляется в том, что хромосома выглядит нетипично при специальном окрашивании, как будто один кусок отделился, хотя физически она остается цельной. Генетическая основа этого явления заключается в увеличении числа тринуклеотидных повторов CGG в гене FMR1, расположенном на X-хромосоме.
У здоровых людей число повторов в этом гене колеблется от 5 до 54. Если повторов больше 200, то наработка белка с гена FMR1 нарушается, что приводит к развитию синдрома Мартина-Белл и клиническому проявлению заболевания. Премутационное состояние — это количество повторов CGG от 55 до 200. В таком состоянии заболевание у людей в типичной форме не проявляется, но чем больше повторов в этом гене у носителя, тем больше вероятность того, что у ее или его детей количество повторов будет больше 200 и заболевание разовьется. В случае носительства премутации при формировании половых клеток количество повторов может увеличиваться, поэтому если у родителя количество повторов от 55 до 200, то высока вероятность рождения ребенка с мутантным геном FMR1 и синдромом Мартина-Белл. При этом носительство премутационного состояния будущим папой и мамой неравнозначно по вероятности возникновения мутантного аллеля у их детей: если носитель – мама, то вероятность значительного увеличения числа повторов гораздо выше. Количество повторов от 45 до 54 является промежуточной формой, которая не имеет никакого влияния на здоровье человека, но может приводить к проблемам у будущих поколений, как и в случае премутационного состояния гена.

Важно учитывать, что наследование и развитие заболевания зависит от пола, так как ген FMR1 находится на Х-хромосоме. У мужчин только одна Х-хромосома, которую они получают от матери. Поэтому, в случае, если эта одна хромосома оказалась «ломкой», у них проявляется заболевание. У женщин две Х-хромосомы, однако активно работает только одна из них. Поэтому наличие одной Х-хромосомы с мутантным геном FMR1 может не проявляться клинически, в случае инактивации именно «ломкой» хромосомы, или приводить к развитию заболевания в 30-50% случаев. Мужчина с ломкой Х-хромосомой может передать её всем дочерям, но ни одному из сыновей. Женщина с мутантной хромосомой имеет шансы передать её как сыновьям, так и дочерям с равной вероятностью.
Премутационное состояние гена влияет как на судьбу потомков носителя такого гена, так и непосредственно на его здоровье:
Развитие первичной недостаточности яичников (FXPOI) (снижение овариального резерва и наступление менопаузы до 40 лет). Мутация FMR1 является причиной преждевременного истощения яичников у 5% женщин с этим диагнозом. Среди носительниц премутации примерно у четверти развивается это состояние. Оно влияет не только на общие репродуктивные возможности, но и на подбор протокола стимуляции при ВРТ, так как часто оказывается причиной бедного ответа яичников на стимуляцию. Интересно, что по данным, полученным в центре Genetico, хотя бедный ответ яичников на стимуляцию влияет на число получаемых в цикле эмбрионов, он не приводит к увеличению доли анеуплоидных эмбрионов.
Тремор/атаксия, ассоциированные с ломкой Х-хромосомой (FXTAS). Это состояние чаще развивается у мужчин: при носительстве премутации мужчиной проявляется в 33% случаев, а при носительстве премутации женщиной – лишь в 5-10%. Синдром FXTAS начинает проявляться в пожилом возрасте. Наблюдается тремор, шаткая походка, может страдать речь.
Метод диагностики, используемый в лаборатории Genetico, основан на использовании полимеразной цепной реакции с особым набором праймеров, позволяющих не только детектировать нормальное, премутационное и мутационное состояния, но и точно определить количество повторов в случаях, когда их меньше 200. Такая диагностика позволяет выявить синдром ломкой X-хромосомы на молекулярном уровне, а также оценить вероятность рождения ребенка с этим синдромом и возможность развития у пациента расстройств, связанных с увеличенным количеством повторов в гене FMR1. Такая диагностика также позволяет детектировать наличие AGG повторов среди повторов CGG. Полагают, что участки AGG, прерывающие длинную последовательность из CGG повторов, придают ДНК устойчивость и снижают риск увеличения количества повторов в следующем поколении.
Генетический тест, определяющий количество повторов в гене FMR1, рекомендуется пройти в первую очередь женщинам с синдромом преждевременного истощения яичников или с выявленной неслучайной инактивацией Х-хромосомы (косвенный признак), семьям, в которых есть сыновья с интеллектуальной недостаточностью. Также анализ состояния гена FMR1 необходим:
1) женщинам с репродуктивными проблемами или нарушениями фертильности, связанными с повышенным уровнем фолликулостимулирующего гормона (ФСГ)
2) пациентам с интеллектуальной недостаточностью и их родственникам
3) тем, у кого в семье были случаи синдрома ломкой Х-хромосомы или умственной отсталости без точного диагноза
4) женщинам, у родственников которых наблюдались нарушения, связанные с премутационным состоянием FMR1
5) пациентам с поздно проявившимся тремором и мозжечковой атаксией (нарушения согласованности работы мышц из-за поражения систем мозга, управляющих движением мышц).
В случае обнаружения бессимптомного носительства мутации в гене FMR1 у женщины может быть рекомендовано использование донорских ооцитов или проведение преимплантационной генетической диагностики (ПГД) с целью исключить возможность проявления синдрома у ребенка. Также важно правильно оценивать риск рождения больного ребенка в случае премутационного состояния гена FMR1 у будущих родителей. В таком случае по результатам теста рекомендуется консультация врача-генетика.
Автор: Очир Мигяев
Стажер лаборатории Genetico
Источник
Синдром Мартина-Белл — сцепленное с полом наследственное заболевание, характеризующееся умственной отсталостью, определенными фенотипическими особенностями и нарушениями аутистического спектра.
При данной патологии ломкость затрагивает всегда один и тот же участок Х-хромосомы, где локализован мутантный ген.
Причина заболевания
Основная причина синдрома Мартина-Белл — выключение гена FMR1 в Х-хромосоме в следствии мутации, в результате чего нарушается секреция специфического белка. Белок FMR нужен для нормального развития нервной системы. При мутации меняется число повторов последовательностей ЦГГ в гене. Чем больше количество повторов, тем более выраженная симптоматика заболевания.
В 1/3 случаев, заболевание характеризуется как типичное Х-сцепленное рецессивного типа. Заболевание проявляется исключительно у лиц мужского пола. Генотип мужчины устанавливается по его фенотипу: если он болен, то гемизиготен по аномальному гену, если здоров, то свободен от него. Женщины-носительницы мутантного гена, как правило, фенотипически здоровы. Однако в большем числе случаев (2/3), наследование синдрома носит характер нерегулярного сцепленного с Х-хромосомой, возможна передача маркёрной хромосомы здоровыми мужчинами (облигатными носителями), в потомстве дочерей которых отмечаются случаи рождения больных сыновей.
Клинические проявления
При рождении масса тела ребенка часто повышена — от 3,5 до 4 кг.
У подростков и взрослых больных отмечается макроорхизм при отсутствии изменений эндокринной функции.
Системные соматические изменения затрагивают связочный аппарат, хрящ, кожу, костную систему. У больных следующие признаки строения лица: большая голова с высоким и широким лбом, длинное лицо с увеличенным подбородком, несколько уплощенная средняя часть лица, тупой, слегка клювовидно загнутый кончик носа. Уши большие, иногда оттопыренные, низко расположенные. Кисти и стопы широкие, дистальные фаланги пальцев также широкие, суставы имеют повышенную подвижность. Кожа нередко гиперэластична.
Неврологическая симптоматика при данном синдроме характеризуется мышечной гипотонией и дискоординацией движений, в меньшей степени отмечаются экстрапирамидные, пирамидные и глазодвигательные нарушения.
Ведущим психопатологическим нарушением является интеллектуальное недоразвитие. Степень умственной отсталости различна. У больных своеобразная речь по типу «бормочущей». Отмечаются нарушения поведения: синдром двигательной расторможенности, выраженная аффективная возбудимость, агрессивность.
Одна из частых психопатологических особенностей — шизофреноподобная симптоматика, включающая в себя подпрыгивания, похлопывания руками, повороты вокруг своей оси, встряхивание кистями, «манежный» бег, разнообразные гримасы, монотонное хныканье.
Помимо умственной отсталости, чаще всего у больных отмечаются проявления раннего детского аутизма. У больного ребенка отсутствует потребность в контактах с окружающими, отгороженность от внешнего мира, слабость эмоционального реагирования по отношению к близким, недостаточность реакций на зрительные и слуховые раздражители, приверженность к сохранению неизменности окружающего, боязнь всего нового, однообразность поведения со склонностью к стереотипным примитивным движениям, разнообразные расстройства речи, непереносимость взгляда в глаза, взгляд «мимо» и «сквозь» людей.
Подготовка
Генетическое обследование не требует специальной подготовки.
Рекомендуется взятие крови не ранее чем через 4 часа после последнего приёма пищи.
Перед диагностикой не рекомендуется подвергать себя стрессовым ситуациям, принимать спиртные напитки и курить.
Рацион и приём лекарственных препаратов не влияет на результат исследования.
Интерпретация результатов
Для интерпретации результатов генетического тестирования требуется консультация врача-генетика.
Источник
Синдром ломкой Х-хромосомы: причины, диагностика, лечениеЭтиология и встречаемость синдрома ломкой Х-хромосомы. Синдром ломкой Х-хромосомы (MIM №309550) — Х-сцепленное заболевание с задержкой умственного развития, вызванное мутациями в гене FMR1 в Xq27.3. Синдром ломкой Х-хромосомы встречается с частотой 16-25 на 100 000 в общей популяции среди мужчин и в два раза реже среди женщин. Синдром ломкой Х-хромосомы составляет 3-6% всех случаев умственной отсталости среди мальчиков с положительным семейным анамнезом по умственной отсталости при отсутствии врожденных пороков. Патогенез синдрома ломкой Х-хромосомыПродукт гена FMR1, FMRP, экспрессируется во многих типах клеток, но наиболее сильно в нейронах. FMRP может сопровождать определенный подкласс мРНК от ядра к рибосомам. Более 99% мутаций в гене FMR1 — экспансия нуклеотидного повтора (CGG)n в 5′-нетранслируемом участке гена. В нормальных аллелях FMR1 число повторов CGG составляет от 6 до приблизительно 50. В патогенных аллелях (или при полных мутациях) количество повторов более 200. Аллели с более чем 200 повторами CGG обычно имеют гиперметилированную последовательность повторов CGG и смежного промотора FMR1. Гиперметилирование инактивирует промотор FMR1, вызывая снижение экспрессии FMRP. Полные мутации возникают из аллелей премутации (от 59 до 200 повторов CGG) с передачей мутантного аллеля FMR1 от матери (но не от отца); фактически при отцовской передаче премутации часто, наоборот, сокращаются. Полные мутации не могут возникать из нормальных аллелей. Поскольку длина неустойчивых повторов CGG увеличивается в каждом последующем поколении, если они передаются женщиной, обычно наблюдается увеличение числа пораженных потомков в последующих поколениях в семье; этот феномен называется генетической антиципацией. Риск экспансии премутации в полную мутацию возрастает с увеличением числа повторов в премутации. Тем не менее не все премутации одинаково предрасположены к экспансии. Хотя премутации встречаются сравнительно часто, переход в полную мутацию наблюдают только в ограниченном количестве гаплотипов, т.е. когда есть склонность гаплотипа к экспансии. Эта склонность гаплотипа частично может быть связана с присутствием нескольких триплетов AGG, вставленных в последовательность повторов CGG; оказывается, такие триплеты AGG тормозят экспансию повторов CGG, следовательно, их отсутствие в некоторых гаплотипах может предрасполагать к экспансии.
Фенотип и развитие синдрома ломкой Х-хромосомыСиндром ломкой Х-хромосомы вызывает умеренную умственную отсталость у мужчин и легкую умственную задержку у женщин. Наиболее пораженные индивидуумы также имеют поведенческие аномалии, включая гиперактивность, размахивание руками, истерики, плохой зрительный контакт и признаки аутизма. Физические характеристики мужчин изменяются с пубертатом. До полового созревания пораженные мальчики имеют несколько увеличенный размер головы и некоторые другие неотчетливые симптомы; после наступления половой зрелости у них частые более отчетливые признаки (длинное лицо с выдающейся челюстью и лбом, крупные ушные раковины, макроорхидизм). Поскольку эти клинические признаки не уникальны для синдрома ломкой Х-хромосомы, диагноз зависит от молекулярного обнаружения мутаций. Пациенты с синдромом ломкой Х-хромосомы имеют нормальную продолжительность жизни. Почти все мужчины и 40-50% женщин, унаследовавших полную мутацию, будут иметь синдром ломкой Х-хромосомы. Тяжесть фенотипа зависит от мозаицизма метилирования повторов и их числа. Поскольку полные мутации неустойчивы, некоторые пациенты имеют смесь клеток с числом повторов, колеблющимся от премутации до полной мутации (мозаицизм числа повторов). Все мужчины с мозаицизмом числа повторов больны, но часто имеют более высокие показатели умственного развития, чем пациенты с полной мутацией в каждой клетке; у женщин с мозаицизмом числа повторов клинические проявления варьируют от нормы до полного проявления. Аналогично некоторые пациенты имеют смесь клеток с метилированием повторов CGG и без него (мозаицизм метилирования повторов). Все мужчины с мозаицизмом метилирования больны, но часто имеют более высокие показатели умственного развития, чем с гиперметилированием в каждой клетке; женщины с мозаицизмом метилирования также могут быть здоровыми или больными.
Очень редко пациенты имеют полную мутацию, неметилированную во всех клетках; независимо от пола, степень тяжести у них варьирует от нормы до полной клиники. Кроме того, у женщин фенотип зависит от степени смещения инактивации Х-хромосомы. Носительницы премутации (но не полных мутаций) имеют 20% риск ранней дисфункции яичников. Мужчины-носители премутации имеют риск развития синдрома FXTAS. FXTAS проявляет себя как поздняя прогрессирующая мозжечковая атаксия с интенционным тремором. У больных могут также присутствовать снижение краткосрочной памяти и двигательных функций, когнитивные нарушения, а также паркинсонизм, периферическая нейропатия, проксимальная мышечная слабость нижних конечности и дизавтономия. Пенетрантность FXTAS зависит от возраста, обнаруживается в 17% в течение шестого десятилетия жизни, в 38% в течение седьмого десятилетия, в 47% в течение восьмого десятилетия и в трех четвертях старше 80 лет. FXTAS может встречаться и у некоторых женщин — носительниц премутации. Особенности фенотипических проявлений синдрома ломкой Х-хромосомы: Лечение синдрома ломкой Х-хромосомыК настоящему времени никакого патогенетического лечения при синдроме ломкой Х-хромосомы нет. Помощь направлена на обучение и фармакологическое лечение поведенческих проблем. Риски наследования синдрома ломкой Х-хромосомыРиск того, что женщина с премутацией будет иметь больного ребенка, определяется размером премутации, полом плода и семейным анамнезом. Эмпирически риск для носителя перестройки иметь больного ребенка может достигать 50% для каждого мальчика и 25% для каждой девочки, но зависит от размера премутации. На основе анализа сравнительно небольшого количества матерей-носительниц известно, что риск повторения может снижаться, если премутация уменьшается со 100 до 59 повторов. Пренатальная диагностика доступна за счет использования ДНК плода из ворсин хориона или амниоцитов. Пример синдрома ломкой Х-хромосомы. Р.Л., 7-летний мальчик, направлен в клинику педиатрии в связи с умственной задержкой и гиперактивностью. Он не смог посещать детский сад, поскольку был агрессивным, не в состоянии выполнять задания, имел бедные речевые и двигательные навыки. Несмотря на задержанное развитие, он не потерял основных этапов: сидел к 10-11 мес, ходить начал в 20 мес, говорил два или три ясных слова в 24 мес. В остальном ребенок здоров. Его мать и тетя по матери имели небольшие проблемы обучения в детстве, дядя по матери умственно задержан. Данные медицинского осмотра в норме, за исключением гиперактивности. Врач рекомендовал несколько тестов, включая кариотипирование, функциональные исследования щитовидной железы и ДНК-анализ на синдром ломкой Х-хромосомы. Анализ гена FMR1 методом блот-гибридизации по Саузерну соответствовал синдрому ломкой Х-хромосомы. — Также рекомендуем «Недостаточность глюкозо-6-фосфат дегидрогеназы (Г6ФД): причины, диагностика, лечение» Оглавление темы «Генетические болезни»:
|
Источник