Адреногенетический синдром у детей это

Медицинский эксперт статьи

х
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Врождённая дисфункция коры надпочечников (синоним: адреногенитальный синдром у детей) включает группу наследственных ферментопатий. В основе каждой из ферментопатий — генетически детерминированный дефект фермента, участвующего в стероидогенезе.
Описаны дефекты пяти ферментов, участвующих в синтезе глюко- и минералокортикоидов, при этом формируется тот или иной вариант адреногенитального синдрома у детей. Все формы врождённой дисфункции коры надпочечников наследуются по аутосомно-рецессивному типу.
Код по МКБ-10
- Е25 Адреногенитальные расстройства.
- Е25.0 Врождённые адреногенитальные нарушения, связанные с дефицитом ферментов.
- Е25.8 Другие адреногенитальные нарушения.
- Е25.9 Адреногенитальное нарушение неуточнённое.
Что вызывает адреногенитальный синдром у детей?
В 90% случаев наблюдают дефект 21-гидроксилазы, который может быть обусловлен различными мутациями гена CYP21, кодирующего данный фермент. Описаны десятки мутаций CYP21, приводящих к дефекту Р450с21. Встречается также точечная мутация с частичной активностью 21-гидроксилазы. При частичном дефиците этого фермента развивается простая (вирильная) форма заболевания. 21-Гидроксилаза участвует в синтезе кортизола и альдостерона и не участвует в синтезе половых стероидов. Нарушение синтеза кортизола стимулирует продукцию АКТГ, что приводит к гиперплазии коры надпочечников. При этом накапливается 17-ОН-прогестерон — предшественник кортизола. Избыток 17-ОН-прогестерона превращается в андрогены. Надпочечниковые андрогены приводят к вирилизации наружных половых органов у плода женского пола — рождается девочка с ложным женским гермафродитизмом. У мальчиков гиперандрогенемия определяет преждевременное появление вторичных половых признаков (синдром преждевременного полового развития).
При значительном дефиците 21-гидроксилазы гиперплазированная кора надпочечников не синтезирует кортизол и альдостерон в необходимых количествах. при этом на фоне гиперандрогенемии развивается синдром потери солей или надпочечниковая недостаточность — сольтеряющая форма заболевания.
Неклассическая форма 21-гидроксилазной недостаточности проявляется в пре- и пубертатном возрасте в виде адренархе, умеренного гирсутизма и нарушения менструального цикла у девочек. Умеренная или лёгкая вирилизация при этом является результатом точечной мутации V281L и P30L.
Симптомы адреногенитального синдрома у детей
При классической вирильной форме адреногенитального синдрома у детей наружные половые органы девочки сформированы по гетеросексуальному типу — гипертрофирован клитор, большие половые губы напоминают мошонку, вагина и уретра представлены урогенитальным синусом. У новорождённых мальчиков явных нарушений выявить не удаётся. С 2-4 лет у детей обоего пола появляются другие симптомы адреногенитального синдрома у детей, то есть андрогенизации: формируется подмышечное и лобковое оволосение, развивается скелетная мускулатура, грубеет голос, маскулинизируется фигура, появляются юношеские угри на лице и туловище. У девочек не растут молочные железы, не появляются менструации. При этом ускоряется дифференцировка скелета, и зоны роста закрываются преждевременно, это обусловливает низкорослость.
При сольтеряющей форме 21-гидроксилазной недостаточности, помимо вышеописанных симптомов, у детей с первых дней жизни отмечают признаки надпочечниковой недостаточности. Появляются вначале срыгивания, затем рвоты, возможен жидкий стул. Ребёнок быстро теряет массу тела, развиваются симптомы дегидратации, нарушения микроциркуляции, снижается артериальное давление, начинается тахикардия, возможна остановка сердца вследствие гиперкалиемии.
Неклассическая форма адреногенитального синдрома у детей характеризуется ранним появлением вторичного оволосения, ускорением роста и дифференцировки скелета. У девочек пубертатного возраста возможны умеренные признаки гирсутизма, нарушения менструального цикла, формирование вторичного поликистоза яичников.
Недостаточность 11-гидроксилазы в отличие от 21-гидроксилазной недостаточности, помимо симптомов вирилизации и андрогенизации, сопровождается ранним и стойким повышением артериального давления. обусловленным накоплением в крови предшественника альдостерона — дезоксикортикостерона.
Диагностика адреногенитального синдрома у детей
 [1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11]
[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11]
Лабораторная диагностика адреногенитального синдрома у детей
- Всем детям с неправильным строением наружных половых органов, в том числе мальчикам с двусторонним брюшным крипторхизмом, показано определение полового хроматина и исследование кариотипа.
- С первых дней жизни в сыворотке крови больного обнаруживают повышенное содержание 17-ОН-прогестерона. Возможно проведение скрининг-теста у новорождённых на 2-5-й день жизни — 17-ОН-прогестерон повышен в несколько раз.
- При синдроме потери солей характерны гиперкалиемия, гипонатриемия, гипохлоремия.
- Повышается экскреция с мочой 17-кетостероидов (метаболиты андрогенов).
Инструментальная диагностика адреногенитального синдрома у детей
- Костный возраст по рентгенограмме лучезапястных суставов опережает паспортный.
- При УЗИ у девочек обнаруживают матку и яичники.
Дифференциальная диагностика адреногенитального синдрома у детей
У детей первого года жизни дифференциальную диагностику адреногенитального синдрома у детей проводят с различными формами ложного мужского гермафродитизма и истинным гермафродитизмом. Опорным моментом в диагностике служат кариотипирование (кариотип 46ХХ при бисексуальном строении наружных половых органов) и определение 17-ОН-прогестерона в сыворотке крови. Сольтеряющую форму врождённой дисфункции коры надпочечников следует дифференцировать с пилоростенозом, сложности возникают при дифференциальном диагнозе адреногенитального синдрома у детей и пилоростеноза у мальчиков — в этом случае имеют значение гиперкалиемия и высокий уровень 17-ОН-прогестерона при врождённой дисфункции коры надпочечников.
У детей старшего возраста при симптомах гиперандрогенемии следует помнить об андрогенпродуцирующих опухолях надпочечников или гонад.
 [12], [13], [14]
[12], [13], [14]
Какие анализы необходимы?
Лечение адреногенитального синдрома у детей
Медикаментозное лечение адреногенитального синдрома у детей
Вирильная форма адреногенитального синдрома у детей требует постоянной заместительной терапии преднизолоном. Дозу препарата подбирают индивидуально в зависимости от возраста и степени вирилизации и делят на 2-3 приёма. Дозы его распределены равномерно в течение дня. В среднем суточная доза преднизолона составляет 4-10 мг. Такое количество препарата подавляет избыточную продукцию андрогенов, не оказывая побочных действий.
Лечение сольтеряющей формы адреногенитального синдрома у детей при кризе надпочечниковой недостаточности проводят так же, как и лечение острой надпочечниковой недостаточности — капельным введением изотонического раствора натрия хлорида и глюкозы, а также парентеральным введением препаратов гидрокортизона (10-15 мг/кг в сутки). Суточное количество гидрокортизона распределяют равномерно. Препарат выбора — водорастворимый гидрокортизон (солукортеф). При стабилизации состояния постепенно инъекции гидрокортизона заменяют таблетками гидрокортизона, при необходимости добавляют минералокортикоид — флудрокортизон (2,5-10.0 мкг в сутки).
Хирургическое лечение адреногенитального синдрома у детей
Девочкам в 4-6-летнем возрасте проводят хирургическую коррекцию наружных половых органов.
Критерии эффективности лечения адреногенитального синдрома у детей: нормализация темпов роста ребёнка, нормальные показатели артериального давления, электролитов в сыворотке крови. Оптимальная доза глюкокортикостероидов определяется по уровню 17-ОН-прогестерона в сыворотке крови, минералокортикоидов — по содержанию ренина в плазме крови.
Прогноз адреногенитального синдрома у детей
Прогноз для жизни при своевременной диагностике и правильно проводимого лечения адреногенитального синдрома у детей благоприятный. Следует помнить о риске развития острой надпочечниковой недостаточности при травмах, интеркуррентных заболеваниях, стрессовых ситуациях, оперативных вмешательствах. Для профилактики кризов надпочечниковой недостаточности следует повышать дозу глюкокортикостероидов в 3-5 раз. При неотложных состояниях важно своевременное парентеральное введение гидрокортизона.
Источник
Адреногенитальный синдром — наследственное заболевание надпочечников, при котором вследствие функциональной несостоятельности ферментов нарушается стероидогенез. Проявляется вирилизацией гениталий, маскулиноподобным телосложением, недоразвитием груди, гирсутизмом, акне, аменореей или олигоменореей, бесплодием. В ходе диагностики определяют уровни 17-гидроксипрогестерона, 17-кетостероидов, андростендиона, АКТГ, проводят УЗИ яичников. Пациенткам назначают заместительную гормонотерапию глюкокортикоидами и минералокортикоидами, эстрогены в комбинации с андрогенами или прогестинами нового поколения. При необходимости выполняют пластику половых органов.
Общие сведения
Адреногенитальный синдром, или врожденная дисфункция (гиперплазия) коры надпочечников, — наиболее частое из наследуемых заболеваний. Распространенность патологии отличается у представителей разных национальностей. Классические варианты АГС у лиц европеоидной расы встречаются с частотой 1:14 000 младенцев, в то время как у эскимосов Аляски этот показатель составляет 1:282.
Существенно выше заболеваемость у евреев. Так, неклассическую форму адреногенитального расстройства выявляют у 19% лиц еврейской национальности группы ашкенази. Патология передается по аутосомно-рецессивному типу. Вероятность рождения ребенка с таким синдромом при носительстве патологического гена у обоих родителей достигает 25%, в браке носителя и больного — 75%. Если один из родителей имеет полноценные ДНК, клинические проявления синдрома у детей не развиваются. При наличии АДС у отца и матери ребенок также будет болен.
Адреногенитальный синдром
Причины
У больных с наследуемой гиперплазией надпочечников генетический дефект проявляется несостоятельностью ферментных систем, участвующих в секреции стероидных гормонов. В 90-95% случаев патология возникает при повреждении гена, который отвечает за синтез 21-гидроксилазы — фермента, влияющего на образование кортизола. В остальных клинических случаях вследствие дефекта ДНК нарушается производство других ферментов, обеспечивающих стероидогенез, — StAR/20,22-десмолазы, 3-β-гидрокси-стероиддегидрогеназы, 17-α-гидроксилазы/17,20-лиазы, 11-β-гидроксилазы, P450-оксидоредуктазы и синтетазы альдостерона.
У пациентов с признаками вирилизирующего синдрома вместо активного гена CYP21-B в коротком плече 6-й аутосомы расположен функционально несостоятельный псевдоген CYP21-A. Структура этих участков ДНК-цепи во многом гомологична, что повышает вероятность конверсии генов в мейозе с перемещением участка нормального гена на псевдоген или делецию CYP21-B.
По-видимому, именно этими механизмами объясняется существование скрытых форм болезни, дебютирующих в пубертате или постпубертатном периоде. В таких случаях клинические признаки патологии становятся заметными после нагрузок, истощающих кору надпочечников: тяжелых болезней, травм, отравлений, радиационных воздействий, длительного периода интенсивной работы, психологически напряженных ситуаций и т. д.
Патогенез
В основе механизма развития наиболее распространенного варианта адреногенитального синдрома с дефектом CYP21-B-гена лежит принцип обратной связи. Ее начальным звеном становится дефицит стероидов — кортизола и альдостерона. Несостоятельность процессов гидроксилирования сопровождается неполным переходом 17-гидроксипрогестерона и прогестерона в 11-дезоксикортизол и дезоксикортикостерон. В результате снижается секреция кортизола, а для компенсации этого процесса в гипофизе усиливается синтез АКТГ — гормона, вызывающего компенсаторную гиперплазию коры надпочечников для стимуляции выработки кортикостероидов.
Параллельно возрастает синтез андрогенов и появляются видимые признаки их влияния на чувствительные ткани и органы. При умеренном снижении активности фермента минералокортикоидная недостаточность не развивается, поскольку потребность организма в альдостероне почти в 200 раз ниже по сравнению с кортизолом. Только глубокий дефект гена вызывает тяжелую клиническую симптоматику, которая проявляется с раннего возраста. Патогенез развития заболевания при нарушении структуры других участков ДНК аналогичен, однако пусковым моментом являются нарушения в других звеньях стероидогенеза.
Классификация
Систематизация различных форм вирилизирующей гиперплазии надпочечников основана на особенностях клинической картины заболевания, выраженности генетического дефекта и времени проявления первых патологических признаков. Тяжесть расстройства напрямую связана со степенью повреждения ДНК. Специалисты в сфере эндокринологии различают следующие виды адреногенитального синдрома:
- Сольтеряющий. Самый тяжелый вариант патологии, проявляющийся в первый год жизни ребенка грубыми нарушениями строения наружных половых органов у девочек и их увеличением у мальчиков. Активность 21-гидроксилазы составляет не более 1%. Значительное нарушение стероидогенеза приводит к выраженным соматическим нарушениям — рвоте, поносу, судорогам, чрезмерной пигментации кожи. Без лечения такие дети умирают в раннем возрасте.
- Простой вирильный. Течение заболевания менее тяжелое, чем при сольтеряющем варианте. Преобладают проявления неправильного развития гениталий у младенцев женского пола, увеличение их размеров у мальчиков. Признаки надпочечниковой недостаточности отсутствуют. Уровень активности 21-гидроксилазы снижен до 1-5%. С возрастом у пациентов нарастают признаки вирилизации вследствие стимулирующего действия андрогенов.
- Неклассический (постпубертатный). Наиболее благоприятная форма АГС, явные признаки которой возникают в период полового созревания и в репродуктивном возрасте. Наружные половые органы имеют нормальное строение, может быть увеличен клитор у женщин и половой член у мужчин. Функциональность 21-гидроксилазы снижена до 20-30%. Заболевание выявляется случайно при обследовании в связи с бесплодием или нарушениями менструальной функции.
Сольтеряющий и простой вирильный виды адреногенитальных расстройств относят к категории антенатальной патологии, формирующейся внутриутробно и проявляющейся с момента рождения. При дефекте строения других генов наблюдаются более редкие варианты заболевания: гипертензивные — классический (врожденный) и неклассический (поздний), гипертермический, липидный, с ведущими проявлениями гирсутизма.
Симптомы
Сольтеряющий и простой вирильный
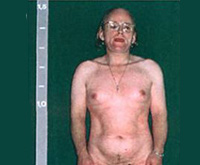
При антенатальных формах заболевания основным клиническим симптомом является видимая вирилизация гениталий. У новорожденных девочек обнаруживаются признаки женского псевдогермафродитизма. Клитор большой по размерам или имеет пенисообразную форму, преддверие влагалища углублено, сформирован урогенитальный синус, большие и малые половые губы увеличены, промежность высокая. Внутренние половые органы развиты нормально.
У младенцев-мальчиков увеличен половой член и гиперпигментирована мошонка. Кроме того, при сольтеряющем адреногенитальном расстройстве выражена симптоматика надпочечниковой недостаточности с тяжелыми, зачастую несовместимыми с жизнью соматическими нарушениями (понос, рвота, судороги, обезвоживание и др.), которые проявляются с 2-3-недельного возраста. У девочек с простым вирильным АГС по мере взросления признаки вирилизации усиливаются, формируется диспластическое телосложение.
Из-за ускорения процессов окостенения пациентки отличаются невысоким ростом, широкими плечами, узким тазом, короткими конечностями. Трубчатые кости массивные. Половое созревание начинается рано (до 7 лет) и протекает с развитием вторичных мужских половых признаков. Отмечается увеличение клитора, снижение тембра голоса, нарастание мышечной силы, формирование типичной для мужчин формы перстневидного хряща щитовидной железы. Грудь не растет, менархе отсутствует.
Неклассический
Менее специфичны клинические симптомы при неклассических формах вирилизирующего синдрома, возникшие в пубертате и после стрессовых нагрузок (выкидыша на ранних сроках беременности, медицинского аборта, операции и др.). Обычно пациентки вспоминают, что у них еще в младшем школьном возрасте появилось небольшое оволосение в подмышечных впадинах и на лобке. В последующем развились признаки гирсутизма с ростом стержневых волос над верхней губой, по белой линии живота, в области грудины, в сосково-ареолярной зоне.
Женщины с АГС предъявляют жалобы на стойкую угревую сыпь, пористость и повышенную жирность кожи. Менархе наступает поздно — к 15-16 годам. Менструальный цикл неустойчив, интервалы между менструациями достигают 35-45 дней и более. Кровянистые выделения во время месячных скудные. Молочные железы небольшие. Клитор несколько увеличен. Такие девушки и женщины могут иметь высокий рост, узкий таз, широкие плечи.
По наблюдениям специалистов в сфере акушерства и гинекологии, чем позже развиваются адреногенитальные расстройства, тем менее заметны внешние признаки, характерные для мужчин, и тем чаще ведущим симптомом становится нарушение месячного цикла. При более редких генетических дефектах пациентки могут жаловаться на повышение артериального давления или, наоборот, гипотонию с низкой работоспособностью и частыми головными болями, гиперпигментацию кожи с минимальными симптомами вирилизации.
Осложнения
Основным осложнением адреногенитального синдрома, по поводу которого пациентки обращаются к акушерам-гинекологам, является стойкое бесплодие. Чем раньше проявилось заболевание, тем меньше вероятность забеременеть. При значительной ферментной недостаточности и клинических проявлениях простого вирилизирующего синдрома беременность вообще не наступает.
У забеременевших пациенток с пубертатными и постпубертатными формами заболевания возникают самопроизвольные выкидыши на раннем сроке. В родах возможна функциональная истмико-цервикальная недостаточность. Такие женщины более склонны к возникновению психоэмоциональных расстройств — склонности к депрессии, суицидальному поведению, проявлениям агрессии.
Диагностика
Постановка диагноза при антенатальных типах АГС с характерными изменениями половых органов не представляет сложности и проводится сразу после родов. В сомнительных случаях применяют кариотипирование для подтверждения женского кариотипа (46ХХ). Большее значение диагностический поиск приобретает при позднем клиническом дебюте или скрытом течении с минимальными внешними проявлениями вирилизации. В подобных ситуациях для выявления адреногенитального синдрома используют следующие лабораторные и инструментальные методы:
- Уровень 17-ОН-прогестерона. Высокая концентрация 17-гидроксипрогестерона, который является предшественником кортизола — ключевой признак недостаточности 21-гидроксилазы. Его содержание увеличено в 3-9 раз (от 15 нмоль/л и выше).
- Стероидный профиль (17-КС). Повышение уровня 17-кетостероидов в моче у женщин в 6-8 раз свидетельствует о высоком содержании андрогенов, производимых корой надпочечников. При выполнении преднизолоновой пробы концентрация 17-КС уменьшается на 50-75%.
- Содержание андростендиона в сыворотке крови. Повышенные показатели этого высокоспецифичного метода лабораторной диагностики подтверждают усиленную секрецию предшественников мужских половых гормонов.
- Уровень АКТГ в крови. Для классических форм заболевания характерна компенсаторная гиперсекреция адренокортикотропного гормона передней долей гипофиза. Поэтому при синдроме вирилизирующей дисфункции показатель повышен.
- УЗИ яичников. В корковом веществе определяются фолликулы на разных стадиях созревания, не достигающие преовуляторных размеров. Яичники могут быть несколько увеличены, однако разрастания стромы не наблюдается.
- Измерение базальной температуры. Температурная кривая типична для ановуляторного цикла: первая фаза растянута, вторая укорочена, что обусловлено недостаточностью желтого тела, которое не образуется из-за отсутствия овуляции.
Для сольтеряющего варианта АГС также характерна повышенная концентрация ренина в плазме крови. Дифференциальная диагностика адреногенитальных расстройств, возникших в пубертатном и детородном возрасте, проводится с синдромом поликистозных яичников, овариальными андробластомами, андростеромами надпочечников, вирильным синдромом гипоталамического происхождения и конституциональным гирсутизмом. В сложных случаях к диагностике привлекают эндокринологов, урологов, врачей-генетиков.
Лечение адреногенитального синдрома
Основным способом коррекции вирильной дисфункции надпочечников является заместительная гормональная терапия, восполняющая дефицит глюкокортикоидов. Если у женщины со скрытым АГС нет репродуктивных планов, кожные проявления гиперандрогении незначительны и месячные ритмичны, гормоны не применяют. В остальных случаях выбор схемы лечения зависит от формы эндокринной патологии, ведущей симптоматики и степени ее выраженности. Зачастую назначение глюкокортикоидных препаратов дополняют другими медикаментозными и хирургическими методами, подобранными в соответствии с конкретной терапевтической целью:
- Лечение бесплодия. При наличии планов по деторождению женщина под контролем андрогенов крови принимает глюкокортикоиды до полного восстановления овуляторного месячного цикла и наступления беременности. В резистентных случаях дополнительно назначают стимуляторы овуляции. Во избежание выкидыша гормонотерапию продолжают до 13-й недели гестационного срока. В I триместре также рекомендованы эстрогены, во II-III — аналоги прогестерона, не обладающие андрогенным эффектом.
- Коррекция нерегулярных месячных и вирилизации. Если пациентка не планирует беременность, но жалуется на расстройство менструального цикла, гирсутизм, угри, предпочтительны средства с эстрогенным и антиандрогенным эффектом, оральные контрацептивы, содержащие гестагены последнего поколения. Терапевтический эффект достигается за 3-6 месяцев, однако по окончании лечения при отсутствии заместительной гормонотерапии признаки гиперандрогении восстанавливаются.
- Лечение врожденных форм АГС. Девочкам с признаками ложного гермафродитизма проводят адекватную гормонотерапию и выполняют хирургическую коррекцию формы половых органов — клитеротомию, интроитопластику (вскрытие урогенитального синуса). При сольтеряющих адреногенитальных расстройствах кроме глюкокортикоидов под контролем рениновой активности назначают минералокортикоиды с увеличением терапевтических доз при возникновении интеркуррентных заболеваний.
Определенные сложности в ведении пациентки возникают в тех случаях, когда заболевание не диагностировано в акушерском стационаре, и девочка с выраженной вирилизацией гениталий регистрируется и воспитывается как мальчик. При решении о восстановлении женской половой идентичности хирургическую пластику и гормонотерапию дополняют психотерапевтической поддержкой. Решение о сохранении гражданского мужского пола и удалении матки с придатками принимается в исключительных случаях по настоянию больных, однако такой подход считается ошибочным.
Прогноз и профилактика
Прогноз при своевременном обнаружении адреногенитального синдрома и адекватно подобранной терапии благоприятный. Даже у пациенток со значительной вирилизацией гениталий после пластической операции возможна нормальная половая жизнь и естественные роды. Заместительная гормонотерапия при любой форме АГС способствует быстрой феминизации — развитию грудных желез, появлению месячных, нормализации овариального цикла, восстановлению генеративной функции. Профилактика заболевания осуществляется на этапе планирования беременности.
Если в роду наблюдались случаи подобной патологии, показана консультация генетика. Проведение пробы с АКТГ обоим супругам позволяет диагностировать гетерозиготное носительство или скрытые формы адреногенитального расстройства. При беременности синдром может быть обнаружен по результатам генетического анализа клеток хорионических ворсин или содержимого околоплодных вод, полученных методом амниоцентеза. Неонатальный скрининг, проводимый на 5-е сутки после родов, направлен на выявление повышенной концентрации 17-гидропрогестерона для быстрого выбора терапевтической тактики.
Источник
