Забрюшинное пространство код мкб
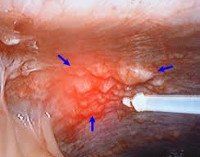
Рубрика МКБ-10: C48.0
МКБ-10 / C00-D48 КЛАСС II Новообразования / C00-C97 Злокачественные новообразования / C45-C49 Злокачественные новообразования мезотелиальной и мягких тканей / C48 Злокачественное новообразование забрюшинного пространства и брюшины
Определение и общие сведения[править]
Первичные опухоли забрюшинного пространства представляют собой гетерогенную группу мезенхимальных, нейрогенных, нейроэндокринных и герминогенных новообразований, составляющих около 1% всех солидных опухолей.
Мезенхимальные опухоли
Мезенхимальные опухоли, происходящие из мезенхимальных клеток в мышцах, жировой и соединительной ткани, подразделяют на доброкачественные (фибромы, лейомиомы, ангиомы) и злокачественные (саркомы). Доброкачественные мезенхимальные опухоли встречают редко. Лечение оперативное. Прогноз благоприятный.
Эпидемиология
Треть опухолей забрюшинного пространства составляют саркомы. Средний возраст заболевших около 50 лет. Соотношение заболевших мужчин и женщин — 1:1.
Этиология и патогенез[править]
Клинические проявления[править]
Наиболее распространёнными гистологическими типами злокачественных опухолей данной локализации выступают липосаркома (41%), лейомиосаркома (28%), злокачественная фиброзная гистиоцитома (7%) и фибросаркома (6%). Около 50% ретроперитонеальных сарком имеет высокую степень дифференцировки. Опухоли данной группы склонны к местноинвазивному росту с инвазией магистральных сосудов в 34% и паренхиматозных органов более чем в 50% наблюдений. Для всех ретроперитонеальных сарком, кроме липосаркомы, характерно гематогенное метастазирование с поражением лёгких, печени и костей (15-34%). Липосаркомам свойственна низкая частота появления отдалённых метастазов (7%).
Злокачественное новообразование забрюшинного пространства: Диагностика[править]
Нередко забрюшинные саркомы проявляются как пальпируемые опухоли живота значительных размеров, не вызывающие появления других жалоб. В связи с этим на момент выявления размер данных опухолей, как правило, превышает 5 см. Рост новообразования и его инвазия в окружающие структуры может привести к появлению жалоб, связанных с гастроинтестинальной обструкцией (кишечная непроходимость), прорастанием стенки кишки опухолью (кишечное кровотечение), сдавлением нижней полой вены (отёки нижней половины тела, асцит, гепатоспленомегалия, «голова медузы»), сдавлением корешков спинномозговых нервов (боль).
Методом выбора в диагностике забрюшинных опухолей служит КТ, позволяющая выявить новообразование и оценить его синтопию с окружающими тканями, а также исключить метастатическое поражение органов брюшной полости. КТ даёт возможность определить содержание жировой ткани в опухоли, что важно в диагностике липосарком. МРТ также позволяет получить объективную информацию о размерах опухоли и её соотношении с соседними органами. Всем больным с забрюшинными неорганными опухолями обязательно выполняют рентгенографию органов грудной клетки для исключения метастазов в лёгкие. Биопсия до начала лечения рекомендуется лишь в тех случаях, когда верификация диагноза может повлиять на тактику ведения пациента (назначение дооперационной химиотерапии).
Дифференциальный диагноз[править]
При ретроперитонеальных саркомах дифференциальную диагностику проводят с опухолями надпочечника, почки, поджелудочной железы. Для исключения гастроинтестинальных новообразований следует выполнять гастродуоденоскопию и колоноскопию. Также необходимо исключить забрюшинные метастазы герминогенных опухолей яичка и первичные внегонадные герминогенные новообразования. При этом существенную помощь оказывает определение уровней β-субъдиницы хорионического гонадотропина человека (ХГЧ) и α-фетопротеина (АФП), которые повышаются при герминогенных опухолях. От забрюшинных сарком следует дифференцировать увеличенные забрюшинные лимфатические узлы при лимфоме; с этой целью рекомендуют биопсию.
Злокачественное новообразование забрюшинного пространства: Лечение[править]
Стандарт лечения ретроперитонеальных сарком — операция. Удаление новообразований данной группы нередко ассоциировано с техническими трудностями, обусловленными большими размерами опухолей и сложной анатомией забрюшинного пространства. Радикальное оперативное вмешательство технически выполнимо у 70% больных. С целью полного удаления ретроперитонеальных сарком примерно в 30% наблюдений требуется резекция нижней полой вены и/или аорты, в 63-86% наблюдений — резекция или удаление смежных органов, таких как почка, толстая и тонкая кишка, поджелудочная железа, мочевой пузырь. Нерадикальное удаление забрюшинных сарком не увеличивает выживаемость пациентов, за исключением больных ретроперитонеальной липосаркомой.
Для забрюшинных сарком характерна высокая частота местных рецидивов после радикального оперативного лечения, достигающая 50-70%. Возможно позднее локальное рецидивирование, через 5 и даже 10 лет после операции. Около 90% больных с местными рецидивами опухоли погибает от прогрессирования болезни. Это диктует длительное тщательное наблюдение за больными.
С целью улучшения результатов оперативного лечения ретроперитонеальных сарком предпринимали попытки введения в схему лечения облучения и терапии цитостатиками. Данных, свидетельствующих об эффективности неоадъювантной и адъювантной лучевой терапии, не получено. В нерандомизированных исследованиях проведение интраоперационного облучения снижало частоту местных рецидивов в два раза. Роль неоадъювантной химиотерапии при забрюшинных саркомах не изучена. Согласно метаанализу Sarcoma Meta-analysis Collaboration, включившему 1568 больных, подвергнутых радикальному оперативному удалению локализованных сарком всех локализаций, адъювантная цитостатическая терапия приводит к достоверному увеличению безрецидивной выживаемости на 10%.
Метод выбора в лечении солитарных или единичных метастазов и местных рецидивов ретроперитонеальных сарком — операция. Роль дополнительной химиотерапии и лучевой терапии при метастатических и рецидивных опухолях не определена.
Диссеминированные ретроперитонеальные саркомы служат показанием к проведению паллиативной химиотерапии. У данной категории больных продемонстрирована умеренная эффективность доксорубицина, ифосфамида и дакарбазина в режиме монотерапии. Комбинация ифосфамида с доксорубицином повышает частоту объективных ответов по сравнению с монотерапией данными препаратами, однако увеличения выживаемости при этом не наблюдают.
Все больные ретроперитонеальными саркомами нуждаются в тщательном наблюдении после окончания лечения. При высокодифференцированных опухолях после завершения лечения рекомендуют КТ грудной полости, брюшной полости и таза каждые 3 мес в течение 1-го года, каждые 6 мес — в течение 2-3-го года, каждые 12 мес — с 4-го года и пожизненно. При низкодифференцированных новообразованиях после завершения лечения аналогичное исследование проводят чаще (каждые 3 мес в течение 1-3-го года, каждые 6 мес — в течение 4-5-го года, каждые 12 мес с 5 года до смерти больного).
Общая 5-летняя выживаемость больных ретроперитонеальными саркомами составляет 46-71%. Факторы прогноза выживаемости — гистологический тип, степень дифференцировки опухоли, стадия опухолевого процесса, вид лечения и радикальность оперативного удаления опухоли. Наиболее благоприятным морфологическим вариантом служит высокодифференцированная липосаркома. Появление отдалённых метастазов уменьшает медиану выживаемости до 6-12 мес. Наилучших результатов позволяет добиться агрессивная оперативная тактика, при этом радикальное удаление локализованных опухолей позволяет добиться 5-летней общей выживаемости, достигающей 53,6%, рецидивов первичного опухолевого очага и солитарных метастазов — 25-39%.
Профилактика[править]
Прочее[править]
Нейрогенные опухоли
Нейрогенные забрюшинные опухоли подразделяют на ганглионарные (ганглионейромы, ганглионейробластомы, нейробластомы), параганглионарные (феохромоцитома, параганглиома) и опухоли нервных оболочек (нейролеммома, нейрофиброма, злокачественная футлярная опухоль).
Нейрогенные опухоли чаще всего располагаются в паравертебральной области и надпочечниках. Большинство новообразований данной группы, исключая нейробластому и ганглионейробластому, развивается у взрослых. Методом выбора в диагностике этой группы новообразований является КТ. Радиологическая картина нейрогенных опухолей представляет собой хорошо отграниченное солидное или дольчатое объёмное образование; возможно наличие кальцинатов.
Лечение
Лечение оперативное.
Прогноз
Прогноз зависит от течения заболевания: при злокачественных нейрогенных опухолях — неблагоприятный, при доброкачественных — хороший.
Нейроэндокринные опухоли
Определение и общие сведения
Нейроэндокринные опухоли — группа новообразований, развивающихся в различных органах или имеющих внеорганное происхождение, клетки которых содержат нейросекреторные гранулы и продуцируют особые пептиды. Выделяют три группы внеорганных нейроэндокринных опухолей: карциноид, мелкоклеточная карцинома и недифференцированная карцинома.
Клинические проявления
Клиническое течение первичного ретроперитонеального карциноида аналогично карциноидной опухоли любого происхождения (проявления первичной опухоли и её метастазов в сочетании или без карциноидного синдрома, вызванного выработкой серотонина в опухоли). Мелкоклеточная карцинома — агрессивная опухоль, биологически сходная с мелкоклеточным раком лёгкого. Недифференцированная карцинома составляет 10% нейроэндокринных опухолей и, как правило, не вызывает эндокринных проявлений.
Лечение
Лечение локализованных нейроэндокринных опухолей забрюшинного пространства оперативное. Диссеминированный опухолевый процесс служит показанием к проведению системного лечения. Как правило, используют режимы, основанные на цисплатине, доксорубицине и этопозиде. Частота объективных ответов на химиотерапию — 67-82%. При карциноиде с паллиативной целью для подавления карциноидного синдрома возможно применение соматостатина, а также интерферона альфа.
Внегонадные герминогенные опухоли
Определение и общие сведения
От 3 до 10% герминогенных опухолей имеет первичную внегонадную локализацию, при этом в 50% наблюдений поражено забрюшинное пространство. Клинические наблюдения ретроперитонеальных герминогенных новообразований описаны во всех возрастных группах, однако пик заболеваемости приходится на 20-35 лет.
Все герминогенные опухоли как тестикулярного, так и внегонадного происхождения, подразделяют на семиномы и несеминомы (опухоль желточного мешка, эмбриональный рак, хориокарцинома, тератома), что существенно влияет на прогноз.
Как правило, к моменту обращения большинство ретроперитонеальных герминогенных опухолей имеет значительные размеры и вовлекает в процесс органы забрюшинного пространства. До 90% этих пациентов имеют метастазы. Чаще всего поражены лёгкие, надключичные и медиастинальные лимфатические узлы, печень.
Клинические проявления
Для первичных внегонадных герминогенных опухолей характерно длительное бессимптомное течение. По мере увеличения новообразований возможно постепенное появление жалоб, связанных со сдавлением магистральных сосудов, двенадцатиперстной кишки и мочеточников опухолью. Развитие отдалённых метастазов вызывает соответствующие клинические проявления.
Диагностика
При наличии объёмного образования забрюшинного пространства у молодого пациента, особенно мужского пола, в круг рассматриваемых диагнозов должна входить герминогенная опухоль. Помимо обязательного физикального обследования необходимо выполнение УЗИ органов мошонки, рентгенографии и КТ органов грудной клетки, КТ брюшной полости и забрюшинного пространства, а также определение уровня сывороточных маркеров — АФП, β-ХГЧ и ЛДГ. Сканирование костей и КТ головного мозга следует производить по показаниям, при наличии соответствующей симптоматики или при повышении уровня β-ХГЧ более 10 000 Ед/л. Тонкоигольная биопсия с последующим цитологическим и иммуногистохимическим исследованием полученного материала позволяет подтвердить диагноз внегонадной герминогенной опухоли в 71% наблюдений.
Лечение
Тактика лечения первичных ретроперитонеальных герминогенных опухолей определяется гистологическим вариантом новообразования и степенью распространённости опухолевого процесса. Доброкачественная (зрелая) тератома резистентна к лучевой и химиотерапии. Метод выбора — оперативное удаление опухоли. Рецидивы опухоли после выполнения радикального оперативного вмешательства редки. Даже больные, подвергнутые паллиативным циторедуктивным операциям, имеют длительную выживаемость.
Оптимальная тактика лечения злокачественных внегонадных герминогенных опухолей забрюшинного пространства не выработана. В настоящее время наиболее эффективно у пациентов с внегонадной семиномой проведение индукционной химиотерапии, основанной на цисплатине (4 цикла ВЕР: цисплатин 20 мг/м2 1-5 дни, этопозид 100 мг/м2 1-5 дни, блеомицин 30 мг/м2 1, 3, 5-й дни). У 20% пациентов после индукции выявляют резидуальные опухоли, за которыми рекомендуют наблюдать. В случае увеличения остаточных опухолевых масс возможно проведение химиотерапии второй линии, основанной на ифосфамиде, или оперативного вмешательства.
Первичная внегонадная несеминома забрюшинного пространства служит показанием к проведению индукционной химиотерапии, основанной на цисплатине (4 цикла ВЕР), с последующим удалением резидуальной опухоли. При выявлении жизнеспособных клеток герминогенной опухоли в удалённых забрюшинных массах проводят два цикла адъювантной химиотерапии, основанной на цисплатине.
Прогноз
Несмотря на значительное улучшение результатов лечения герминогенных опухолей после появления цисплатина и этопозида, прогноз больных внегонадными новообразованиями остаётся плохим. Отдалённая выживаемость этой категории пациентов в разных сериях наблюдений колеблется от 13% до 88%. Наиболее важный фактор, влияющий на отдалённые результаты, — гистологический вариант опухоли. Общая 5-летняя выживаемость больных зрелой тератомой составляет 100%, семиномой — 88%, злокачественной несеминомой — 45%.
Источники (ссылки)[править]
Урология [Электронный ресурс] / Под ред. Н.А. Лопаткина — М. : ГЭОТАР-Медиа, 2011. — https://www.rosmedlib.ru/book/ISBN9785970419908.html
Дополнительная литература (рекомендуемая)[править]
Действующие вещества[править]
Источник
Связанные заболевания и их лечение
Описания заболеваний
Национальные рекомендации по лечению
Содержание
- Описание
- Дополнительные факты
- Причины
- Симптомы
- Классификация
- Диагностика
- Лечение
Названия
C78,6 Вторичное злокачественное новообразование забрюшинного пространства и брюшины.
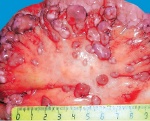
C78.6 Вторичное злокачественное новообразование забрюшинного пространства и брюшины
Описание
Канцероматоз брюшины. Вторичное злокачественное поражение брюшины, являющееся следствием диссеминации эпителиальных опухолей желудочно — кишечного тракта, репродуктивной системы, реже — первичных перитонеальных новообразований. Признаками канцероматоза брюшины являются асцитический синдром, прогрессирующее снижение веса, тошнота, слабость. Диагностика основана на визуализации очагов поражения при проведении МСКТ, УЗИ органов брюшной полости, лапароскопии, цитологическом анализе асцитической жидкости. Лечение включает хирургическое удаление первичного очага с метастазами по брюшине и химиотерапию. Прогноз неблагоприятный.
Дополнительные факты
Канцероматоз брюшины – наиболее часто встречающийся вариант метастазирования онкологических заболеваний различной локализации. Согласно имплантационной теории развития данной патологии, источником поражения являются опухолевые клетки, которые отделились от первичного очага и попали в брюшную полость с серозной жидкостью. Основным пусковым механизмом данного процесса является утрата клетками опухоли факторов межклеточной адгезии. Согласно данным статистики, канцероматоз брюшины встречается у 20-35% пациентов с онкопатологией: в 40% случаев данное осложнение формируется при опухолях желудочно-кишечного тракта, в 30% — при раке яичников (причем на момент верификации диагноза рака яичников у подавляющего большинства пациенток уже имеет место поражение брюшины). Канцероматоз брюшины является неблагоприятным прогностическим фактором; данная форма прогрессирующего опухолевого поражения практически не поддается хирургическому лечению, а химиотерапия улучшает состояние лишь на некоторое время.

C78.6 Вторичное злокачественное новообразование забрюшинного пространства и брюшины
Причины
Канцероматоз брюшины является вторичным опухолевым поражением, результатом прогрессирования рака различной локализации. Наиболее часто поражением брюшины осложняется рак желудка, тонкого кишечника, поджелудочной железы, злокачественные опухоли яичников, матки, маточных труб, печеночноклеточный рак, реже — первичные опухоли брюшины (перитонеальная мезотелиома). В ряде случаев первичный очаг остается неустановленным.
Развитие канцероматоза брюшины является поэтапным процессом. Первый этап – распространение опухолевых клеток из первичного очага поражения. Это связано с нарушением межклеточного взаимодействия и приобретением клетками опухоли подвижности. При этом эпителиальные клетки меняют фенотип на мезенхимальный, происходит деградация межклеточного матрикса. Распространение опухолевых клеток может происходить в ходе оперативного вмешательства. Их механическое отделение возможно при повреждении лимфатических или кровеносных сосудов. Попавшие в брюшную полость клетки опухоли мигрируют под действием силы тяжести, сокращений внутренних органов, имплантируются в местах повышенной резорбции: большом сальнике, в области слепой кишки, дугласовых карманах.
На втором этапе опухолевые клетки взаимодействуют с мезотелием брюшины. Механизмы адгезии определяются природой клеток, особенностями морфологии брюшины, а также наличием участков ее повреждения. Далее клетки закрепляются в мезотелии, происходит их горизонтальное распространение по поверхности перитонеума, а затем инвазивный рост – прорастание в базальную мембрану, соединительную ткань. Следующим этапом является стимуляция неоангиогенеза – обязательного фактора развития опухоли. Морфопатогенетические механизмы формирования канцероматоза брюшины еще недостаточно изучены, в связи с чем отсутствуют радикальные методы лечения.
Частота развития канцероматоза брюшины зависит не только от первичной локализации опухоли, но и от ее размеров, глубины инвазии, гистотипа, степени дифференцировки (недифференцированный рак желудка осложняется поражением брюшины в 60% случаев, ограниченный – в 15%).
Симптомы
Канцероматоз брюшины является вторичным поражением, поэтому его клиническая картина во многом определяется проявлениями первичной опухоли. Характерным признаком является обильный выпот в брюшную полость – формирование асцита. Зачастую асцитический синдром, развивающийся вследствие обструкции лимфатического дренажа, является единственным признаком заболевания, и пациенты могут поступать в отделение гастроэнтерологии или терапии для диагностики причин асцита. Состояние больных тяжелое, характерна значительная потеря веса. Неспецифическими признаками являются тошнота, рвота, выраженная слабость, утомляемость. При наличии крупных метастазов возможно их прощупывание через брюшную стенку.
Классификация
Единая классификация данного заболевания отсутствует, поскольку характеристики первичных опухолей, приводящих к поражению брюшины, весьма разнообразны. Наиболее распространена классификация канцероматоза брюшины в зависимости от числа, локализации метастазов, которая предусматривает три степени:
Р1. Локальное поражение брюшины;
Р2. Несколько областей канцероматоза, разделенных здоровыми участками брюшины;
Р3. Многочисленные очаги поражения.
Диагностика
Канцероматоз брюшины имеет неспецифическую клиническую картину, однако консультация гастроэнтеролога или онколога позволяет предположить данное заболевание на основании симптомов и физикальных данных. Лабораторные анализы не выявляют специфических изменений: определяется лейкоцитоз, ускорение СОЭ. Диагностическая программа обязательно должна включать УЗИ органов брюшной полости и малого таза, позволяющее обнаружить распространенное поражение, а также МСКТ брюшной полости с контрастированием. Обязательно проводится цитологическое исследование асцитической жидкости, полученной при лапароцентезе, которое дает возможность впервые установить или подтвердить диагноз, а также определить гистогенез клеток опухоли.
Информативным методом диагностики канцероматоза брюшины является лапароскопия с осмотром перитонеума, дугласова пространства, диафрагмы, сопровождающаяся биопсией. Высокой специфичностью обладает обратнотранскриптазная полимеразная цепная реакция (ОТ-ПЦР), которая позволяет определить источник диссеминации даже при малом количестве опухолевых клеток.
Сложности диагностики возникают при наличии канцероматоза брюшины без выявленного первичного очага. Данная форма заболевания, встречающаяся в 3-5 % случаев, проявляется клинически только при уже сформировавшемся поражении брюшины. При этом первичный очаг может иметь настолько малые размеры, что его прижизненное обнаружение невозможно.
В качестве дополнительных методов может использоваться определение онкомаркеров (кислой фосфатазы, раково-эмбрионального антигена, альфа-фетопротеина, бета-субъединицы ХГЧ). Такая диагностика не обладает высокой специфичностью, но применяется для оценки прогноза, раннего выявления диссеминации, рецидивов, а также для контроля эффективности лечения.
Лечение
Хирургическое лечение канцероматоза включает удаление первичной опухоли с регионарными метастазами и отсевами по брюшине. Циторедуктивная операция выполняется в объеме перитонэктомии, может сочетаться с удалением матки и придатков, сигмовидной кишки, желчного пузыря. После проведения операции оценивается индекс полноты циторедукции: СС-0: после проведения хирургического лечения очаги поражения визуально не определяются; СС-1: имеются неудаленные очаги диаметром до 2,5 мм; СС-2: очаги диаметром 2,5 мм – 2,5 см; СС-3: очаги поражения более 2,5 см в диаметре. Однако даже при определении индекса СС-0 нельзя полностью исключить возможность диссеминации, поэтому обязательно проводится химиотерапия.
Системная химиотерапия при канцероматозе брюшины имеет определенные недостатки. На сегодняшний день эффективным методом лечения является интраперитонеальная химиотерапия. При местном введении цитостатических препаратов есть возможность применения высоких дозировок, которые при системной терапии слишком токсичны. Использование гипертермии усиливает поступление активных веществ в опухолевые клетки. Существенным преимуществом является длительное нахождение препарата в брюшной полости. Гипертермическая внутрибрюшная химиотерапия проводится в ходе операции или после ее завершения; химиотерапевтический агент (чаще препараты платины) вводится подогретым до температуры 40-43 градуса. Время циркуляции раствора составляет 30-90 минут.
Альтернативным методом лечения канцероматоза брюшины является фотодинамическая терапия с локальным или системным введением фотосенсибилизатора. Данная методика основана на интраоперационном световом воздействии с применением лазера, которое приводит к прямому повреждению мембран опухолевых клеток. Но такое лечение не устраняет процессы ангиогенеза, поэтому его эффективность недостаточно высока.
Ни один из существующих на сегодняшний день методов лечения канцероматоза брюшины не вызывает полную регрессию опухолевых диссеминантов, а также не предупреждает рецидивирование заболевания, поэтому разработка оптимального лечения продолжается. Исследуется таргетная терапия, целью которой являются молекулярные мишени. Низкая эффективность противоопухолевой терапии обусловлена отсутствием достаточного понимания морфологии и патогенеза заболевания, унифицированной классификации, разнородностью первичных опухолей.
Источник
