Врожденный синдром левых отделов сердца
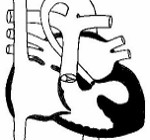

Синдром гипоплазии левых отделов сердца – группа морфологически близких дефектов сердца, включающих недоразвитие его левых отделов, атрезию или стеноз аортального и/или митрального клапанного отверстия, резкую гипоплазию восходящей аорты или комбинацию этих дефектов. Проявления синдрома развиваются по мере закрытия артериального протока, в первые сутки жизни новорожденного и характеризуются признаками кардиогенного шока: тахипноэ, одышкой, слабым пульсом, бледностью и цианозом, гипотермией. Диагноз синдрома гипоплазии левых отделов сердца можно предположить на основании двухмерной эхокардиографии, катетеризации сердца, рентгенографии, ЭКГ. Ведение больных с синдромом гипоплазии левых отделов сердца предполагает инфузию простагландина Е1; проведение ИВЛ, коррекцию метаболического ацидоза; поэтапную хирургическую коррекцию порока (операция Норвуда — операция Гленна или Геми-Фонтена – операция Фонтена).
Общие сведения
Синдром гипоплазии левых отделов сердца (СГЛОС) – термин, используемый для обозначения критического врожденного порока сердца, характеризующегося резким недоразвитием его левых камер и восходящей части аорты, а также митральным или аортальным стенозом. Синдром входит в пятерку наиболее часто встречающихся в кардиологии ВПС, наряду с дефектом межжелудочковой перегородки, транспозицией магистральных сосудов, тетрадой Фалло и коарктацией аорты. СГЛОС составляет 2-4% от всех встречающихся врожденных аномалий сердца, являясь ведущей причиной гибели новорожденных в первые дни и недели жизни. Мальчики страдают данным сочетанным пороком сердца в 2 раза чаще, чем девочки.
Синдром гипоплазии левых отделов сердца
Причины СГЛОС
Причины гипоплазии левых отделов сердца достоверно неясны. Предполагается возможность аутосомно-рецессивного, аутосомно-доминантного и полигенного типов наследования. Наиболее вероятной является теория мультифакториальной этиологии порока.
Различают два морфологических варианта СГЛОС. Первый (наиболее тяжелый) вариант включает гипоплазию левого желудочка и атрезию устья аорты, которые могут сочетаться с атрезией либо стенозом митрального отверстия; при этом полость левого желудочка щелевидна, ее объем составляет не более 1 мл. При втором (наиболее распространенном) варианте порока имеет место гипоплазия левого желудочка, стеноз устья аорты и гипоплазия ее восходящего отдела в сочетании с митральным стенозом; объем полости левого желудочка равен 1-4,5 мл.
Оба варианта гипоплазия левых отделов сердца сопровождаются наличием широкого открытого артериального протока и открытого овального окна, расширением правых отделов сердца и ствола легочной артерии, гипертрофией миокарда правого желудочка; нередко — фиброэластозом эндокарда.
Особенности гемодинамики
Тяжелые расстройства кровообращения при гипоплазии левых отделов сердца развиваются вскоре после рождения и характеризуются в литературе как «гемодинамическая катастрофа». Сущность нарушения гемодинамики определяется тем фактом, что кровь из левого предсердия не может поступить в гипоплазированный левый желудочек, а вместо этого попадает через открытое овальное окно в правые отделы сердца, где происходит ее смешение с венозной кровью. Эта особенность приводит к объемной перегрузке правых отделов сердца и их дилатации, которые наблюдаются с момента рождения.
В дальнейшем основной объем смешанной крови из правого желудочка поступает в легочную артерию, остальная же часть недонасыщенной кислородом крови через открытый артериальный проток устремляется в аорту и большой круг кровообращения. Ретроградным путем небольшое количество крови поступает в гипоплазированную часть восходящей аорты и венечные сосуды.
Фактически правый желудочек берет на себя двойную функцию, перекачивая кровь в легочный и системный круг кровообращения. Попадание крови в большой круг кровообращения возможно только по артериальному протоку, в связи с чем гипоплазия левых отделов сердца рассматривается как порок с дуктус-зависимым кровообращением. Прогноз для жизни ребенка зависит от сохранения артериального протока открытым.
Тяжелейшие расстройства гемодинамики приводят к выраженной легочной гипертензии вследствие высокого давления в системе сосудов малого круга; артериальной гипотонии, обусловленной неадекватным наполнением большого круга; артериальной гипоксемии, связанной со смешением крови в правом желудочке.
Симптомы СГЛОС
Клинические признаки, указывающие на гипоплазию левых отделов сердца, проявляются в первые часы или сутки после рождения. По своим проявлениям они схожи с респираторным дистресс-синдромом или кардиогенным шоком.
Как правило, дети с СГЛОС рождаются доношенными. У новорожденных наблюдается адинамия, сероватый цвет кожных покровов, тахипноэ, тахикардия, гипотермия. При рождении цианоз выражен незначительно, однако вскоре нарастает и становится диффузным либо дифференцированным, только на нижней половине туловища. Конечности наощупь холодные, периферическая пульсация на них ослаблена.
С первых дней жизни нарастает сердечная недостаточность с застойными хрипами в легких, увеличением печени, периферическими отеками. Характерно развитие метаболического ацидоза, олигурии и анурии. Нарушение системной циркуляции сопровождается неадекватной церебральной и коронарной перфузией, что приводит к развитию ишемии головного мозга и миокарда. В случае закрытия артериального протока ребенок быстро погибает.
Диагностика
Во многих случаях диагноз синдрома гипоплазии левых отделов сердца ставится еще до рождения ребенка при проведении ЭхоКГ плода. При объективном обследовании новорожденного ребенка определяется слабый пульс на руках и ногах, одышка в покое, усиленный сердечный толчок и видимая эпигастральная пульсация; выслушивается систолический шум изгнания, ритм галопа и одинарный II тон.
На ЭКГ отмечается отклонение ЭОС вправо, признаки резкой гипертрофии правых отделов сердца и левого предсердия. Фонокардиография фиксирует наличие низко- или среднеамплитудного систолического шума. Рентгенография грудной клетки при синдроме гипоплазии левых отделов сердца выявляет высокую степень кардиомегалии, шарообразные контуры сердечной тени, усиление легочного рисунка.
Эхокардиография обнаруживает следующие характерные признаки гипоплазии сердца: стеноз устья аорты и ее восходящего отдела, уменьшение размеров левого желудочка и увеличение правого желудочка, грубые изменения митрального клапана.
Зондирование полостей сердца обнаруживает пониженное насыщение крови кислородом в периферических артериях, лево-правый сброс крови на уровне предсердий, повышенное давление в правом желудочке и легочной артерии. Ангиокардиография позволяет визуализировать открытый артериальный проток, гипоплазированную восходящую аорту, резко дилатированный правый желудочек, расширенный легочный ствол и легочные артерии.
Дифференциальный диагноз при синдроме гипоплазии левых отделов сердца необходим с гипоплазией правого желудочка, единственным желудочком сердца, аномальным дренажем легочных вен, транспозицией магистральных сосудов, изолированным аортальным стенозом. Из внесердечных аномалий необходимо исключить острую дыхательную недостаточность, травму черепа, кровоизлияние в мозг.
Лечение СГЛОС
Наблюдение за новорожденными осуществляется в отделении реанимации. Для предупреждения закрытия или попытки открытия артериального протока осуществляется инфузия простагландина Е1. Необходимо проведение ИВЛ, коррекция метаболического ацидоза, введение диуретиков и инотропных препаратов.
Хирургическая коррекция гипоплазии левых отделов сердца проводится поэтапно и последовательно. Первый этап лечения – паллиативный; проводится в первые 2 недели жизни и заключается в выполнении операции Норвуда для уменьшения нагрузки на легочную артерию, и в то же время, для обеспечения кровоснабжения аорты. На втором этапе, в возрасте 3-6 месяцев ребенку выполняется операция Геми-Фонтена (или операция Гленна по наложению двухстороннего двунаправленного кава-пульмонального анастомоза). Окончательная гемодинамическая коррекция порока проводится примерно через год путем выполнения операции Фонтена (наложения тотального кавопульмонального анастомоза), позволяющей полностью разобщить круги кровообращения.
Прогноз
Порок является крайне неблагоприятным в отношении прогноза. В первый месяц жизни погибает около 90% детей с гипоплазией левых отделов сердца. Выживаемость после 1-го корригирующего этапа составляет 75 %, после 2-го — 95 %, после 3-го — 90 %. В целом через 5 лет после полной коррекции порока в живых остаются 70% детей.
Если гипоплазия левых отделов сердца выявляется у ребенка внутриутробно, ведение беременности и родоразрешение проводится в условиях специализированного перинатального медицинского центра. С первых дней жизни ребенок должен находиться под наблюдением неонатолога, детского кардиолога и кардиохирурга для проведения как можно более ранней коррекции порока.
Источник
Этот термин используется для обозначения группы схожих аномалий, общей чертой которых является серьезная гипоплазия левых отделов сердца. Они в совокупности составляют от 2 до 4% всех врожденных пороков сердца.
Морфология
Патогенез этой группы аномалий недостаточно понятен. С одной стороны, гипоплазию левых структур сердца в экспериментах на животных можно получить, ограничив приток крови к этим отделам сердца, однако увеличение риска таких состояний у сибсов и других родственников предполагает наличие генетической основы. Сердце, как правило, расположено слева и увеличено за счет его вершины, сформированной ПЖ. ЛП маленькое с узким или заросшим предсердным отверстием. Отмечается тяжелый митральный стеноз или митральная атрезия. ЛЖ маленький и часто с крохотной восходящей аортой или с атрезией аорты. Трикуспидальный клапан, как правило, сформирован нормально, отмечается гипертрофия ПЖ. Главные легочные артерии расширены, имеет место увеличенный артериальный проток. Легочный венозный возврат обычно происходит в ЛП, но в случае неизмененной предсердной перегородки (в 10% случаев) может быть аномальный легочный венозный возврат. Почти всегда отмечается коарктация аорты.
Патофизиология
Гипоплазия левых отделов сердца (рис. 1) — хороший пример выдающейся адаптивности кровообращения плода, обеспечивающей выживание плода даже при таких сложных пороках. Церебральное и коронарное кровообращение осуществляется ретроградно вокруг дуги аорты через артериальный проток. У приблизительно 30% пациентов описаны врожденные структурные аномалии головного мозга. Постнатально системное кровообращение остается зависимым от проходимости артериального протока. Для поддержания системного кровотока легочный венозный возврат должен происходить в ПЖ (как правило, через предсердную перегородку). Неперфорированная или рестриктивная предсердная перегородка приведет к раннему отеку легких. Соотношение потоков в малом и большом круге зависит от баланса между легочным и системным сосудистым сопротивлением. При сохранении артериального протока открытым, по мере постнатального снижения легочного сосудистого сопротивления, будет увеличиваться ток крови через легкие и снижаться системное кровообращение, что приведет к ацидозу.
Рис. 1. Изображения гипоплазированых левых отделов сердца.
А — вид на четыре камеры через грудную клетку плода, видна гипоплазия левых отделов сердца. ЛЖ визуализируется как маленькая эхогенная область, рядом с расширенным ПЖ.
Б — аксиальное магнитно-резонансное постнатальное изображение ребенка с гипоплазией левых отделов сердца. Маленький гипертрофированный ЛЖ можно наблюдать кзади от формирующего верхушку расширенного ПЖ.
В и Г — 3D-МРТ-реконструкции пациента с гипоплазией левых отделов сердца сразу после первого этапа реконструктивной операции Norwood в модификации Sano. Изображения обозначены цветом, при этом белый цвет отображает ПЖ, голубой — соединение между ПЖ и легочной артерией и ветку легочных артерий, красный — реконструкцию дуги аорты и нисходящей аорты.
В- вид слева, обратите внимания на крохотную восходящую аорту, рядом с гораздо большим ПК, инкорпорированным в реконструкцию дуги аорты.
Г — вид слева, обратите внимание на расположенное спереди соединение между ПЖ и ЛА, которое снабжает ветвь ЛА. H — голова; P — задний; L — левый; F — ноги; A — передний; R — правый.
Диагностика
Клинические проявления
Многим детям диагноз ставится пренатально после проведения ЭхоКГ плода. Это дает возможность оптимизировать постнатальное ведение ребенка и ограничить осложнения. Клинические признаки, описанные ниже, отражают ситуацию, когда диагноз не был поставлен пренатально. Сразу после рождения большинство детей будут чувствовать себя хорошо в том случае, если у них неинтактная или очень рестриктивная предсердная перегородка. Симптомы начинают появляться с закрытием артериального протока, при этом быстро проявляются признаки ОСН с нарастающим цианозом, ацидемией, дыхательными расстройствами. Необходимо своевременно обеспечить респираторную поддержку и инфузию простагландинов для восстановления фетальной модели кровообращения и обеспечения проходимости артериального протока, от которого зависимы такие новорожденные. Данные объективного осмотра включают:
- тахипноэ с диспноэ;
- цианоз с отсутствием пульса на нижних конечностях и бледность;
- гиподинамическую прекардиальную область;
- нормальный I тон, одинарный II и ритм галопа;
- систолический шум изгнания (как правило, мягкий);
- гепатомегалию.
Рентгенография грудной клетки
На рентгенографии определяются кардиомегалия, большая тень ПП, легочный застой/отек легких.
ЭКГ
Часто отмечаются правостороннее смещение оси, гипертрофия ПЖ, признаки ишемии миокарда.
ЭхоКГ
В случаях подтвержденного диагноз гипоплазии левых отделов сердца ЭхоКГ должна выявить детали, которые могут повлиять на выживаемость таких младенцев после проведения хирургического вмешательства. У всех пациентов с таким заболеванием систематически должно выполняться:
- подтверждение нормального легочного венозного возврата;
- оценка размеров и характеристик потока через любые предсердные коммуникации;
- оценка функции и состоятельности трикуспидального клапана;
- оценка легочного клапана — исключение значительного стеноза или несостоятельности;
- тщательное определение размеров восходящей аорты и дуги аорты;
- характеристика потока через артериальный проток;
- выявление наличия коарктации аорты;
- оценка функций желудочков.
Катетеризация сердца и ангиография
Диагностическая катетеризация не играет или играет очень маленькую роль в начальном ведении младенцев, которые часто находятся в критическом состоянии. Лечебная катетеризация использовалась как первый этап паллиативного лечения данного порока.
Естественное течение и лечение
Естественное течение этого состояния без вмешательства в раннем постнатальном периоде ведет к смерти в результате закрытия артериального протока, обычно на первой неделе жизни. Появление возможности инфузии простагландинов и развитие стадийности паллиативных манипуляций привело к очевидному изменению прогноза. Но даже при наличии открытого артериального протока, поддерживаемого инфузиями простагландинов, для обеспечения выживаемости таких детей необходимо адекватное и постоянное ведение для предотвращения перегрузки по малому кругу с последующей СН. Постанальное ведение детей с гипоплазией левых отделов сердца можно разделить на активное хирургическое лечение (этапное паллиативное и редко трансплантационное) и «поддерживающий уход», когда активные постнатальные вмешательства не выполняются.
Очень небольшое количество центров предлагают трансплантацию как первоочередной метод лечения, что связано со сложностями в поиске донора, которое ограничивает такой подход. Впервые паллиативные манипуляции были выполнены в 1980-х годах и это привело к стабильному увеличению выживаемости. Первоначальное хирургическое вмешательство (процедура Норвуда) выполняется в неонатальный период и требует рассечения легочного ствола, который анастомозируют с гипоплазированной аортой, которую, в свою очередь, наращивают с помощью гомотрансплантата. Снабжение отсоединенных легочных артерий осуществляется через модифицированный правосторонний шунт Blalock-Taussig или, в последнее время, наложением специального переходника, ограничивающего ПЖ и соединяющий его с ЛА, используя GoreTex® трубку (модификация Sano).
После первой стадии в 4-6 мес следует выполнение верхнего кавопульмонального анастомоза и закрытие этого кавопульмонального соединения в 2-3 года путем создания нижнего кавопульмонального анастомоза. Выживаемость после 1-го этапа в большинстве центров составляет 80-90% и обычно выше для 2-й и 3-й стадий. Успешно применяемый в некоторых центрах комбинированный подход, использующий, как хирургические вмешательства, так и лечебные катетеризации (гибридные процедуры), приводит к сходным результатам. Через срединную стернотомию, выполняется хирургическое билатеральная перевязка ЛА и установка, через затягивающийся шов на ЛА, стента в артериальный проток для обеспечения его проходимости.
При необходимости выполняют рассечение предсердной перегородки. Все это пока не требует обеспечения новорожденному искусственного кровообращения. Вторая стадия является более сложной, так как необходимо провести реконструкцию дуги аорты, удалить стент из протока и наложить верхний кавопульмональный анастомоз.
Согласно всем данным, происходит постепенное потеря пациентов, как между стадиями, так и после третей. Более того, похоже что неврологические результаты у большинства пациентов, леченных по протоколу Норвуда не соответствуют норме.
Долгосрочный прогноз
Лишь некоторые пациенты, которым была выполнена операция Норвуда, в настоящее время дожили до взрослой жизни, но взрослые кардиологи должны осознавать, каких огромных усилий стоило выхаживание этих пациентов в детском возрасте и насколько улучшились ранние результаты. Всем выжившим понадобится длительное наблюдение в специализированных центрах для взрослых с врожденными заболеваниями сердца, так как проблемы могут рецидивировать. У таких больных «пластика единственного желудочка» оставляет последний работать в качестве системного двигателя. Понятно, что скорее всего, будет иметь место постепенное снижение желудочковой функции, что приведет к росту пациентов с признаками недостаточности кровообращения по типу Фонтена.
Долгосрочная стратегия в лечении этой группы пациентов может заключаться в трансплантации сердца, однако ограничением будут предыдущие операции и малое число доноров, что приведет к ситуации, когда лишь некоторые из пациентов смогут ей воспользоваться.
John E. Deanfield, Robert Yates, Folkert J. Meijboom и Barbara J.M. Mulder
Врожденные пороки сердца у детей и взрослых
Опубликовал Константин Моканов
Источник
